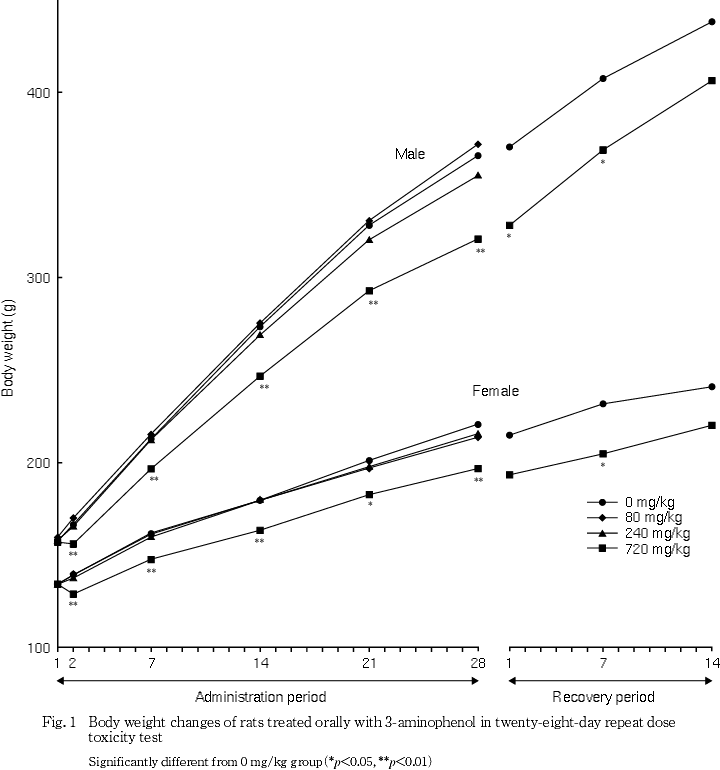
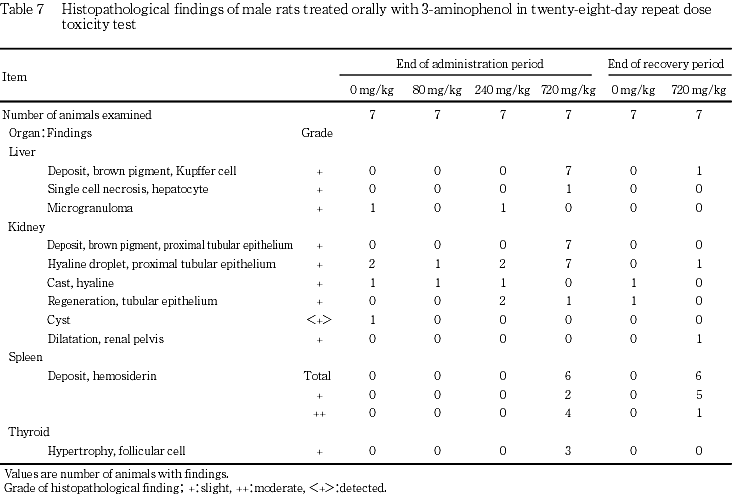
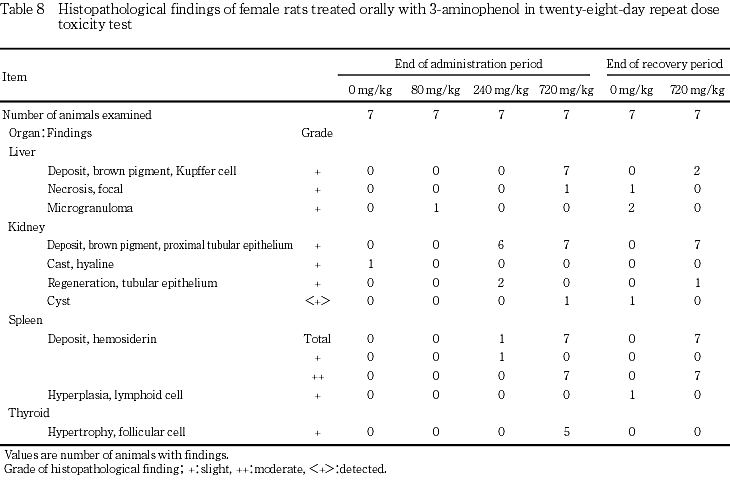
一般状態では,720 mg/kg群で投与期間中に雌雄とも振戦および流涎が認められ,投与2日に体重減少が認められた.投与期間中は雌雄とも低体重が継続したが,回復期間中は順調に体重が増加した.摂餌量では,240 mg/kg群の雄に投与2日のみに低値がみられ,720 mg/kg群の雌雄ともに投与期間中に低値が散見されたが,回復期間中は変化は認められなかった.尿検査では,雌雄ともに80 mg/kg以上の投与群に褐黒色尿が認められ,720 mg/kg群の雌雄に飲水量および尿量の高値,雌に尿比重の低下がみられたが,回復2週には変化は認められなかった.血液学検査では,720 mg/kg群の雌で投与期間終了時に,雄で回復期間終了時に貧血が認められた.血液生化学検査では,投与期間終了時に720 mg/kg群の雌雄ともにGPTおよび総ビリルビンの高値,雄に総コレステロールの高値およびトリグリセリドの低値が認められた.これらの変化は回復期間終了時には認められなかった.剖検では,720 mg/kg群の雌雄ともに肝臓の暗褐色化,脾臓の暗赤色化,雌に腎臓の暗褐色化が認められ,回復期間終了時にも雌雄の脾臓に暗赤色化が認められた.器官重量では,720 mg/kg群の雌雄の甲状腺および雌の脾臓で絶対重量および相対重量が高値,雌雄の肝臓および腎臓で相対重量が高値を示したが,回復期間終了時には雌雄の甲状腺で相対重量が高値を示した.病理組織学検査では,240 mg/kg群の雌および720 mg/kg群の雌雄で腎臓の近位尿細管上皮の褐色色素沈着および脾臓のヘモジデリン沈着が認められた.720 mg/kg群の雌雄に肝臓のクッパー細胞の褐色色素の沈着および甲状腺の濾胞細胞の肥大も認められたが,回復期間終了時にはこれら色素沈着の発現例数の減少あるいは程度の軽減がみられた.720 mg/kg群の雄に腎臓の近位尿細管上皮の硝子滴および肝細胞の単細胞壊死も認められたが,いずれも可逆性の変化であった.
以上のことから,本試験条件下における3-アミノフェノールの無影響量(NOEL)は雌雄とも80 mg/kg/day未満と考えられた.
各個体の投与液量は投与日に最も近い測定日の体重に基づき,5 mL/kgの容量でラット用胃ゾンデを用いて強制的に胃内に投与した.
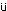 nwald-Giemsa染色)を測定した.また,3.8 %クエン酸ナトリウムで処理した後,3000回転/分で10分間遠心分離して得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血液凝固自動測定装置アメルングKC-10A,バクスター)を測定した.
nwald-Giemsa染色)を測定した.また,3.8 %クエン酸ナトリウムで処理した後,3000回転/分で10分間遠心分離して得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血液凝固自動測定装置アメルングKC-10A,バクスター)を測定した.
 blewski & La Due法)およびグルコース(ヘキソキナーゼ法)を測定し,無処理血液を3000回転/分で10分間遠心分離して得られた血清を用いてGPT(IFCC法),アルカリホスファターゼ(Bessey-Lowry法),γ-GTP(包接L-γ-グルタミル-ρ-ニトロアニリド基質法),総コレステロール(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff
blewski & La Due法)およびグルコース(ヘキソキナーゼ法)を測定し,無処理血液を3000回転/分で10分間遠心分離して得られた血清を用いてGPT(IFCC法),アルカリホスファターゼ(Bessey-Lowry法),γ-GTP(包接L-γ-グルタミル-ρ-ニトロアニリド基質法),総コレステロール(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff 法),カルシウム(OCPC法),無機リン(Fiske-SubbaRow法),総蛋白(ビウレット法)(以上,自動分析装置7150形,日立製作所),ナトリウム,カリウム(以上,炎光光度法,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),蛋白分画およびA/G比(以上,セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
法),カルシウム(OCPC法),無機リン(Fiske-SubbaRow法),総蛋白(ビウレット法)(以上,自動分析装置7150形,日立製作所),ナトリウム,カリウム(以上,炎光光度法,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),蛋白分画およびA/G比(以上,セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
尿比重および尿検査の定性的項目の成績については,Kruskal-Wallisの検定法で解析し,有意差がみられた場合はMann-WhitneyのU-検定法を用いて解析した.
これら対照群と被験物質投与群との間の検定においては,いずれも有意水準を5 %とした.


720 mg/kg群の雌雄に肝臓のクッパー細胞の褐色色素沈着がみられ,シュモール反応陽性で,ベルリン青染色にも陽性であった.腎臓は近位尿細管上皮の褐色色素沈着がみられ,シュモール反応陽性,ベルリン青染色陰性であった.脾臓はヘモジデリン沈着がみられ,ベルリン青染色陽性であった.甲状腺の濾胞細胞の肥大もみられた.雄に腎臓の近位尿細管上皮の硝子滴が,240 mg/kg以下の投与群よりも多数例に認められた.また雌雄とも各1例ではあるが,肝臓の肝細胞の単細胞壊死または限局性壊死が認められた.雄の2例に下垂体の好塩基性細胞の肥大が認められた.回復期間終了時にも,720 mg/kg群の雌雄に肝臓のクッパー細胞の褐色色素沈着,脾臓のヘモジデリン沈着がみられ,雌に腎臓の近位尿細管上皮の褐色色素沈着が認められた.
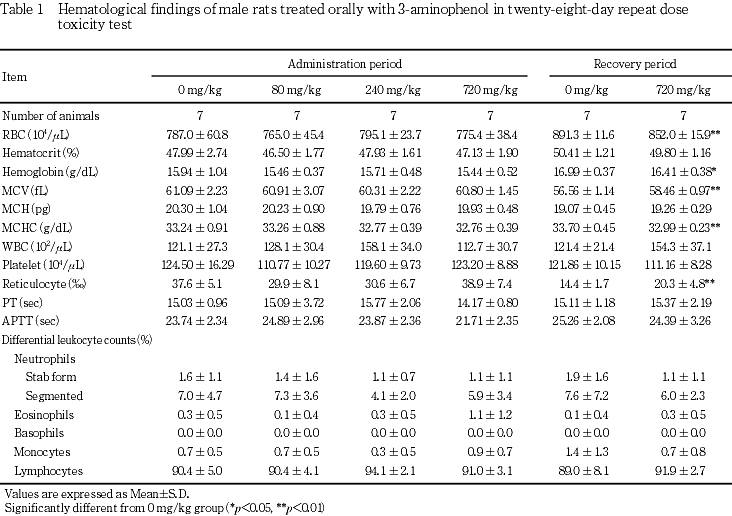
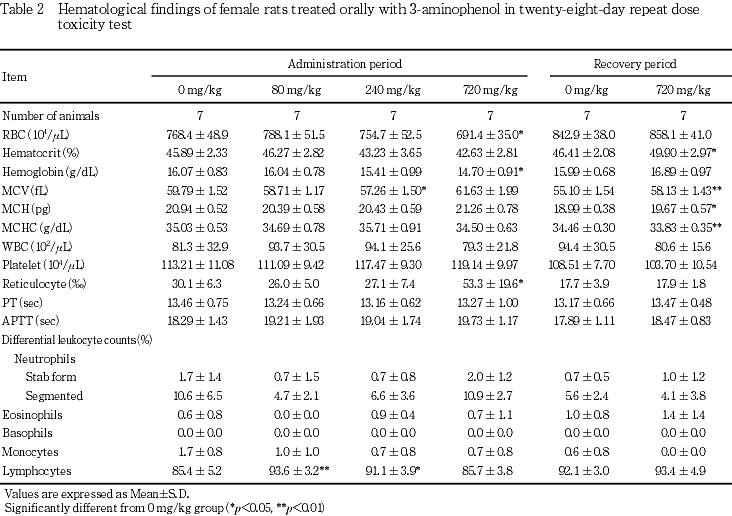
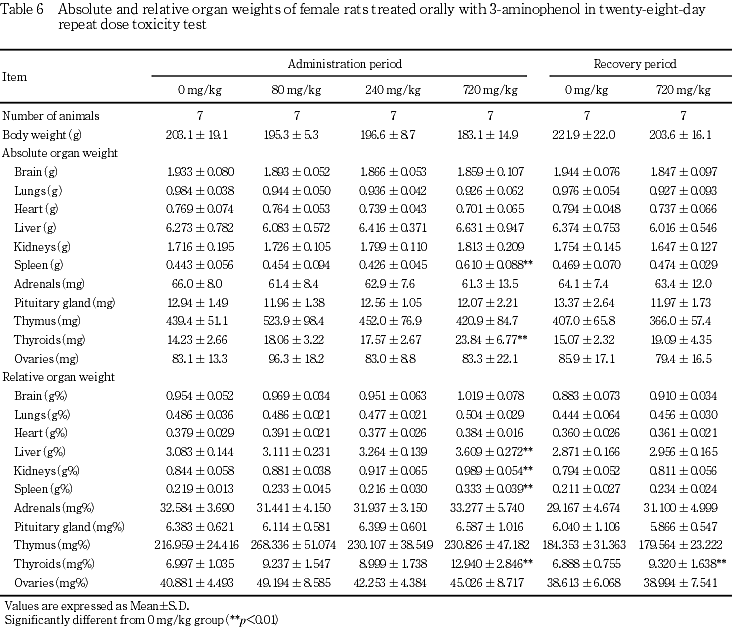
体重では,720 mg/kg投与群の雌雄で投与2日に体重減少が認められ,投与期間中は雌雄とも有意な低値が継続した.この有意差は回復期間中にも継続したが,体重増加量および体重増加率では対照群を上回り,回復14日には有意差がなかったことから,3-アミノフェノール投与による体重変化は可逆性の変化と考えられた.
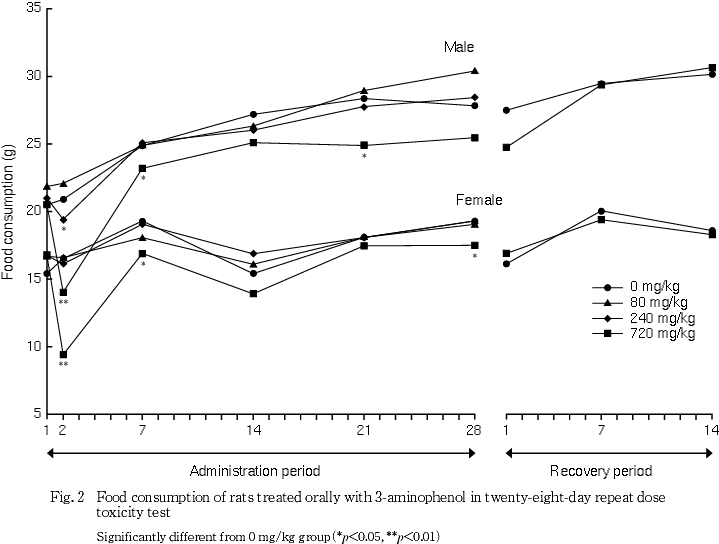
摂餌量では,240 mg/kg投与群の雄で投与2日に低値が認められ,720 mg/kg投与群の雌雄でも投与期間中に低値が散見された.しかし回復期間中には変化が認められなかった.
尿検査では,80 mg/kg以上の投与群に雌雄とも褐黒色尿がみられた.褐黒色尿は尿色調の異常の一つで,その原因としてヘマチン,メトヘモグロビン,メラニン,アルカプトン,フェノール類の服用等があげられている3).またアミノフェノール類を大量に吸入するとメトヘモグロビン血症を生じることがあること4)から,この尿色の変化は3-アミノフェノール投与により生成したメトヘモグロビンが尿中に出現した可能性が考えられた.その他の変化として,720 mg/kg投与群では雌雄に飲水量および尿量の増加,雌に尿比重の有意な低下がみられた.飲水量および尿量の増加は,3-エチルフェノール,4-エチルフェノールあるいはm-クレゾールの28日間反復経口投与毒性試験の高用量群で認められていることから,フェノール類の共通の変化と考えられた.投与4週にみられたこれらの変化は回復2週には認められず,可逆性の変化と考えられた.
血液学検査では,投与期間終了時に720 mg/kg投与群の雌で赤血球数およびヘモグロビン量の低値ならびに網赤血球数の高値がみられた.この貧血は雌雄の720 mg/kg投与群で総ビリルビンの上昇が認められていることから溶血性貧血と考えられた.3-アミノフェノール等のアミノ基,水酸基を持つ芳香族化合物は溶血を起こすことが知られており5),類縁化合物である4-アミノフェノールにおいても溶血の可能性が示唆されている6).このことは雌雄の720 mg/kg投与群において赤血球由来と考えられる褐色色素あるいはヘモジデリンの肝臓,腎臓および脾臓への沈着が認められていることからも,3-アミノフェノール投与により雌雄ともに溶血が生じていると考えられた.雄では投与期間終了時に認められなかった貧血所見が回復期間終了時に出現していることから,雌と比較して貧血が遅れて出現した可能性が考えられた.一方,雌ではヘマトクリット値および平均赤血球ヘモグロビン量の増加も認められていることから,回復期間においてこの貧血は改善傾向にあると考えられた.病理組織学検査における褐色色素あるいはヘモジデリンの沈着については雌雄ともにその発現例数の減少あるいは程度が軽減していることから,溶血により生じた変化は可逆性の変化と考えられた.
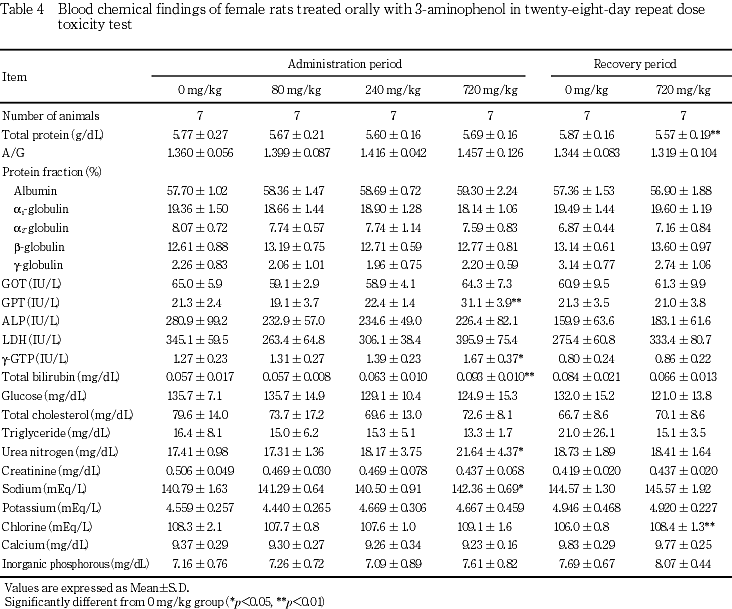
血液生化学検査では,720 mg/kg投与群で雌雄ともGPTの高値が認められ,肝臓の相対重量の高値,ならびに病理組織学検査で雄1例に肝細胞の単細胞壊死が認められたことから,3-アミノフェノールの肝機能に及ぼす影響が示唆された.この変化は回復期間終了時には認められないことから,可逆性の変化と考えられた.また,この変化は720 mg/kg投与群の雄で総コレステロールの高値およびトリグリセリドの低値が認められたこと,甲状腺の絶対重量および相対重量が雌雄とも高値であることから,後述の甲状腺機能との関連が考えられた.720 mg/kg投与群の雌に認められた尿素窒素およびナトリウムの高値については,尿量の高値および尿比重の低下との関連が考えられ,腎臓に病理組織学的な変化は認められなかったが,被験物質投与の影響と考えられた.720 mg/kg投与群の雌でγ-GTPの高値が認められたが,アルカリホスファターゼに変化はみられないこと,また病理組織学検査においても胆道系に変化はないこと,さらに1例を除いて対照群の変動範囲内の数値であることから,毒性学的意義は少ないと考えられた.回復期間終了時の雌雄にみられた総蛋白の低値,雄にみられたA/G比およびアルブミンの高値,および雌のクロールの高値については,いずれも投与期間終了時にみられない変化であることときわめて軽度であることから毒性学的意義は少ないと考えられた.
剖検では,720 mg/kg投与群の雌雄で肝臓の暗褐色化および脾臓の暗赤色化が認められ,雌では腎臓の暗褐色化も認められた.これらの変化は急性経口投与後7日の剖検例にも認められ7),前述の褐色色素あるいはヘモジデリンの肝臓,腎臓および脾臓への沈着に起因した変化と考えられた.回復期間終了時には,雌雄とも脾臓の暗赤色化のみが認められ,褐色色素あるいはヘモジデリン沈着の軽減を反映したものと考えられた.
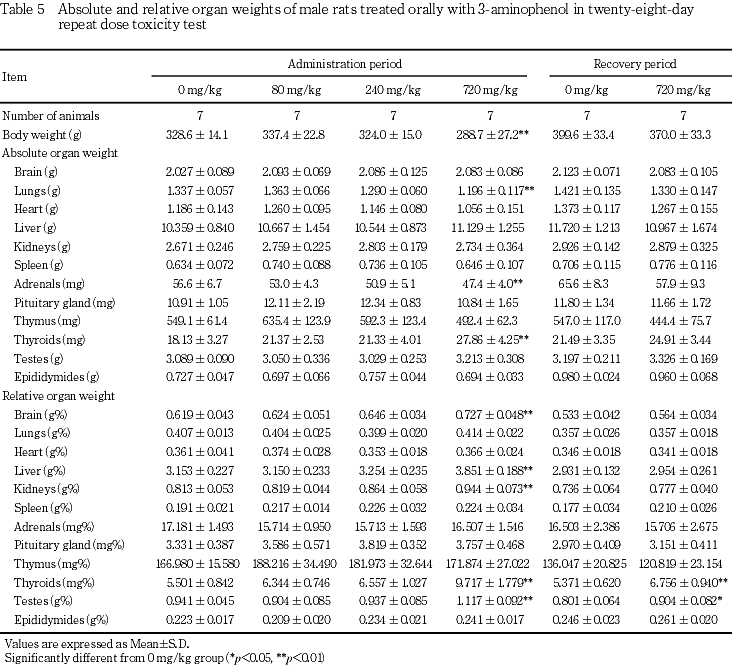
器官重量では,720 mg/kg投与群で雌雄とも甲状腺の絶対重量および相対重量に高値がみられ,病理組織学検査で甲状腺の濾胞細胞の肥大が認められた.Reら8)も甲状腺重量の変化と甲状腺の濾胞上皮の肥厚および濾胞の小型化を報告している.濾胞細胞の肥大と濾胞上皮の肥厚および濾胞の小型化は同質の変化と考えられ,甲状腺ホルモン合成抑制作用を有する化合物の投与で発現することが知られている.この変化は肝臓における酵素誘導に伴って発現する場合もあるとされている9)が,本試験では肝臓に酵素誘導を示唆する所見は認められていないことから,甲状腺の濾胞細胞の肥大は3-アミノフェノールの直接作用と考えられた.雄の2例の下垂体に好塩基性細胞の肥大がみられたことから,甲状腺刺激ホルモンの産生が示唆され,甲状腺の濾胞細胞の肥大との関連性が考えられた.甲状腺機能の変化に伴い変動するとされている9)総コレステロール,トリグリセリド等の高値あるいは低値が本試験においても認められていることから,甲状腺機能に対する影響も示唆された.同群の雌雄で腎臓の相対重量の高値が認められたが,これらの変化は病理組織学検査における褐色色素の腎臓への沈着に対応した変化と考えられた.この重量変化は回復期間終了時には軽減ないしは回復していることから可逆性の変化であると考えられた.
病理組織学検査では,前述の肝臓,腎臓および脾臓の色素沈着および甲状腺の濾胞細胞の肥大の他に,720 mg/kg投与群の雄で腎臓に近位尿細管上皮の硝子滴沈着が認められ,240 mg/kg以下の投与群では散見される程度であるのと比較して発現例数の増加が認められた.この変化は通常ラットの雄に特有の変化10)であるが,今回の発現状況が全例であることから3-アミノフェノール投与に関連した変化と考えられた.この変化も回復期間終了時には認められず可逆性の変化と考えられた.
以上のことから,本試験条件下における3-アミノフェノールの無影響量(NOEL)は雌雄とも80 mg/kg/day未満と考えられた.
| 1) | G. K. Lloyd, M. P. Liggett, S. R. Kynoch and R. E. Davies, Food Cosmet. Toxicol., 15, 607(1977). |
| 2) | 須永昌男他,化学物質毒性試験報告,8, 689(2001). |
| 3) | 金井泉,“臨床検査法提要,”金井正光編,金原出版,東京,1983, pp. 103-109. |
| 4) | 竹内康浩,“毒性試験講座. 18,産業化学物質・環境化学物質,”和田攻編,地人書館,東京,1991, pp. 135-136. |
| 5) | J. R. Glaister,“毒性病理学の基礎:Principles of Toxicological Pathology,”ソフトサイエンス社,東京,1992, pp. 142-147. |
| 6) | 須藤雅人他,化学物質毒性試験報告,5, 447(1997). |
| 7) | 3-アミノフェノールのラットにおける急性経口投与毒性試験のための予備試験(未公刊). |
| 8) | T. A. Re, R. F. Loehr, S. C. Rodriguez, D. E. Rodwell, and C. M. Burnett, Fundam. Appl. Toxicol., 4, 98(1984). |
| 9) | 伊東信行編著,“最新 毒性病理学,”中山書店,東京,1994, pp. 289-295. |
| 10) | J. R. Glaister, “Principles of Toxicological Pathology : 毒性病理学の基礎,”ソフトサイエンス社,東京,1992, pp. 160-161. |
| 連絡先 | |||
| 試験責任者: | 須永昌男 | ||
| 試験担当者: | 堀川裕尚,咲間正志,山本美代子,平田真理子,古川正敏 | ||
| (株)化合物安全性研究所 | |||
| 〒004-0839 札幌市清田区真栄363番24 | |||
| Tel 011-885-5031 | Fax 011-885-5313 | ||
| Correspondence | ||||
| Authors: | Masao Sunaga(Study director) Hironao Horikawa, Masashi Sakuma, Miyoko Yamamoto, Mariko Hirata, Masatoshi Furukawa | |||
| Safety Research Institute for Chemical Compounds Co., Ltd. | ||||
| 363-24 Shin-ei, Kiyota-ku, Sapporo, Hokkaido, 004-0839, Japan | ||||
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | |||