
全試験期間を通して死亡は認められず,体重および摂餌量には変化はみられなかった.
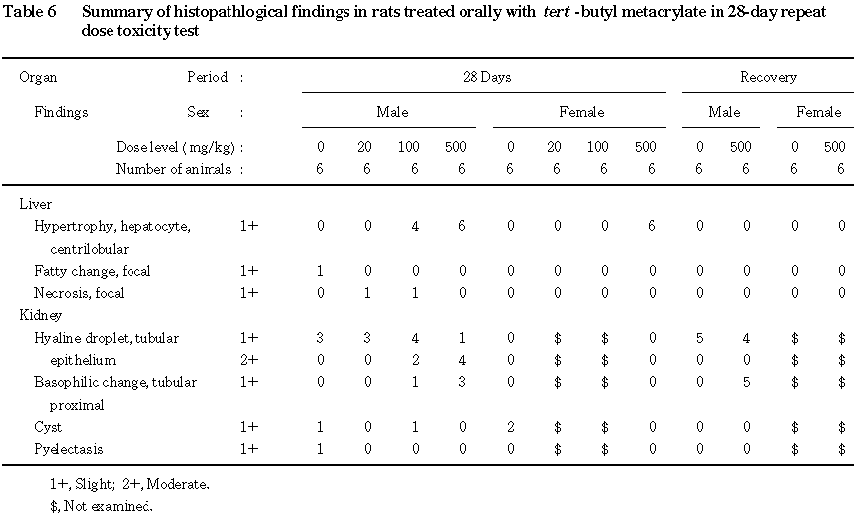
一般状態観察では,流涎が 500 mg/kg/day群の雌雄で認められた.血液生化学検査では,総コレステロール,総蛋白の高値が100 mg/kg/day以上の群の雌雄で,アルブミンの高値が100 mg/kg/day群の雌と500 mg/kg/day群の雌雄で,ALPの低値が100 mg/kg/day群の雄と500 mg/kg/day群の雌雄で認められた.尿検査では,蛋白の高値が500 mg/kg/day群の雌雄で,潜血の高値が100 mg/kg/day以上の群の雄で,ビリルビンの高値および尿沈渣における赤血球数の増加が500 mg/kg/day群の雄で,上皮細胞数の増加が500 mg/kg/day群の雌で認められた.病理学的検査では,肝臓の変化として腫大が500 mg/kg/day群の雌雄で,重量の増加および小葉中心性の肝細胞肥大が100 mg/kg/day群の雄と500 mg/kg/day群の雌雄で,腎臓の変化として重量の増加が500 mg/kg/day群の雌雄で,近位尿細管上皮の硝子滴の増加および再生性変化である好塩基性変化が100 mg/kg/day以上の群の雄で認められた.これらの変化は,回復期間終了時には消失もしくは軽減しており,回復傾向が認められた.20 mg/kg/day群では被験物質投与に起因した変化は認められなかった.
以上の結果より,本試験条件下におけるメタクリル酸 tert-ブチルエステルの無影響量は,雌雄ともに20 mg/kg/dayであると考えられる.
検疫・馴化期間を含めた全飼育期間中,温度 20〜25℃,湿度40〜70%,換気約12回/時,照明12時間(7:00〜19:00)に自動調節された飼育室を使用した.動物は,実験動物用床敷(ベータチップ:日本チャールス・リバー(株))を敷いたポリカーボネート製ケージに1ケージ当り2匹で収容し飼育した.
動物には,実験動物用固型飼料 (MF:オリエンタル酵母工業(株))および5 μmのフィルター濾過後紫外線照射した水道水を,それぞれ自由摂取させた.
被験物質は 28日間毎日1回,午前中に胃ゾンデを用いて強制経口投与した.投与液量は10 ml/kgとし,至近測定日の体重を基に算出した.対照群には同様に溶媒を投与した.
 法),カルシウム(O-CPC法),無機リン(UV法),GOT(SSCC改良法),GPT(SSCC改良法),γ-GPT(SSCC改良法),ALP(GSCC改良法),ナトリウム,カリウム,クロール(イオン選択電極法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
法),カルシウム(O-CPC法),無機リン(UV法),GOT(SSCC改良法),GPT(SSCC改良法),γ-GPT(SSCC改良法),ALP(GSCC改良法),ナトリウム,カリウム,クロール(イオン選択電極法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
投与終了時解剖動物の対照および 500 mg/kg群の雌雄の心臓,肝臓,腎臓,副腎および脾臓を対象に,常法に従いヘマトキシリン・エオジン染色標本を作製し鏡検した.その結果,雌雄の肝臓および雄の腎臓に被験物質投与に起因すると思われる変化が認められたため,投与期間終了時解剖動物の他の群と回復期間終了時解剖動物の当該器官についても同様に検査した.
 法により平均値の比較検定を行った.分散が一様でない場合にはKruskal-Wallisの検定を行い,Dunnett型またはScheff
法により平均値の比較検定を行った.分散が一様でない場合にはKruskal-Wallisの検定を行い,Dunnett型またはScheff 型の順位和検定を行った.尿検査で得られた計数データについては,Armitageのχ^2検定を用いた.有意水準は5%以下とした.
型の順位和検定を行った.尿検査で得られた計数データについては,Armitageのχ^2検定を用いた.有意水準は5%以下とした.

回復期間終了時の検査では,総コレステロール,総蛋白およびアルブミンの高値が 500 mg/kg群の雄で認められたが,投与期間終了時よりも軽減していた.なお,カリウムの高値が500 mg/kg群の雄で認められたが,投与期間終了時には認められなかったことから,被験物質投与と関連のない偶発性の変化と判断した.
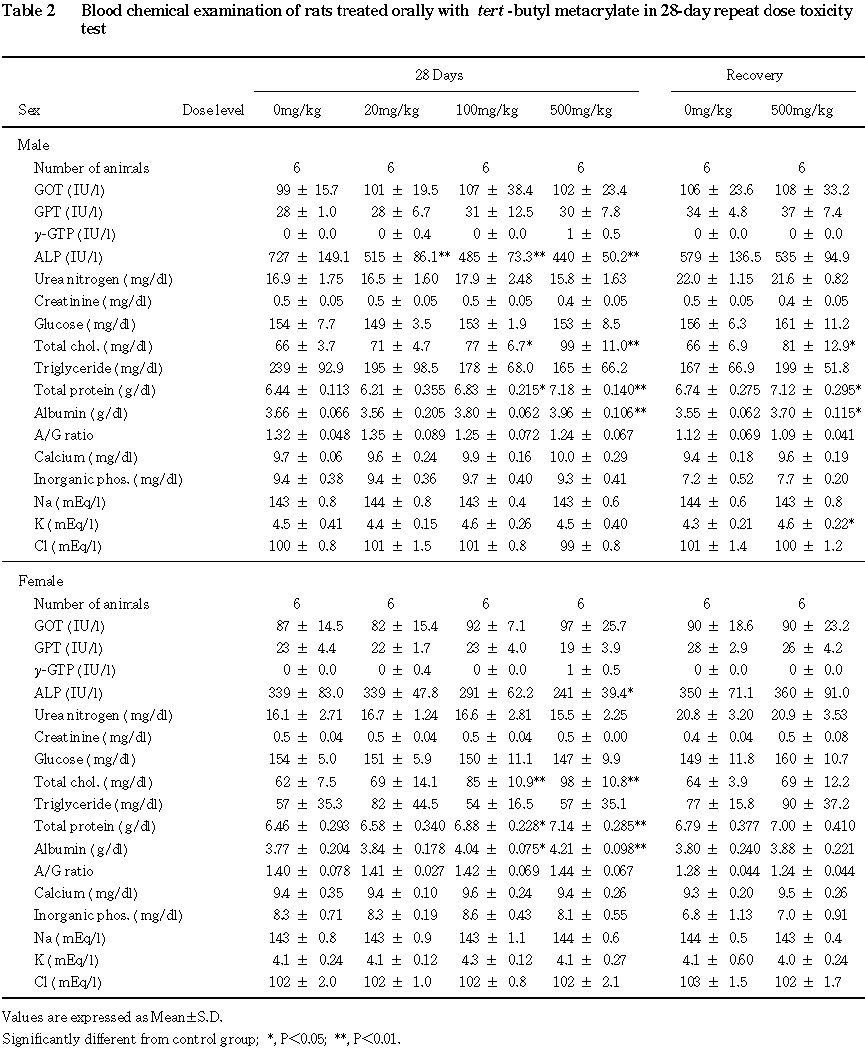
その他,投与期間の沈渣において,白血球数の減少が 20 mg/kg群の雄で,リン酸アンモニウム・マグネシウム結晶および上皮細胞数の減少が20 mg/kg群の雌で認められた.しかし,これらの変化は500 mg/kg群では認められないことから,被験物質投与とは関連のない変化であると判断した.また,回復期間の検査では,ケトン体の高値が500 mg/kg群の雌で認められたが,本変化は投与期間には認められなかったことから,被験物質投与と関連のない偶発性の変化と考えられた.

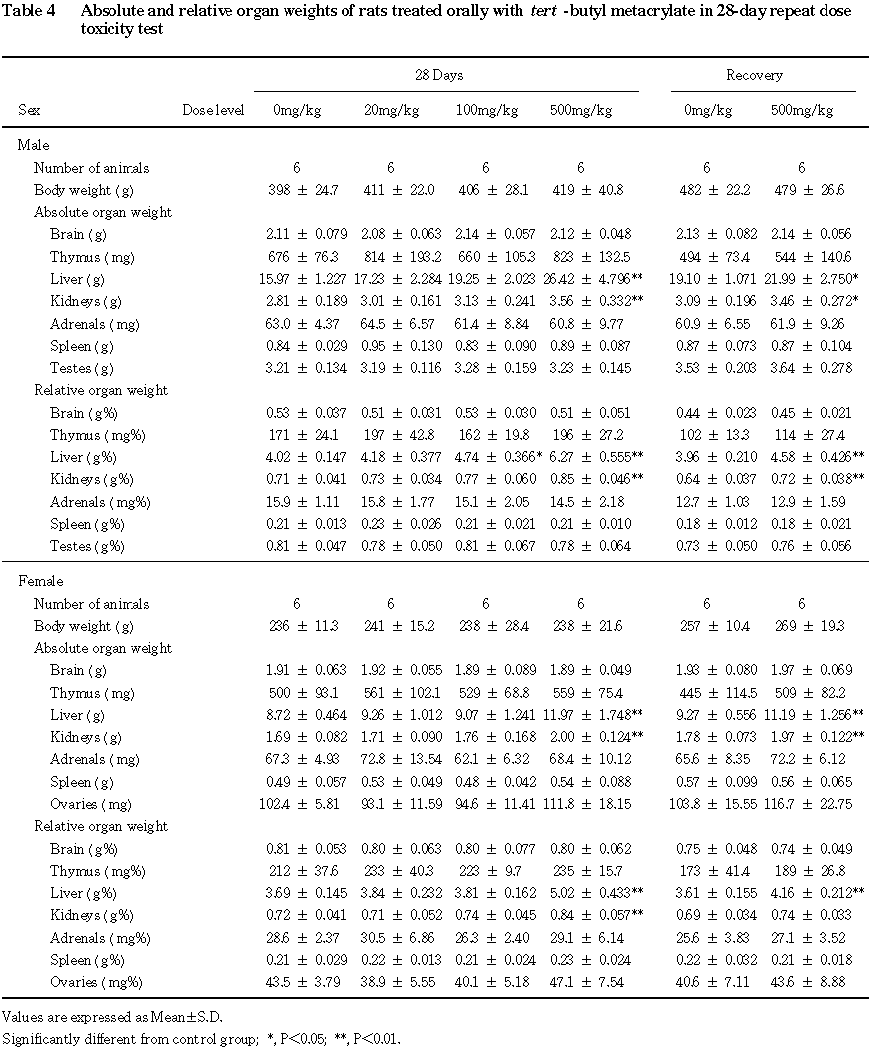
回復期間終了時には,肝臓の実重量および相対重量の高値が 500 mg/kg群の雌雄で認められ,腎臓の実重量の高値が500 mg/kg群の雌雄,相対重量の高値が500 mg/kg群の雄で認められた.なお,いずれの器官についても,投与期間終了時より変化が軽減していた.

肝臓では,小葉中心性の肝細胞肥大が 100 mg/kg群の雄4例と500 mg/kg群の雌雄全例に認められた.肥大した肝細胞の細胞質は弱好酸性で,微細顆粒状を呈していた.
腎臓では,近位尿細管上皮の硝子滴が対照群を含む雄の全群で認められたが, 100 mg/kg群の雄2例と500 mg/kg群の雄4例では明らかに増加していた.さらに,近位尿細管上皮の好塩基性変化が100 mg/kg群の雄1例と500 mg/kg群の雄3例に認められた.この変化は皮質で巣状にみられ,好塩基性化した上皮細胞は腫大し,有糸分裂像もしばしば観察された.
回復期間終了時の検査では,投与期間終了時に発現していた変化のうち肝臓の小葉中心性の肝細胞肥大と腎臓の近位尿細管上皮の硝子滴の増加は認められなかった.しかし,近位尿細管上皮の好塩基性変化は 500 mg/kg群の雄5例に認められた.なお,剖検時に肝臓の軽度の腫大が500 mg/kg群の雌1例でみられたが,組織学的に異常は認められなかった.
その他,対照群あるいは被験物質投与群で種々の変化が散見されたが,その発現状況には用量との関連はなく,偶発変化と判断した.
被験物質投与により,流涎が 500 mg/kg/day群に認められた.流涎は,投与後数分で消失する一過性の変化であることから,被験物質の刺激性に起因したものと考えられる.
被験物質投与に起因した毒性変化が 100 mg/kg/day以上の投与群の肝臓および腎臓に発現し,それに伴うと思われる血液生化学検査値および尿検査値の変動が認められた.
肝臓では,重量の増加および腫大が認められ,組織学的検査では小葉中心性の肝細胞肥大として認められた.小葉中心性の肝細胞肥大は,一般に種々の薬物投与によって薬物代謝酵素の誘導が惹起された際に認められる変化であり,適応現象と考えられている 1).また,血液生化学検査では,総コレステロール,アルブミンおよび総蛋白の高値も認められており,肝臓での蛋白等の合成能の亢進が示唆された.なお,回復期間終了時には,肝重量の増加を含む上記検査値の高値は継続して認められたが,その程度は軽減していることや肝細胞肥大が認められなかったことから,回復性は良好であると考えられる.
腎臓では,雄で重量の増加および近位尿細管の硝子滴の増加が認められた.近位尿細管の硝子滴の増加は,種々の薬物や化学物質の投与によって雄ラットに特異的に発現するα 2uグロブリン腎症2,3)の特徴的変化である.α2uグロブリン腎症では硝子滴の増加とともに尿細管上皮が変性,脱落し,好塩基性の尿細管上皮の出現を特徴とする再生性変化が起こることが知られており2),本試験においても同様の変化が観察された.尿検査で認められた潜血の高値と尿沈渣の赤血球数の増加は,いずれも尿細管の変化に関連したものと考えられる.また,雌においては組織障害性の変化は認められなかったが,腎重量の増加および尿沈渣の上皮細胞数の増加が認められたことから,雌の腎臓に対しても被験物質の影響が示唆された.回復期間終了時にも腎重量の増加および尿沈渣の赤血球数の増加が認められたが,いずれもその程度は軽減していた.また,組織学的検査においても,投与期間終了時に雄でみられた近位尿細管の硝子滴の増加は認められず,尿細管の再生性変化のみが認められたことから,回復性は良好であると判断した.
その他,尿蛋白の高値が 500 mg/kg/day群の雌雄で,尿中ビリルビンの高値が同群の雄で認められた.尿中ビリルビンの変動については,その程度が極めて軽微であることや肝機能障害を示唆するGOTやGPT等の血清酵素の上昇あるいは病理組織学的変化が認められないことから,毒性学的意義は低いと思われる.
なお, ALPの低値が20 mg/kg/day以上の投与群の雄および500 mg/kg/day群の雌で認められたが,毒性学的に意義のある増加性の変化ではなかった.また,当研究所の背景データと比較した場合,雄の対照群の値は通常の値に比べ高く,雄の20 mg/kg/day群の値は背景データの範囲内であることから,少なくとも20 mg/kg/day群でみられたALPの有意な低値は被験物質投与に起因した変化ではないものと判断した.
以上の結果から,本試験条件下におけるメタクリル酸 tert-ブチルエステルの無影響量は雌雄ともに20 mg/kg/dayと考えられる.
| 1) | C. Gopinath, D. E. Prentis, and D. J. Lewis, "Atlas of experimental toxicological pathology," MTP press limited, Lancaster, 1987, pp. 43-60. |
| 2) | P. Greaves, "Histopathology of preclinical toxicity studies," Elsevier, Amsterdum, 1990, pp. 532-538. |
| 3) | J.A. Swenberg, B. Short, S. Broghoff, J. Strasser, and M. Charbonneau, Toxicol. Appl. Pharmacol., 97, 35 (1989). |
| 連絡先 | |||
| 試験責任者: | 山本恭之 | ||
| 試験担当者: | 大西康之,岡部恵美,土谷 稔, 山岸保彦,豊田直人,高野克代, 鈴木美江 | ||
| (株)三菱化学安全科学研究所鹿島研究所 | |||
| 〒3l4-02茨城県鹿島郡波崎町砂山l4 | |||
| Tel 0479-46-287l | Fax 0479-46-2874 | ||
| Correspondence: | |||
| Authors: | Yasuyuki Yamamoto(Study director) Yasuyuki Ohnishi, Emi Okabe, Minoru Tsuchitani, Yasuhiko Yamagishi, Naoto Toyota, Katsuyo Takano, Yoshie Suzuki | ||
| Mitsubishi Chemical Safety Institute Ltd., Kashima Laboratory | |||
| 14 Sunayama, Hasaki-mach, Kashima-gun, Ibaraki, 314-02, Japan | |||
| Tel +8l-479-46-287l | Fax +8l-479-46-2874 | ||