なお、本試験はOECDガイドライン「反復投与毒性・生殖発生毒性併合試験(1990年)」に従って実施した。また、化審法(1984年)およびOECD(1981年)のGLP基準を満足している。
以上の結果より、本試験条件下における1, 2−ブタンジオールの反復投与毒性に関する無影響量は雄が1000 mg/kg、雌が200 mg/kg、生殖・発生毒性に関する無影響量は親動物の雌雄および児動物ともに1000 mg/kgと考えられる。
今回、OECDによる既存化学物質の安全性点検に係わる毒性調査事業の一環としてラットを用いて1, 2−ブタンジオールの反復投与毒性・生殖発生毒性併合試験を実施し、生体への一般毒性学的影響および生殖・発生に及ぼす影響について検討したので報告する。
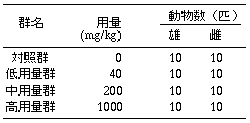
動物入荷後6日間馴化し、健康状態が良好なことを確認した後、雌雄とも8週齢で投与を開始した。
投与開始前日に動物を体重別層化無作為抽出法により群分けした後、イヤーパンチを用いて群および個体を識別した。投与開始時の体重範囲は、雄が296〜332g、雌が187〜215gであった。
実験動物用床敷(ベータチップ:日本チャールス・リバー株式会社)を敷いたポリカーボネート製ケージ(265W×426D×200Hmm)に1ケージあたり馴化・検疫期間中は2匹(同性)、交配前投与期間中は1匹、交配期間中は雌雄各1匹、哺育期間は1腹で収容し、スチール製架台上で飼育した。ステンレス製の固型飼料用給餌器およびポリカーボネート製の給水瓶(700 ml)を用いた。
ケージ(含床敷)、給餌器および給水瓶は、週1回の頻度でオートクレーブ滅菌したものと交換した。
被験物質の投与液中での安定性については、投与開始前に低用量群および高用量群の投与液を当研究所において分析し、本保存条件下で14日間安定であることを確認した。また濃度については、いずれの用量も設定濃度に対し±2%以内の値であった。

| a) 赤血球数 | レーザー光散乱法 |
| b) 白血球数 | 同上 |
| c) 血小板数 | 同上 |
| d) ヘモグロビン濃度 | シアンメトヘモグヘモグロビン法 |
| e) ヘマトクリット値 | ミクロヘマトクリット法 |
| f) 白血球百分率 | ライト染色塗抹標本について測定 |
| g) 網状赤血球数 | ニューメチレンブルー染色後ライト染色した塗抹標本について測定 |
| h) 平均赤血球容積(MCV) | a)、e)より算出 |
| i) 平均赤血球血色素量(MCH) | a)、d)より算出 |
| j) 平均赤血球血色素濃度(MCHC) | d)、e)より算出 |
a)〜d)は自動血液分析装置(ELT-8/ds:オルソインスツルメンツ社)、e)はヘマトクリット用遠心機(MC-201:株式会社日立製作所)、f)、g)は血液細胞自動分析装置(MICROX HEG-70A:立石電機株式会社)により測定した。
| a) GOT(AST) | UV-Rate法(SSCC改良法) |
| b) GPT(ALT) | UV-Rate法(SSCC改良法) |
| c) ALP | p-ニトロフェニルリン酸基質法(GSCC改良法) |
| d) γ-GTP | γ- グルタミル・p-ニトロアニリド基質法(SSCC改良法) |
| e) 尿素窒素 | 酵素-UV法(Urease-GLDH法) |
| f) グルコース | 酵素-UV法(GK-G6PDH法) |
| g) 総コレステロール | 酵素法(CES-CO-POD法) |
| h) トリグリセライド | 酵素法(LPL-GK-G3PO-POD法) |
| i) クレアチニン | Jaffe法 |
| j) 総ビリルビン | Jendrassik改良法 |
| k) 総蛋白 | Biuret法 |
| l) アルブミン | BCG法 |
| m) A/G比 | k)およびl)より算出 |
| n) カルシウム | O-CPC法 |
| o) 無機リン | UV法 |
| p) ナトリウム | イオン選択電極法 |
| q) カリウム | イオン選択電極法 |
| r) クロライド | イオン選択電極法 |
雄は投与42日、雌は哺育4日(投与40〜45日)に、全生存動物について、ペントバルビタールナトリウムの腹腔内投与による麻酔下で腹大動脈切断により放血致死させ剖検した。
(2)器官重量
全生存動物について、剖検後に以下の器官の重量を測定した。測定には電子上皿天秤(ED-H60:株式会社島津製作所)を用いた。さらに、解剖日の体重を基に対体重比についても算出した。なお未交尾の雌のデータについては、解剖日が異なるため集計から除外した。
(3)病理組織学的検査
全生存動物について以下の器官を採取し、10%リン酸緩衝中性ホルマリン液(精巣および精巣上体はブアン液)にて固定後保存した。
雌雄とも対照および高用量群の器官について、常法に従いヘマトキシリン・エオジン染色標本を作製し鏡検した。また、剖検時に高用量群の雄の1例に精巣萎縮が認められたため精巣および精巣上体については低および中用量群も検査した。一部の肝臓および腎臓については脂肪滴の証明のためOil red O染色を施した。
7日間の交配で低用量群の2対を除き他は全例に交尾が認められたため、交尾能に被験物質の影響はないと判断し以後の交配は行わなかった。この間に交尾しなかった雌については、交配期間終了後14日(投与35日)に剖検し、卵巣を保存した。
交配および雌の妊娠状況から次の項目を算出した。
| a) | 交尾所要日数 |
| b) | 交尾が成立するまでに逸した発情期の回数 |
| c) | 交尾率(%):(交尾動物数/同居動物数)×100 |
| d) | 受胎率(%):妊娠動物数/交尾動物数)×100 |
哺育4日の解剖時に卵巣、子宮を摘出して黄体数および着床数を検査した。これらの検査結果から次の項目を算出した。
| a) 妊娠期間: | 妊娠0日から出産が確認された前日までの期間 |
| b) 出産率(%): | (生存児出産雌数/妊娠雌数)×100 |
| c) 着床率(%): | (着床数/黄体数)×100 |
| d) 分娩率(%): | (総出産児数/着床数)×100 |
哺育1日に生存児数、死亡児数、性別および外表異常の有無を検査した後、一般状態、死亡の有無を毎日観察した。哺育1および4日の生存児数から、次の項目を算出した。
| a) 出生率(%): | (出産確認時生存児数/総出産児数)×100 |
| b) 新生児生存率(%): | (哺育4日生存児数/出産確認時生存児数)×100 |
(2)体重
哺育1日および4日に1腹毎に雌雄単位でまとめて測定し、それぞれの平均値を算出した。
(3)剖検
全ての生存児について哺育4日に口腔を含む外表を検査した後、ペントバルビタールの腹腔内投与による麻酔下で開腹し、腹大動脈切断により放血致死させ剖検した。
 の方法により平均値あるいは順位の多重比較検定を行った。ただし、一部の項目については、はじめにKruskal-Wallisの検定を行い、有意差が認められた場合に順位の多重比較検定を行った(下記*印)。
の方法により平均値あるいは順位の多重比較検定を行った。ただし、一部の項目については、はじめにKruskal-Wallisの検定を行い、有意差が認められた場合に順位の多重比較検定を行った(下記*印)。
計数データについてはFisherの直接確率法により検定した。有意水準は5%以下とした。新生児に関するデータについては、各母動物毎に算出した平均値を統計単位とした。以下に検定の対象となる項目を示す。
その他、自然発生と考えられる所見として、脱毛が1000 mg/kg群の雌で1例観察された。


剖検時に雄の1000 mg/kg群で認められた精巣の萎縮は組織学的には広範囲に亘る精細管の萎縮であった。この変化に伴い軽度の両側性精巣上体萎縮も認められた。精巣では精細胞は変性しており、空胞化および多核細胞の形成が認められたが、セルトリー氏細胞および間細胞には異常はなかった。しかし、40および200 mg/kg群も含めて本例以外の動物の精巣および精巣上体には異常は認められなかった。その他に、雌の1000 mg/kg群の1例では、脾臓の胚中心の消失および片側の副腎皮質の広範な出血性壊死が認められた。


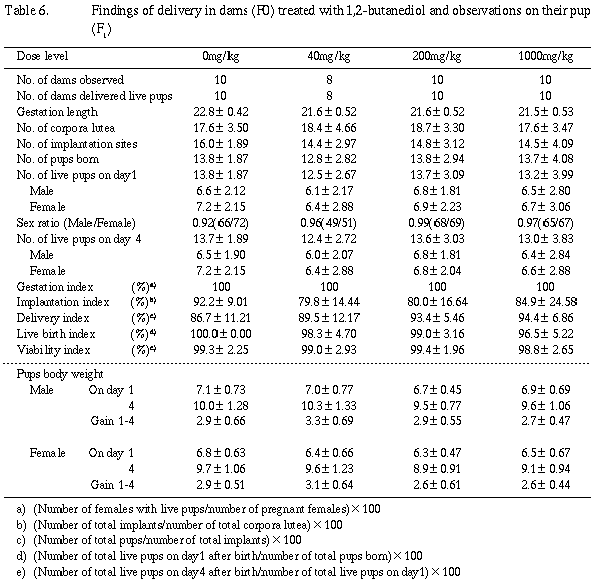
哺育1日から4日までに各群ともに死亡が少数例観察されたが、出産児数、生存児数および性比、また出生率および新生児生存率ともに対照群と被験物質投与群との間に有意な差は認められなかった。
(2)新生児の観察
哺育1日の観察において、いずれの群でも外表異常は認められなかった。40 mg/kg群の新生児1例が哺育2日に貧血兆候を示し、3日に死亡した。その他の新生児に異常は認められなかった。
(3)体重
雌雄とも哺育1日および4日の体重ならびにその間の体重増加量に対照群と被験物質投与群との間に有意な差は認められなかった。
(4)剖検
哺育4日の全生存動物の剖検の結果、胸腺頸部残留が対照群より順次3、2、5および2例、左臍動脈が対照群の1例に認められた。また、肝臓の白色斑が1000 mg/kg群の雌1例に認められた。本例の肝臓について病理組織学的検査を行った結果、葉の周辺部における広範囲の壊死および肝細胞のび漫性脂肪化が認められた。
死亡動物の剖検では200 mg/kg群で腎盂拡張が1例に認められた。
これらの所見はいずれも用量依存性がないか、または極少数例の発現であることから、被験物質投与に起因するものではないと考えられる。
被験物質の位置異性体である1,3-ブタンジオールはラットへの投与で中枢抑制作用を示し1)、その作用はエタノールに類似するといわれる2)。また、1,4-ブタンジオールも鎮静、歩行失調、カタレプシーおよび呼吸抑制などの中枢抑制を起こすことが報告されている3)。これらのことから、被験物質も他の構造のブタンジオールと同様な中枢抑制作用を有し、一般状態の変化はその反映である可能性が考えられる。
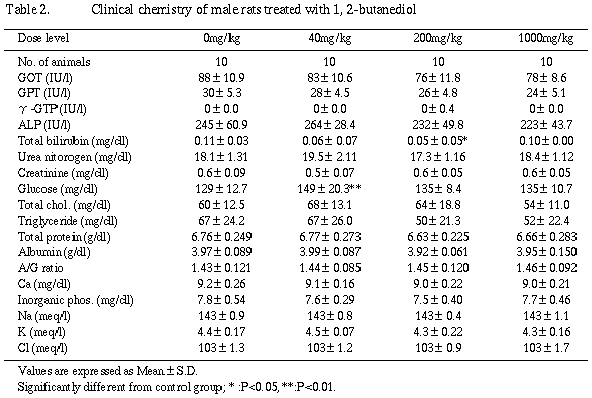
体重、摂餌量、器官重量、雄の血液学的検査および臨床化学検査では被験物質の影響は認められなかった。
病理学的検査において、雄の1000 mg/kg群の1例で精巣の萎縮が認められたが、ラットでは自然発生的にしばしば認められる所見であることから、被験物質投与とは関連のない変化と考えられる。
雌の1000 mg/kg群の1例で副腎皮質の広範な出血性壊死が認められたが、同様の変化は妊娠あるいは出産による血液循環の変化やストレスによっても生じるといわれている4)。本例については脾臓の胚中心の消失、即ちリンパ球の分裂抑制も観察されていることから、本所見は妊娠あるいは出産によるストレスに関連した変化である可能性が考えられる。同様に、雌の多数例に認められた脾臓の造血細胞の増数は分娩時の出血に対する反応であり、副腎束状帯のび漫性肥大は泌乳・哺乳に伴う内分泌性5)あるいはストレス性4)の変化と考えられる。
その他に病理組織学的検査において認められた種々の変化については、ラットではしばしば遭遇する自然発生性の変化であり、用量と関係なく発現していることから被験物質の影響によるものではないと考えられる。
以上のことから、被験物質の親動物に対する影響は軽度のものと考えられる。
新生児の剖検で、胸腺頚部残留および左臍動脈が各群で散見されたが、これらの所見は胎生末期の胎児でしばしば自然発生的に認められる所見であり6)、発現頻度にも用量との相関はなかった。また、1000 mg/kg群の1例で観察された肝臓の白色斑は病理組織学的には肝臓の壊死および脂肪化であった。このような変化は、様々な要因によって引き起こされ、循環障害あるいは栄養を含めた代謝障害によっても惹起されることが広く認識されている7)。しかしながら、今回の場合は1例のみの発現であり、他の新生児に異常は認められなかったことから被験物質投与とは関連のない変化と考えられる。
以上のように、本試験では1000 mg/kg群で雌の親動物に軽度の毒性兆候が認められたが、交尾、妊娠、分娩、哺育等の生殖機能および新生児には被験物質の影響は認められなかった。したがって、本試験条件下における反復投与毒性に関する無影響量は雄が1000 mg/kg、雌が200 mg/kg、生殖・発生毒性に関する無影響量は親動物の雌雄および児動物ともに1000 mg/kgと考えられる。
| 1) | R.F. Mankes, V. Renak, J. Fieseher and R. Lefevre, J. Am. Coll. Toxcol., 5, 189(1986). |
| 2) | G.D. Frye, R.A. Chapin, R.B.Vogel, R.B. Mailman, C.D. Kilts, R.A. Mueller, and G.R. Breese, J. Pharmacol. Exp. Ther., 216, 306 (1981). |
| 3) | F. Poldrugo, S. Barker, M. Bassa, F. Mallardi, and O.C. Snead, Clin. Exp. Res., 9, 493 (1985). |
| 4) | 笹野公伸, 笹野伸昭, "現代病理学体系 17(B)巻 副甲状腺 副腎 胃腸膵内分泌系 副腎皮質, 6. 変性・壊死・炎症・ストレスに伴う変化," 飯島宗一ら編, 中山書店,東京, 1991, pp.139-154 . |
| 5) | 水野秀夫, 横山 昭, "畜産大事典, 泌乳とホルモン, " 養賢堂, 東京 , 1978, pp.316-325 . |
| 6) | H. Morita, F. Ariyuki, N. Inomata, K. Nishimura, Y. Hasegawa, M. Miyamoto, and T. Watanabe, Cong. Anom, 27, 147 (1987). |
| 7) | 奥平雅彦, "肝臓 -構造・機能・病態生理, 肝細胞の変性・壊死, B. 食餌性障害, " 第3版, 三浦義彰ら編, 医学書院, 東京, 1976, pp.725-733. |
| 連絡先: | |||
| 試験責任者 | 松浦郁夫 | ||
| (株)三菱化成安全科学研究所鹿島研究所 | |||
| 〒314 -02 茨城県鹿島郡波崎町砂山 14 | |||
| Tel 0479-46-2871 | Fax 0479-46-2874 | ||
| Correspondence: | |||
| Matsuura, Ikuo | |||
| Mitsubishi-Kasei Institute of Toxicological and Environmental Sciences, Japan | |||
| 14 Sunayama, Hasaki-machi, Kashima-gun, Ibaraki, 314-02, Japan | |||
| Tel 81-479-46-2871 | Fax 81-479-46-2874 | ||