投与期間中に1000 mg/kg投与群の雄5例および雌4例が死亡ないし瀕死状態のため切迫屠殺となった.また,500 mg/kg投与群の雄1例が死亡した.
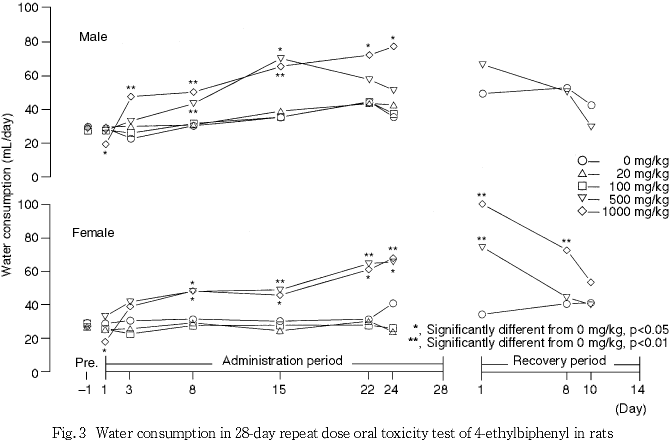
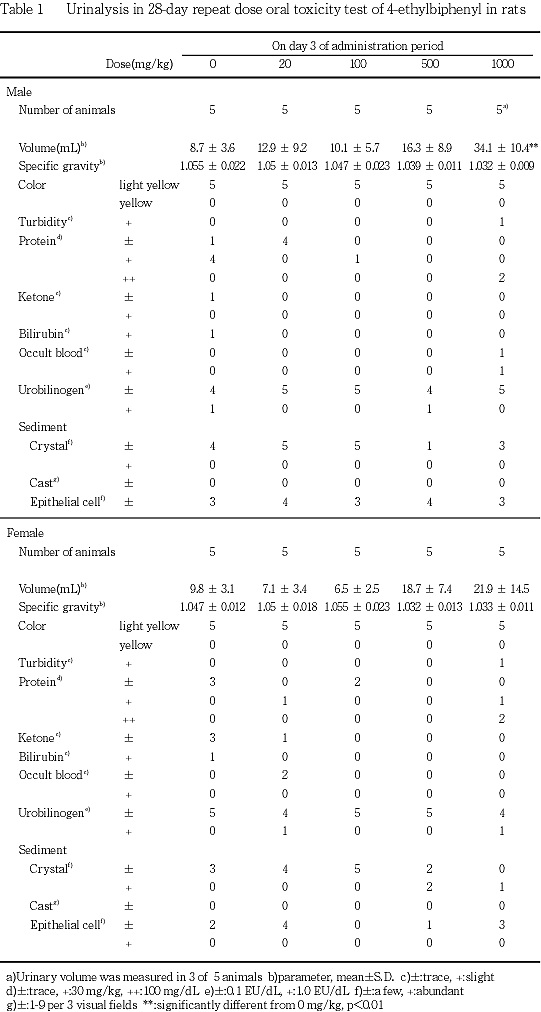
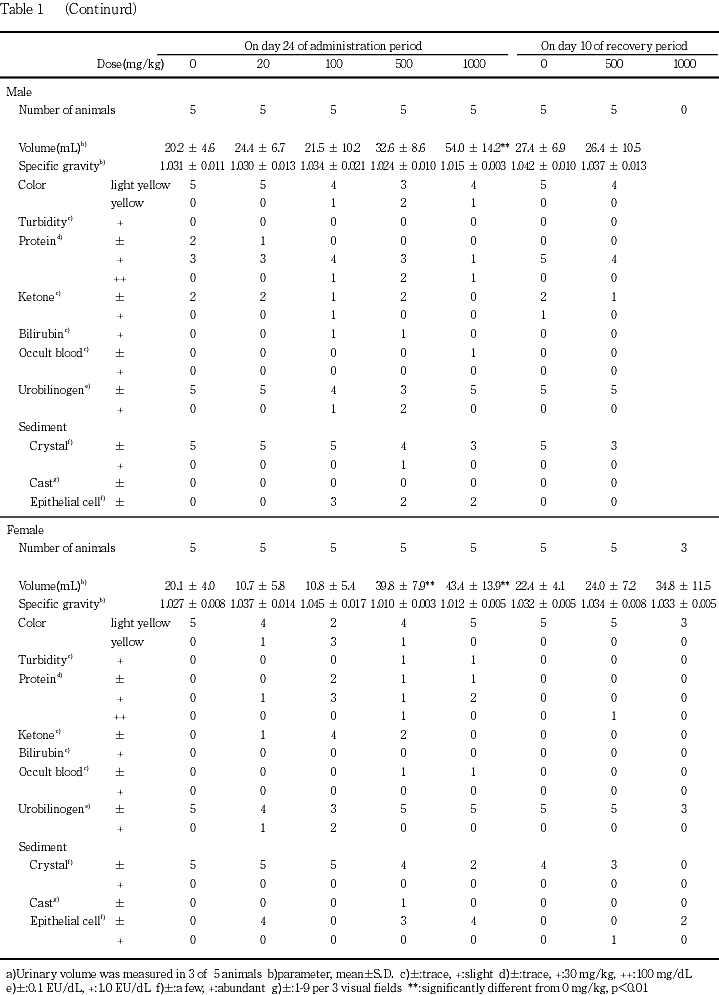
腎臓に関する所見として,摂水量および尿量が500 mg/kg以上の投与群で増加した.同群では,剖検時の検査で血漿中クレアチニン濃度が増加し,腎臓の変色および腫大,組織学的に乳頭壊死,好塩基性尿細管の増加,尿細管拡張,蛋白性尿円柱等が観察された.好塩基性尿細管の増加は,100 mg/kg以上の投与群の皮質でもみられた.その他,切迫屠殺例では,血漿中の尿素窒素濃度が増加した.
肝臓に関する所見として,1000 mg/kg投与群では,γ-GTP,GPTおよびLDH活性の増加がみられ,肉眼的に肝臓は腫大して暗色調を呈し,組織学的に肝細胞は肥大してその細胞質は好酸性で顆粒状を呈し,一部の例で肝臓の限局性壊死がみられた.この肝臓の肉眼的変化は500 mg/kg投与群から,組織学的変化は,100 mg/kg投与群から認められた.
消化管に関する所見として,1000 mg/kg投与群では,投与初期に黒色便が観察され,組織学的には,前胃粘膜上皮の過形成およびびらん,腺胃のびらんおよび潰瘍等が散見された.この他,粘膜下織の水腫が一部の例でみられた.黒色便および前胃粘膜の変化は500 mg/kg投与群から,粘膜下織の水腫および腺胃の所見は100 mg/kg投与群から散見された.100 mg/kg 以上の投与群で投与第2日から,被験物質の刺激性によると推測される一過性の流涎が投与直後に認められた.
血液に関する所見として,1000 mg/kg投与群で投与初期に皮膚色蒼白が散見され,500 mg/kg以上の投与群で肝臓のクッパー細胞のヘモジデリン沈着および脾臓のヘモジデリン沈着の増加がみられた.切迫屠殺例では,赤血球数,血色素量およびヘマトクリット値が低く,網状赤血球比率が高い傾向にあり,剖検時に脾臓の小型化および淡色化が散見された.
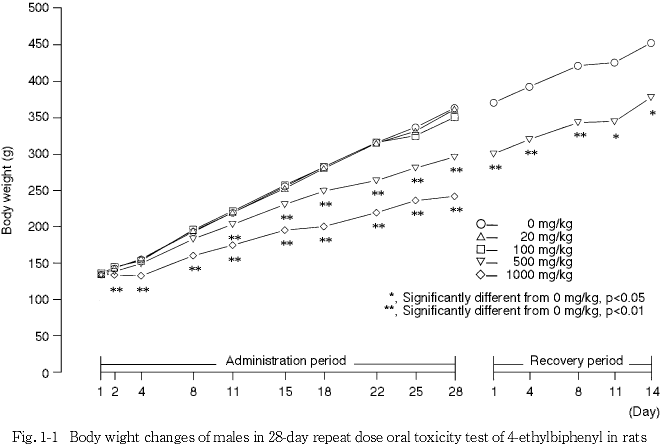
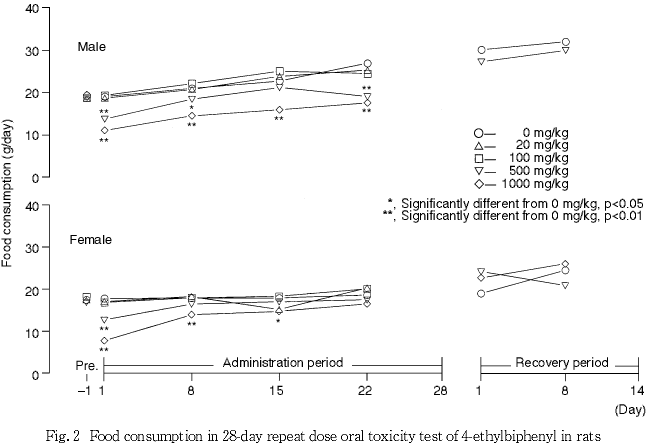
この他,500 mg/kg以上の投与群では体重が低い傾向にあり,摂餌量も減少した.また,同群では,胸腺の萎縮が認められた.
回復期間終了後,多くの所見が軽減ないし消失したが,腎乳頭壊死等は回復傾向が認められなかった.死亡および切迫屠殺例の主な変化は投与期間終了時屠殺例と同様であったが,腎臓,胃,脾臓および胸腺ではより所見が強く,投与初期の剖検例の肝臓の所見はより軽度であった.
以上のことから,4-エチルビフェニルの反復投与により,100 mg/kg以上の用量で,主として腎臓の尿細管および乳頭が障害され,1000 mg/kgでは,重篤な個体は死亡することが明らかとなった.また,100 mg/kg以上の用量で,肝臓の代謝酵素を誘導する一方,1000 mg/kgでは,肝障害が示唆された.これらの腎臓および肝臓の変化は,腎乳頭を除き,投与中止により回復する傾向にあった.また,被験物質は刺激性を有することが示唆され,これに起因すると考えられる胃を中心とした消化管粘膜の損傷も100 mg/kg以上の用量で生じた.これらのことから,本試験条件下における4-エチルビフェニルの無影響量は雌雄とも20 mg/kg/dayであると考えられた.
群分けは,検疫期間中に異常がなかった動物を用い,投与開始前日の体重に基づいて体重別層化無作為抽出法により行った.動物数は,雌雄とも0,500および1000 mg/kg投与群を回復試験を予定した5匹を含め各群10匹とし,20および100 mg/kg投与群を各群5匹としたが,結果にも示したように投与期間中に死亡および切迫屠殺例があったため,回復試験は雌雄の溶媒対照群および雌の中用量2群では各5匹,雄の中用量2群では4匹,雌の高用量群では3匹を,それぞれ動物番号が若い方から選択して行った.生存例が5例となった雄の高用量群は,回復試験を実施しなかった.
 (コールターエレクトロニクス(株))により赤血球数,白血球数,平均赤血球容積,血小板数(以上,電気抵抗法)および血色素量(吸光度法)を測定し,これらを基にヘマトクリット値,平均赤血球血色素量および平均赤血球血色素濃度を算出した.血液の一部は塗抹標本とし,白血球分類(Wright-Giemsa染色)および網状赤血球比率(Brecher法)を求めた.また,クエン酸ナトリウムを抗凝固剤として採取した血液を用いてプロトロンビン時間および活性部分トロンボプラスチン時間(光散乱検出法,CA-1000,東亜医用電子(株))を測定した.また,切迫屠殺例でも可能な限り定期解剖例と同様の検査をしたが,プロトロンビン時間および活性部分トロンボプラスチン時間は測定しなかった.骨髄像検査は,大腿骨骨髄を用いて塗抹標本を作製(Wright-Giemsa染色)し,投与期間終了時剖検例の溶媒対照群および高用量群,ならびに切迫屠殺例について実施した.
(コールターエレクトロニクス(株))により赤血球数,白血球数,平均赤血球容積,血小板数(以上,電気抵抗法)および血色素量(吸光度法)を測定し,これらを基にヘマトクリット値,平均赤血球血色素量および平均赤血球血色素濃度を算出した.血液の一部は塗抹標本とし,白血球分類(Wright-Giemsa染色)および網状赤血球比率(Brecher法)を求めた.また,クエン酸ナトリウムを抗凝固剤として採取した血液を用いてプロトロンビン時間および活性部分トロンボプラスチン時間(光散乱検出法,CA-1000,東亜医用電子(株))を測定した.また,切迫屠殺例でも可能な限り定期解剖例と同様の検査をしたが,プロトロンビン時間および活性部分トロンボプラスチン時間は測定しなかった.骨髄像検査は,大腿骨骨髄を用いて塗抹標本を作製(Wright-Giemsa染色)し,投与期間終了時剖検例の溶媒対照群および高用量群,ならびに切迫屠殺例について実施した.
 法),アルカリフォスファターゼ活性(GSCC法),GOT活性(IFCC法),GPT活性(IFCC法),LDH活性(Wr
法),アルカリフォスファターゼ活性(GSCC法),GOT活性(IFCC法),GPT活性(IFCC法),LDH活性(Wr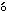 blewski-La Due法),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),トリグリセライド濃度(GPO・DAOS法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(イオン電極法)を測定した.
blewski-La Due法),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),トリグリセライド濃度(GPO・DAOS法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(イオン電極法)を測定した.

回復期間終了時屠殺例では,1000 mg/kg投与群の雌で赤血球数,血色素量およびヘマトクリット値が有意に減少し,500 mg/kg投与群の雌でも血色素量が有意に減少した.また,500 mg/kg投与群の雄では,平均赤血球容積が有意に減少し,プロトロンビン時間および活性部分トロンボプラスチン時間が有意に短縮した.その他の検査項目では,いずれの時点の検査でも有意な変化は認められなかった.なお,これらの変化は,投与期間終了時の変化と関連するものではなかったため,投与を中止したことによる変化ではないと考えられた.
切迫屠殺例では,投与第5日に屠殺した1000 mg/kg投与群の雌1例を除き,雌雄とも赤血球数,血色素量およびヘマトクリット値が減少傾向を示し,網状赤血球比率が増加傾向を示した.白血球比率では,分葉核好中球比率が増加し,リンパ球比率が減少傾向を示した.一方,投与第5日に屠殺した1000 mg/kg投与群の雌1例では,血色素量,血小板数およびヘマトクリット値が増加した.
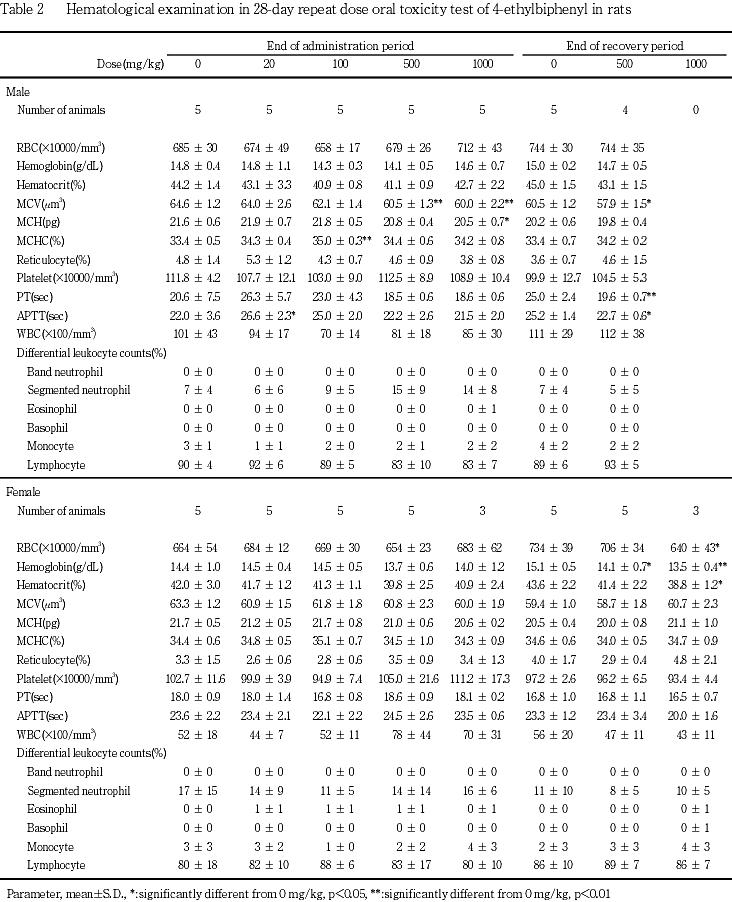
回復期間終了時屠殺例では,1000 mg/kg投与群の雌でトリグリセライド濃度,ナトリウム濃度およびγ-GTP活性が有意に増加し,総蛋白濃度が有意に減少した.また,500 mg/kg投与群の雄でブドウ糖濃度が有意に減少し,無機リン濃度が有意に増加した.その他に有意な変化は認められなかったが,個体別にみて,1000 mg/kg投与群の雌1例でLDH,GPTおよびGOT活性が高値を示した.
切迫屠殺例では,全体的に尿素窒素濃度が増加し,その他,A/G比,クレアチニン濃度,無機リン濃度,カリウム濃度,GPT活性およびγ-GTP活性が増加した個体ならびにカルシウム,ナトリウム,カリウムおよび塩素濃度が減少した個体が散見された.
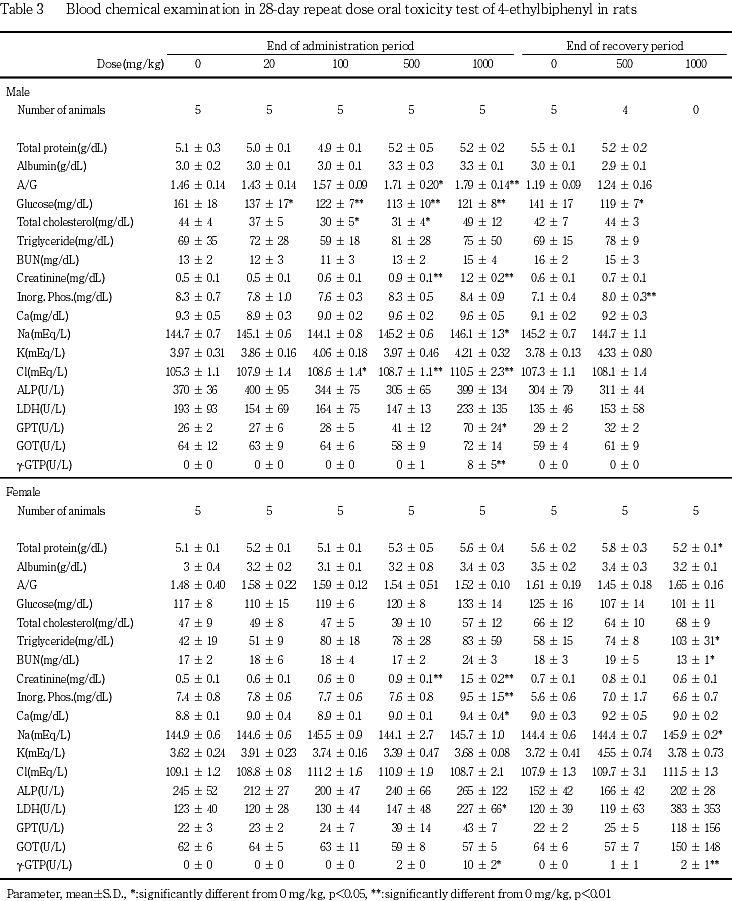
回復期間終了時屠殺例では,500 mg/kg以上の投与群の雌で肝臓の相対重量が増加し,500 mg/kg投与群の雌雄および1000 mg/kg投与群の雌で腎臓の相対重量が有意に増加した.その他,有意な変化が散見されたが,いずれも投与期間終了時に認められた変化とは関連がなかった.また,切迫屠殺例では,明らかな変化は認められなかった.
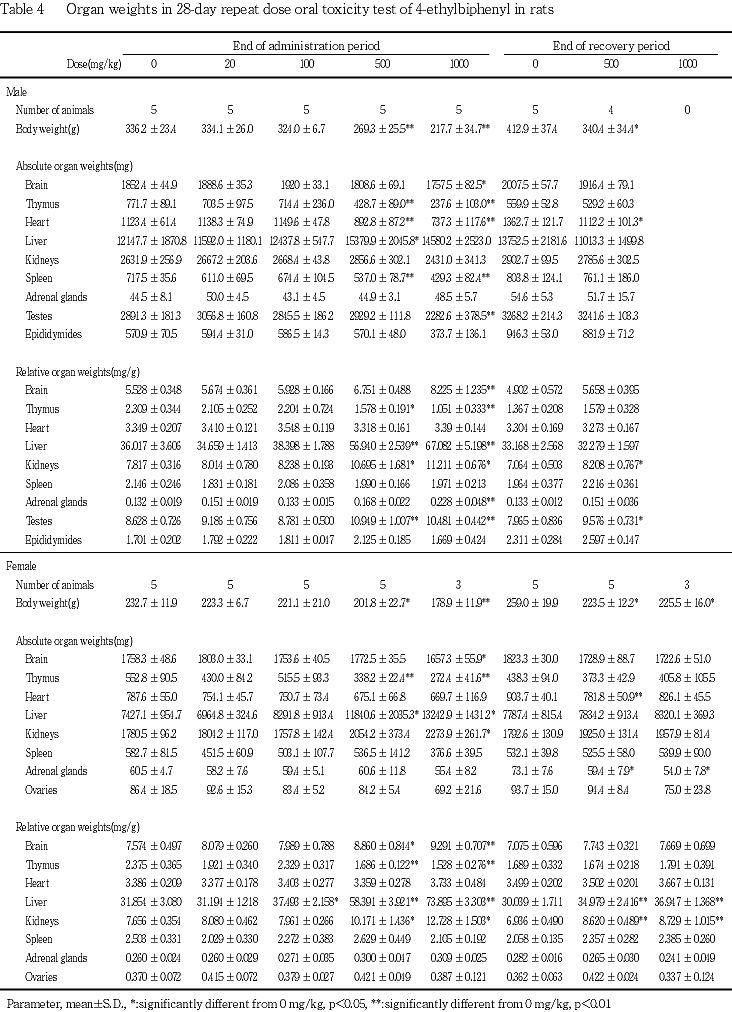
回復期間終了時屠殺例の剖検では,被験物質投与群の所見として,雌雄で肝臓の暗色化,腎臓の腫大,淡色化あるいは淡色領域,1000 mg/kg投与群の雌で前胃部と腹腔内臓器との癒着,500 mg/kg投与群の雌で腺胃粘膜の暗色点などがみられた.
死亡例および切迫屠殺例では,各群で,腎臓の淡色化,軟弱化および腫大,腎乳頭の淡色化あるいは黄色化,脾臓の小型化ないし淡色化,出血によると考えられる腸内容の暗色化,胸腺の小型化および混濁が散見された.また,1000 mg/kg投与群では,肝臓の暗色化,前胃粘膜の潰瘍あるいは修復像と考えられる陥凹部,白濁,肥厚,白斑,腺胃の陥凹部もみられた.その他,少数例で前胃の肝臓および脾臓等との癒着,肺の暗色化あるいは暗色領域,卵巣,前立腺および精嚢の小型化等も認められた.
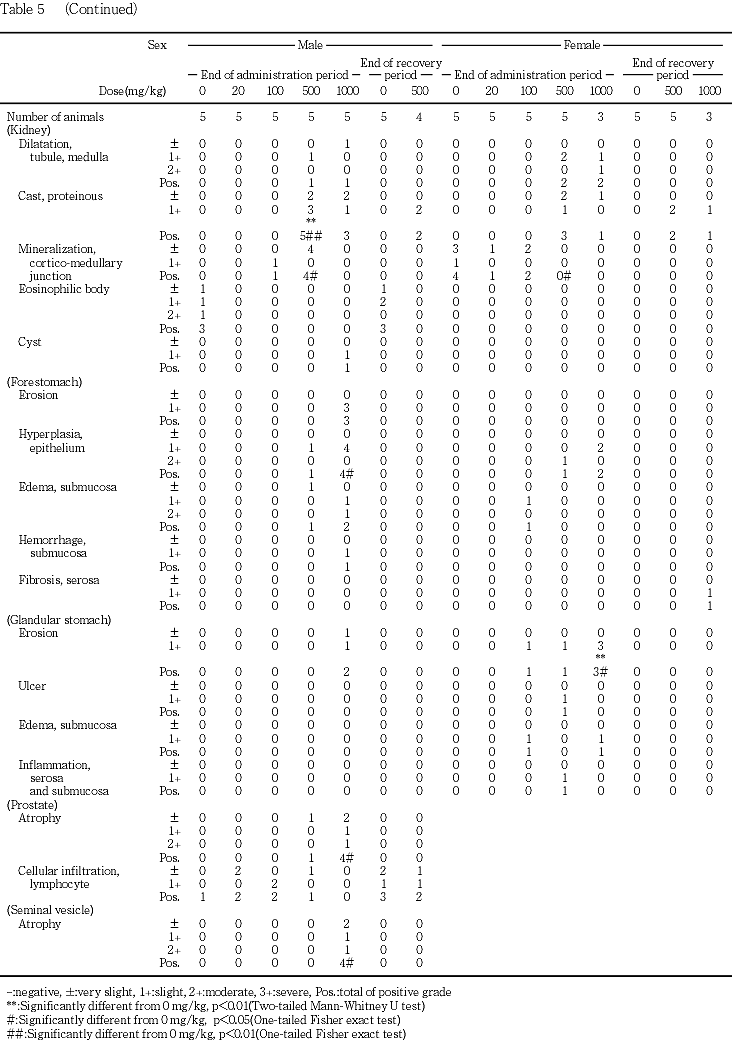
腎臓では,500 mg/kg以上の投与群の雌雄で乳頭壊死がみられ,壊死部に鉱質沈着を伴う例もあった.また,髄質に好塩基性尿細管がみられ,1000 mg/kg投与群の雌でその程度および発現頻度とも有意に増加した.同群の雌雄では,皮質あるいは髄質の尿細管拡張および蛋白性尿円柱がみられ,このうち1000 mg/kg投与群の雌で皮質の尿細管拡張が,500 mg/kg投与群の雄で蛋白性尿円柱が,それぞれその程度および発現頻度とも有意に増加した.この他,溶媒対照群を含む各群で皮質に好塩基性尿細管がみられたが,100 mg/kg以上の投与群の雌雄ではその程度が有意に増加した.その他,溶媒対照群および一部の被験物質投与群で皮髄境界部に鉱質沈着がみられ,その頻度は,500 mg/kg投与群の雄で有意に増加し,雌で有意に減少した.
前胃では,1000 mg/kg投与群の雄数例で粘膜のびらんが,500 mg/kg以上の投与群の雌雄で修復像と考えられる上皮の過形成が認められ,1000 mg/kg投与群の雄において上皮の過形成の頻度が有意差を示した.この他,100 mg/kg投与群の雌および500 mg/kg以上の投与群の雄で粘膜下織の水腫が,1000 mg/kg投与群の雄で粘膜下織の出血が散見された.
腺胃では,100 mg/kg以上の投与群の雌および1000 mg/kg投与群の雄でびらんないし潰瘍がみられ,1000 mg/kg投与群の雌ではびらんの程度および発現頻度が有意に増加した.また,びらんや潰瘍に伴って粘膜下織の水腫または粘膜下織および漿膜の炎症が散見された.
脾臓では,溶媒対照群を含む各群でヘモジデリン沈着がみられたが,その程度は1000 mg/kg投与群の雌雄で有意に増加し,500 mg/kg投与群の雌雄でもやや増加した.この他,溶媒対照群を含む全例で髄外造血がみられたが,1000 mg/kg投与群の雄ではその程度が有意に減少した.
胸腺では,500 mg/kg以上の投与群の雌雄で萎縮がみられ,1000 mg/kg投与群の雌雄では,その程度および頻度とも有意に増加した.
その他,肉眼的病変部がみられた各器官では,肺の暗色領域での出血,好中球浸潤,肺胞マクロファージの増加および胸膜の線維化,前立腺および精嚢の萎縮,皮膚脱毛部の被毛の変性等が認められた.この他,いくつかの器官・組織で変化がみられたが,被験物質投与によると考えられる変化ではなかった.
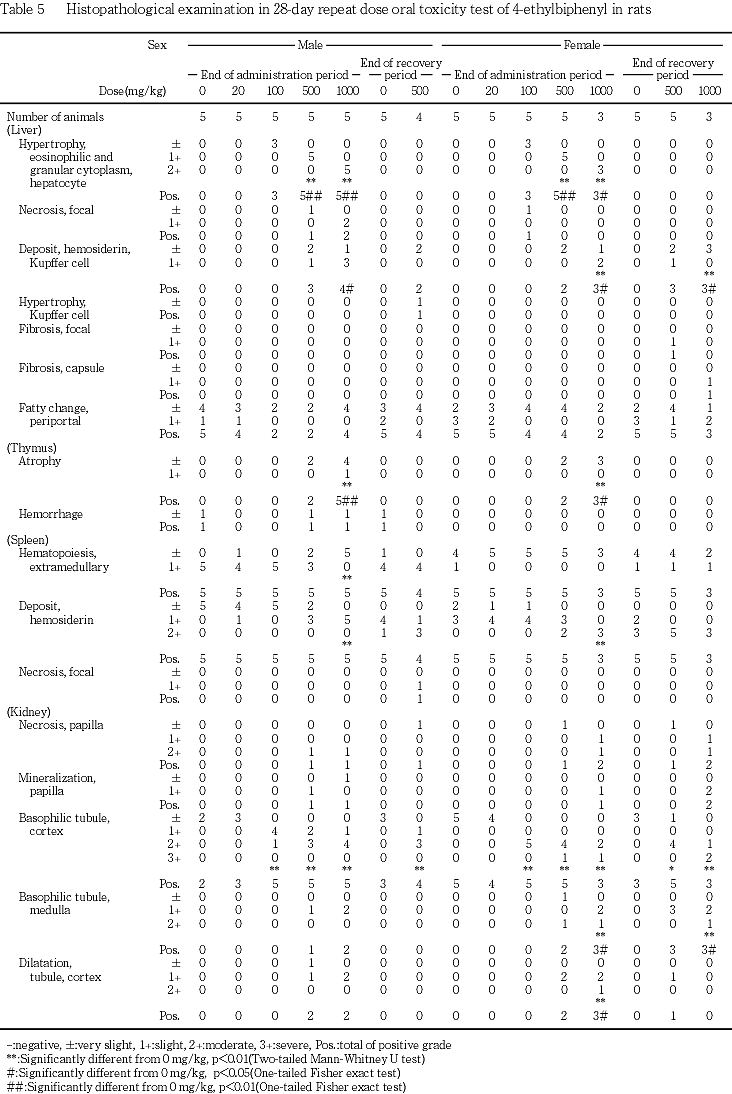
腎臓では,各被験物質投与群で乳頭壊死がみられ,1000 mg/kg投与群の雌では腎乳頭に鉱質沈着を伴っていた.また,溶媒対照群を含む各群で皮質に好塩基性尿細管がみられたが,被験物質投与群でその程度が有意に増加した.被験物質投与群の雌では,好塩基性尿細管が髄質にもみられ,1000 mg/kg投与群でその程度および発現頻度が有意差を示した.この他,蛋白性尿円柱が各被験物質投与群でみられたが,皮質の尿細管拡張は500 mg/kg投与群の雌1例でみられたのみであった.
前胃では,1000 mg/kg投与群の雌1例の漿膜に線維化がみられた.
脾臓では,被験物質投与群の雌雄で,溶媒対照群と比較してヘモジデリン沈着の程度がやや強かったが,髄外造血の程度に差はなかった.その他,500 mg/kg投与群の雄1例では,脾臓に壊死がみられた.
投与期間終了時屠殺例でみられた上記所見の多くが,回復期間終了時屠殺例において程度および発現頻度が軽減ないし消失したが,いくつかの所見は回復傾向が認められなかった.その他,2例の脱毛部位のうち,1例で被毛の変性がみられたが,他の1例では異常が認められなかった.この他には,溶媒対照群の雄1例で胸腺に出血がみられたのみであった.
腎臓では,全例で腎乳頭の壊死がみられた.また,皮質および髄質には好塩基性尿細管がみられ,ほとんどの例で同時に尿細管上皮の壊死が認められたことから,これら好塩基性尿細管の多くは尿細管上皮の再生像であると考えられた.また,皮質および髄質での尿細管の拡張が散見され,変性物を含む顆粒状の尿円柱が認められる例もあった.
前胃では,1000 mg/kg投与群の雌雄で潰瘍が散見され,上皮の過形成や漿膜の炎症を伴っていた.
腺胃では,びらん,粘膜の鉱質沈着,漿膜の炎症および筋層の壊死が散見された.
脾臓では,1000 mg/kg投与群で雌2例を除く全例に萎縮がみられた.また,多くの例でヘモジデリン沈着が観察された.その他,前胃に潰瘍があり,脾臓との間に癒着がみられた例では,被膜に炎症が認められた.
胸腺では,全例にリンパ球の壊死がみられ,軽度であった1例を除き,主に皮質のリンパ球が広範囲に壊死していた.また,出血も数例でみられた.
死亡および切迫屠殺例では,肝臓を除き,多くの所見の程度が投与期間終了時屠殺例と比較して増加した.その他,心筋変性や精細管の多核巨細胞,肺の赤色ないし暗色領域の水腫,前立腺および精嚢の萎縮,腸間膜リンパ節の萎縮等がみられたが,これらはいずれも死亡ないし瀕死状態につながると考えられる変化ではなかった.
1000 mg/kg投与群で摂水量および尿量の増加,尿蛋白陽性,混濁,潜血,沈渣中の結晶の増加および尿酸ナトリウム結晶析出等の尿性状の変化,血漿クレアチニン濃度の増加等が認められた.同群の腎臓は腫大し,淡色化,軟弱化,皮質および髄質の変色等が散見され,組織学的には,好塩基性尿細管の増加および尿細管の拡張,蛋白性尿円柱,腎乳頭壊死および鉱質沈着等も認められた.これらの変化の多くが500 mg/kg投与群でもみられ,好塩基性尿細管は100 mg/kg投与群の皮質でも認められた.死亡および切迫屠殺例では,組織学的に尿細管上皮の壊死,顆粒状尿円柱などもみられ,血漿中尿素窒素濃度の増加もあった.この死亡および切迫屠殺例で尿細管上皮の壊死がみられたことから,好塩基性尿細管の多くが再生尿細管であると考えられた.また,尿量の増加とそれに伴う血漿中電解質濃度の変化は,再吸収機能が未熟な再生尿細管が増加したことにより生じたと考えられ,尿細管の拡張は,この尿量増加に加え,腎乳頭損傷時にみられる尿のうっ滞が一因であると考えられた.これらのことから,反復投与による主な死因は急性腎不全であると考えられる.回復期間では,ほとんど再生されない1)とされる腎乳頭の損傷には回復傾向がみられなかったが,尿量,摂水量および尿細管拡張には回復傾向がみられたことから,腎障害は,乳頭壊死を除き,投与中止により回復することが示唆された.ところで,4-イソプロピルビフェニルを投与することにより,本試験と同様の腎乳頭壊死を伴う腎毒性が生じることが知られており,この物質の主な代謝産物であるγ-メチル-4-フェニルマンデリン酸を250 mg/kgの用量で単回腹腔内投与することにより,腎臓に高濃度に蓄積されて同様の腎毒性を示すことが報告されている2).このことおよび後述の肝臓に関する変化から,本試験で認められた腎毒性も代謝産物による可能性を考慮する必要がある.なお,1,1'-ビフェニルを0.5 %の濃度で60日間反復混餌投与することでも本試験と同様の尿量の増加を伴う尿細管の拡張が報告されているが3),この試験では,腎炎がみられるものの,本試験のような腎乳頭壊死はなく,また,溶解性が低い1,1'-ビフェニルの代謝産物が腎臓で濾過されることによる管腔内浸透圧に関わる変化であると考察されており,本試験の腎障害とは異なる変化であると考えられた.
1000 mg/kg投与群で,肝重量が増加し,肉眼的には暗色調および腫大が認められ,組織学的には肝細胞が肥大し,細胞質が好酸性で顆粒状を呈していた.これらの所見は,100および500 mg/kg投与群でもみられたが,いずれも投与中止により消失した.この好酸性顆粒は,色調および形状から,ライソゾームないしペルオキシゾームであると考えられる.さらに,1000 mg/kg投与群では,ペントバルビタールナトリウム麻酔の導入が悪く,薬物代謝酵素の誘導が示唆された.この他,100 mg/kg投与群の雌および500 mg/kg以上の投与群の雄で限局性壊死が認められ,1000 mg/kg投与群では,γ-GTP活性,GPT活性およびLDH活性が増加した.これらの変化の多くが回復期間終了時屠殺剖検例では軽減ないし消失していたことから,肝臓が受けた影響は,投与中止により軽減することが示唆された.なお,500 mg/kg以上の投与群では血漿が黄色を呈したが,ビリルビンによるものではないことは予備試験で確認さられており,詳細は明らかでないが,血中に分布した被験物質またはその代謝物に由来する可能性がある.
消化管では,500 mg/kg以上の投与群において,前胃粘膜の潰瘍や陥凹部および水腫あるいは潰瘍の修復像と考えられる小突起などが散見され,粘膜上皮のびらんおよびその修復像と考えられる上皮の過形成が認められた.100 mg/kg以上の投与群では粘膜下織の水腫および粘膜下織の出血等も散見された.本試験では,100 mg/kg以上の投与群の多数例で投与に伴い一過性の流涎が観察され,500 mg/kg以上の投与群では,投与の際の保定のみでも観察される場合があったことから,被験物質が苦味ないし局所刺激性を有し,反復投与することにより反射的に流涎が生じた可能性が考えられた.さらに,前胃は刺激性物質に対する変化がよく発現する部位として知られており4),今回の所見は局所刺激性を有する物質の投与による粘膜損傷を示唆するものであった.一方,本試験では,100 mg/kg以上の投与群の一部の例で腺胃のびらんないし潰瘍がみられ,びらんや潰瘍に伴って粘膜下織の水腫または粘膜下織および漿膜の炎症が散見された.腺胃粘膜は粘液細胞から分泌される粘液に保護されているため前胃と比べて刺激による損傷を受けにくいとされているが,被験物質がこの粘液層を通過し,粘膜に刺激を与えた可能性も考えられる.しかし,ストレスや化学物質の作用によっても腺胃粘膜傷害は生じるため,本試験結果からは,いずれの機序によるものであるのか判断できなかった.その他,一般状態で投与初期に黒色便が観察されたが,その多くが前胃および腺胃粘膜のびらんおよび潰瘍に伴う出血によるものであると考えられた.
1000 mg/kg投与群で投与初期に皮膚色蒼白が散見され,死亡および切迫屠殺例では,脾臓の小型化ないし淡色化および組織学的検査により萎縮が観察されて,さらに切迫屠殺例ではヘマトクリット値および血色素量が減少したことから,貧血が示唆された.一方,投与期間終了時屠殺例では,病理組織学的に500 mg/kg以上の投与群の雌雄で,クッパー細胞にヘモジデリンが沈着しており,脾臓でもヘモジデリン沈着が増加したため,貧血の原因には消化管出血だけではなく,溶血の関与が示唆された.しかし,肝臓および脾臓でみられたヘモジデリン沈着は顕著なものではなかったこと,予備試験で血漿中ビリルビン濃度の増加がみられなかったことから,溶血は軽度であったと考えられた.また,投与期間終了時屠殺例では貧血,骨髄毒性を示唆する所見はなかったこと,切迫屠殺例では貧血に伴い,網状赤血球比率が増加したことから,投与初期の貧血は速やかに回復したと考えられる.
胸腺では,死亡および切迫屠殺例でリンパ球壊死および壊死後の変化と推測される萎縮がみられ,血液中のリンパ球比率が減少した.投与期間終了時屠殺例でも500 mg/kg以上の投与群で胸腺萎縮が認められた.このような変化は,ストレスによる非特異的な変化として知られており,一因として,コルチゾルによるTリンパ球のアポトーシスの亢進などが考えられている5).これらのことから,この胸腺の変化は投与期間初期の腎臓および消化管の障害による急激な状態の悪化に伴う二次的変化であることが示唆された.この他,500 mg/kg以上の投与群でみられた体重増加抑制,摂餌量の減少,腹臥位姿勢および呼吸深大等の一般状態の変化も同様の原因によるものと考えられ,剖検時の生殖器の萎縮も個体別にみて,胸腺に変化がみられた例とほぼ一致していることから,発育期のストレス負荷による二次的変化であると考えられた.
その他,500 mg/kg以上の投与群で散見された腹部周囲の脱毛は,他の群ではみられず,投与中止により回復傾向がみられたことから,被験物質投与に起因した変化である可能性が示唆されたが,その原因は明らかとはならなかった.
以上のことから4-エチルビフェニルの反復投与により,100 mg/kg以上の用量で,主として腎臓の尿細管および乳頭が損傷され,1000 mg/kgでは重篤な腎不全に至った個体は死亡することが明らかとなった.また,100 mg/kg以上の用量では,肝臓で酵素誘導をひきおこす可能性がある一方,1000 mg/kgの用量では,肝障害も示唆された.これらの腎臓および肝臓の変化は,腎乳頭の障害を除き,投与中止により回復する傾向が認められた.また,被験物質は刺激性を有することが示唆され,これに起因すると考えられる,前胃を中心とした消化管粘膜の損傷も100 mg/kg以上の用量で生じた.これらのことから,本試験条件下における4-エチルビフェニルの無影響量は雌雄とも20 mg/kg/dayであると考えられた.
| 1) | I. G. Sipes, C. A. McQueen, A. J. Gandolfi, "Comprehensive toxicology, Volume 7 Renal toxicology" Elsevier science Ltd., Oxford, 1997, pp. 289-291 |
| 2) | G. C. Todd, D. G. Hoffman, N. R. Bernhard, G. F. Kiplinger, Vet. Pathol. 12(1), 69(1975) |
| 3) | N. B. Albert, M. A. Anthony, D. Floyd, and J. C. Albin Jr., Toxcol. Appl. Pharmacol., 3, 560(1961) |
| 4) | J. R. Glaister,高橋道人監訳,"毒性病理学の基礎,"ソフトサイエンス社,東京,1992, pp. 87 |
| 5) | I. G. Sipes, C. A. McQueen, A. J. Gandolfi, "Comprehensive toxicology, Volume 5 Toxicology of the immune system" Elsevier science Ltd., Oxford, 1997, pp. 49 |
| 連絡先 | |||
| 試験責任者: | 大原直樹 | ||
| 試験担当者: | 森村智美,加藤博康,関 剛幸,笠間菊子,吉村愼介 | ||
| (財)食品薬品安全センター 秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Naoki Ohara(Study Director) Tomomi Morimura, Hiroyasu Katoh, Takayuki Seki, Kikuko Kasama, Shinsuke Yoshimura | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||