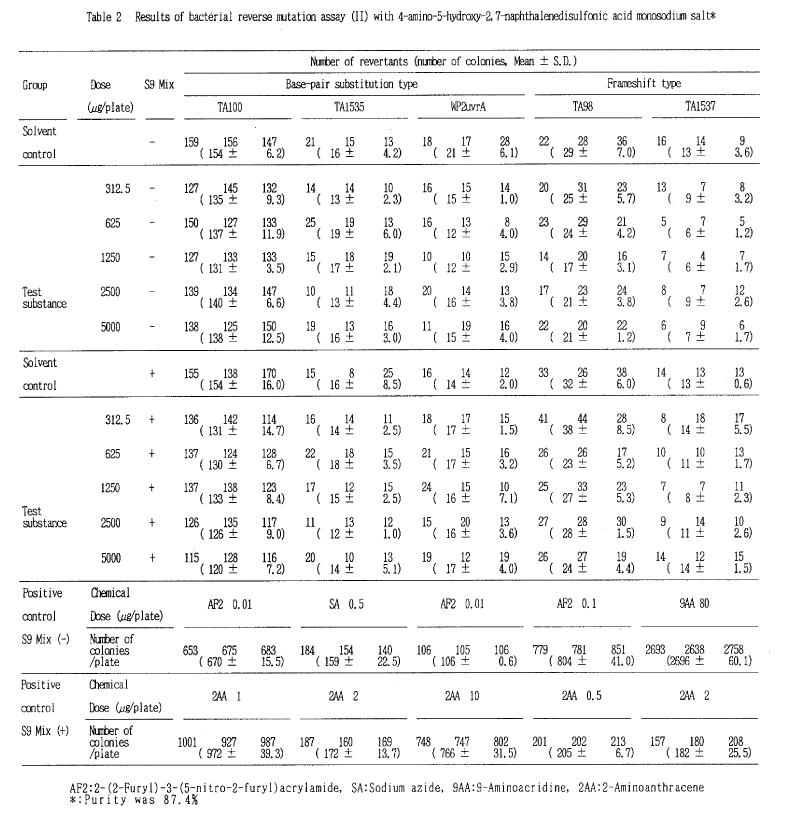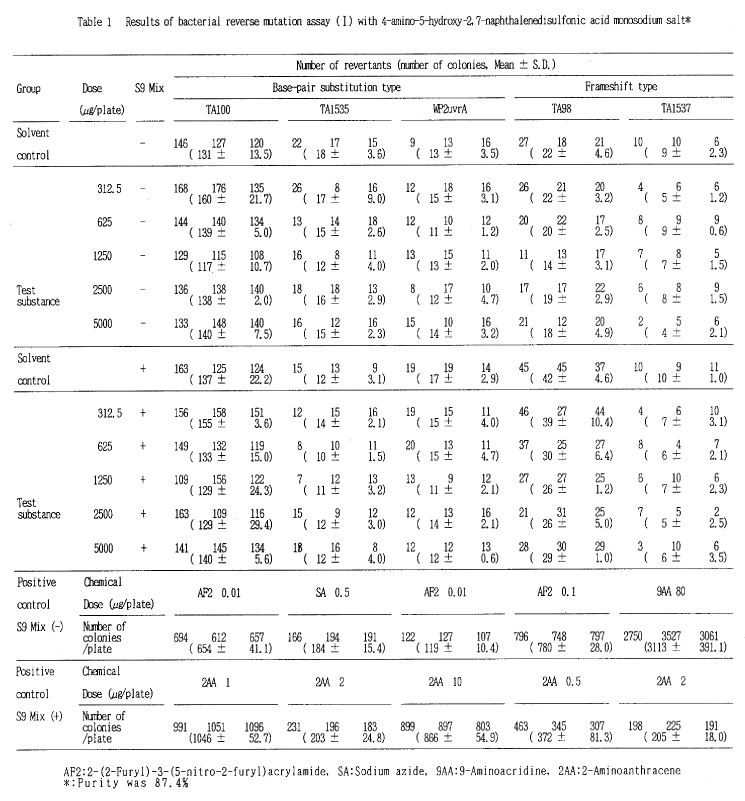
検定菌としてSalmonella typhimurium TA100、TA1535、TA98、TA1537およびEscherichia coli WP2 uvrAを用い、直接試験および代謝活性化試験のいずれも、用量設定試験は50〜5000 μg/プレートの用量で、本試験は312.5〜5000 μg/プレートの用量で試験を行った。
その結果、2回の本試験とも、用いた5種類の検定菌について、いずれの用量でも復帰変異コロニー数の増加が認められなかったことから、4−アミノ−5−ヒドロキシ−2, 7−ナフタレンジスルホン酸モノナトリウムは、用いた試験系において変異原性を有しない(陰性)と判定された。
この試験は、サルモネラ(ネズミチフス菌)におけるヒスチジン要求性から非要求性への復帰変異1)、ならびに大腸菌におけるトリプトファン要求性から非要求性への復帰変異2)を指標とした変異原の検出系である。
試験は、被験物質をそのまま検定菌に作用させる直接試験と、哺乳動物のもつ薬物代謝酵素(S9混液)によって産生される被験物質の代謝物の変異原性を試験する代謝活性化試験とからなっている。
本試験は、「新規化学物質に係る試験の方法について」(昭和62年3月31日、環保業第237号、薬発第306号、62基局第303号)およびOECD化学品試験法ガイドライン:471、472に準拠し、化学物質GLP(昭和59年3月31日、環保業第39号、薬発第229号、59基局第85号、改訂昭和63年11月18日、環企研第233号、衛生第38号、63基局第823号)に基づいて実施した。
Escherichia coli WP2uvrA株は1979年5月9日に国立遺伝学研究所の賀田恒夫博士から分与を受けた。
検定菌は、−80℃以下で凍結保存した。試験に際して、0.5%塩化ナトリウム添加ニュートリエントブロス(Difco)を入れたL字型試験管に種菌を接種し、37℃、10時間往復振とう培養したものを検定菌液とした。
4−アミノ−5−ヒドロキシ−2, 7−ナフタレンジスルホン酸モノナトリウムは、ジメチルスルホキシド(ロット番号:DSL 5887、和光純薬工業(株))を用いて50 mg/mlになるように調製した後、同溶媒で更に公比2ないし3で希釈したものを、速やかに試験に用いた。なお、調製にあたって、純度換算は行わなかった。
試験の開始に先立って、秦野研究所において4−アミノ−5−ヒドロキシ−2, 7−ナフタレンジスルホン酸モノナトリウム塩のDMSO溶液中での安定性試験を行った。本試験における最高濃度(50 mg/ml)および最低濃度(3mg/ml)の2濃度について、室温遮光条件下で実施した。その結果、調製後3時間における各3サンプルの平均含量は、それぞれ初期値の平均(0時間)に対して、96.1および101%であった。これらの値は、当研究所の標準操作手順書の基準(初回の測定平均値の90%以上)を満たしていた。
また、本試験に用いた調製検体について、含量測定試験を行った結果、50mg/ml溶液の含量は既定濃度に対し、98.4〜101%、3.125 mg/ml溶液は、103〜108%であった。これらの値も当研究所の標準操作手順書の基準(平均含量は添加量の85%以上)を満たしていた。
以上の結果から、4−アミノ−5−ヒドロキシ−2, 7−ナフタレンジスルホン酸モノナトリウムはDMSO溶液中では安定であり、また調製液中の被験物質の含量は所定の値の範囲内にあることが確認された。
| AF-2 | : | フリルフラマイド(上野製薬 (株) ) |
| SA | : | アジ化ナトリウム(和光純薬工業 (株) ) |
| 9-AA | : | 9-アミノアクリジン(東京化成工業 (株) ) |
| 2-AA | : | 2-アミノアントラセン(和光純薬工業 (株) ) |
| (A) | バクト・アガー(Difco) | 0.6% |
| 塩化ナトリウム | 0.5% | |
| (B)* | L−ヒスチジン | 0.5 mM |
| ビオチン | 0.5 mM |
| 硫酸マグネシウム・7水和物 | 0.2g |
| クエン酸・1水和物 | 2g |
| リン酸水素二カリウム | 10g |
| リン酸水素アンモニウムナトリウム・4水和物 | 3.5g |
| グルコース | 20g |
| バクト・アガー(Difco) | 15g |
| S9** | 0.1 ml |
| 塩化マグネシウム | 8 μmol |
| 塩化カリウム | 33 μmol |
| グルコース・6リン酸 | 5 μmol |
| NADH | 4 μmol |
| NADPH | 4 μmol |
| 0.2Mリン酸緩衝液(pH 7.4) | 0.5 ml |
| **: | 7週齢のSprague-Dawley系雄ラットをフェノバルビタール(PB)および5、6-ベンゾフラボン(BF)の併用投与で酵素誘導して作製したS9(キッコーマン (株) )を用いた。 |
小試験管中にトップアガー2 ml、被験物質調製液0.1 ml、リン酸緩衝液0.5 ml(代謝活性化試験においてはS9混液0.5 ml)、検定菌液0.1 mlを混合したのち合成培地平板上に流して固めた。また、対照群として被験物質調製液の代わりにDMSO、または数種の陽性対照物質溶液を用いた。各検定菌ごとの陽性対照物質の名称および用量は表中に示した。培養は37℃で48時間行い、生じた復帰変異コロニー数を算定し、それぞれその平均値と標準偏差を求めた。
したがって、本試験における最高用量を、すべての検定菌で、直接試験および代謝活性化試験ともに5000 μg/プレートとし、公比2で5用量を設定することとした。
用量設定試験において、WP2の最低用量、50 μg/プレートで陰性対照の2倍以上の変異コロニーが認められたが、本試験では2回とも、WP2において変異コロニー数の増加は認められなかった。以上から、WP2の用量設定試験における変異コロニー数の増加は偶発的なものと考えられた。
以上の結果に基づき、4−アミノ−5−ヒドロキシ−2, 7−ナフタレンジスルホン酸モノナトリウムは、用いた試験系において変異原性を有しないもの(陰性)と判定した。
| 1) | D. M. Maron and B. N. Ames, Mutation Research. 113, 173-215 (1983) |
| 2) | M. H. Green, "Handbook of Mutagenicity Test Procedures," ( B. J. Kilbey, M. Legator, W. Nichols, and C. Ramel eds.) , Elsevier Science Publisher, New York, 1984, p161. |
| 連絡先: | |||
| 試験責任者 | 澁谷徹 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257 神奈川県秦野市落合 729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence: | |||
| Shibuya, Tohru | |||
| Hatano Research Institute, Food and Drug Safety Center | |||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257, Japan | |||
| Tel 81-463-82-4751 | Fax 81-463-82-9627 | ||