リン酸ドデシルエステルナトリウム塩の0(対照群),250,500及び1000 mg/kgを,Sprague-Dawley系SPFラットの雄には交配前14日間及び交配期間を通して剖検前日(42日間投与)まで,雌には交配前14日間及び交配期間並びに妊娠期間を通して授乳4日まで(42〜45日間投与)投与し,反復投与毒性及び生殖発生毒性を検討した.更に,0及び1000 mg/kg投与群については42日間投与した後,14日間の回復期間を設け,毒性変化の可逆性を検討した.
一般状態,詳細な一般状態の観察,機能検査,握力測定,自発運動量の測定,体重,摂餌量,尿検査(摂水量を含む),血液学検査及び血液化学検査に被験物質投与による影響は認められなかった.
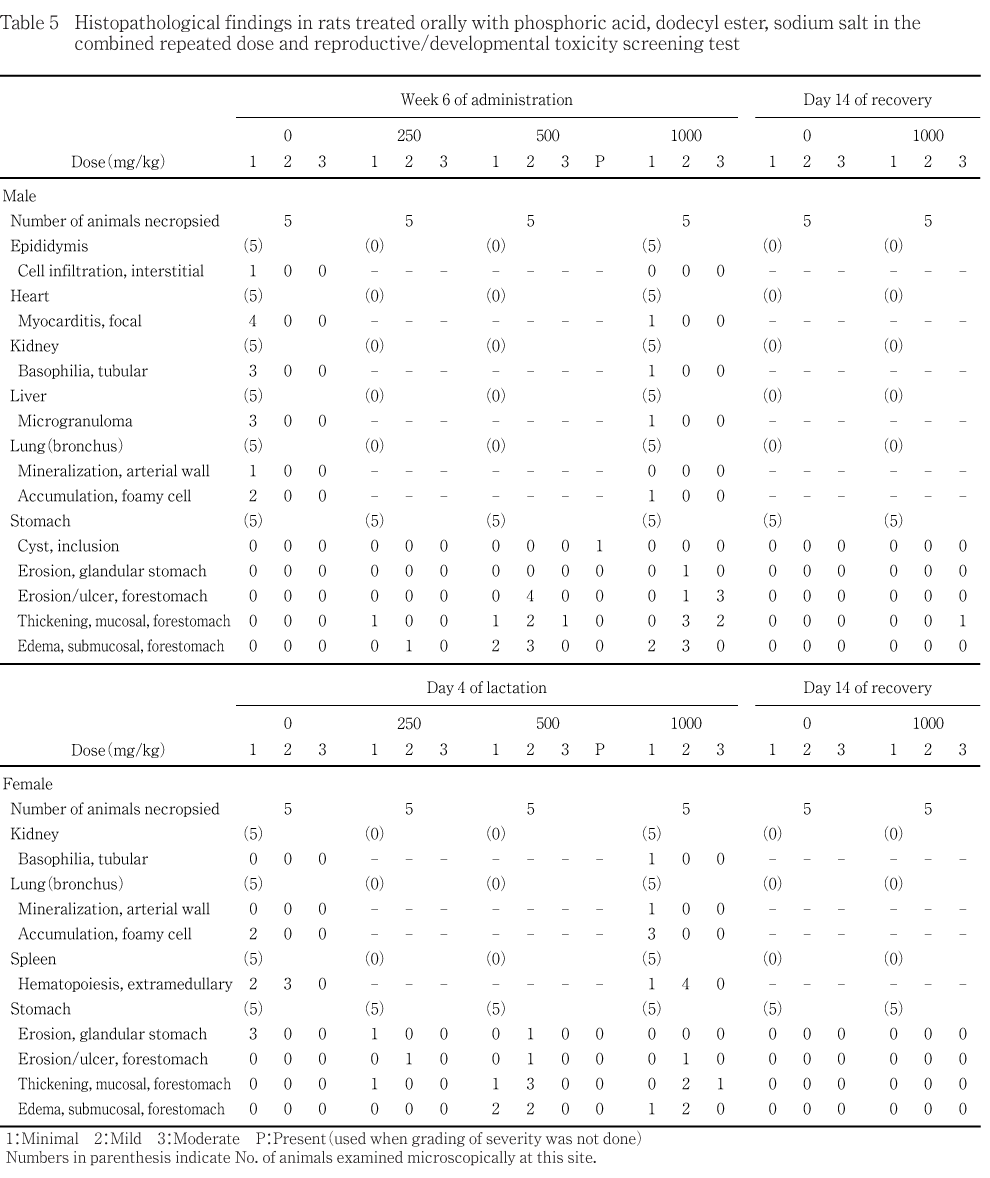
病理学検査では,投与期間終了時検査において,肉眼的に250 mg/kg以上の投与群で前胃の陥凹巣,500 mg/kg以上の投与群で前胃粘膜の粗造あるいは前胃の白色巣がみられ,組織学的に250 mg/kg以上の投与群で前胃の糜爛・潰瘍,前胃粘膜の肥厚及び粘膜下織の水腫が観察された.
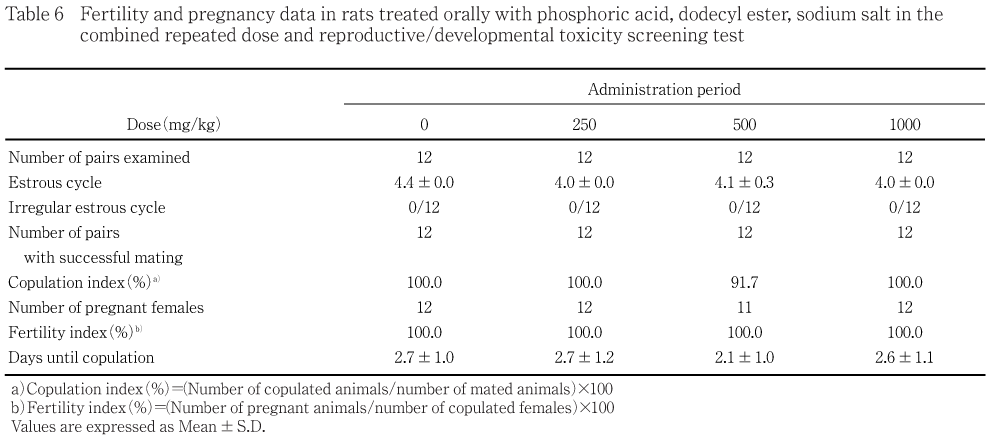
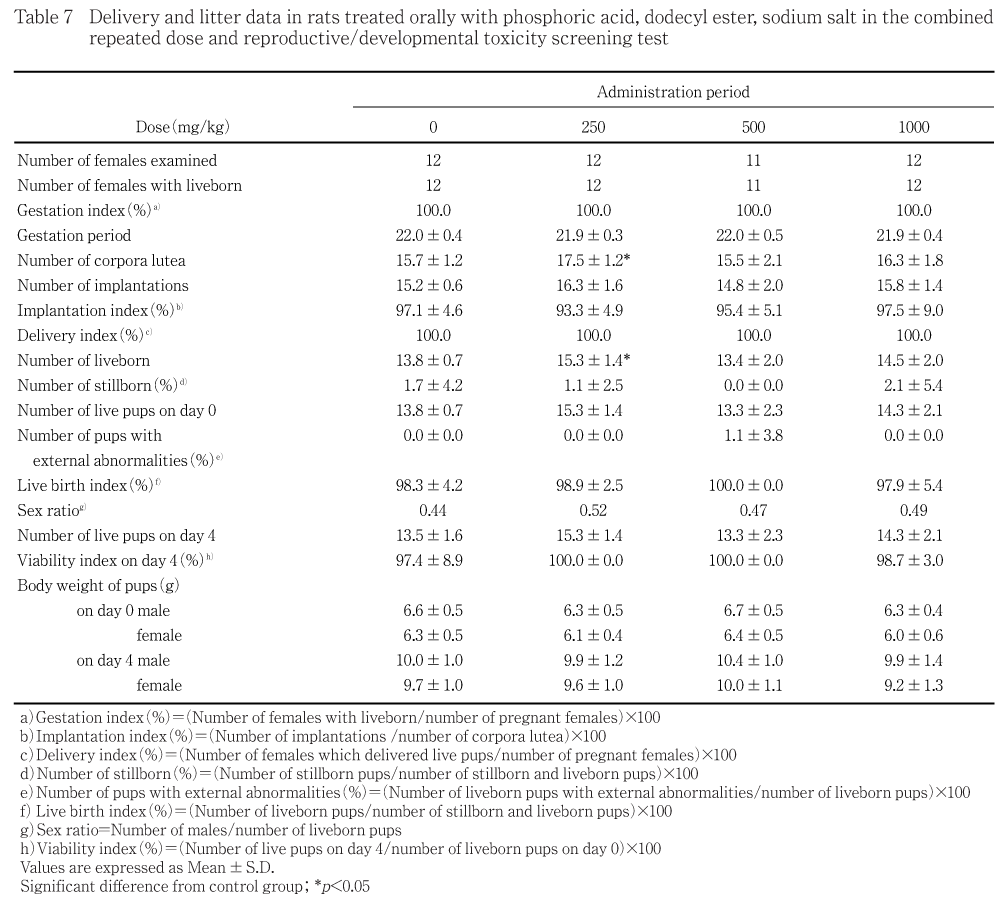
性周期,交尾までに要した日数,交尾率,授精率及び受胎率には被験物質投与の影響は認められなかった.また,母動物の妊娠期間,出産率,黄体数,着床痕数,着床率,分娩及び哺育行動,死産児率,出産生児数,出生率,性比,出生児の出生時観察及び生後4日剖検所見,体重及び生存性には被験物質投与の影響は認められなかった.
これらの結果から,リン酸ドデシルエステルナトリウム塩の反復投与毒性に対する無毒性量は雌雄ともに250 mg/kg/day未満,生殖発生毒性に対する無毒性量は雌雄親動物及び児動物ともに1000 mg/kg/dayと判断した.
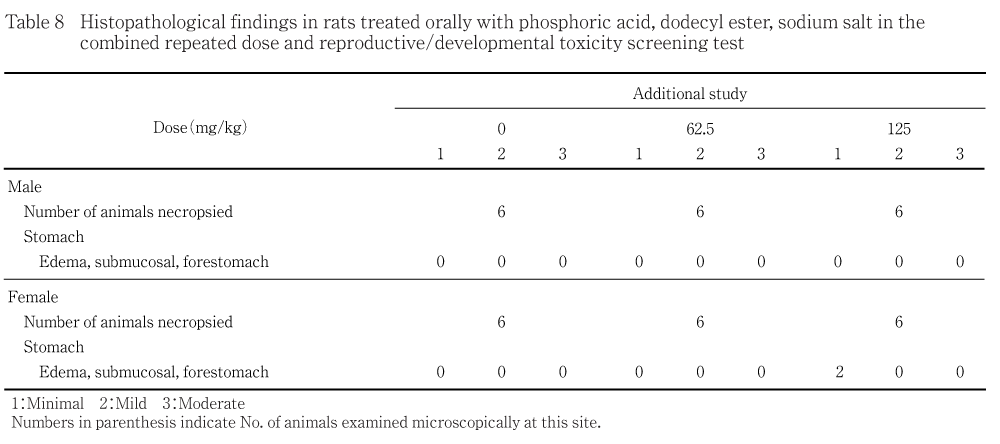
そこで,反復投与毒性の無毒性量を求めるため,同系統の雌雄ラットに62.5及び125 mg/kgを45日間投与する追加試験を行った結果,125 mg/kg投与群の雌で前胃粘膜下織の水腫が観察された.本試験及び追加試験の結果から,リン酸ドデシルエステルナトリウム塩の反復投与毒性に対する無毒性量は雄で125 mg/kg/day,雌で62.5 mg/kg/dayと判断した.
リン酸ドデシルエステルナトリウム塩(日光ケミカルズ,純度は不明,ロット番号3724,乾燥減量2.5 %以下)は白色粉末でわずかに特異なにおいを有している.なお,投与終了後の残余被験物質を分析した結果,使用期間中は安定であったことが確認された.
被験物質は,投与容量が5 mL/kg体重となるようにメノウ乳鉢を用いてオリブ油で懸濁して50,100及び200 mg/mL液を調製した.調製は最大7日分を一括して行い,1日分ずつ褐色ガラス瓶(遮光瓶)に入れて冷蔵(実測値:3〜5℃)で保存した.なお,被験液は上記条件下で安定であることを確認した.また,投与1及び投与最終週の2回,投与に使用した被験液について濃度及び均一性を測定した結果,適正な濃度,均一性であった.
Sprague-Dawley系SPFラット〔Crj:CD(SD)IGS,日本チャールス・リバー,厚木飼育センター〕の雌雄各70匹を8週齢で入手し,14日間検疫・馴化飼育した.その間,一般状態の観察,体重測定及び性周期検査(検疫期間終了後の9日間)を基に,一般状態及び性周期に異常がなく,体重増加が良好な雌雄各58匹を選択し,10週齢で投与に使用した.投与開始日の体重範囲は,雄で338〜395 g,雌で219〜256 gであり,いずれの動物の体重も平均値±20 %以内であった.
動物は,群分け当日の体重に基づいて層別化し,各群平均体重がほぼ均等となるよう,コンピュータを用いて各群に割り付けた.
動物は,温度23 ± 3℃,相対湿度50 ± 20 %,換気回数1時間当たり10〜15回,照明1日12時間の飼育室で,金属製網ケージに1匹ずつ収容し,交配期間中は雌雄各1匹の計2匹を収容した.なお,妊娠17日から授乳5日までは,床敷(ホワイトフレーク:日本チャールス・リバー)を入れたプラスチック製エコンケージで個別に収容した.固形飼料(NMF,オリエンタル酵母工業)及び飲料水(水道水)を自由に摂取させ飼育した.
2週間投与による予備試験(投与量:125,250,500及び1000 mg/kg)の結果(未発表),OECD Guideline for Testing of Chemicals 422で投与限界量とされている1000 mg/kgにおいても被験物質投与の影響は認められなかった.これらの結果から,1000 mg/kgを高用量とし,以下公比2で除して500及び250 mg/kgの3用量を設定し,これに対照群を加えた計4群(1群の動物数は雌雄各12匹)を使用した.さらに,対照群及び1000 mg/kg群では回復群(1群の動物数は雌雄各5匹)を設けた.
被験液の投与容量は5 mL/kg体重とし,胃管を用いて1日1回強制経口投与した.対照群には溶媒(オリブ油)を同様に投与した.投与液量は最新の体重を基準に算出した.回復期間は14日間とした.
投与期間中は毎日2回以上,回復期間中は毎日1回観察した.
投与開始前に1回,投与期間中及び回復期間中は毎週1回観察した.なお,観察及び検査は投与の情報を制限(ブラインド)し,動物をランダムに配置した状態で行った.
姿勢,痙攣,異常行動
ホームケージからの取り出し易さ,ハンドリングに対する反応,被毛・皮膚の状態(被毛の汚れ,粗毛,外傷,皮膚の色など),眼球(眼球突出,眼瞼の開き具合),眼・鼻の分泌物,可視粘膜,自律神経機能(流涙,流涎,立毛,瞳孔径,呼吸)
歩行,姿勢,覚醒状態,振戦,痙攣,立ち上がり回数,排泄物(排糞数,排尿),常同行動(身繕い,旋回など),異常行動(自咬,後方突進など)
雄は投与終了週に,雌は授乳4日のF1児剖検後に,回復群の雌雄は回復終了週にそれぞれ1群当たり5匹について以下の検査をブラインドで行った.
聴覚反応,接近反応,接触反応,痛覚反応,瞳孔反射,空中正向反射,着地開脚幅
上記機能検査に引き続き,前肢及び後肢の握力測定(CPUゲージMODEL-9502A,アイコーエンジニアリング)をブラインドで行った.
上記握力測定に引き続き,自発運動量の測定(実験動物用自発運動センサーNS-AS01,ニューロサイエンス)をブラインドで行った.測定は1時間行い,10分間隔及び60分間の運動量を集計した.
投与期間及び回復期間を通じ,週2回(投与第1週と回復第1週は3回)の頻度で,交尾確認雌動物は妊娠0,4,7,11,14,17及び20日並びに授乳0及び4日に体重を測定した.
投与期間及び回復期間を通じ,週2回(投与第1週は3回)の頻度で,妊娠1,4,7,11,14,17及び20日並びに授乳2及び4日に摂餌量を測定した.
全個体について,群分け日までの性周期観察に引き続き,交尾確認日まで毎日腟スメアを採取し,鏡検した.交配前投与期間中は腟スメア像を発情前期,発情期,発情後期及び発情休止期に分類し,発情期像発現回数及び発情期から次の発情期までの日数(性周期)を調べた.交配期間中は腟スメア内の精子の有無を調べた.
交配前投与期間終了後,主群の同投与群の雌雄を1:1で終夜同居させ,翌朝,腟栓形成あるいは腟スメア中に精子を確認したものを交尾成立とみなした.交尾までに要した日数は交配開始日を0日と起算した.交配成績から交尾率(%)〔(交尾動物数/同居動物数)×100〕,受胎率(%)〔(妊娠した雌の数/交尾した雌の数)×100〕,授精率(%)〔(妊娠した雌の数/交尾した雄の数)×100〕を算出した.
交尾確認雌動物は全例自然分娩させ,分娩状態の異常の有無を観察した.分娩終了の確認は妊娠21日から妊娠25日の午前中まで1日2回(午前,午後)行い,妊娠期間を0.5日単位で算出した.分娩が午後5時に終了していた場合,その日を授乳0日とし,妊娠期間(日)(授乳0日−妊娠0日)及び出産率(%)〔(生児出産雌数/妊娠雌数)×100〕を算出した.
分娩が終了した母動物は出生児の児なめ,胎盤及び羊膜の処理の有無を観察し,分娩終了日を授乳0日とし,授乳4日まで出生児を授乳させ,児集め,営巣及び授乳を指標として授乳状態を観察した.
母動物は授乳4日から一夜(約16〜20時間)絶食させた授乳5日に,各群5匹は血液学検査及び血液化学検査のための採血後に,その他の動物はエーテル麻酔下で腹大動脈切断により放血致死させ,黄体数及び着床痕数を数え,着床率(%)〔(着床痕数/黄体数)×100〕を算出した.
出生日に生存児数,死産児数を数えた.出生児は外表異常の有無を観察し,性別を判定して体重を測定した後,母動物に授乳させた.また,死産児率(%)〔(死産児数/総出産児数)×100〕,出生率(%)〔(生存児数/総出産児数)×100〕,外表異常率(%)〔(外表異常児数/生存児数)×100〕及び性比(雄数/雄数+雌数)を算出した.出生児は生死の観察を授乳4日まで毎日1回行い,出生児生存率(%)〔(授乳4日生存児数/授乳0日生存児数)×100〕を算出した.授乳4日に体重を測定した後,全例をエーテル麻酔下で放血致死させて剖検を行い,頭部・胸部・腹部を含む器官・組織の異常の有無を調べた.なお,出生児は個体別に体重を測定し,各腹単位で雌雄別に平均値を算出した.
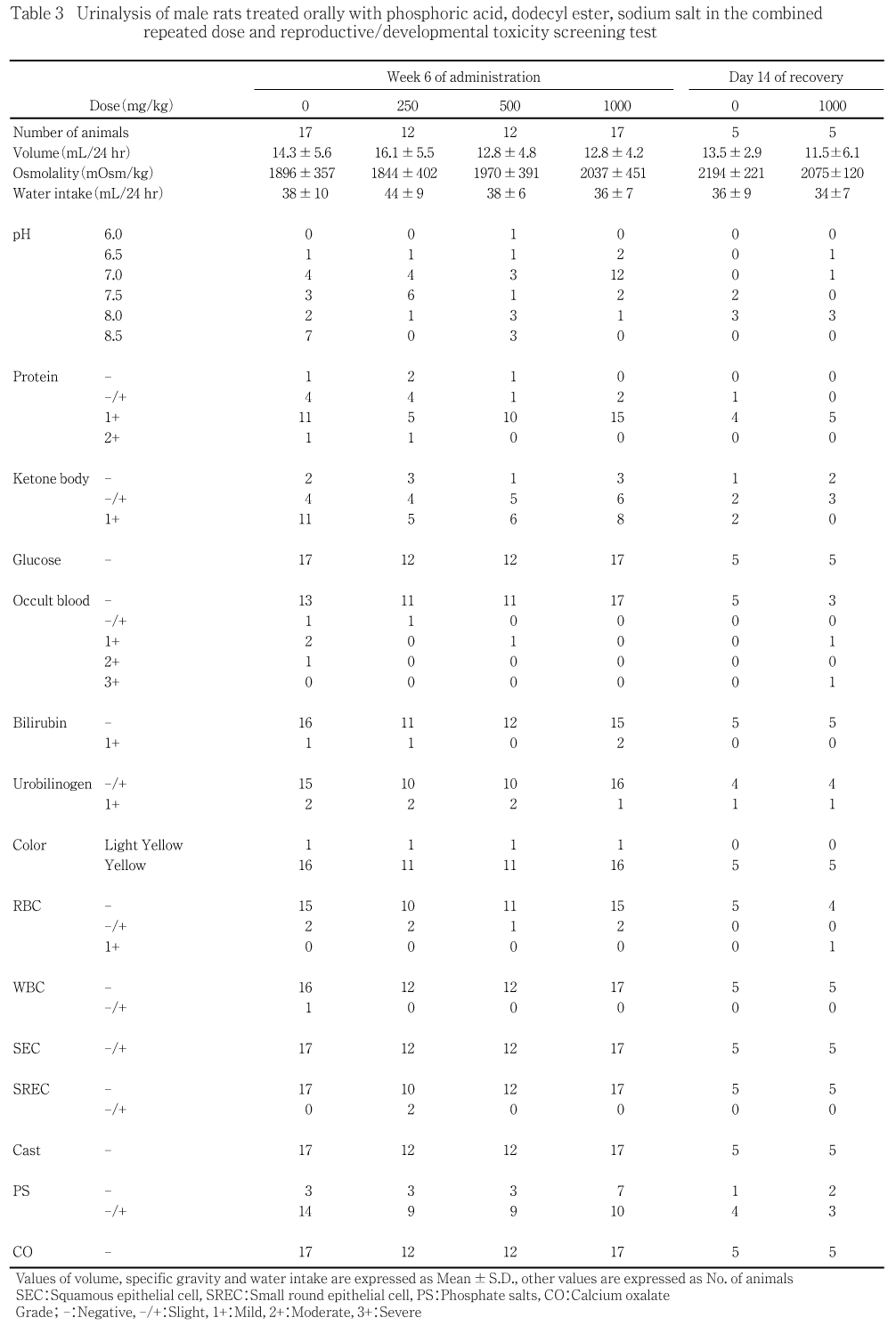
投与最終週(投与36〜37日)及び回復終了週(回復8〜9日)に雄動物を代謝ケージに個別に収容し,絶食・自由摂水下で4時間尿を,次いで自由摂食・自由摂水下でその後の20時間尿を採取した.採取した最初の4時間尿を用いてpH,たん白質,ケトン体,グルコース,潜血,ビリルビン,ウロビリノーゲン(以上オーションスティックス-7EA試験紙,アークレイ),色調(肉眼観察)及び沈渣(鏡検)を検査した.また,その後に得られた20時間尿を用いて浸透圧(氷点降下法,自動浸透圧測定装置オートアンドスタット OM-6030,アークレイ)を測定し,4時間尿量及び20時間尿量から1日の尿量を算出した.更に,代謝ケージに収容した状態で,前日からの1日の摂水量を給水瓶を用いて測定した.
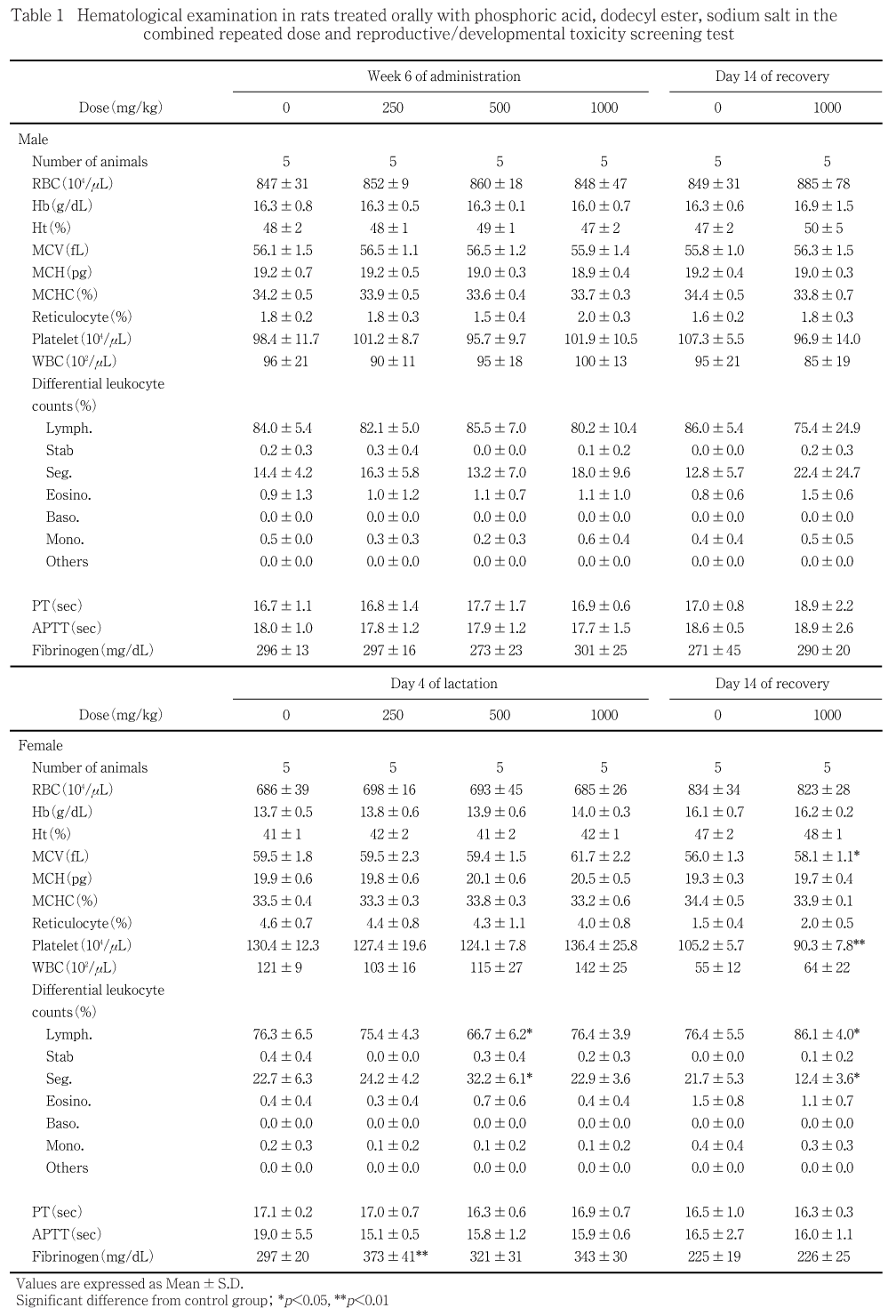
最終投与翌日及び回復期間終了日に検査を行った.前日から一夜(約16時間)絶食させた動物をエーテル麻酔下で開腹し,腹大動脈から抗凝固剤(EDTA-2K)を加えた採血ビンに血液を採取し,赤血球数(電気抵抗変化検出法),ヘモグロビン量(シアンメトヘモグロビン法),ヘマトクリット値(平均赤血球容積及び赤血球数から算出),平均赤血球容積(電気抵抗変化検出法),平均赤血球血色素量(ヘモグロビン量及び赤血球数から算出),平均赤血球血色素濃度(ヘモグロビン量及びヘマトクリット値から算出),血小板数(電気抵抗変化検出法),白血球数(電気抵抗変化検出法)(以上コールター全自動8項目血球アナライザーT890,ベックマン・コールター),網赤血球率(Brecher法)及び白血球百分率(May-Giemsa鏡検法)を測定した.また,3.8 %クエン酸ナトリウムを加えた容器に採取した血液を遠心分離(3000回転/分,10分間)し,得られた血漿を用いてプロトロンビン時間(クロット法),活性化部分トロンボプラスチン時間(クロット法)及びフィブリノーゲン量(トロンボプラスチン法)(以上,血液凝固自動測定装置ACL 100,Instru-mentation Laboratory)を測定した.
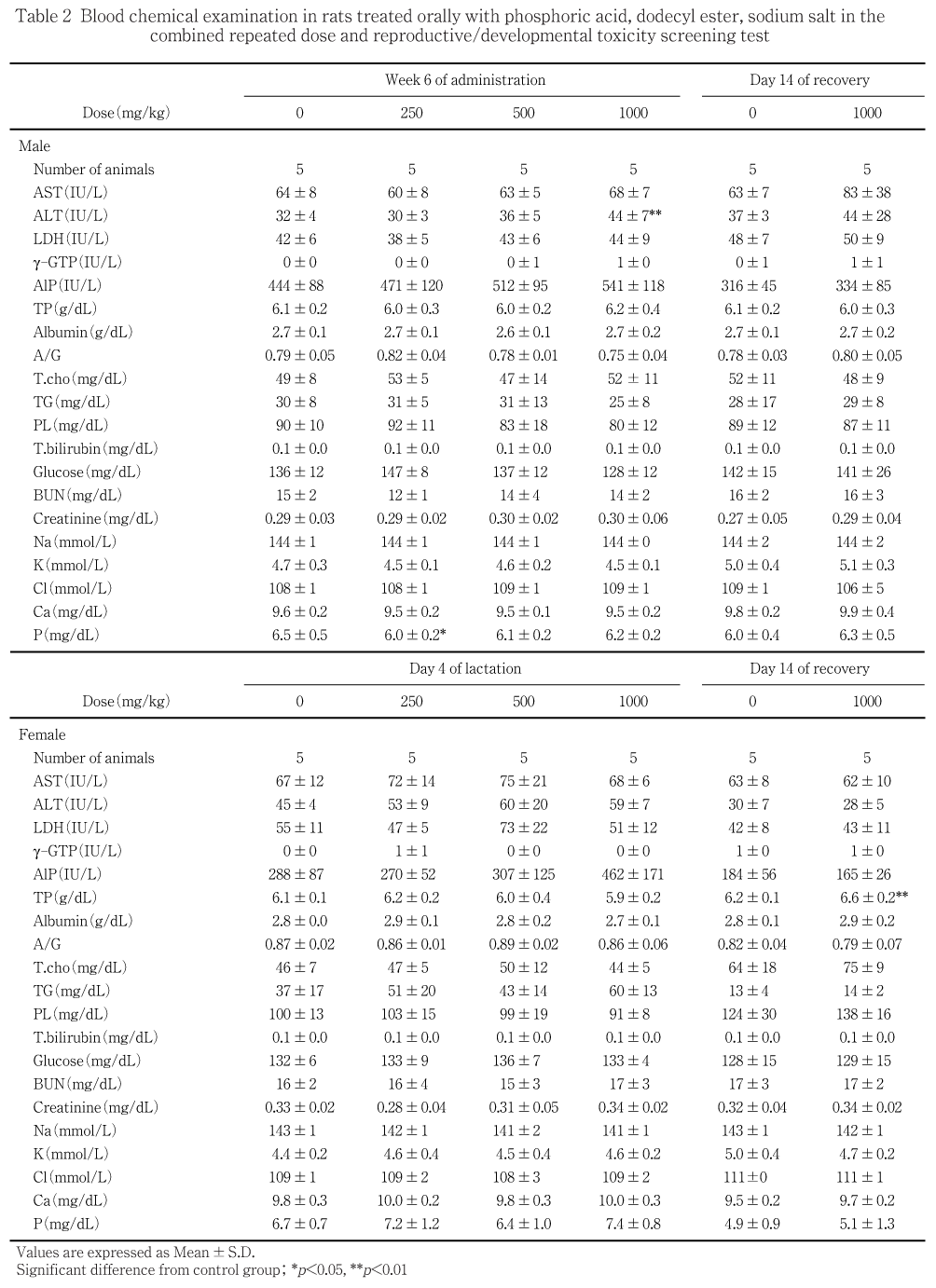
血液学検査のための採血と同時に腹大動脈から採血し,遠心分離(3000回転/分,10分間)により得られた血清を用いてAlP(Bessey-Lowry法),総コレステロール(CEH-COD-POD法),トリグリセライド(LPL-GK- GPO-POD法),リン脂質(PLD-ChOD-POD法),総ビリルビン(ビリルビンオキシダーゼ法),グルコース(グルコースデヒドロゲナーゼ法),尿素窒素(Urease- LEDH法),クレアチニン(Creatininase-creatinase- sarcosine oxidase-POD法),ナトリウム,カリウム及び塩素(イオン選択電極法),カルシウム(OCPC法),無機リン(モリブデン酸法),総たん白質(Biuret法),アルブミン(BCG法)及びA/G比(総たん白質及びアルブミンから算出)を測定した.また,ヘパリンを加えた容器に採血し,遠心分離(3000回転/分,10分間)により得られた血漿を用いてAST,ALT,LDH(UV-rate法)及びg-GTP(L-g-グルタミル-3-カルボキシ-4-ニトロアニリド法)(以上,臨床化学自動分析装置TBA-120FR,東芝)を測定した.
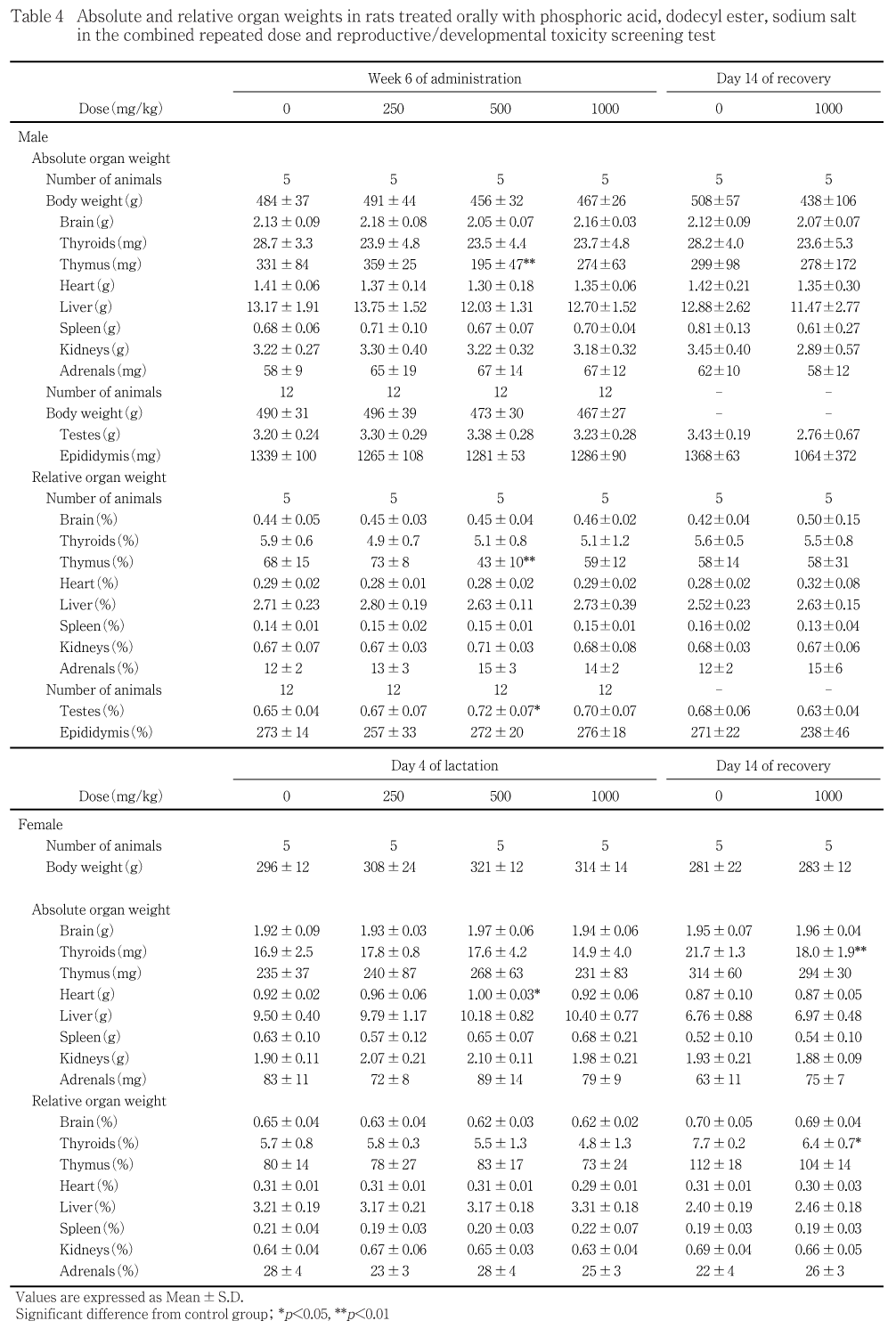
全ての動物について,最終投与翌日及び回復期間終了日に,血液・血液化学検査のために採血した動物(各群雌雄各5匹)は採血後に,その他の動物は腹大動脈切断により放血致死させた後に,それぞれ体外表・頭部・胸部・腹部を含む全身の器官・組織の肉眼による詳細な病理解剖を行い,結果を記録した.なお,雌動物(母動物)は授乳5日に黄体数及び着床痕数を数えた.次いで,血液学検査及び血液化学検査の採血を行った各群雌雄各5匹について,以下に示す器官(精巣及び精巣上体は全例)の重量(絶対重量)を測定するとともに,絶対重量と剖検時の体重から体重100 g当たりの相対重量を算出した.なお,*印をつけた両側性の器官については左右別々に測定し,その合計値で評価した.
[脳,甲状腺*(上皮小体を含む),胸腺,心臓,肝臓,脾臓,腎臓*,副腎*,精巣*及び精巣上体*]
全動物について,以下に示す全器官・組織を採取し,リン酸緩衝10 vol%ホルマリン液で固定,保存した(但し,精巣及び精巣上体はブアン液で固定した後リン酸緩衝10 vol%ホルマリン液で保存).次いで,下線を施した器官・組織についてパラフィン包埋した後,切片としてヘマトキシリン・エオジン(H.E.)染色を行い,このうち対照群及び高用量群の血液・血液化学検査に供した雌雄各5匹について鏡検した(両側性の器官については両側を摘出し,片側を鏡検).その結果,胃に被験物質投与の影響が認められたため,低及び中用量群並びに回復群についても雌雄各5匹を鏡検し,正常及び異常所見の代表例を撮影した.
[大脳,小脳,下垂体,脊髄(胸部),坐骨神経,甲状腺,上皮小体,副腎,胸腺,脾臓,顎下リンパ節,腸間膜リンパ節,心臓,肺(気管支を含む),胃,十二指腸,空腸,回腸,盲腸,結腸,直腸,肝臓,腎臓,膀胱,精巣,精巣上体,卵巣,子宮,精嚢,胸骨(骨髄を含む),大腿骨(骨髄を含む),個体識別部(耳介)]
交尾率,受胎率,授精率,出産率,出生児の性比,聴覚反応,接近反応,接触反応,痛覚反応,瞳孔反射,空中正向反射は,イェーツの連続修正によるx^2検定を行った(有意水準0.05及び0.01,両側).ただし,期待度数が5以下のセルがみられる場合にはFisherの直接確率計算法により検定を行った(有意水準0.05及び0.01,両側).着床率,死産児率,出生率,外表異常率,出生児生存率は母動物ごとに率を求めた後,Bartlett検定により等分散性を検定し(有意水準0.01,両側),等分散の場合はDunnett検定,非等分散の場合はDunnett型検定(mean rank test法)を行った(有意水準0.05及び0.01,両側).その他の数値化した成績についてまずBartlett法により各群の分散の均一性の検定(有意水準0.01,両側)を行った.その結果,分散が均一の場合にはDunnett法を用いて対照群と各投与群との平均値の差の検定を,分散が均一でない場合には,Dunnett型の方法(mean rank test法)を用いて対照群と各投与群との平均順位の差の検定を行った(有意水準いずれも0.05及び0.01,両側).
追加試験は,250 mg/kg以上の投与群で前胃における軽度な糜爛・潰瘍及び粘膜下織に軽度な浮腫が観察されたことから,250 mg/kgを公比2で除して,125 mg/kgを高用量,62.5 mg/kgを低用量に設定し,これに対照群を加え計3群(1群の動物数は雌雄各6匹)を使用した.使用動物は,同系統の雌雄各25匹を8週齢で購入し,14日間検疫・馴化飼育した.その間,一般状態に異常がなく,体重増加が良好な雌雄各18匹を選択し,10週齢で投与に使用した.投与開始時の体重範囲は雄で333〜365 g,雌は211〜263 gであった.被験液は安定性を考慮し,50 mg/mLオリブ油懸濁液を調製して,投与容量を変更して投与したが,一般状態の観察,体重及び摂餌量の測定,剖検,胃の病理組織学検査並びに統計解析は同様に実施した.
一般状態の観察では,主群の500 mg/kg投与群の雌1例で眼球混濁(片側性)が妊娠5日以降みられたが,用量との関連がなく,出現状況から偶発的変化と考えられた.回復群の1000 mg/kg投与群の雄1例で自発運動量の減少が投与37日以降回復7日まで,喘鳴が投与37日以降回復期間終了までみられた.その他の主群及び回復群の動物には異常はみられなかった.
詳細な一般状態の観察,機能検査,握力測定及び自発運動量の測定においては,主群の1000 mg/kg投与群の雄で投与1及び2週にオープンフィールド内の排糞数の有意な高値が認められたが,ごく軽微な一時的変化であり,正常範囲内の変化と考えられた.その他の検査項目では,いずれの動物にも異常はみられなかった.
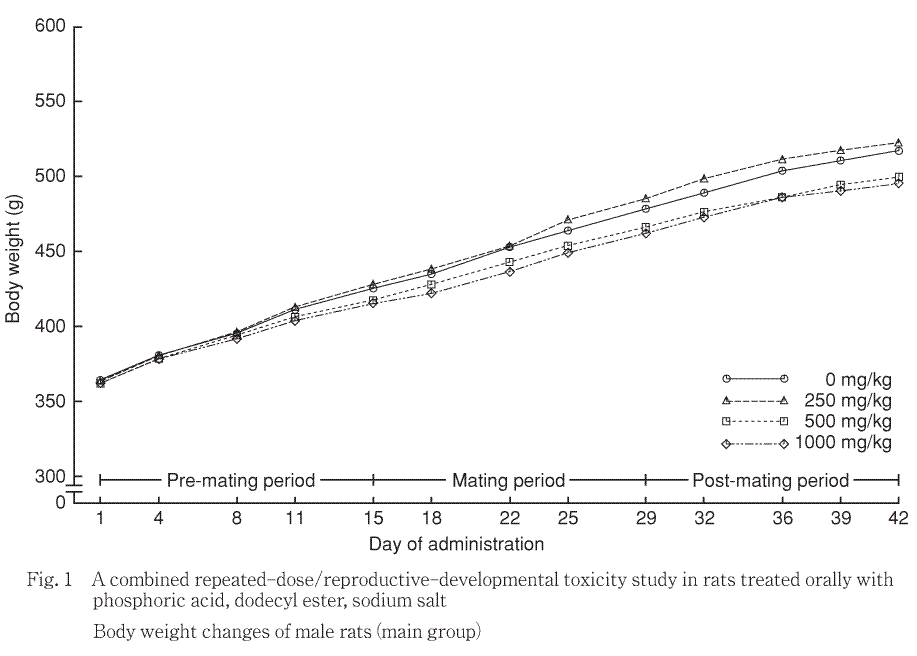
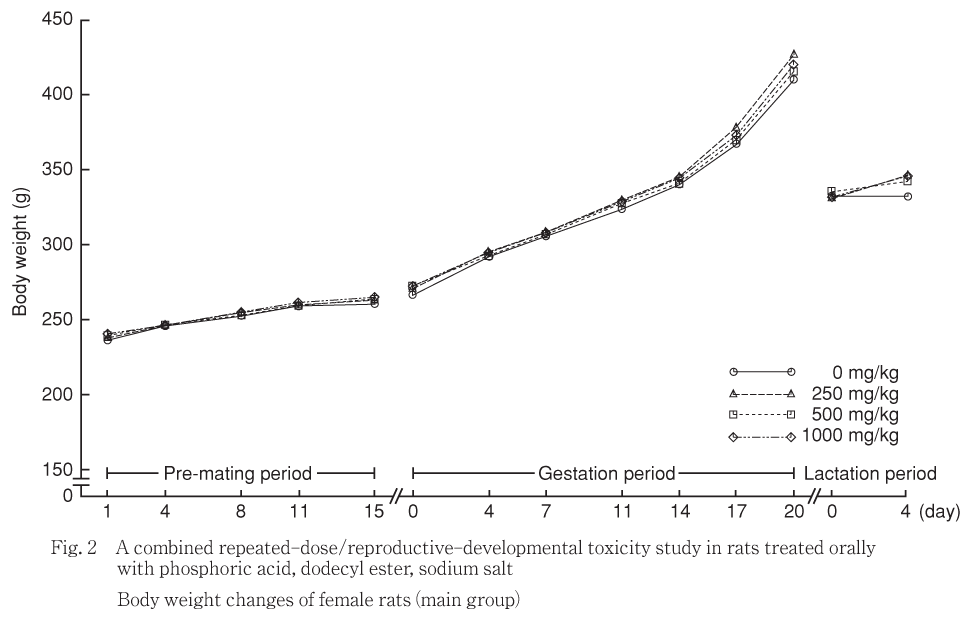
主群の雌雄体重ともに被験物質投与による有意差は認められなかった.なお,250及び1000 mg/kg投与群の雌で授乳期間中の体重増加量に有意な高値が認められたが,用量との関連はなかった.
回復群では,1000 mg/kg投与群の雄で投与期間中の体重増加量に低値,回復期間中の体重増加量に減少(−21 g)が認められた.本変化は5例中1例に継続した体重減少がみられたためである(一般状態の観察において自発運動量の減少及び喘鳴が観察された.症状発現前体重は466 g,回復14日体重は261 gであった).他の雄5例中4例並びに同群の雌5例の体重は対照群と同等値を示し,有意差は認められなかった.

主群及び回復群の雌雄ともに摂餌量には被験物質投与による影響は認められなかった.
なお,主群の250 mg/kg投与群の雌で授乳2及び4日に有意な高値が認められたが,用量との関連はなかった.
250 mg/kg投与群の雌でフィブリノーゲン量の有意な高値,500 mg/kg投与群の雌でリンパ球比率の有意な低値と分葉核好中球比率の有意な高値が認められたが,1000 mg/kg投与群に同様な変化が認められないことから,生理的変動範囲内の変化と考えられた.
1000 mg/kg投与群の雌で平均赤血球容積の有意な高値,血小板数の有意な低値,リンパ球比率の有意な高値及び分葉核好中球比率の有意な低値が認められたが,投与期間終了時にみられない変化であることから,生理的変動範囲内の変化と判断した.
1000 mg/kg投与群の雄でALTの有意な高値が認められた.その他,250 mg/kg投与群の雄で無機リンの有意な低値が認められたが,用量との関連がないことから,生理的変動範囲内の変化と判断した.
1000 mg/kg投与群の雌で総たん白質の有意な高値が認められたが,投与期間終了時にみられない変化であることから,生理的変動範囲内の変化と判断した.
定量項目については,いずれの検査項目においても対照群と各被験物質投与群との間に有意差は認められなかった.また,定性項目についても,いずれの動物にも異常はみられなかった.
絶対及び相対重量の双方に同一方向に有意差が認められた器官・組織はなかった.なお,以下の変化がみられた.500 mg/kg投与群の雄で胸腺の絶対及び相対重量の有意な低値,精巣の相対重量の有意な高値,同群の雌で心臓の絶対重量に有意な高値が認められたが,用量との関連がみられないことから,変動範囲内の変化と考えられた.
1000 mg/kg投与群の雌で甲状腺の絶対及び相対重量の有意な低値が認められたが,投与終了時にみられないことから,変動範囲内の変化と考えられた.
250 mg/kg以上の投与群で胃に被験物質投与の影響がみられた.すなわち,前胃の陥凹巣が250,500及び1000 mg/kg投与群の雄でそれぞれ0,5及び7例,雌でそれぞれ1,1及び3例に,前胃の白色巣が500 mg/kg投与群の雄で1例に,前胃粘膜の粗造が500及び1000 mg/kg投与群の雄でそれぞれ5及び9例,雌でそれぞれ5及び6例に,腺胃の陥凹巣が500 mg/kg投与群の雌で1例にみられた.
他に,腺胃の暗赤色巣が対照群,250,500及び1000 mg/kg投与群の雄でそれぞれ0,1,2及び1例,雌でそれぞれ4,2,1及び1例,腎盂拡張が250及び1000 mg/kg投与群の雄でそれぞれ2及び1例,角膜の混濁(片側性)が500 mg/kg投与群の雌1例みられたが,出現頻度及び病理学的性状から偶発的変化と考えられた.
前胃粘膜の粗造が1000 mg/kg投与群の雄1例にみられた.なお,この動物では胃から結腸までガス貯留による拡張と精巣の軽度な小型化がみられた.
他に,肺の暗赤色巣が1000 mg/kg投与群の雌1例にみられたが,出現頻度及び病理学的性状から偶発的変化と考えられた.
被験物質投与の影響が250 mg/kg投与群以上で胃にみられた.
軽度又は中等度な前胃の糜爛・潰瘍が250,500及び1000 mg/kg投与群の雄でそれぞれ0,4及び4例,雌でそれぞれ1,1及び1例,軽微から中等度な前胃粘膜の肥厚が250,500及び1000 mg/kg投与群の雄でそれぞれ1,4及び5例,雌でそれぞれ1,4及び3例,軽微又は軽度な前胃の粘膜下織の水腫が250,500及び1000 mg/kg投与群の雄でそれぞれ1,5及び5例,雌でそれぞれ0,4及び3例にみられた.これら前胃の変化はほとんどが限局性であった.
上記以外の所見は正常ラットでもしばしば認められる変化であること,あるいはその出現状況からいずれも偶発所見と判断した.
中等度な前胃粘膜の肥厚が1000 mg/kg投与群の雄1例にみられた.
性周期異常の動物はみられず,平均性周期日数には対照群と各被験物質投与群との間に有意差は認められなかった.
500 mg/kg投与群の1組が未交尾であった.他の組み合わせは交配開始後4日までに交尾し,全例が妊娠した.したがって,交尾までに要した日数,交尾率,授精率及び受胎率には対照群と各被験物質投与群との間に有意差は認められなかった.
分娩状態では,妊娠21.5〜23.0日に全例が正常に分娩し,出産率,妊娠期間,黄体数,着床痕数,着床率,死産児率,出生児数及び出生率には被験物質投与による有意差は認められなかった.なお,250 mg/kg投与群に黄体数及び出生児数の有意な高値が認められたが用量との関連はなかった.
哺育状態では,いずれの母動物にも巣作り,児集め及び授乳行動に異常はみられなかった.
性比,出生時体重及び外表異常率には対照群と各被験物質投与群との間に有意差は認められなかった.なお,外表観察において,曲尾が500 mg/kg投与群に1例みられたが,出現頻度及び外表異常の種類から自然発生によるものと考えられた.
授乳期間中の死亡児は対照群で4例及び1000 mg/kg投与群で2例みられたのみであり,授乳4日生存率には対照群と各被験物質投与群との間に有意差は認められなかった.
出生時及び授乳4日の雌雄体重には対照群と各被験物質投与群との間に有意差は認められなかった.
胸腺の頸部残留が対照群,250,500及び1000 mg/kg投与群の雄でそれぞれ1,1,0及び2例,雌でそれぞれ3,1,0及び3例みられたが,発現状況に用量との関連はなかった.
一般状態では,いずれの動物にも異常はみられず,各被験物質投与群の雌雄体重及び摂餌量ともに対照群との間に有意差は認められなかった.
なお,摂餌量の一時的な有意な高値が投与11日に62.5 mg/kg投与群の雌及び125 mg/kg投与群の雄に認められた.
剖検では,いずれの動物にも異常はみられなかった.
病理組織学検査では,前胃粘膜下織における軽微な水腫が125 mg/kg投与群の雌2例にみられた.
詳細な一般状態の観察,機能検査,握力測定,自発運動量の測定,体重,摂餌量,尿検査(摂水量を含む)及び血液学検査に被験物質投与による影響は認められなかった.
一般状態では,回復群の1000 mg/kg投与群の雄1例で自発運動量の減少,喘鳴,体重減少がみられ,肉眼的に前胃粘膜の粗造及び胃から結腸までガス貯留による拡張,組織学的に胃粘膜の肥厚が観察された.このような動物は1例のみであり,投与37日の症状発現までは対照群と同様な体重増加がみられたが,症状発現後は継続して体重減少していることを考慮すると,投与過誤による上気道への影響と判断した.
血液化学検査では,投与期間終了時検査において,1000 mg/kg投与群の雄でALTの有意な高値が認められたが,生理学的な変動範囲内の変化であり,軽微な変化で病理組織学検査異常がないことから,被験物質による影響でないと判断した.
病理学検査では,投与期間終了時検査において,肉眼的に250 mg/kg以上の投与群で前胃の陥凹巣,500 mg/kg以上の投与群で前胃粘膜の粗造あるいは前胃の白色巣がみられ,組織学的に250 mg/kg以上の投与群で前胃の糜爛・潰瘍,前胃粘膜の肥厚及び粘膜下織の水腫が観察され,被験物質の刺激性が示唆された.
性周期,交尾までに要した日数,交尾率,授精率及び受胎率には被験物質投与の影響は認められなかった.また,母動物の出産率,妊娠期間,黄体数,着床痕数,着床率,死産児率,出生児数,出生率及び性比に被験物質投与の影響は認められず,授乳期間中の授乳状態にも異常が認められないことから,1000 mg/kg投与群においても雌雄動物の交尾能,授精能及び受胎能,母動物の妊娠維持,分娩及び哺育行動などの生殖機能への影響はないと考えられた.
出生児では,出生時の観察及び授乳4日剖検所見,体重及び生存率には被験物質投与による変化は認められないことから,1000 mg/kg投与群においても発生へ及ぼす影響はないと考えられた.
これらの結果から,リン酸ドデシルエステルナトリウム塩の反復投与毒性に対する無毒性量は雌雄ともに250 mg/kg/day未満,生殖発生毒性に対する無毒性量は雌雄親動物及び児動物ともに1000 mg/kg/dayと判断した.
そこで,反復投与毒性の無毒性量を求めるため,同系統の雌雄ラットに62.5及び125 mg/kgを45日間投与する追加試験を行った結果,125 mg/kg投与群の雌で前胃粘膜下織の水腫が観察された.本試験及び追加試験の結果から,リン酸ドデシルエステルナトリウム塩の反復投与毒性に対する無毒性量は雄で125 mg/kg/day,雌で62.5 mg/kg/dayと判断した.
| 連絡先 | |||
| 試験責任者: | 石田 茂 | ||
| 試験担当者: | 田代千絵,畠山和久,楠岡 修, 杉山文彦,勝亦倶慶 | ||
| (株)ボゾリサーチセンター御殿場研究所 | |||
| 〒412-0039 静岡県御殿場市かまど1284 | |||
| Tel 0550-82-2000 | Fax 0550-82-2379 | ||
| Correspondence | |||
| Authors: | Shigeru Ishida (Study director) Chie Tashiro, Kazuhisa Hatayama, Osamu Kusuoka, Fumihiko Sugiyama, Tomoyoshi Katsumata |
||
| Gotemba Laboratory, Bozo Research Center Inc. | |||
| 1284, Kamado, Gotemba-shi, Shizuoka, 412-0039, Japan | |||
| Tel +81-550-82-2000 | Fax +81-550-82-2379 | ||