N,N-ジシクロヘキシル-2-ベンゾチアゾールスルフェンアミドの
チャイニーズ・ハムスター培養細胞を用いる染色体異常試験
In Vitro Chromosomal Aberration Test of
N, N-Dicyclohexyl-2-benzothiazolesulfenamide on Cultured Chinese Hamster Cells
要約
OECD既存化学物質安全性点検に係る毒性調査事業の一環として,N, N-ジシクロヘキシル-2-ベンゾチアゾールスルフェンアミドの培養細胞に及ぼす細胞遺伝学的影響を評価するため,チャイニーズ・ハムスター培養細胞(CHL/IU)を用いて試験管内染色体異常試験を実施した.
連続処理(24および48時間)においては,50%を越える増殖抑制濃度,すなわち 0.82 mg/mlの濃度を最高処理濃度とした.一方,短時間処理(6時間)のS9 mix 存在下および非存在下においては,50%を明らかに越える細胞増殖抑制が認められなかったことより,3.5 mg/ml(10 mM)の濃度を最高処理濃度とした.最高処理濃度の 1/2 および1/4をそれぞれ中濃度,低濃度として設定した.連続処理として,S9 mix 非存在下における24時間および48時間連続処理,短時間処理としてS9 mix 存在下および非存在下で6時間処理(18時間の回復時間)後,標本を作製し,検鏡することにより染色体異常誘発性を検討した.
CHL/IU 細胞を24時間連続処理した高濃度群(0.82 mg/ml)において,構造異常の有意な増加が認められたが,その頻度は2.5%で,生物学的には陰性と判定した.また,48時間連続処理したいずれの処理群においても,染色体の構造異常の有意な増加は認められなかった.一方,24時間連続処理した低濃度群(0.21 mg/ml),高濃度群(0.82 mg/ml)および48時間連続処理したすべての処理群において,倍数性細胞の有意な増加が認められ,疑陽性の結果が得られた.そこで, in vitro 小核試験による追加試験を実施したところ,48時間連続処理したすべての処理群で小核と多核細胞の有意な増加が認められた.短時間処理では,S9 mix 存在下および非存在下で6時間処理したすべての処理群において,染色体の構造異常や倍数性細胞の誘発作用は認められなかった.
以上の結果より,N, N-ジシクロヘキシル-2-ベンゾチアゾールスルフェンアミドは,上記の試験条件下で染色体異常を誘発すると結論した.
方法
1.使用した細胞
リサーチ・リソースバンク(JCRB)から入手(1988年2月,入手時:継代 4代,現在12代)したチャイニーズ・ハムスター由来のCHL/IU 細胞を,解凍後継代 10代以内で試験に用いた.
2.培養液の調製
培養には,牛胎児血清(FCS:JRH BIOSCIENCES,およびBiocell)を 10% 添加したイーグル MEM 培養液(日水製薬(株))を用いた.
3.培養条件
2×10^4個のCHL/IU 細胞を,培養液5 mlを入れたディッシュ(径 6 cm,Corning)に播き,37 ℃ のCO2インキュベーター (5% CO2) 内で培養した.連続処理では,細胞播種3日目に被験物質を加え,24時間および48時間処理した.また,短時間処理では,細胞播種3日目にS9 mix存在下および非存在下で6時間処理し,処理終了後,新鮮な培養液で,さらに18時間培養した.
4.被験物質
N, N-ジシクロヘキシル-2-ベンゾチアゾールスルフェンアミド(略号:DCBS,CAS No.: 4979-32-2,ロット番号:304006,大内新興化学工業(株)製造,(社)日本化学工業協会提供)は,灰白色グラニュール状で,水およびアセトンに対する溶解度は,それぞれ 0.003 g/100ml(24℃)および 5.30 g/100ml (24℃),ジメチルスルホキシド(DMSO)に不溶,融点102.5℃,分子式C19H26N2S2,分子量346.59,純度 99.5%以上(不純物:dibenzthiazyl disulfide(0.5%未満を含む))の物質である.被験物質原体は冷暗所・遮光保存下で安定(有効期限は10か月)であるが,熱,光等で非常に緩やかに分解する.媒体中(0.5 %カルボキシメチルセルロースナトリウム水溶液,以下 0.5% CMC Na水溶液と略す)では,2.05〜35.0 mg/ml の濃度範囲で4時間は安定であった.
5.被験物質の調製
被験物質の調製は,使用のつど行った.媒体として0.5% CMC Na(ナカライテスク(株))水溶液を用いた.原体を媒体に懸濁して原液を調製し,ついで原液を媒体で順次希釈して所定の濃度の被験物質調製液を作製した.被験物質調製液は,すべての試験において培養液の 10% (v/v) になるように加えた.染色体異常試験および小核試験に用いた被験物質調製液の濃度は,許容範囲内(媒体中での平均含量が添加量の85.0〜115%)の値であった.なお,濃度の記載について,純度換算は行わなかった.
6.細胞増殖抑制試験による処理濃度の決定
染色体異常試験に用いる被験物質の処理濃度を決定するため,被験物質の細胞増殖に及ぼす影響を調べた.被験物質の CHL /IU 細胞に対する増殖抑制作用は,単層培養細胞密度計(MonocellaterTM,オリンパス光学工業(株))を用いて各群の増殖度を計測し,被験物質処理群の陰性対照群に対する細胞増殖の比をもって指標とした.
その結果,連続処理における50%を明らかに越える増殖抑制濃度(約60%の増殖抑制濃度)を,60%の増殖抑制濃度をはさむ2点の値より算出したところ,0.82 mg/mlであった.一方,短時間処理の S9 mix存在下および非存在下では,処理したすべての濃度範囲で50%を越える増殖抑制作用は認められなかった(Fig. 1).
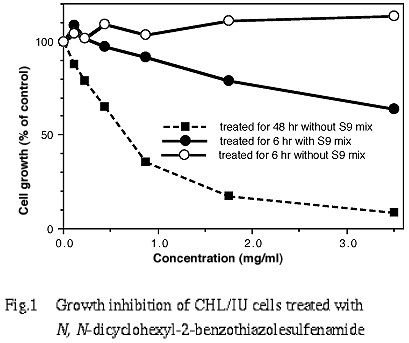
7.実験群の設定
細胞増殖抑制試験の結果より,染色体異常試験で用いる被験物質の高濃度群を,連続処理では 0.82 mg/ml,短時間処理では 3.5 mg/ml (10 mM) とし,それぞれ高濃度群の 1/2 の濃度を中濃度,1/4 の濃度を低濃度とした.陽性対照物質として用いたマイトマイシンC(MC,協和醗酵工業(株))およびシクロホスファミド(CPA,Sigma Chemical Co.)は,注射用水((株)大塚製薬工場)に溶解して調製した.それぞれ染色体異常および小核を誘発することが知られている濃度を適用した.
8.染色体標本作製法
培養終了の 2時間前に,コルセミドを最終濃度が約 0.1 μg/ml になるように培養液に加えた.染色体標本の作製は常法に従って行った.スライド標本は各ディッシュにつき6枚作製した.作製した標本を3%ギムザ液で染色した.
9.染色体分析
作製したスライド標本のうち,1つのディッシュから得られた異なるスライドを,4名の観察者がそれぞれ処理条件が分からないようにコード化した状態で分析した.染色体の分析は,日本環境変異原学会,哺乳動物試験(MMS)分科会1)による分類法に基づいて行い,染色体型あるいは染色分体型のギャップ,切断,交換などの構造異常の有無と倍数性細胞(polyploid)の有無について観察した.また構造異常については, 1群 200個,倍数性細胞については 1群 800個の分裂中期細胞を分析することとした.
10.小核標本作製法
培養終了後シャーレより細胞を剥離し,遠心して得られた細胞を 0.15 M KCl 水溶液で約20分間低張処理した.メタノール:氷酢酸(5:1)の固定液で細胞を固定後スライドに 1滴滴下し,スライド標本を作製した.作製した標本を 3%ギムザ溶液で染色した.
11.小核標本の観察法
作製したスライド標本のうち,1つのディッシュから得られた異なるスライドを,2名の観察者がそれぞれ処理条件が分からないようにコード化した状態で分析した.観察は,60倍以上の対物レンズ(接眼10倍)をつけた顕微鏡を用いて行った.細胞質を含み,細胞質周辺の明瞭な間期細胞1000個について観察し,小核(直径が主核の1/3以下であり,色調により明らかに核由来と判定できるもの2))をもった細胞を算定した.なお,本被験物質は倍数性細胞を誘発したことから,その指標となる異常な多核および異形核の出現頻度について,さらに1ディッシュあたり1000細胞分析することとした.
12.記録と判定
無処理対照,陰性および陽性対照群と被験物質処理群についての分析結果は,観察した細胞数,構造異常の種類と数,倍数性細胞の数について集計し,各群の値を記録用紙に記入した.染色体異常を有する細胞の出現頻度について,フィッシャーの exact probability test 法により,陰性対照群と被験物質処理群間および陰性対照群と陽性対照群間の有意差検定(p<0.05)を行った.被験物質の染色体異常誘発性についての最終判定は,石館ら3)の判定基準に従い,染色体異常を有する細胞の頻度が 5% 未満を陰性,5%以上10%未満を疑陽性,10%以上を陽性とした.疑陽性の結果が得られた群については,小核試験により,再現性,用量依存性等を検討し最終判定を行うこととした.
小核試験に関しては,Kastenbaum & Bowman の方法(1970)4)に従って有意差検定(p<0.05)を行い,小核誘発の判定を行った.
結果および考察
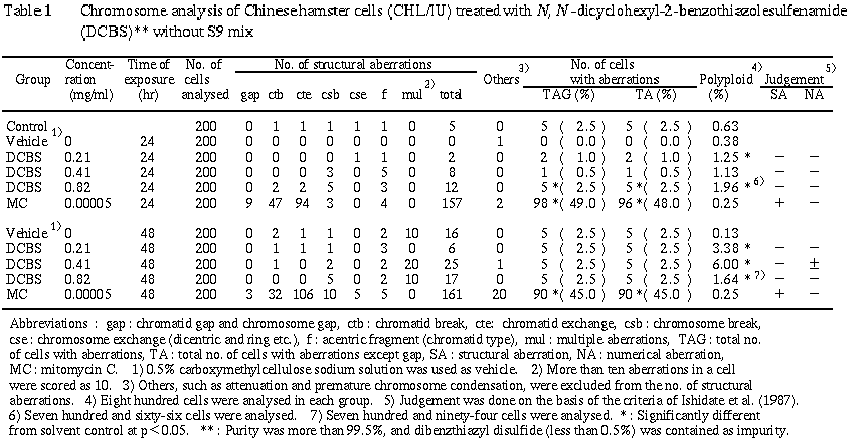
連続処理による染色体分析の結果を Table 1 に示した.
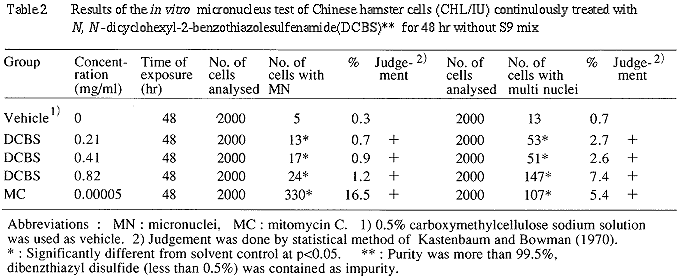
N,N-ジシクロヘキシル-2-ベンゾチアゾールスルフェンアミドを加えて 24時間連続処理した高濃度群(0.82 mg/ml)で,染色体の構造異常の有意な増加(p=0.0304)が認められたが,その頻度は5%未満で,生物学的には陰性と判断した.また,48時間連続処理したいずれの処理群においても,染色体の構造異常は誘発されなかった.一方,24時間連続処理した低濃度群(0.21mg/ml,p=0.0454),高濃度群(0.82 mg/ml,p=0.00274)および48時間連続処理したすべての処理群(P<8.38×10^-4)で,倍数性細胞の有意な増加が認められた.特に中濃度群(0.41 mg/ml)では,その頻度が6%となり,疑陽性の結果が得られた.そこで,再現性のための追加試験として,染色体の構造異常と数的異常を精度よく反映することができる in vitro 小核試験を実施した(Table 2).その結果,48時間連続処理したすべての処理群において,小核および異形の多核細胞の有意な増加(P<0.05)が認められた.異形の多核細胞は,倍数性細胞を誘発する薬剤処理によって誘発される場合が多いことから,本被験物質による異形多核細胞の生成は,倍数性細胞の誘発と関連していることが示唆された.
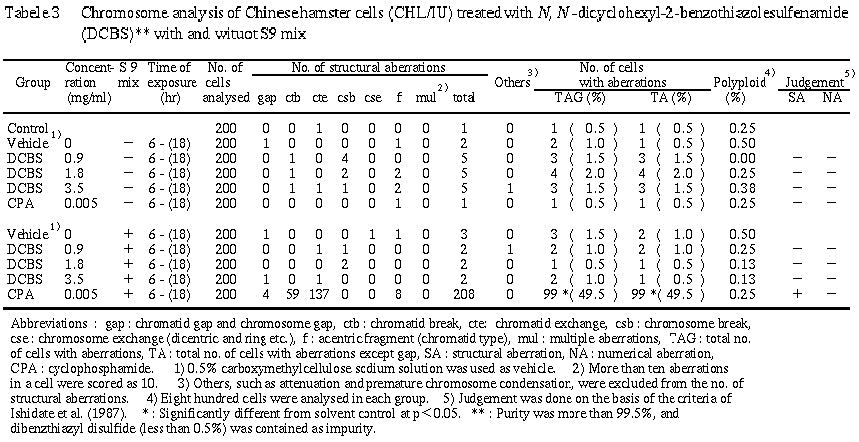
短時間処理による染色体分析の結果を Table 3に示した.
N, N-ジシクロヘキシル-2-ベンゾチアゾールスルフェンアミドを加えて S9 mix 存在下および非存在下で 6時間処理したすべての処理群で,染色体の構造異常および倍数性細胞の誘発作用は認められなかった.
従って,N, N-ジシクロヘキシル-2-ベンゾチアゾールスルフェンアミドは,上記の試験条件下で,試験管内の CHL/IU 細胞に染色体異常を誘発すると結論した.
文献
| 1) | 日本環境変異原学会・哺乳動物試験分科会編, "化学物質による染色体異常アトラス," 朝倉書店, 東京, 1988. |
| 2) | 日本組織培養学会編, "細胞トキシコロジー試験法," 朝倉書店, 東京, 1991, pp. 247-251. |
| 3) | 石館 基 監修, "〈改訂〉染色体異常試験データ集," エル・アイ・シー社, 東京, 1987. |
| 3) | M.A. Kastenbaum, K.O. Bowman, Mutation Res., 9, 527-549, (1970). |
| 連絡先 |
| 試験責任者: | 田中憲穂 |
| 試験担当者: | 山影康次,若栗 忍,中川ゆづき,
日下部博一,橋本恵子 |
| (財)食品薬品安全センター秦野研究所 |
| 〒257 神奈川県秦野市落合 729-5 |
| Tel 0463-82-4751 | Fax 0463-82-9627 | |
| Correspondence |
| Authors: | Noriho Tanaka ( Study director )
Kohji Yamakage, Shinobu Wakuri,
Yuzuki Nakagawa, Hirokazu Kusakabe,
Keiko Hashimoto |
| Hatano Research Institute, Food and Drug Safety Center |
| 729-5 Ochiai, Hadano-shi, Kanagawa 257, Japan |
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |




