シアノグアニジンのラットを用いる経口投与簡易生殖毒性試験
Preliminaly Reproduction Toxicity Screening Test of
Cyanoguanidine by Oral Administration in Rats
要約
シアノグアニジンは,メラミン,グアニジン塩やグアナミン類の製造原料,ジシアンジアミド樹脂(染料固着剤,繊維加工剤),化成肥料,爆薬の原料,その他にエポキシ樹脂硬化剤,安定剤,医薬品,合成洗剤,粘度調整剤として使用されている.毒性に関する情報としては,マウスの経口投与によるLD50値が4000 mg/kg以上で1),ラットの混餌法による13週間の経口投与では50000 ppm以上の大量投与で腎障害が報告されている2).今回,OECDによる既存化学物質の安全性点検に係わる毒性調査事業の一環として,SDラット(1群雌雄各12匹)に40,200および1000 mg/kgの用量を交配前14日から交配を経て雄は計44日間,雌は妊娠,分娩を経て哺育3日まで経口投与し,反復投与毒性および生殖発生毒性について検討した.
1. 反復投与毒性
一般状態,体重および摂餌量に被験物質の影響は認められなかった.また,剖検,腎臓,精巣,精巣上体の重量および病理組織学検査でも被験物質に起因する変化は認められなかった.
2. 生殖発生毒性
親動物の交尾率,受胎率,黄体数,着床数,着床率,分娩率,出産率,妊娠期間,分娩および哺育行動には被験物質に起因する変化は認められなかった.また,出産児数,出産生児数,性比,出生率,新生児の4日生存率,外表,一般状態,体重および剖検のいずれにおいても被験物質に起因する変化は認められなかった.
以上の結果より,シアノグアニジンの反復投与毒性に関する無影響量は雌雄とも1000 mg/kg/day,生殖発生毒性に関する無影響量についても親動物および児動物ともに1000 mg/kg/dayと考えられる.
方法
1. 被験物質
シアノグアニジン(日本カーバイド工業 ,Lot No. L-2271,純度99.8 %)は,融点209℃,水,エタノールおよびアセトンにわずかに溶ける白色結晶粉末である.被験物質は室温・暗所で保管した.また,試験期間中安定であったことが確認された.
,Lot No. L-2271,純度99.8 %)は,融点209℃,水,エタノールおよびアセトンにわずかに溶ける白色結晶粉末である.被験物質は室温・暗所で保管した.また,試験期間中安定であったことが確認された.
2. 試験動物および飼育条件
日本チャールス・リバー から入手した雌雄のSDラット〔Crj:CD(SD)IGS〕を6日間検疫・馴化後,試験に供した.投与開始前日に体重別層化無作為抽出法により,1群につき雌雄各12匹を振り分けた.投与開始時の週齢は雌雄とも9週齢,体重範囲は雄が344〜376 g,雌が204〜245 gであった.
から入手した雌雄のSDラット〔Crj:CD(SD)IGS〕を6日間検疫・馴化後,試験に供した.投与開始前日に体重別層化無作為抽出法により,1群につき雌雄各12匹を振り分けた.投与開始時の週齢は雌雄とも9週齢,体重範囲は雄が344〜376 g,雌が204〜245 gであった.
検疫・馴化期間を含めた全飼育期間中,温度22±2℃,湿度55±15 %,換気約12回/時,照明12時間/日(7:00〜19:00)に設定した飼育室を使用した.動物は実験動物用床敷(ベータチップ:日本チャールス・リバー )を敷いたポリカーボネート製ケージに,群分け後は1匹,交配期間は雌雄各1匹,哺育期間は1腹で収容し,飼育した.
)を敷いたポリカーボネート製ケージに,群分け後は1匹,交配期間は雌雄各1匹,哺育期間は1腹で収容し,飼育した.
動物には,オートクレーブ滅菌した実験動物用固型飼料(CRF-1:オリエンタル酵母工業 )および5 μmのフィルターで濾過後,紫外線照射した水道水をそれぞれ自由摂取させた.
)および5 μmのフィルターで濾過後,紫外線照射した水道水をそれぞれ自由摂取させた.
3. 投与量および投与方法
SDラットの雌雄を用いて,被験物質を100,300および1000 mg/kgの用量で14日間経口投与した結果,1000 mg/kg群でも雌雄ともに被験物質による明確な毒性変化は認められなかった.以上の結果から,本試験では高用量を1000 mg/kgとし,以下公比5で中用量を200 mg/kg,低用量を40 mg/kgとした.また,媒体(3%アラビアゴム水溶液)のみを投与する対照群を設けた.
投与期間は,雌雄とも交配前14日間,交配期間,および雄は剖検前日までの計44日間,雌は交尾成立後,妊娠,分娩を経て哺育3日まで(41〜46日間)とし,プラスチック製胃ゾンデを用いて1日1回,午前中に強制経口投与した.投与液量は5 mL/kgとし,至近測定日の体重を基に算出した.
被験物質は3%アラビアゴム水溶液に懸濁させ,投与に供するまで冷蔵保存し,調製後7日以内に使用した.投与開始前に投与液中の被験物質の均一性,安定性および濃度を確認した.
4. 反復投与毒性に関する観察・検査
1) 一般状態
全例について生死,外観,行動等を投与前および投与後に毎日観察した.
2) 体重および摂餌量
体重は,雌雄とも投与開始日,投与開始後3,7,14日,およびその後週1回,交尾した雌は妊娠0,7,14,20日および哺育0,4日に測定した(交尾確認日を妊娠0日,分娩確認日を哺育0日とする).また,雄では投与開始日の体重を基準に,雌では交配前期間,妊娠期間,哺育期間をそれぞれ投与開始日,妊娠0日,哺育0日の体重を基準に体重増加量を算出した.摂餌量は,交配期間を除き体重測定日に測定した.
3) 病理学検査
雌雄とも最終投与日の翌日に,全生存動物についてチオペンタールナトリウムの腹腔内投与による麻酔下で腹大動脈の切断・放血により安楽死させて剖検し,腎臓,精巣および精巣上体の重量を測定した.また,解剖日の体重を基に相対重量(対体重比)を算出した.さらに,これらの器官に加えて,卵巣および肉眼的異常部位を採取し,10 %中性リン酸緩衝ホルマリン液で固定後保存した.ただし,精巣および精巣上体はブアン液で固定した.
病理組織学検査は雌雄の対照群および1000 mg/kg群の腎臓,精巣および精巣上体,全動物の肉眼的異常部位,非妊娠雌の卵巣について,常法に従いヘマトキシリン・エオジン染色標本を作製して鏡検した.
5. 生殖発生毒性に関する観察・検査
1) 生殖機能
交配前の投与期間終了後,各群内で雄1雌1の交配対を設け,最長7日間昼夜同居させ,毎日午前中に雌の膣垢を採取し,ギムザ染色して鏡検した.膣栓形成あるいは膣垢標本中に精子が認められた場合を交尾成立とし,その日を妊娠0日とした.交尾した対は雌雄を分離し,以後の検査に供した.これらの結果から,交尾所要日数(交配開始後,交尾成立までに要した日数),交尾成立までに逸した発情期の回数,交尾率〔(交尾動物数/同居動物数)×100〕,受胎率〔(受胎動物数/交尾動物数)×100〕を算出した.
2) 分娩・哺育状態
交尾が確認された雌は全例を自然分娩させ,分娩状態を観察した.午前9時の時点で分娩が完了している動物を当該日分娩とし,その日を哺育0日とした.その後,新生児を生後4日(哺育4日)まで哺育させ,授乳,営巣,食殺の有無等の哺育状態を毎日観察した.
母動物は,哺育4日の剖検時に卵巣,子宮を摘出し,黄体数および着床数を検査した.分娩しない雌は交尾確認後26日に剖検し,肉眼的に着床が認められない動物の子宮は2 % KOH 水溶液に浸漬して着床の有無を確認した.これらの結果から,妊娠期間(妊娠0日から出産が確認された日までの期間),出産率〔(生児出産雌数/受胎雌数)×100〕,着床率〔(着床数/黄体数)×100〕,分娩率〔(総出産児数/着床数)×100〕を算出した.
3) 新生児の観察・検査
(1) 新生児の観察
哺育0日に出産児数(出産生児数,死産児数),性別および外表異常の有無を検査した.その後,一般状態,死亡の有無を哺育4日まで毎日観察した.哺育0および4日の生存児数から出生率〔(出産生児数/総出産児数)×100〕,新生児の4日生存率〔(哺育4日生児数/出産生児数)×100〕を算出した.
(2) 体重
哺育0および4日に全生存児を個体ごとに測定した.また,哺育0日の体重を基準に体重増加量を算出した.
(3) 剖検
哺育4日に全生存児の口腔を含む外表を検査した後,親動物と同様にして安楽死させ,剖検した.死亡動物は食殺等で検査に耐えないものを除き,10 %中性リン酸緩衝ホルマリン液に浸漬・固定後,実体顕微鏡下で剖検した.
6. 統計解析
計量データについては,パラメトリックデータはBartlett法による等分散性の検定を行い,分散が一様の場合は一元配置分散分析を行った.分散が一様でない場合およびノンパラメトリックデータはKruskal-Wallisの検定を行った.群間に有意な差が認められた場合はDunnett法またはDunnett型の多重比較を行った.計数データのうち,病理組織所見はa×bのχ^2 検定を行い,有意差が認められた場合はArmitageのχ^2 検定により対照群と各被験物質投与群間の比較を行った.その他の計数データはFisherの直接確率法により検定した.有意水準は5 %とし,新生児に関するデータは各母動物ごとに算出した平均値を標本単位とした.
結果
1. 反復投与毒性
1) 一般状態
雌雄とも全観察期間を通して一般状態に変化は認められなかった.
2) 体重(Fig.1,2)
雌雄とも全期間を通して体重および体重増加量ともに対照群と被験物質投与群との間に有意な差は認められなかった.
3) 摂餌量
雌雄とも全期間を通して対照群と被験物質投与群との間に有意な差は認められなかった.
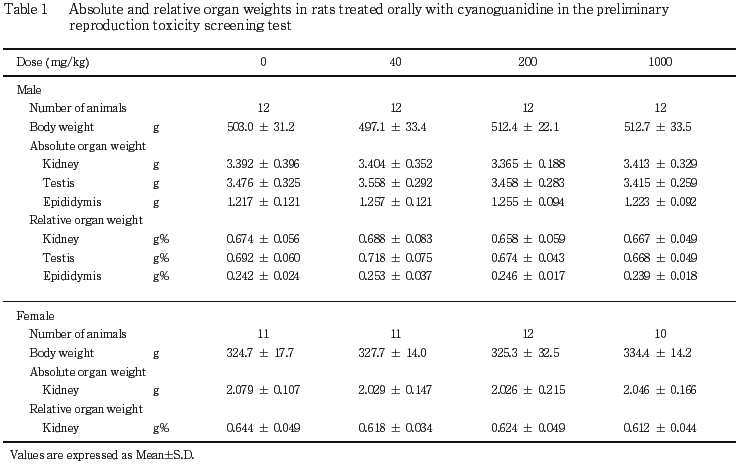
4) 器官重量(Table 1)
腎臓,精巣および精巣上体のいずれにも絶対重量および相対重量とも対照群と被験物質投与群との間に有意な差は認められなかった.
5) 剖検所見
腎臓に片側性の嚢胞,瘢痕,腎盂の拡張および腎盂内顆粒状物,精巣上体の片側性の結節,脾臓の腫大が対照群を含む各群の雌雄で散発的に認められたが,いずれも1例のみの発現で,1000 mg/kg群で多発する傾向もみられなかったことから,被験物質との関連はない変化と判断した.
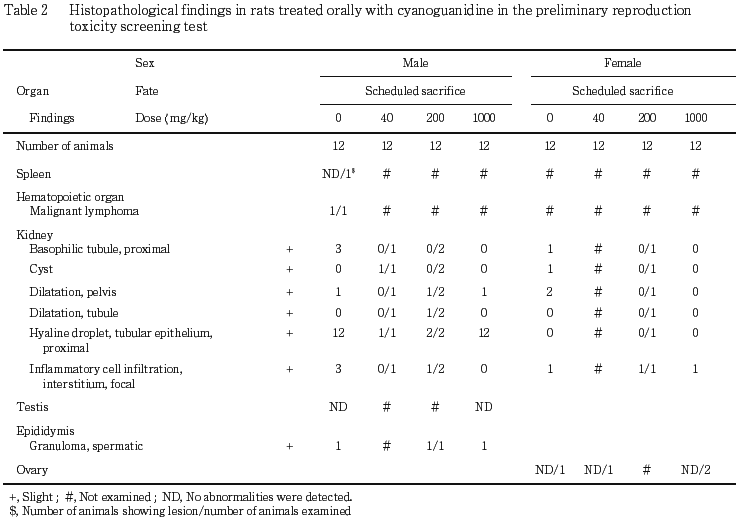
6) 組織所見(Table 2)
腎臓の尿細管上皮の硝子滴および尿細管の拡張,精巣上体の精子肉芽腫が雄で,腎臓の嚢胞,好塩基性尿細管,腎盂の拡張および間質における限局性炎症性細胞浸潤が雌雄で認められたが,いずれもラットで自然発生性に観察される変化であり,1000 mg/kg群で多発する所見もなく,発現頻度にも対照群との間に有意な差は認められなかったことから,偶発病変と判断した.この他,悪性リンパ腫が脾臓の腫大を示した対照群の雄1例に認められた.なお,非妊娠動物の卵巣に異常は認められなかった.
2. 生殖発生毒性
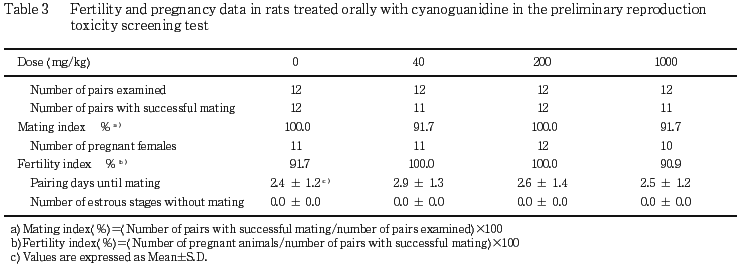
1) 生殖機能(Table 3)
未交尾動物は40および1000 mg/kg群でそれぞれ1対観察されたが,他の全ての交配対は交配開始後5日以内に雌が発情期を示して交尾し,交尾率,交尾所要日数および交尾成立までに逸した発情期の回数ともに対照群と被験物質投与群との間に有意な差は認められなかった.また,非妊娠動物は対照群および1000 mg/kg群でそれぞれ1例観察されただけであり,受胎率にも有意な差は認められなかった.
2) 分娩・哺育状態(Table 4)
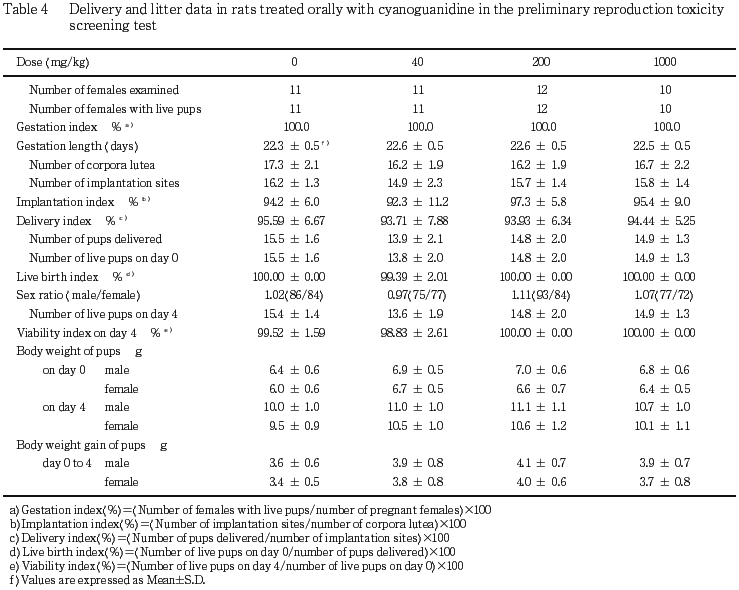
各群とも母動物全例が交尾確認後22または23日に正常な分娩を示した.また,妊娠期間,黄体数,着床数,着床率,分娩率および出産率には,対照群と被験物質投与群との間に有意な差は認められなかった.また,各群いずれの母動物にも哺育行動に異常は認められなかった.
3) 新生児に及ぼす影響
(1) 生存率(Table 4)
死産児あるいは生後の死亡児は対照群および40 mg/kg群のそれぞれ1,3腹で各1例観察されただけであり,出産児数,出産生児数,性比,出生率および新生児の4日生存率ともに対照群と被験物質投与群との間に有意な差は認められなかった.
(2) 外表および一般状態
出生日に皮下出血が対照群の2腹でそれぞれ1例に観察されたが,いずれも生後3日までに消失した.その他の動物には外表および一般状態ともに異常は認められなかった.
(3) 体重(Table 4)
各被験物質投与群の雌雄ともに対照群とほぼ同様な体重および体重増加量を示し,有意差は認められなかった.
(4) 剖検
対照群の1腹の生存動物1例で副脾が認められた.その他の動物には死亡例も含めて異常は認められなかった.
考察
1. 反復投与毒性
反復投与による影響について,一般状態,体重および摂餌量には雌雄ともに被験物質の影響は認められなかった.また,投与終了後の雌雄の剖検,腎臓,精巣,精巣上体の重量および病理組織学検査においても被験物質に起因する変化は認められなかった.シアノグアニジンについてはラットを用いた混餌法による反復経口投与毒性試験が実施されており,13週間の投与では50000 ppm以上の濃度で腎臓に近位尿細管上皮の核内封入体など,腎障害を示す変化が報告されている2).しかし,本試験条件下では1000 mg/kg群でも腎臓には重量変化や組織変化は認められなかった.なお,近年シアノグアニジンのラットを用いた2年間の発癌性試験が実施され,それによると50000 ppmの濃度でも腎病変の進行はみられず,さらに腎臓をはじめ催腫瘍性は認められなかったことが報告されている3).
2. 生殖発生毒性
親動物の検査において,交尾率,受胎率,黄体数,着床数,着床率,分娩率,出産率,妊娠期間,分娩および哺育行動ともに被験物質の影響を示唆する変化は認められなかった.また,新生児の検査においても,出産児数,出産生児数,性比,出生率,新生児の4日生存率,外表,一般状態,体重および剖検のいずれにも被験物質に起因する変化は認められなかった.したがって,被験物質による親動物の生殖機能,分娩・哺育機能および次世代の発育への影響はないと考えられる.
以上のように,本試験では反復投与による一般毒性学的影響は認められず,また,生殖・発生に及ぼす影響も認められなかった.したがって,本試験条件下における反復投与毒性に関する無影響量は雌雄とも1000 mg/kg/day,生殖発生毒性に関する無影響量についても親動物および児動物ともに1000 mg/kg/dayと考えられる.
文献
| 1) | 後藤 稠, 池田正之, 原 一郎編,"産業中毒便覧(増補版)," 医歯薬出版 , 東京, 1984, pp. 1153-1182. , 東京, 1984, pp. 1153-1182. |
| 2) | 松島裕子,小野寺博志,小笠原裕之,北浦敬介,三森国敏,前川昭彦,高橋道人,衛生試験所報告,109, 61(1991). |
| 3) | K. Yasuhara, T. Shimo, K. Mitsumori, H. Onodera, K. Kitaura, M. Takahashi, Food Chem. Toxicol., 35, 475(1997). |
| 連絡先 |
| 試験責任者: | 松浦郁夫 |
| 試験担当者: | 青山涼子,土井卓也,鈴木美江 |
|  三菱化学安全科学研究所鹿島研究所 三菱化学安全科学研究所鹿島研究所 |
| 〒314-0255 茨城県鹿島郡波崎町砂山14 |
| Tel 0479-46-2871 | Fax 0479-46-2874 | |
| Correspondence |
| Authors: | Ikuo Matsuura(Study director)
Ryoko Aoyama, Takuya Doi,
Yoshie Suzuki |
| Mitsubishi Chemical Safety Institute Ltd., Kashima Laboratory |
| 14 Sunayama, Hasaki-machi, Kashima-gun, Ibaraki, 314-0255, Japan |
| Tel +81-479-46-2871 | Fax +81-479-46-2874 | |
 )を敷いたポリカーボネート製ケージに,群分け後は1匹,交配期間は雌雄各1匹,哺育期間は1腹で収容し,飼育した.
)を敷いたポリカーボネート製ケージに,群分け後は1匹,交配期間は雌雄各1匹,哺育期間は1腹で収容し,飼育した. ,Lot No. L-2271,純度99.8 %)は,融点209℃,水,エタノールおよびアセトンにわずかに溶ける白色結晶粉末である.被験物質は室温・暗所で保管した.また,試験期間中安定であったことが確認された.
,Lot No. L-2271,純度99.8 %)は,融点209℃,水,エタノールおよびアセトンにわずかに溶ける白色結晶粉末である.被験物質は室温・暗所で保管した.また,試験期間中安定であったことが確認された. から入手した雌雄のSDラット〔Crj:CD(SD)IGS〕を6日間検疫・馴化後,試験に供した.投与開始前日に体重別層化無作為抽出法により,1群につき雌雄各12匹を振り分けた.投与開始時の週齢は雌雄とも9週齢,体重範囲は雄が344〜376 g,雌が204〜245 gであった.
から入手した雌雄のSDラット〔Crj:CD(SD)IGS〕を6日間検疫・馴化後,試験に供した.投与開始前日に体重別層化無作為抽出法により,1群につき雌雄各12匹を振り分けた.投与開始時の週齢は雌雄とも9週齢,体重範囲は雄が344〜376 g,雌が204〜245 gであった. )を敷いたポリカーボネート製ケージに,群分け後は1匹,交配期間は雌雄各1匹,哺育期間は1腹で収容し,飼育した.
)を敷いたポリカーボネート製ケージに,群分け後は1匹,交配期間は雌雄各1匹,哺育期間は1腹で収容し,飼育した. )および5 μmのフィルターで濾過後,紫外線照射した水道水をそれぞれ自由摂取させた.
)および5 μmのフィルターで濾過後,紫外線照射した水道水をそれぞれ自由摂取させた.





 , 東京, 1984, pp. 1153-1182.
, 東京, 1984, pp. 1153-1182. 三菱化学安全科学研究所鹿島研究所
三菱化学安全科学研究所鹿島研究所