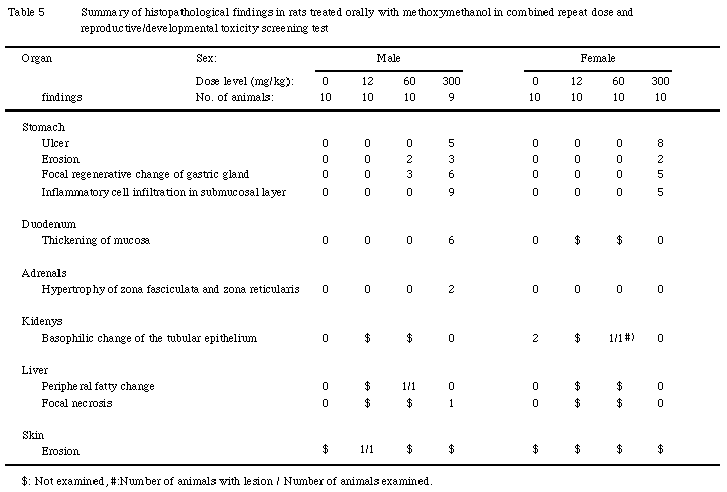
60mg/kg群においても,雄で胃の病理組織学的変化が認められた.
以上の結果より,本試験条件下におけるメトキシメタノールの反復役与毒性に関する無影響量は雄が12mg/kg,雌が60mg/kg,生殖発生毒性に関する無影響量は親動物に対して雌雄とも300mg/kg,児動物に対しては60mg/kgと考えられる.
検疫・馴化期間を含めた全飼育期間中,温度20〜25℃,湿度40〜70%R.H.,換気約12回/時,照明12時間(7:00〜19:00)に自動調節された飼育室を使用した.動物は,実験動物用床敷(ベータチップ:日本チャールス・リバー(株))を敷いたポリカーボネート製ケージに,1ケージ当り投与開始後は1匹,交配期間中は雌雄各1匹,哺育期間は1腹で収容し飼育した.
動物には,オートクレープ滅菌した実験動物用固型飼料(CRF-1:オリユンタル酵母工業(株))および5μmのフィルター濾過後紫外線照射した水道水を,それぞれ自由摂取させた.
投与期間は,雌雄とも交配前14日問,交配期問中,および雄は計画殺前日までの計44日間,雌は交尾成立後分娩を経て哺育3日までの計41〜47目間とした.被験物質は,精製水に用時溶解させ,胃ゾンデを用いて毎日1回,午前中に強制経口役与した.投与液量は5ml/kgとし,至近測定日の体重を基に算出した.なお,調製に際し純度換算は行わなかった.
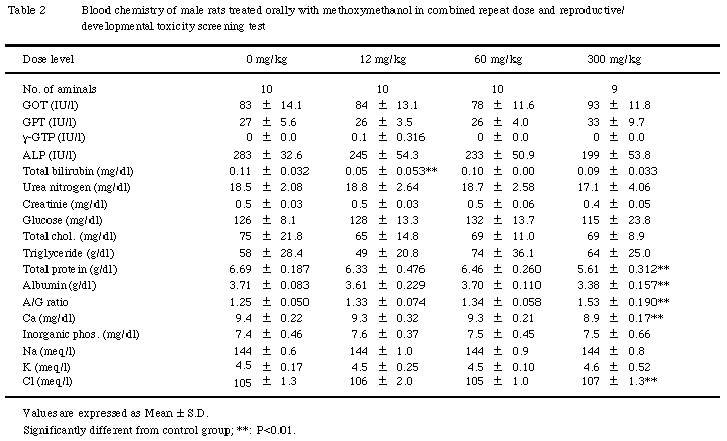
 法),総ビリルビン(Jendrassik改良法),総蛋白(Biuret法),アルプミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(O-CPC法),無機リン(UV法),ナトリウム,カリウム,クロライド(イオン選択電極法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
法),総ビリルビン(Jendrassik改良法),総蛋白(Biuret法),アルプミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(O-CPC法),無機リン(UV法),ナトリウム,カリウム,クロライド(イオン選択電極法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
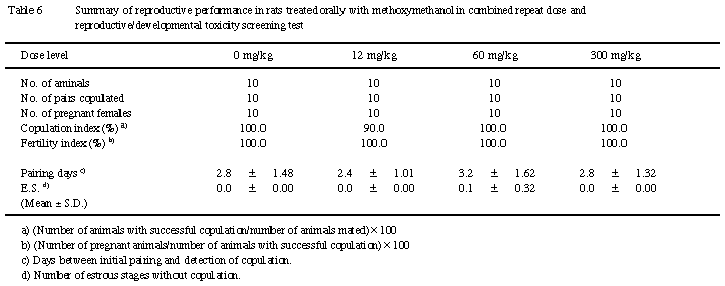
交配結果ならびに雌の妊娠状況から交尾所要日数(交配後,交尾成立までに要した日数),交尾が成立するまでに逸した発情期の回数,交尾率[(交尾動物数/同居動物数)×100],受胎率[(受胎動物数/交尾動物数)×100]を算出した.
哺育4目の解剖時に卵巣,子宮を摘出して黄体数および着床数を検査した.これらの検査結果から妊娠期間(妊娠0日から出産が確認された朝の前日までの期間),出産率[(生存児出産雌数/受胎雌数)×100],着床率[(着床数/黄体数)×100],分娩率[(総出産児数/着床数)×100]を年出した.
哺育0日に生存児数,死亡児数,性別および外表異常の有無を検査した後,一般状態,死亡の有無を毎日観察した.死亡動物は食殺等で検査に耐えないものを除き,ホルマリン,酢酸混合液により浸漬・固定し,実体顕微鏡下で内臓異常の有無を中心に剖検した.哺育0および4日の生存児数から,出生率[(出産確認時生存児数/総出産児数)×100],新生児生存率[(哺育4日生存児数/出産確認時生存児数)×100]を算出した.
(2)体重
哺育0日および4日に1腹毎に雌雄単位でまとめて測定し,それぞれの平均値を算出した.また,哺育0日の体重を基に4日までの体重増加量を算出した.
(3)形態学的検査
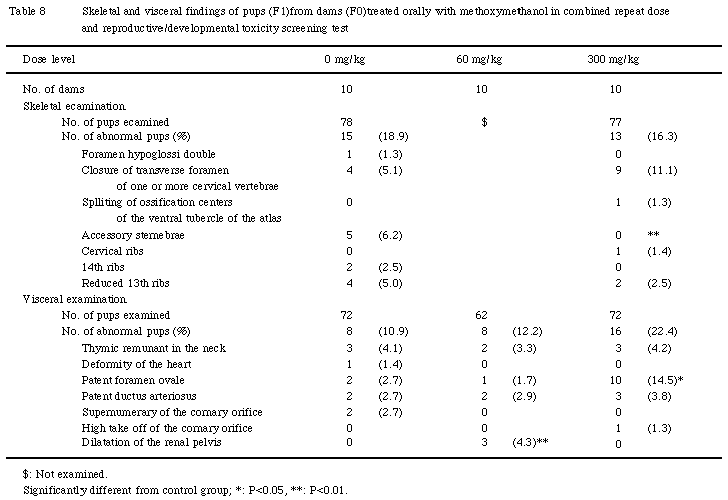
全ての生存児について哺育4日に口腔を含む外表異常の有無を検査した.その後各腹毎に,雌雄それぞれ約半数の生存児についてアリザリンレッドS骨格染色標本1)を作製し,対照群および300mg/kg群について骨格異常の有無を検査した.残りの生存児については,ホルマリン・酢酸混合液で固定後内臓標本とし,対照群および300mg/kg群について頭部をWilson氏法2),胸部および腹部を顕微解剖法3)により内臓異常の有無を検査した.この結果,300mg/kg群の卵円孔開存の発現率がやや高い傾向を示したため,60mg/kg群についても内臓検査を実施した.
 法により平均値を比較した.分散が一様でない場合はKruskal-Wallisの検定を行い,Dunnett型またはScheff
法により平均値を比較した.分散が一様でない場合はKruskal-Wallisの検定を行い,Dunnett型またはScheff 型の順位和検定を行った.ただし,下記*印の項目については,はじめにKruskal-Wallisの検定を行い,有意差が認められた場合に順位和検定を行った.計数データについてはFisherの直接確率法により検定した.有意水準は5%以下とした.新生児に関するデータについては,各母動物毎に算出した平均値を統計単位とした.以下に検定の対象となる項目を示す.
型の順位和検定を行った.ただし,下記*印の項目については,はじめにKruskal-Wallisの検定を行い,有意差が認められた場合に順位和検定を行った.計数データについてはFisherの直接確率法により検定した.有意水準は5%以下とした.新生児に関するデータについては,各母動物毎に算出した平均値を統計単位とした.以下に検定の対象となる項目を示す.
(1)多重比較検定
体重,体重増加量,摂餌量,血液学的検査,血液生化学的検査,器官重量,交尾所要日数*,交尾成立までに逸した発情期の回数*,妊娠期間*,黄体数,着床数,着床率*,分娩率*,新生児数,新生児体重,出生率*,新生児生存率*,生存児の骨格および内臓異常の発現率*
(2)Fisherの直接確率法
交尾率,受胎率,出産率,性比(雄/雌)
60mg/kg群においても流挺が雌雄とも少数例で観察されたが,ほとんどが投与期間を通して1〜2回認められたのみであった.

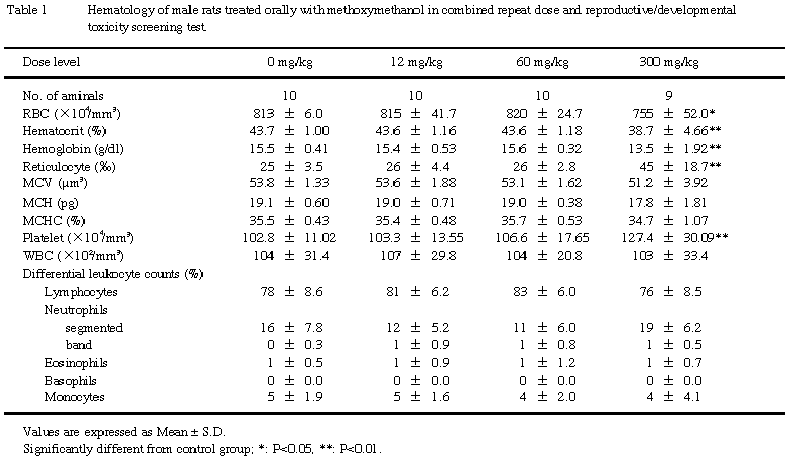
白血球百分率には対照群と被験物質投与群との間に有意な差は認められなかった.
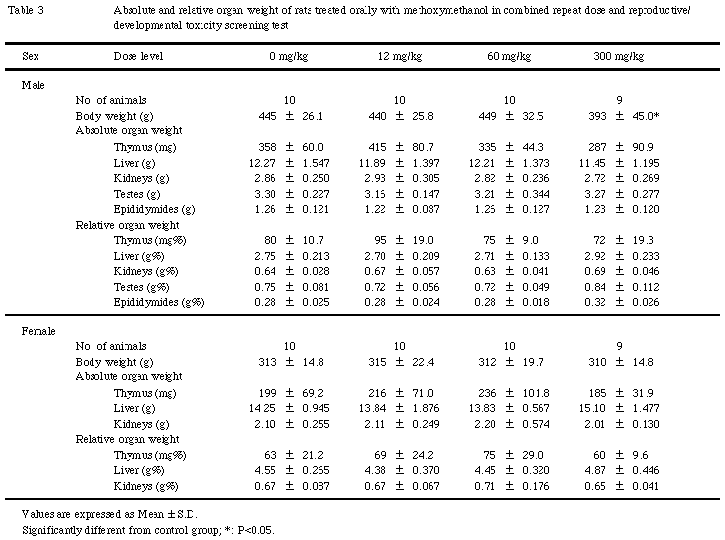
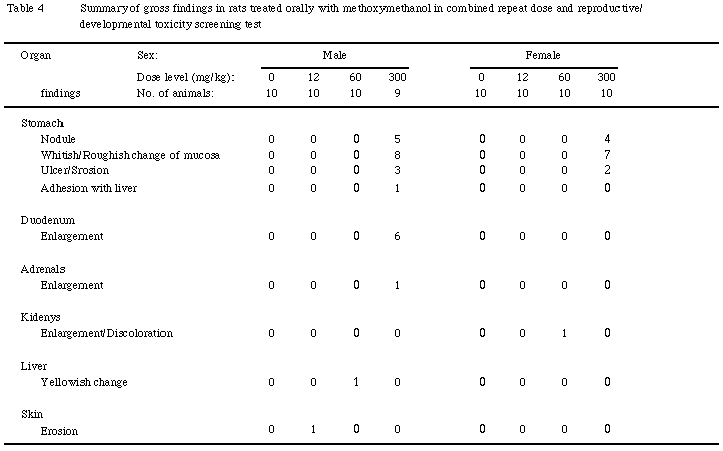
胃では,腺胃および前胃粘膜における潰瘍ないしびらんが300mg/kg群の雄3例および雌2例で,大小様々な結節形成が300mg/kg群の雄5例および雌4例で認められ,そのうち雄の1例では病変部の漿膜面が肝臓と癒着していた.また,腺胃粘膜の全体的な白色化ないし粗造化が300mg/kg群の雄8例および雌7例で認められた.
十二指腸の拡張が300mg/kg群の雄6例で認められた.拡張した十二指腸では,内容物の滞留や粘膜面の変化は認められなかった.
副腎の腫大が300mg/kg群の雄1例で認められた.
300mg/kg群の雄の死亡動物では,心房の拡張,肺のうっ血,胸腺の萎縮,腺胃粘膜における赤色斑および腸管の膨満が認められた.
胃では,腺胃および前胃粘膜の潰瘍が300mg/kg群の雄5例および雌8例で認められ,潰瘍部は滲出した炎症性細胞と肉芽組織によって隆起し,中には大肉茅腫を形成するものや病変が筋層を貫通したものもあった.また,腺胃では粘膜表層だけが剥離したびらんが60mg/kg群の雄2例,300mg/kg群の雄3例および雌2例で,粘膜下織における炎症性細胞浸潤が300mg/kg群の雄9例および雌5例で,腺胃粘膜の腺上皮の限局性再生性変化が60mg/kg群の雄3例,300mg/kg群の雄6例および雌5例で認められた.この限局性の再生部粘膜は,正常の固有腺細胞と異なった好塩基性の腺上皮によって構成されていた.なお,これらの病変はいずれも前胃,腺胃の境界部周囲で好発していた.
十二指腸では,十二指腸粘膜の肥厚が300mg/kg群の雄6例で認められた.肥厚した粘膜は深い陰窩と丈の高い絨毛から構成されており,対照群の雄の十二指腸とは明らかな差が認められた.
副腎では,束状帯および網状帯の肥大が300mg/kg群の雄2例で認められた.この2例では胃における潰瘍が重篤であった.
途中死亡動物では,計画解剖動物とほぼ同様の変化が認められ,腺胃粘膜における腺上皮の再生性変化,十二指腸における粘膜の肥厚,副腎における束状帯および網状帯の肥大が認められた.その他,肺のうっ血および水腫,胸腺の萎縮が認められた.
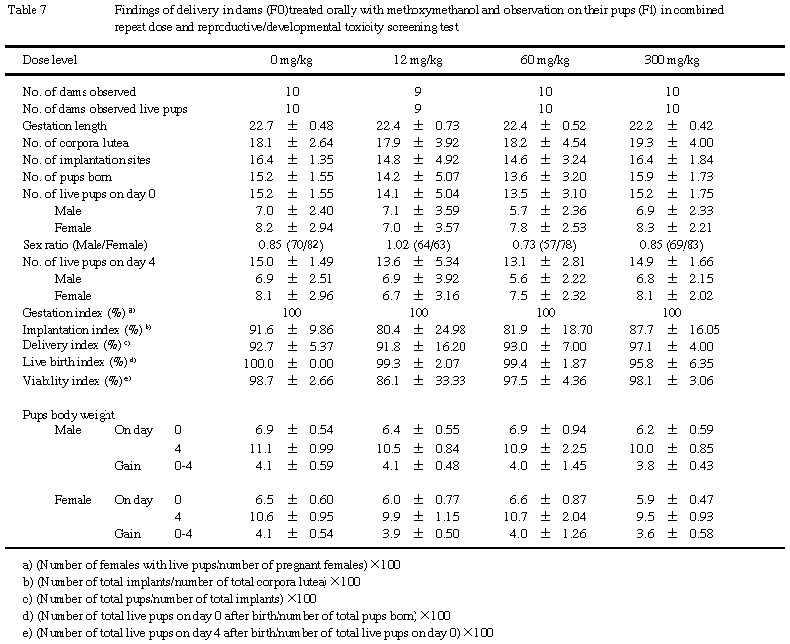
各群で死産児および出生後の死亡が少数例観察されたが,出産児数,生存児数および性比,また,出生率および新生児生存率ともに対照群と被験物質役与群との間に有意な差は認められなかった.
(2)新生児の観察
いずれの群においても外表異常を示す新生児は認められず,生後の一般状態にも被験物質投与に起因する異常は認められなかった.
(3)体重(Table 7)
雌雄とも哺育0日および4日の体重,ならびにその間の体重増加量に対照群と被験物質投与群との問に有意な差は認められなかった.
対照群および300mg/kg群ともに骨格奇形は認められなかった.変異として過剰舌下神経孔,頸椎椎体横突孔閉鎖,第一頸椎腹結節骨化核分離,過剰胸骨分節,頸肋骨,14本肋骨(痕跡肋骨)および第13肋骨短小が観察されたが,対照群に比べ有意に増加した所見は認められなかった.なお,300mg/kg群の過剰胸骨分節の発現率が有意な低値を示したが,偶発的な変化と考えられる.
(2)内臓検査
300mg/kg群において卵円孔開存の発現率に有意な増加が認められた.本所見は対照群では2腹で2例,60mg/kg群では1腹で1例であったのに対し,300mg/kg群では6腹で10例と発現腹数もやや多かった.
その他,各群で胸腺頸部残留,心臓変形,動脈管開存,過剰冠状動脈口,冠状動脈口高位および腎孟拡張が観察されたが,300mg/kg群で有意な変化を示した所見はなかった.
(3)死亡動物の内臓検査
検査可能であった動物は,対照群より順次,1,3,2および9例であった.分娩確認日の死亡動物では,水頭症が300mg/kg群の1例に認められた.また,哺育1日以降の死亡動物では,動脈管開存が対照群および300mg/kg群でそれぞれ1例,腎孟拡張が12mg/kg群の1例に認められた.いずれも少数例であることから,被験物質役与に起因したものではないと考えられる.その他,分娩確認日の死亡動物で卵円孔開存が12mg/kg群の1例および300mg/kg群の2例,動脈管開存が300mg/kg群の4例で認められたが,これらは出産前後に死亡したため卵円孔あるいは動脈管が完全に閉鎖しなかったものと考えられる.
なお,本試験において認められた消化管の変化はホルムアルデヒドのラットへの経口投与で認められた変化と同様の所見であった7).被験物質はその構造から,酸性条件下では速やかにホルムアルデヒドおよびメタノールに分解すると考えられる.これらのことから,今回認められた消化管障害は,胃内に投与された被験物質から分解生成したホルムアルデヒドの作用によるものである可能性が考えられる.
雄の血液学的検査において300mg/kg群で認められた赤血球数,ヘマトクリット値,ヘモグロンビン濃度の減少および網状赤血球の増加などの貧血性変化については,消化管障害による病変部からの出血に伴う二次的な変化であり,血小板数の増加については貧血に対する代償性の造血機能亢進が反映した結果と推察される.また,血液生化学的検査において300mg/kg群で認められた総蛋白,アルブミン,カルシウムの減少およびA/G比の変動についても,消化管障害およびそれに伴う摂餌量減少に起因した低栄養性変化と考えられる.
その他,副腎の束状帯および網状帯の肥大が300mg/kg群の雄2例で認められたが,これらの動物ではいずれも胃における潰瘍が重篤であったことから,ストレスによる二次的な変化と考えられる.また,一般状態観察で60mg/kg以上の群の雌雄で認められた流挺については,投与直前から流挺し始める動物が散見されたこと,および病理学的検査で被験物質の刺激性が示唆されていることから,局所刺激性に起因した変化と考えられる.
新生児の検査において,出産児数,生存児数,出生率,新生児生存率,一般状態および体重には対照群と被験物質投与群間で差は認められなかった.一方,形態学的検査において,外表および骨格異常は認められなかったが,生後4日における卵円孔開存の平均発現頻度が対照群の2.7%(2腹で2例)に対し,300mg/kg群では14.5%(6腹で10例)と有意な増加を示した.しかしながら,同一ロットのSD系ラットを用いた他の試験では対照群の新生児の平均9.1%(3腹で5例)に卵円孔開存がみられ8),300mg/kg群の発現頻度はこれをやや上回る程度であった.ヒトでは軽度の卵円孔開存が障害を現すのはまれであり9),さらに針孔状のものはヒトの約25%に残存がみられるといわれる10).本試験の300mg/kg群の新生児には卵円孔開存の発現率増加以外には特に異常な所見は観察されず,その毒性学的意義は明らかでなかった.
なお,卵円孔開存は心臓の一次あるいは二次心房中隔の形成不全に基づく心臓中隔の異常である.被験物質から分解生成すると考えられるホルムアルデヒドについてはラットでの催奇形性の報告はないが11-13),被験物質に含まれるメタノールについては吸入でラット胎児に心臓中隔の異常である心室中隔欠損を起こすことが報告されている14,15).しかし,メタノールでは心臓の異常とともに種々の骨格変異の増加および周産期死亡の増加を伴っているのに対して,本試験の新生児には同様の変化は認められず,卵円孔開存の発現率増加と被験物質に含まれるメタノールとの関連については明らかでなかった.なお,被験物質と類似の構造を有するメトキシエタノールもラットの胎児に心・血管系の異常を起こすことが報告されているが16-18),メトキシエタノールが毒性を示すにはアルコキシ酢酸型への代謝が必要といわれている19,20).被験物質から分解生成されると考えられるホルムアルデヒドおよびメタノールはともに生体内でギ酸に代謝されることから,被験物質からアルコキシ酢酸が生成し影響を及ぼす可能性は少ないものと考えられる.
以上のように,本試験では雄は60mg/kg以上の群,雌は300mg/kg群で親動物に被験物質の刺激性に起因する消化管障害を主とした毒性変化が認められた.親動物の生殖機能,分娩,哺育行動おょび新生児の一般状態,生存率,体重には被験物質投与の影響は認められなかったが,300mg/kg群で生後4日における新生児の卵円孔開存の発現頻度に軽度の増加が認められた.従って,本試験条件下における反復投与毒性に関する無影響量は雄が12mg/kg,雌が60mg/kg,生殖発生毒性に関する無影響量は親動物に対して雌雄とも300mg/kg,児動物に対しては60mg/kgと考えられる.
| 1) | R. E. Staples and V. L. Schnell, Stein Techn., 39, 61 (1964). |
| 2) | J. G. Wilson, “Teratology pdnciples and techniquesed,” ed. by J. G. Wilson and Warkany, The Univ. of Chicago press, Chicago and London, 1965, pp.262-277. |
| 3) | 西村耕一,Cong. Anom., 14, 23 (1974). |
| 4) | P. Greves, “Histopathology of preclinical toxicity studies: Stomach,” Elsevier, Amsterdam, 1990, pp.305-308. |
| 5) | 賀来亨,“新病理学各論,消化器・胃,胃の炎症 胃炎,”菊地浩,吉木敬編,南山堂,東京,1992,pp.228-231. |
| 6) | P. Greves, “Histopathology of preclinical toxicity studies: Small intesting,” Elsevier, Amsterdam, 1990, pp.346-348. |
| 7) | H. P. Til et al., Food Chem. Toxicol.,27, 77 (1989). |
| 8) | ジフェニルクレジルフォスフェートの経口投与によるラットの反復投与毒性・生殖発生毒性併合試験,(株)三菱化成安全科学研究所(1993). |
| 9) | 安田峰生ら,“現代外科学大系第8巻A,奇形I,I心臓,”木本誠二監修,中山書店,東京,1974,pp.128-144. |
| 10) | J. Warkany, “Congenital malformations: Atrial septal defects,” ed. by J. Warkany, Year Book Medical Publishers, Inc., Chicago, 1981, pp.480-489. |
| 11) | T. H. Ma and M. M. Harris, Mut. Res., 196, 37 (1988). |
| 12) | T. A. Marks et al., Teratology, 22, 51 (1980). |
| 13) | A. M. Saillenfait, et al., Food Chem. Toxicol., 27, 545 (1989). |
| 14) | B. K. NeIson et al., Fund. Appl. Toxicol., 5,727 (1985). |
| 15) | メタノールのラットを用いた吸入催奇形性試験(胎児器官形成期投与試験), (株)三菱化成安全科学研究所(l986). |
| 16) | B. K. Nelson, Teratology, 25, 64A (1984). |
| 17) | M. Toraason et al., Teratology 32, 33 (1985). |
| 18) | T. R. Hanley et al., Toxicol.Appl. Phermacol., 75, 409 (1984). |
| 19) | J. Yonemoto et al., Toxicol Lett., 21, 97 (1984). |
| 20) | N. A. Brown et al., Toxicol Lett., 22, 93 (1984). |
| 連絡先 | |||
| 試験責任者: | 松浦郁夫 | ||
| 試験担当者: | 佐藤ゆかり,谷栄之介
土谷稔,松本順子,豊田直人 | ||
| (株)三菱化学安全科学研究所鹿島研究所 | |||
| 〒3l4-02茨城県鹿島郡波崎町砂山l4 | |||
| Tel 0479-46-287l | Fax 0479-46-2874 | ||
| Correspondence | |||
| Authors: | Ikuo Matsuura(Study director)
Yukari Satoh, Einosuke Tani, Minoru Tsuchitani, Junko Matsumoto, Naoto Toyota | ||
| Mitsubishi Chemical Safety Institute Ltd., Kashima Laboratory | |||
| 14 Sunayama, Hasaki-mach, Kashima-gun, Ibaraki, 314-02, Japan | |||
| Tel +8l-479-46-287l | Fax +8l-479-46-2874 | ||