3-メチル-1,5-ペンタンジオールのラットを用いる
反復経口投与毒性・生殖発生毒性併合試験
Combined Repeat Dose and Reproductive/Developmental Toxicity Screening Test of
3-Methyl-1,5-pentanediol by Oral Administration in Rats
要約
3-メチル-1,5-ペンタンジオールは,塩化ビニール製造に用いるポリエステル系の可塑剤の原料,またはポリウレタンの原料であるポリエステルポリオールの原料として広く使用されている.3-メチル-1,5-ペンタンジオールの0(対照群),100,300および1000 mg/kgの用量を雌雄ラット(SD系ラット;Crj:CD)に1日1回,雄には交配2週間前から交配期間を通して剖検前日までの49日間,雌には交配2週間前から交配期間,妊娠期間中および分娩後の哺育3日までの41〜45日間経口投与し,反復投与による一般毒性学的な影響を検索するとともに,雌雄動物の性腺機能,交尾行動,受胎および分娩などの生殖発生に及ぼす影響について検索した.
1.反復投与毒性
1000 mg/kg群の約半数例において,投与直後に発現し,投与1時間後以降に消失する流涎が雄で投与29日以降,雌で妊娠10日以降に観察された.また,同群では雌の病理学検査において肝細胞の脂肪化の消失およびグリコーゲン量の増加と肝臓重量の高値が認められた.1000 mg/kg群の体重,摂餌量,雄の血液学検査,血液生化学検査および病理学検査には被験物質投与の影響は認められなかった.300および100 mg/kg群にはいずれの観察,測定および検査においても被験物質投与の影響は認められなかった.
2.生殖発生毒性
親動物に関して,雌の性周期および発情回数,雌雄の交尾率および受胎率,雌の妊娠期間,分娩および哺育状態,さらには黄体数,着床痕数および着床率,出産率および分娩率に被験物質投与の影響は認められなかった.
新生児に関して,哺育0日の生産児数,死産児数および出生率,性比に被験物質投与の影響は認められず,外表異常児もみられなかった.また,体重推移および新生児の4日の生存率に被験物質投与の影響は認められず,剖検においても異常はみられなかった.
以上の成績から,本試験条件下における一般毒性学的な無影響量は雌雄ともに300 mg/kg/dayと考えられた.また,生殖発生学的な無影響量は雌雄親動物および次世代の児動物ともにいずれも1000 mg/kg/dayと考えられた.
方法
1.被験物質
3-メチル-1,5-ペンタンジオール[CAS No. 4457-71-0,(株)クラレ,Lot No. 63136,純度99.18%,分子量118.20,比重0.97(20℃),沸点270℃,凝固点-50℃以下]は,無色透明な液体であり,容器中の大気を窒素置換し,室温・密閉・暗所条件下で保存した.なお,動物試験終了後に残余の被験物質を分析した結果,純度は99.05%であり,被験物質は安定であったことが確認された.
被験物質は,注射用水(日本薬局方,(株)大塚製薬工場)に溶解し,2,6および20%(w/v)濃度に調製した.調製は1週間に1回の頻度で行った.調製後の被験液は,1日分ずつ褐色ガラス瓶に分注し,容器中の大気を窒素置換した上で室温・暗所条件下で保存した.本被験物質の2〜20%(w/v)液は,窒素置換・室温・暗所保存条件下で8日間安定であることが確認されている.
被験液の濃度確認は,雌雄の投与開始前および雄の投与最終週の2回,各濃度液について実施した.その結果,いずれの被験液も設定濃度の99.0〜105.0%の範囲であり,ほぼ設定濃度の3-メチル-1,5-ペンタンジオールが含有されていたことを確認した.
2.使用動物および飼育条件
試験には,雌雄とも日本チャールス・リバー(株)より7週齢で購入したSprague-Dawley(Crj:CD)系SPFラットを使用した.動物は,購入後7日間検疫・馴化飼育した後,一般状態に異常がなく,体重増加が良好な動物を8週齢で群分けして試験に使用した.群分け時の体重範囲は雄で302〜326 g,雌で206〜232 gであった.なお,雌については,検疫・馴化期間中に全動物の膣スメアを採取して,性周期に異常のない動物を試験に使用した.
動物は,温度22.5±3.5℃,相対湿度50±20%,換気回数1時間10〜15回,照明1日12時間(午前7時〜午後7時)の飼育室で飼育した.
動物は,交配期間および妊娠17日から哺育4日までの期間を除き,金属製網ケージ[リードエンジニアリング(株)]に個別に収容し,飼育した.交配期間中の夕方から翌朝までの間は,金属製網ケージ[理工電気(株)]に雌雄各1匹の計2匹を収容した.妊娠17日の母動物は,哺育4日まで床敷として木製チップ[ホワイトフレーク:日本チャールスリバー(株)]を入れたプラスチック製エコンケージ[日本クレア(株)]に個別に収容し,飼育した.
飼料は,オリエンタル酵母工業(株)のNMF固形飼料を使用し,飼料および飲料水は飼育期間中自由に摂取させた.
3.群分け
群分けは,投与開始日に行った.動物は,雌雄とも群分け当日の体重,検疫・馴化期間中の一般状態,増体重あるいは性周期の観察結果により選択した後,群分け当日の体重で層別化し,コンピュータを用いたブロック配置法により各群に振り分けた.1群の動物数は,雌雄各12匹とした.
4.投与量,群構成,投与期間および投与方法
3-メチル-1,5-ペンタンジオールの投与量は,先に実施した予備試験の結果を参考にして設定した.すなわち,3-メチル-1,5-ペンタンジオールの0,125,250,500および1000 mg/kg/dayを8週齢のSprague-Dawley (Crj:CD)系ラット雌雄各5匹に1日1回,14日間にわたって反復経口投与した結果,雌雄とも1000 mg/kgの投与においても一般状態,体重,摂餌量,血液学検査,血液生化学検査および剖検所見に被験物質投与の影響は認められなかった.したがって,高用量は,1000 mg/kg/dayとし,以下,公比約3で減じて中用量を300 mg/kg/day,低用量を100 mg/kg/dayに設定した.
投与経路は,OECDガイドラインに準じて強制経口投与とした.投与期間は,雄については交配前14日間およびその後剖検前日までの49日間,雌については交配前14日間,交配期間,妊娠期間および剖検前日の哺育3日までの41〜45日間とした.投与容量は,体重100 g当たり0.5 mlとし,個体毎の投与液量は,雄は各測定日の体重を,雌は交配前および交配期間中については各測定日の体重,妊娠期間中についたは妊娠0日,7日,14日および21日の体重,哺育期間中については哺育0日の体重を基準に算出した.投与は,金属製胃ゾンデを用いて1日1回行った.対照群には溶媒として使用した注射用水を同様に投与した.
5.反復投与毒性に関する観察,測定および検査
1) 一般状態
一般状態の観察は,雌雄とも試験期間を通じて毎日行った.
2) 体重
雄の体重は,投与1日(投与開始日),4日,8日,11日,15日,22日,29日,36日,43日および50日(剖検日)に測定した.雌の体重は,交配前については投与1日,4日,8日,11日および15日,妊娠期間中については妊娠0日,7日,14日および21日,哺育期間中については哺育0日および4日(剖検日)に測定した.
3) 摂餌量
雄の摂餌量は,剖検日を除く体重測定と同じ日に測定した.雌の摂餌量は,交配前については体重測定と同じ日に,妊娠期間中については妊娠1日,7日,14日および21日に,哺育期間中については哺育1日および4日に測定した.摂餌量は,前日からの残量を測定し,給餌量との差から1日摂取量として算出した.
4) 雄の血液学検査
雄の全個体について,剖検日の前日より約16時間絶食させ,エーテル麻酔下で開腹し,腹大動脈より血液を採取した.この血液の一部に抗凝固剤(EDTA-2K)を加えた血液を用いて赤血球数,ヘモグロビン量,ヘマトクリット値,平均赤血球容積(MCH),平均赤血球血色素量(MCH),平均赤血球血色素濃度(MCHC),血小板数および白血球数(電気抵抗変化検出法およびシアンメトヘモグロビン法)をコールター全自動8項目血球アナライザーT890[(株)日科機]を用いて測定,算出した.また,採取した血液の一部に3.8%クエン酸ナトリウムを加え,遠心分離(3000 rpm,10分間)して得られた血漿を用いてプロトロンビン時間,活性化部分トロンボプラスチン時間およびフィブリノーゲン量(クロット法およびトロンボプラスチン法)を血液凝固自動測定装置ACL100(Instrumentation Laboratory)を用いて測定した.また,採取した血液を用いてMay-Giemsa染色塗抹標本の観察により白血球百分率を,Brecher法による超生体染色標本の観察により網赤血球率を算出した.
5) 雄の血液生化学検査
雄の全個体について,血液学検査のための採血時に腹大動脈から採取したヘパリン処理血液を遠心分離(3000 rpm,10分間)して得られた血漿を用いてGOT,GPT,LDH(UV-rate法)を,また,血清を用いてAlP(Bessey-Loery法),総コレステロール(CEH-COD-POD法),トリグリセライド(GK-GPO-POD法),リン脂質(PLD-ChOD-POD法),総ビリルビン(アゾビリルビン法),血糖(Hexokinase-G6PD法),尿素窒素(Urease-GLDH法),クレアチニン(Jaff 法),ナトリウム,カリウムおよび塩素(イオン選択電極法),カルシウム(OCPC法),無機リン(モリブデン酸法),総蛋白質(Biuret法)を全自動分析装置Monarch(Instrumentation Laboratory)を用いて測定した.また,電気泳動装置CLINISCAN 2[(株)ヘレナ研究所]を用いて蛋白質分画(セルロースアセテート膜による電気泳動法)を測定し,蛋白質分画比率からA/G比を算出した.
法),ナトリウム,カリウムおよび塩素(イオン選択電極法),カルシウム(OCPC法),無機リン(モリブデン酸法),総蛋白質(Biuret法)を全自動分析装置Monarch(Instrumentation Laboratory)を用いて測定した.また,電気泳動装置CLINISCAN 2[(株)ヘレナ研究所]を用いて蛋白質分画(セルロースアセテート膜による電気泳動法)を測定し,蛋白質分画比率からA/G比を算出した.
6) 病理学検査
剖検は,雄については最終投与の翌日に,雌については哺育4日にそれぞれ全生存動物をエーテル麻酔下で放血致死させた後,内部器官および組織を肉眼的に観察した.さらに,心臓,胸腺,肝臓,腎臓,脾臓,精巣および精巣上体あるいは卵巣を摘出し,重量を測定し,最終体重から相対器官重量を算出した.これら器官に加えて,脳,下垂体,甲状腺(上皮小体を含む),肺(気管支を含む),副腎,子宮および膣を摘出し,リン酸緩衝液(1/15M,pH7.1〜7.4)で調製した10%ホルマリン液(精巣および精巣上体はブアン液)に固定した.なお,妊娠25日においても分娩しなかった対照群の1例および誤投与により死亡した100 mg/kg群の雄1例についても同様に処置した.
病理組織学検査は,雌雄とも対照群および1000 mg/kg群の脳,心臓,肝臓,腎臓,副腎,脾臓,精巣および精巣上体あるいは卵巣ならびに剖検時の肉眼的異常部位について常法に従ってヘマトキシリン・エオジン染色を行い鏡検した.その結果,雌の肝臓に被験物質投与の影響が疑われたため,300および100 mg/kgの雌の肝臓についても同様に検査した.さらに,1000 mg/kg群の雌に肝細胞のグリコーゲン量の増加が観察されたため,対照群および1000 mg/kg群の代表例各2例の肝臓についてPAS染色を施し,検索した.
6.生殖発生毒性に関する観察,測定および検査
1) 性周期観察および交配
性周期の観察は,投与開始日から交尾が確認されるまで毎日膣スメアを採取し鏡検し,発情期発現回数および発情期から次の発情期までの日数を性周期として算出した.
交配は,交配前14日間性周期の観察を行った雌を同一群内の雄と1対1の組み合わせで終夜同居させた.同居期間は最長14日間とし,交尾が確認されるまでとした.交尾の確認は,毎朝膣栓形成あるいは膣垢中の精子の有無により行い,これらが確認された日を妊娠0日とした.交配結果から,交尾率[(交尾動物数/交配動物数)×100],受胎率[(受胎動物数/交尾確認動物数)×100]および交尾までに要した同居日数を求めた.なお,100 mg/kg群において雄1例が誤投与により死亡したため,交配すべき相手の雄がいなかった雌は,同一群内で交尾が確認された雄と交配した.
2) 分娩および哺育状態の観察
分娩観察は,交尾が確認された雌全例を自然分娩させて行った.分娩終了の確認は,妊娠21日から25日まで毎日午前,午後の2回行い,分娩が午前10時の時点で終了していた場合その日を哺育0日とし,午前10時以降に分娩が終了した場合はその翌日を哺育0日とした.妊娠25日においても分娩が確認されなかった動物は剖検し,妊娠の成否を確認した.
哺育状態の観察は,分娩終了が確認された母動物に出生児を哺育させ,哺育4日まで毎日行った.これらの観察結果から,妊娠期間[哺育0日(分娩確認日)-妊娠0日],出産率[(生児出産雌数/受胎動物数)×100],着床率[(着床痕数/黄体数)×100],分娩率[(総出産児数/着床痕数)×100]を算出した.
7.新生児の観察,測定および検査
1) 新生児の観察
哺育0日に生産児数および死産児数を数え,性別および外表異常の有無を検査した.生産児は全例を母動物に哺育させ,生死の観察を毎日1回行った.これらの観察結果から,性比[雄/(雄+雌)],出生率[(哺育4日の生存児数/総出産児数)×100],新生児の4日の生存率[(哺育4日の生存児数/哺育0日の生産児数)×100]を算出した.
2) 体重
体重は,哺育0日および4日に測定し,1腹毎に雌雄の平均値を算出した.
3) 剖検
哺育4日に生存児全例をエーテル麻酔下で放血致死させ剖検し,内部器官の異常の有無を観察した.
8.統計解析
体重,摂餌量,発情期発現回数,性周期,同居日数,妊娠期間,血液学および血液生化学検査値,器官重量(相対重量を含む),黄体数,着床痕数,生産児数,死産児数,着床率,性比,分娩率,出生率および新生児の4日の生存率については,まずBartlett法により各群の分散の均一性の検定を行い,分散が均一の場合は一元配置法による分散分析を行い,分散が有意で各群の例数が等しいときにはDunnett法,各群の例数が異なるときにはScheff 法の多重比較検定で対照群と各被験物質群の有意差を検定した.分散が均一でない場合は,Kruskal-Wallisの順位検定を行い,有意であれば対照群と各被験物質群との平均順位の差について,各群の例数が等しいときはDunnett型,各群の例数が異なるときはScheff
法の多重比較検定で対照群と各被験物質群の有意差を検定した.分散が均一でない場合は,Kruskal-Wallisの順位検定を行い,有意であれば対照群と各被験物質群との平均順位の差について,各群の例数が等しいときはDunnett型,各群の例数が異なるときはScheff 型の検定を行った.交尾率,受胎率および出産率についてはχ^2検定を行った.また,病理組織学検査の成績についてはMann-WhitenyのU検定を行った.有意水準は5および1%とした.なお,新生児に関するデータは1腹の平均を1標本とした.
型の検定を行った.交尾率,受胎率および出産率についてはχ^2検定を行った.また,病理組織学検査の成績についてはMann-WhitenyのU検定を行った.有意水準は5および1%とした.なお,新生児に関するデータは1腹の平均を1標本とした.
結果
1.反復投与毒性
1) 死亡動物および一般状態
被験物質投与による死亡はみられなかった.
一般状態の変化として,流涎が1000 mg/kg群の雌雄約半数例に観察され,雄では投与29日以降,雌では妊娠10日以降全試験期間を通じて一時的にあるいは継続してみられた.この流涎は,投与直後に発現し,投与1時間後以降に消失した.その他には,各群の雌雄に被験物質投与に関連した変化はみられなかった.
2) 体重および摂餌量(Fig.1〜4)
各群の体重および摂餌量は,雌雄とも全試験期間を通じて対照群と同様の推移を示し,被験物質投与の影響は認められなかった.


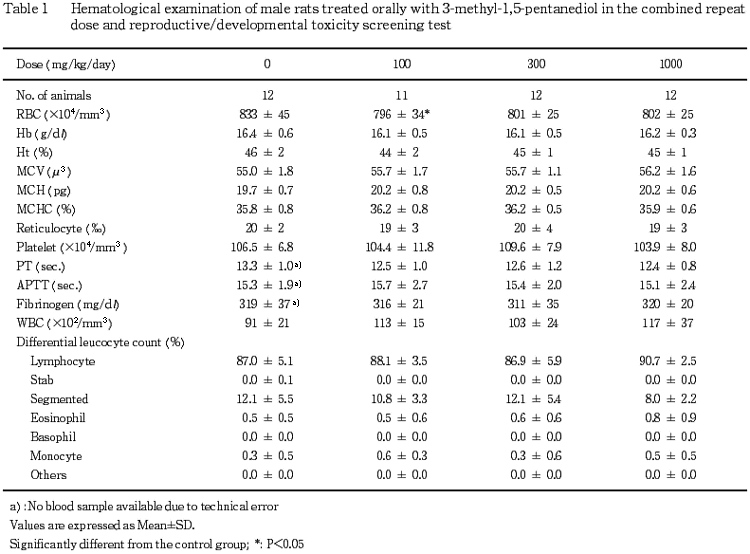
3) 雄の血液および血液生化学検査(Table 1,2)
血液学検査では,赤血球数の有意な低値が100 mg/kg群に認められたが,投与量との関連はなかった.その他に被験物質投与に関連した変化は認められなかった.
血液生化学検査では,1000 mg/kg群において蛋白分画におけるα1-グロブリン分画比率の有意な低値とアルブミン比率およびA/G比のわずかな増加傾向がみとめられたが,その変動が僅かであること,用量依存性がないことおよび血清蛋白に関連する諸項目に異常の認められないことから偶発的なものと判断した.その他,尿素窒素の有意な低値が300 mg/kg群に認められたが,投与量との関連はなかった.

4) 剖検所見
1000 mg/kg群において肺の暗赤色斑の散在が雄1例に,脾臓と肝臓,胃およびこれら器官周囲の脂肪組織の癒着が雌1例にみられた.これら変化は,組織検査においては肺については限局的な炎症性細胞の浸潤が軽微に,脾臓については被膜の線維化が軽度にみられたが,病変の性状および発現状況から被験物質投与との関連はないと考えられた.その他に,肉眼的な異常は認められなかった.
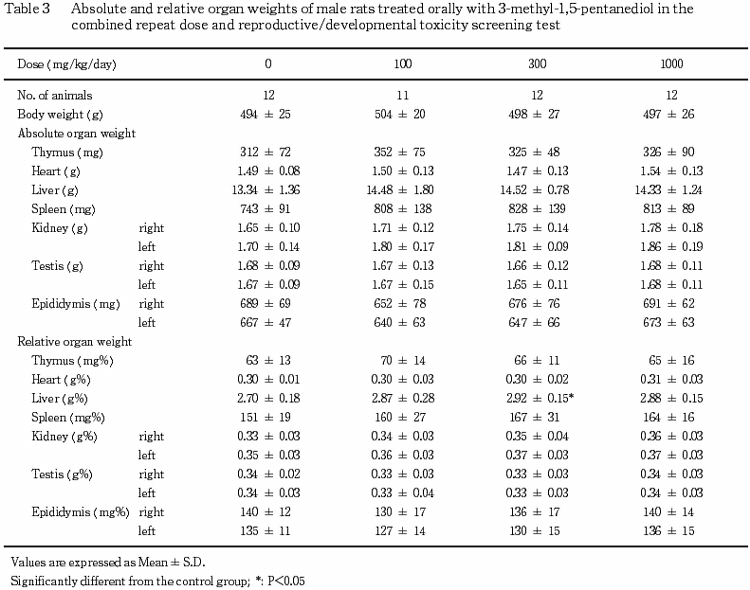
5) 器官重量(Table 3,4)
1000 mg/kg群の雌において,肝臓の絶対重量および相対重量の有意な高値,腎臓の絶対重量の高値傾向および相対重量の有意な高値,胸腺の絶対重量および相対重量の低値傾向が認められた.その他には,肝臓の相対重量の有意な増加が300 mg/kg群の雄に認められたが,投与量との関連はなかった.

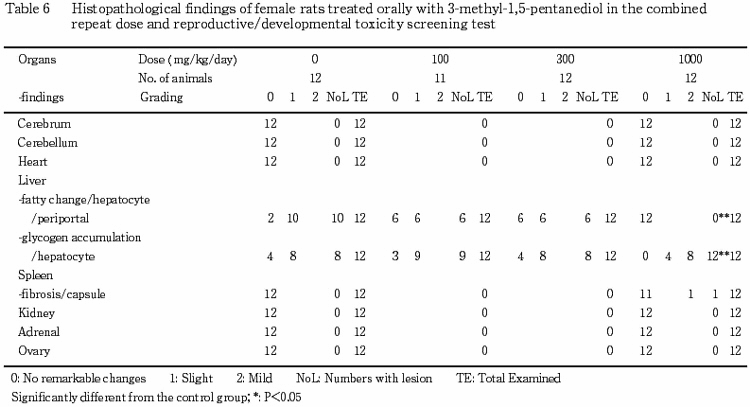
6) 病理組織学検査(Table5,6)
被験物質投与に起因すると考えられる変化は1000 mg/kg群の雌の肝臓にのみみられた.すなわち,肝細胞内に蓄積しているグリコーゲン量の増加が対照群,100および300 mg/kg群では8〜9例に軽微にみられたのに対し,1000 mg/kg群では全例に軽微あるいは軽度にみられ,1000 mg/kg群において発現総数の有意な増加が認められた.また,小葉周辺性の肝細胞の脂肪化が対照群,100および300 mg/kg群では6〜10例にみられたのに対し,1000 mg/kg群では同所見はみられず,1000 mg/kg群において発現総数の有意な減少が認められた.これらのことから,1000 mg/kg群では肝細胞の脂肪化が消失し,同時に肝細胞内の蓄積グリコーゲン量増加があるものと判断された.
その他,雄の小数例に腎臓に好酸性小体および精巣に限局的な精細管の萎縮がみられたが,これらの変化はその発現状況および病変の性状から,被験物質投与との関連はないと考えられた.

2.生殖発生毒性
1) 生殖機能(Table 7)
被験物質投与群における性周期,すなわち観察期間中における発情期発現回数および発情期から次の発情期までの日数は対照群とほぼ同等で有意な差は認められなかった.また,交配成績については被験物質投与群のいずれの組み合わせにおいても同居開始後5日以内に交尾が確認され,交尾までに要した日数にも有意な差は認められなかった.さらに,被験物質投与群における交尾率および受胎率はいずれも100%であった.

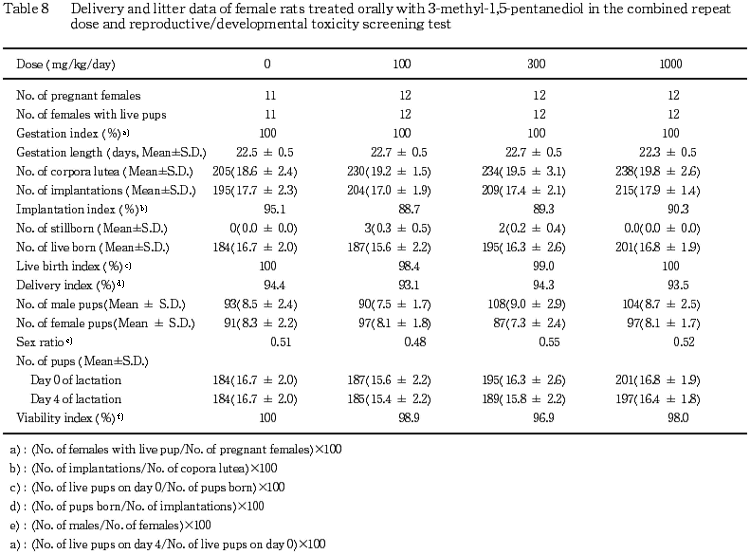
2) 分娩および哺育状態(Table 8)
各群のいずれの例においても妊娠23日までに分娩終了が確認され,分娩異常はみられなかった.また,被験物質投与群における妊娠期間,黄体数,着床痕数,着床率,出産率および分娩率は対照群と同等で有意な差は認められなかった.
哺育状態では,各群いずれの例においても巣作り,児集めおよび授乳などの哺育行動に異常は認められなかった.
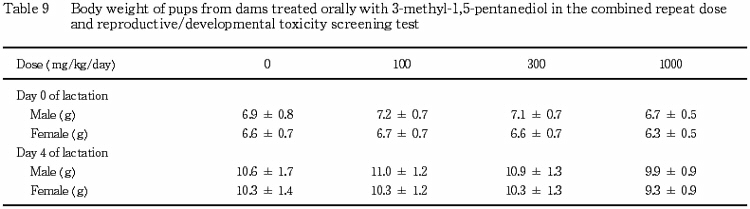
3) 新生児の形態観察,生存性,体重および剖検所見(Table 9)
新生児の外表検査では各群のいずれにも異常はみられなかった.被験物質投与群における生産児数および出生率は対照群とほぼ同等で有意な差は認められなかった.また,哺育0および4日の体重,新生児の4日の生存率は各群ともに同等の値を示し,対照群と各被験物質投与群の間に有意な差は認められなかった.哺育4日の剖検では,いずれの例においても異常はみられなかった.
考察
1.反復投与毒性
雄では,各群ともに被験物質投与による死亡はみられなかった.一般毒性学的な影響に関して,1000 mg/kg群において被験物質投与の影響として一般状態における投与直後の流涎が投与29日以降に約半数例に観察された.この流涎は,被験物質の苦み,刺激性あるいは物理的性状に起因して投与直前あるいは投与直後に一過性にみられる反射的な流涎とは異なり,投与直後に出現し,投与1時間後まで持続的に観察される変化であった.なお,同群の体重推移および摂餌量に変化は認められず,剖検においても唾液腺に肉眼的な異常は認められなかった.300および100 mg/kg群においては,いずれの観察,測定および検査においても被験物質投与の影響は認められなかった.
雌では,全試験期間を通じて死亡はみられなかった.一般毒性学的な影響に関して,1000 mg/kg群において被験物質投与の影響が一般状態および肝臓の病理学検査所見に認められた.すなわち,一般状態では雄と同様の流涎が約半数例において投与開始後,雄とほぼ同じ時期に相当する妊娠10日以降に観察された.肝臓では,病理組織学検査において肝細胞内のグリコーゲン量の増加が対照群および各被験物質投与群に認められた.この変化は雌にのみ認められたことから,妊娠あるいは分娩に関連した変化と考えられる.しかしながら,1000 mg/kg群ではこのグリコーゲン量の増加が他の群と比べわずかに増強し,一方,肝細胞の脂肪化は消失していた.さらに,同群では肝臓重量の有意な高値が認められたので,肝臓に被験物質投与の影響があるものと考えられたが,変性性の変化は認められず,毒性学的な意義は低いものと判断した.以上の他に,1000 mg/kg群において,胸腺重量の低値傾向および腎臓重量の高値が認められた.胸腺重量の低値は,同群において流涎が観察されており,ストレスに関連する可能性も考えられるが,副腎にストレス性変化を示唆する異常は認められなかった.腎臓の高値についてもその変動幅はわずかであり,組織学的な異常は認められなかった.したがって,これら器官重量の変化は,毒性学的な意義に乏しいものと考えられた.300および100 mg/kg群においては,一般状態,体重,摂餌量および病理学検査のいずれにも被験物質投与の影響は認められなかった.
以上の如く,1000 mg/kg群において雌雄に流涎が観察され,雌では肝臓に被験物質投与に関連した器官重量の高値および組織学的な変化が認められた.したがって,本試験条件下における3-メチル-1,5-ペンタンジオールの一般毒性学的な無影響量は,雌雄ともに300 mg/kg/dayであると判断された.
2.生殖発生毒性
1000 mg/kg群において雌の性周期,雌雄の交尾および受胎能力に及ぼす被験物質投与の影響は認められなかった.また,雄の精巣および精巣上体に被験物質投与に関連した組織学的な変化は認められず,精子の発生および発育に関する精巣毒性はないと判断された.雌動物では,妊娠期間および分娩に異常は認められず,黄体数,着床痕数および着床率,出産率および分娩率に被験物質投与の影響は認められなかった.さらに,分娩後の哺育行動にも異常は認められなかった.したがって,1000 mg/kgの用量においても雌雄親動物の生殖能力に及ぼす影響はないと考えられた.
新生児に関して,1000 mg/kg群においても新生児に外表異常は認められず,性比,生産児数および出生率に被験物質投与の影響は認められなかった.また,体重推移および新生児の4日の生存率に被験物質投与の影響は認められず,剖検においても異常は認められなかった.したがって,1000 mg/kgの用量においても次世代の発生および生後の発育に及ぼす影響はないと考えられた.
以上の如く,1000 mg/kg群においても雌雄親動物の生殖能力,新生児の生存および発育に影響は認められなかった.したがって,本試験条件下における3-メチル-1,5-ペンタンジオールの生殖発生毒性的な無影響量は,雌雄親動物および次世代の児動物いずれにおいても1000 mg/kg/dayと判断された.
| 連絡先 |
| 試験責任者: | 松岡哲也 |
| 試験担当者: | 杉沢健一,野村典行,石井孝広,田村一利,沼田昭弘,
勝亦倶慶 |
| (株)ボゾリサーチセンター 函南研究所 |
| 〒419-01 静岡県田方郡函南町桑原三本松1308 |
| Tel:0559-78-7851 | Fax:0559-78-7898 | |
| Correspondence |
| Authors: | Tetsuya Matsuoka(Study director)
Ken-ichi Sugisawa, Noriyuki Nomura,Takahiro Ishii, Kazutosi Tamura, Akihiro Numata, Tomoyoshi Katsumata |
| Bozo Research Center Inc. Kannami Laboratory |
| 1308 Kuwahara Sanbonmatsu, Kannami-cho, Tagata-gun, Shizuoka-ken, 419-01, Japan |
| Tel:0559-78-7851 | Fax:0559-78-7898 | |

 法),ナトリウム,カリウムおよび塩素(イオン選択電極法),カルシウム(OCPC法),無機リン(モリブデン酸法),総蛋白質(Biuret法)を全自動分析装置Monarch(Instrumentation Laboratory)を用いて測定した.また,電気泳動装置CLINISCAN 2[(株)ヘレナ研究所]を用いて蛋白質分画(セルロースアセテート膜による電気泳動法)を測定し,蛋白質分画比率からA/G比を算出した.
法),ナトリウム,カリウムおよび塩素(イオン選択電極法),カルシウム(OCPC法),無機リン(モリブデン酸法),総蛋白質(Biuret法)を全自動分析装置Monarch(Instrumentation Laboratory)を用いて測定した.また,電気泳動装置CLINISCAN 2[(株)ヘレナ研究所]を用いて蛋白質分画(セルロースアセテート膜による電気泳動法)を測定し,蛋白質分画比率からA/G比を算出した.
 法の多重比較検定で対照群と各被験物質群の有意差を検定した.分散が均一でない場合は,Kruskal-Wallisの順位検定を行い,有意であれば対照群と各被験物質群との平均順位の差について,各群の例数が等しいときはDunnett型,各群の例数が異なるときはScheff
法の多重比較検定で対照群と各被験物質群の有意差を検定した.分散が均一でない場合は,Kruskal-Wallisの順位検定を行い,有意であれば対照群と各被験物質群との平均順位の差について,各群の例数が等しいときはDunnett型,各群の例数が異なるときはScheff 型の検定を行った.交尾率,受胎率および出産率についてはχ^2検定を行った.また,病理組織学検査の成績についてはMann-WhitenyのU検定を行った.有意水準は5および1%とした.なお,新生児に関するデータは1腹の平均を1標本とした.
型の検定を行った.交尾率,受胎率および出産率についてはχ^2検定を行った.また,病理組織学検査の成績についてはMann-WhitenyのU検定を行った.有意水準は5および1%とした.なお,新生児に関するデータは1腹の平均を1標本とした.












