2, 2, 4, 4, 6, 8, 8−ヘプタメチルノナンのラットにおける
28日間反復経口投与毒性試験(回復14日間)
Twenty-eight Day Repeat Dose Toxicity Test of 2,2,4,4,6,8,8-Heptamethylnonane in Rats
要約
2, 2, 4, 4, 6, 8, 8−ヘプタメチルノナンの28日間反復経口投与毒性試験(回復14日間)を雌雄のSprague-Dawley系(Crj:CD)ラットを用いて実施した。投与量は、0(溶媒対照群)、100、300および1000 mg/kgとした。雌雄とも溶媒対照群および1000 mg/kg投与群では1群10匹、100および300 mg/kg投与群では1群5匹を使用し、このうち溶媒対照群および1000 mg/kg投与群の各群5匹については、14日間の回復試験を行った。
その結果、いずれの投与群においても死亡例は認められなかった。300 mg/kg以上の投与群では、肝臓の絶対重量あるいは相対重量が増加し、300 mg/kg投与群の雄および1000 mg/kg投与群の雌雄では、小葉中心部肝細胞の腫脹がみられる例があった。また、300 mg/kg以上の投与群の雄において、トリグリセライド濃度の減少がみられたほか、1000 mg/kg投与群の雄において、プロトロンビン時間および活性部分トロンボプラスチン時間の延長が認められた。その他、300 mg/kg以上の投与群の多くの例では、投与第2週以降に投与直後の流涎が認められた。100 mg/kg投与群では、投与第2週以降に投与直後の流涎が少数例に認められたが、その他には被験物質投与に起因すると思われる変化は認められなかった。
1000 mg/kg投与群について行った14日間の回復試験では、投与期間終了時にみられた小葉中心部肝細胞の腫脹は認められなかった。また、雄においては、肝臓の相対重量の増加、プロトロンビン時間および活性部分トロンボプラスチン時間の延長が引き続き認められたが、いずれも投与期間終了時と比較して、その程度は軽減する傾向にあった。
これらの結果から、本試験条件下における2, 2, 4, 4, 6, 8, 8−ヘプタメチルノナンの無影響量は、雌雄とも100 mg/kg以下と推察された。
緒言
「OECD既存化学物質安全性点検に係る毒性調査」事業の一環として、2, 2, 4, 4, 6, 8, 8−ヘプタメチルノナンのラットにおける28日間反復投与毒性試験(回復14日間)を実施した。
方法
1. 被験物質および投与検体の調製
本試験の被験物質として、(社) 日本化学工業協会から提供された2, 2, 4, 4, 6, 8, 8−ヘプタメチルノナン[CAS No.:4390-04-09、ロット番号:AU02(東京化成工業 (株) 製)、無色透明の液体、比重:0.78、純度:99.9%]を用いた。
被験物質を25.6%(v/v)の濃度になるようコーンオイルに混和し、さらに、この25.6%溶液を7.68および2.56%(v/v)となるよう段階希釈して投与検体を調製し、投与時まで室温遮光の条件下で保管した。投与検体の調製は、1週間に1回の頻度で行った。
なお、被験物質の安定性試験の結果、2.56および25.6%(v/v)コーンオイル溶液中の被験物質は、室温遮光の条件下で7日間は安定であることが確認された。また、今回の試験で使用した投与検体について、含量試験を実施した結果、各投与検体中の被験物質の平均含量は、所定濃度の96.8〜98.0%であった。
2. 動物および飼育方法
生後4週で購入した雌雄のSprague-Dawley系ラット(Crj:CD;SPF、日本チャールス・リバー (株)、厚木飼育センター生産)を8日間にわたり予備飼育した後、一般状態に異常の認められなかった雌雄各30匹を試験に供した。投与開始時体重は、雌が115.9〜131.6g、雄が143.1〜160.0gであった。全飼育期間を通じて、動物を金属製金網床ケージ(220 W×270 D×190 H mm、日本ケージ (株) 製)に1匹ずつ収容し、温度24±1℃、湿度55±5%、換気回数約15回/時間、照明12時間(7〜19時点灯)に設定された飼育室内(バリアーシステム)で飼育した。動物には、剖検前約18〜24時間の絶食期間を除き、固型飼料(CE-2、日本クレア (株))を自由に摂取させ、また、飲料水として、全飼育期間を通じて水道水を自由に摂取させて維持管理した。
3. 群および群分け
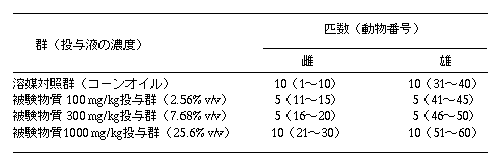
先に秦野研究所で実施した本被験物質2, 2, 4, 4, 6, 8, 8−ヘプタメチルノナンのラットにおける急性経口投与毒性試験1)で雌雄のSprague-Dawley系ラットに本被験物質を2000 mg/kg投与した結果、死亡例はみられず、また、被験物質投与に起因すると思われる一般状態および剖検特に異常所見は認められなかった。従って、本試験における投与量は、化審法ガイドライン「ほ乳類を用いる28日間の反復投与毒性試験」を参考にして、雌雄とも最高投与用量を1000 mg/kgとし、以下公比約3で除して300および100 mg/kgの各投与用量を設定した。なお、1群は、溶媒対照群としてコーンオイル投与群を設けた。
群分けは、投与開始前日の体重に基づいて、体重別層化無作為抽出法により行った。各群の匹数および動物番号を以下に示す。
4. 投与方法
本試験の投与経路は、化審法ガイドライン「ほ乳類を用いる28日間の反復投与毒性試験」に従い経口投与とした。
投与は、1日1回、28日間、ラット用胃管を用いて強制的に行い、投与液量は、雌雄とも5 ml/kgとして、各投与時に最も近い体重値を基準にして算出した。なお、雌雄とも溶媒対照群および最高投与用量群の各5匹については、投与期間終了後、14日間の回復試験期間を設けた。
5. 検査項目
1) 一般状態の観察
投与期間および回復試験期間を通じて、死亡例の有無を調べたほか、全例について、一般状態を毎日1回(投与期間中は投与後)観察した。
2) 体重および摂餌量の測定
全例について、投与開始週では、投与開始直前と投与第4日、第2週以降の投与期間および回復試験期間中は、1週に2回の頻度で体重を測定し、投与期間あるいは回復試験期間終了日および剖検日にも体重の測定を行った。また、全例について、投与開始週では投与開始日に、第2週以降の投与期間および回復試験期間中は、1週に1回の頻度で1日当たりの摂餌量の測定を行った。
3) 尿検査
各群とも動物番号の若い方から5匹を選択し、投与期間終了週(投与第23日〜24日)および回復試験期間終了週(回復第9日〜10日)に、動物を約24時間代謝ケージに収容して採尿し、以下の項目について検査した。なお、pH、潜血、総蛋白、糖、ケトン体、ビリルビン、ウロビリノーゲンおよび沈渣の検査には、代謝ケージに収容して約4時間以内に採取された新鮮尿を用いた。

4) 血液学的検査
投与期間終了時および回復試験期間終了時の剖検に先立ち、全例について、約18ないし24時間絶食させたのち、ペントバルビタール麻酔下で腹部後大静脈よりEDTAを抗凝固剤として採血し、以下の項目について検査した。なお、プロトロンビン時間および活性部分トロンボプラスチン時間の測定には、上記の採血とは別に、クエン酸ナトリウムを抗凝固剤として採血した血液を用いた。

5) 血液生化学的検査
全例について、血液学的検査のための採血に引き続き、ヘパリンを抗凝固剤として採血し、血漿を分離して以下の項目について検査を行った。

6) 病理学的検査
全例について、上記の採血に引き続き、必要に応じて腋窩動脈を切断して放血屠殺したのち、器官および組織の肉眼的観察を行った。また、各動物の脳、肝臓、腎臓、副腎、卵巣または精巣の重量測定を行い、各器官重量を剖検日の体重で除して、それぞれの相対重量を算出した。さらに、各動物より摘出した脳、下垂体、眼球、甲状腺、上皮小体、心臓、肺、肝臓、腎臓、脾臓、副腎、胃、十二指腸、空腸、回腸、結腸、直腸、卵巣または精巣、膀胱、大腿骨骨髄および肉眼的変化のみられた器官については、0.1 Mリン酸緩衝10%ホルマリン(pH 7.2)で固定し、心臓、肝臓、腎臓、脾臓、副腎および剖検時に肉眼的変化の認められた器官について、パラフィン包埋後、ヘマトキシリン・エオジン染色標本を作製した。組織学的検査は、雌雄とも投与期間終了時の溶媒対照群および1000 mg/kg投与群の心臓、肝臓、腎臓、脾臓、副腎について行い、さらに、被験物質投与に起因したと考えられる病理組織学的変化の認められた肝臓については、100、300 mg/kg投与群および回復試験期間終了時の溶媒対照群および1000 mg/kg投与群についても実施した。その他、投与期間終了時の剖検時に肉眼的変化の認められた一部の例の顎下リンパ節、皮膚、胸腺、肺、胃、子宮および精巣について、また、回復試験期間終了時の剖検時に肉眼的変化の認められた一部の例の胃、肺、腎臓および胸腺について組織学的検査を実施した。
6. 統計処理法
体重、摂餌量、半定量検査を除く尿検査および定期解剖例の血液学的検査、血液生化学的検査ならびに器官重量の値について、各群ごとに平均値および標準偏差を求めた。また、試験群の構成が溶媒対照群を含め3群以上ある場合は、Bartlettの方法による分散の一様性の検定(有意水準:5%)を行い、ついで、分散が一様な場合は、一元配置型の分散分析を行い、有意(有意水準:5%)の時はDunnettあるいはScheff 方法で多重比較を行った。一方、分散が一様でない場合はKruskal-Wallisの順位検定を行い、有意(有意水準:5%)ならばDunnett型あるいはScheff
方法で多重比較を行った。一方、分散が一様でない場合はKruskal-Wallisの順位検定を行い、有意(有意水準:5%)ならばDunnett型あるいはScheff 型の方法で多重比較を行った。また、試験群が溶媒対照群を含め2群となる場合には、溶媒対照群と被験物質投与群の各平均値の差の検定は、等分散であればStudentのt検定、不等分散であればAspin-Welch検定を行った。
型の方法で多重比較を行った。また、試験群が溶媒対照群を含め2群となる場合には、溶媒対照群と被験物質投与群の各平均値の差の検定は、等分散であればStudentのt検定、不等分散であればAspin-Welch検定を行った。
結果
1. 一般状態
投与期間および回復試験期間中に、溶媒対照群を含む各群に死亡例は認められなかった。一般状態の変化としては、溶媒対照群を含む一部の例で、投与直後に一過性の流涎がみられ、その多くは投与第2週以降に認められた。特に雌雄とも1000 mg/kg投与群では、投与を重ねるに従って発生例数が増加する傾向があり、まれに、投与時に保定するだけで観察されることもあった。なお、各群の投与期間中に流涎のみられた例数は、溶媒対照群の雌の2例と雄の1例、100 mg/kg投与群の雌の1例と雄の3例、300 mg/kg投与群の雌雄各3例および1000 mg/kg投与群の雌雄全例であった。その他、呼吸音の異常および頚部周囲皮膚の痂皮、潰瘍あるいは脱毛などが散発的にみられたが、いずれも用量依存性は認められなかった。
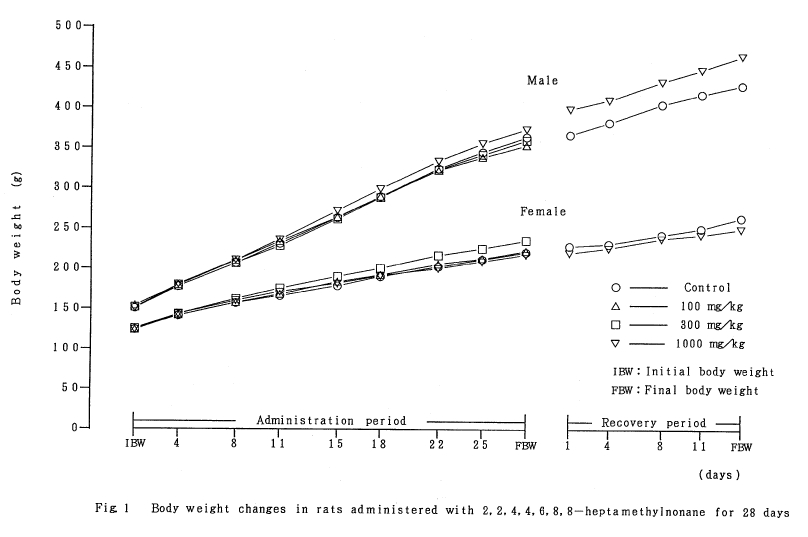
2. 体重(Fig.1)
各群の平均体重は、投与期間および回復試験期間中を通して、溶媒対照群と被験物質投与群の間に有意差は認められなかった。
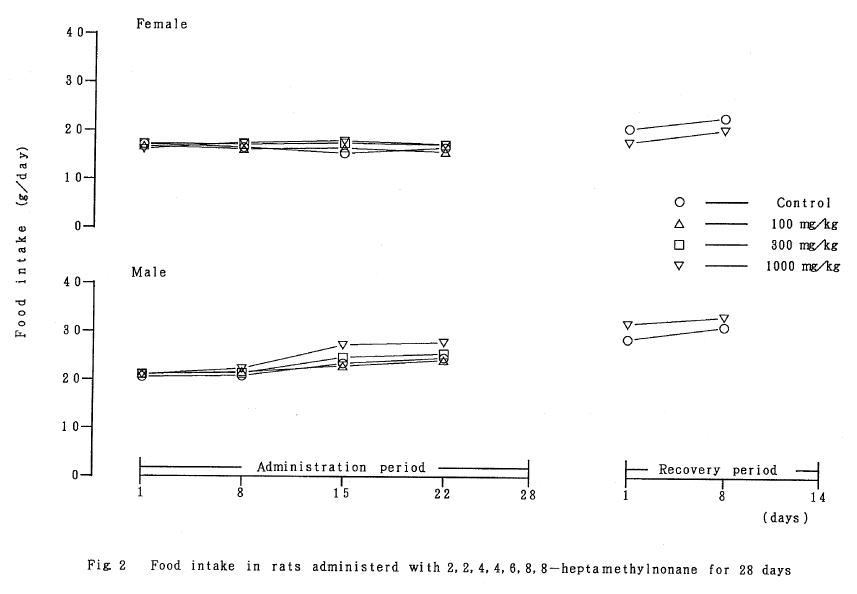
3. 摂餌量(Fig.2)
各群の平均摂餌量は、投与期間および回復試験期間中を通して、溶媒対照群と被験物質投与群の間に有意差は認められなかった。
4. 尿検査
投与期間終了週の検査では、100 mg/kg投与群の雌および300 mg/kg投与群の雄の各1例でビリルビンが陽性であり、また、300 mg/kg投与群の雌および1000 mg/kg投与群の雄の各1例では尿沈渣中に上皮細胞がみられた。その他、一部の例で蛋白、ケトン体、ウロビリノーゲンが陽性であり、尿沈渣中に結晶の認められる例もあったが、いずれも、その出現例数あるいは程度に溶媒対照群と被験物質投与群の間で用量に依存した差はみられなかった。なお、尿量、比重、混濁度、色調、pHには溶媒対照群と被験物質投与群の間に著しい差はなく、いずれの個体においても、糖、潜血、赤血球、円柱および白血球は検出されなかった。
回復試験期間終了週の検査では、1000 mg/kg投与群の雄の1例で糖および潜血反応が陽性であったほか、雄の他の1例で潜血反応が陽性となった。一方、溶媒対照群と1000 mg/kg投与群の間で、尿量、比重、混濁度、色調、pHに著しい差はなく、また、蛋白、ケトン体、ウロビリノーゲン、結晶および上皮細胞の出現頻度あるいは程度にも両群間で差は認められなかった。なお、いずれの個体においても、赤血球、円柱および白血球は観察されなかった。
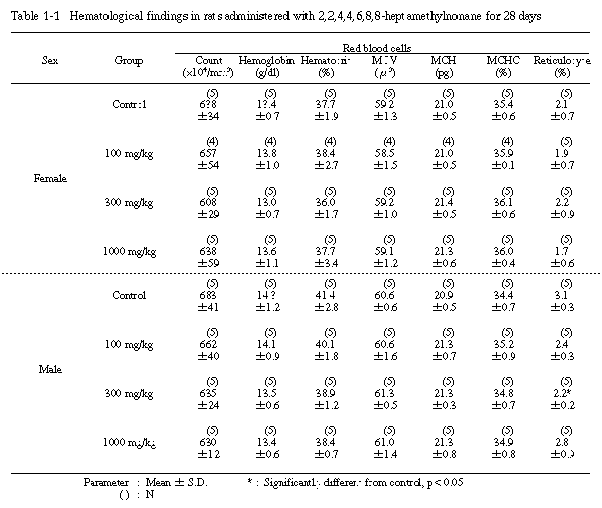
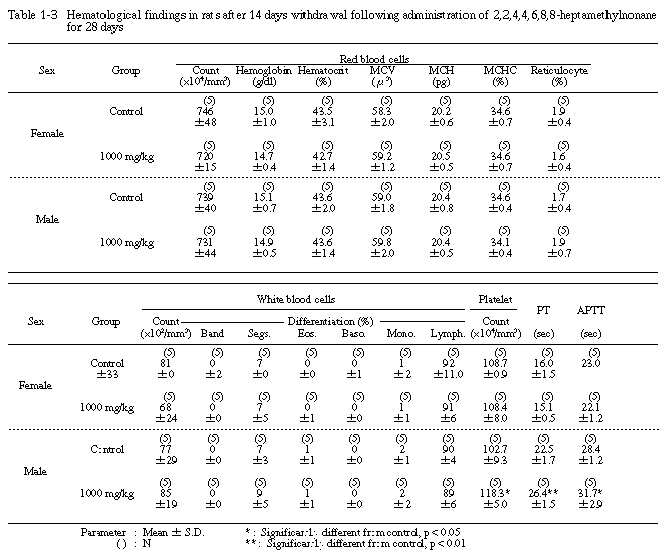
5. 血液学的検査(Table 1-1〜1-3)
投与期間終了時の検査では、300 mg/kg投与群の雄の網状赤血球比率が有意に減少し、1000 mg/kg投与群の雄では、プロトロンビン時間および活性部分トロンボプラスチン時間に有意な延長が認められた。その他の検査項目では、溶媒対照群と被験物質投与群の間に有意な差は認められなかった。
回復試験期間終了時の検査では、1000 mg/kg投与群の雄のプロトロンビン時間および活性部分トロンボプラスチン時間に有意な延長がみられたが、投与期間終了時に比較すると、その程度は軽減される傾向にあった。さらに、血小板数が有意に増加したが、その他の検査項目では、溶媒対照群と1000 mg/kg投与群の間に有意な差は認められなかった。
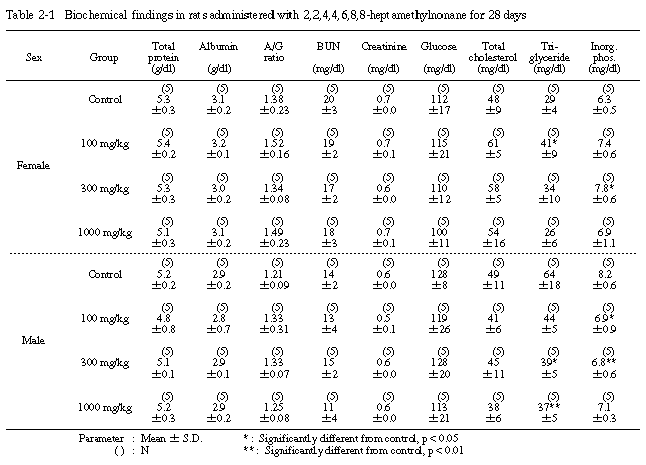
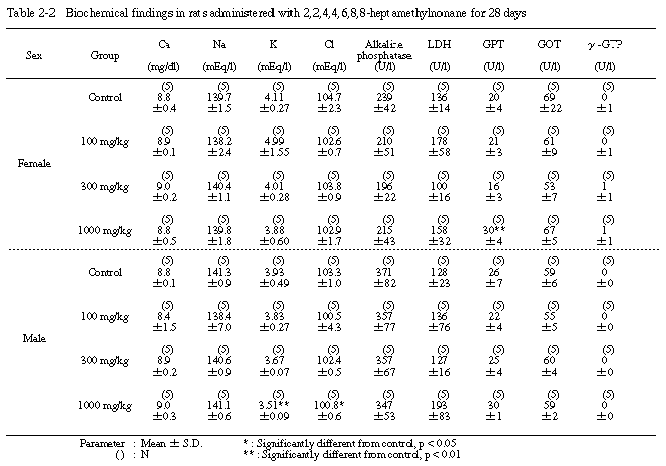
6. 血液生化学的検査(Table 2-1〜2-3)
投与期間終了時の検査では、溶媒対照群と比較すると、トリグリセライド濃度が100 mg/kg投与群の雌で有意に増加し、300および1000 mg/kg投与群の雄では有意に低下した。また、無機リン濃度は、300 mg/kg投与群の雌で有意に増加し、100および300 mg/kg投与群の雄では有意に低下した。さらに、GPT活性は、1000 mg/kg投与群の雌で有意に上昇し、カリウム濃度および塩素濃度は、1000 mg/kg投与群の雄でいずれも有意に低下した。その他の項目では、溶媒対照群と被験物質投与群の間に有意差は認められなかった。
回復試験期間終了時の検査では、1000 mg/kg投与群の雌でA/G比が有意に低下し、1000 mg/kg投与群の雄でLDH活性が有意に上昇したが、その他の項目では、溶媒対照群と1000 mg/kg投与群の間に有意差は認められなかった。


7. 病理学的検査
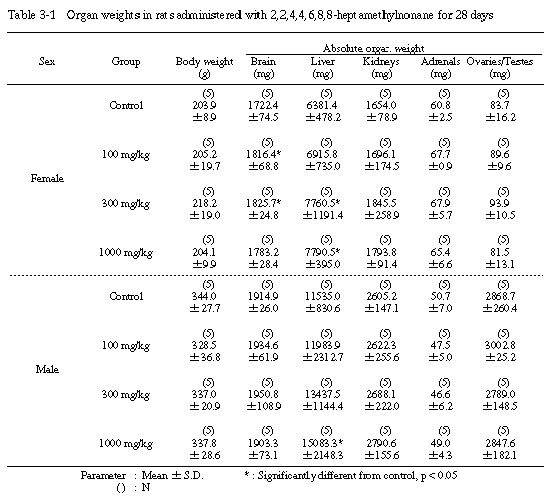
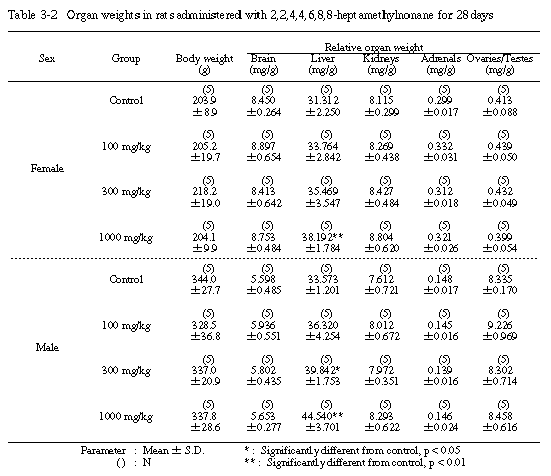
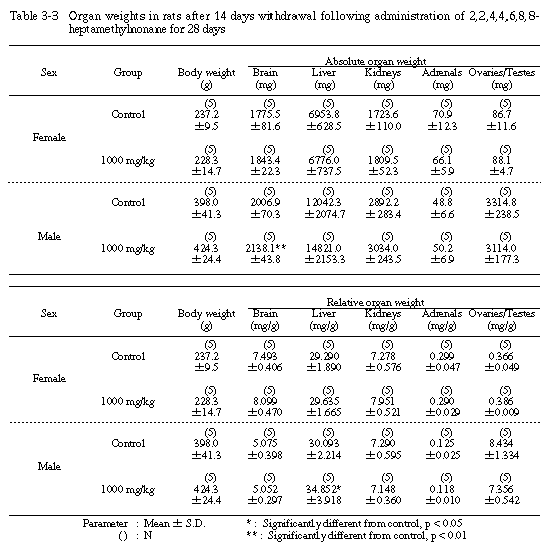
1) 器官重量(Table 3-1〜3-3)
投与期間終了時の剖検例では、100および300 mg/kg投与群の雌で脳の絶対重量が有意に増加した。また、300 mg/kg投与群の雌では、肝臓の絶対重量が、300 mg/kg投与群の雄では、肝臓の相対重量がそれぞれ増加し、1000 mg/kg投与群の雌雄とも、肝臓の絶対重量および相対重量が有意に増加した。その他の器官については、溶媒対照群と被験物質投与群の間に絶対重量および相対重量とも有意差は認められなかった。
回復試験期間終了時の剖検例では、1000 mg/kg投与群の雄で脳の絶対重量と肝臓の相対重量が有意に増加した。その他の器官については、溶媒対照群と1000 mg/kg投与群の間に絶対重量および相対重量とも有意差は認められなかった。
2) 剖検所見
投与期間終了時および回復試験期間終了時剖検例ともに、被験物質投与に起因すると思われる肉眼的変化は認められなかった。
3) 組織学的所見(Table 4-1〜4-3)
投与期間終了時屠殺例では、1000 mg/kg投与群の雌雄各4例と300 mg/kg投与群の雄の1例の肝臓に、小葉中心部肝細胞の腫脹がみられ、1000 mg/kg投与群の雄の1例では、肝細胞の壊死巣が認められた。また、溶媒対照群を含む各群で主に小葉周辺部肝細胞の脂肪変性、小肉芽巣の形成がみられたが、その発生頻度あるいは変化の程度に用量依存性は認められなかった。その他、肝臓の変化として、300 mg/kg投与群の雄の1例に限局性の肝細胞の脂肪変性があり、100 mg/kg投与群の雄の1例に出血が認められた。心臓では、1000 mg/kg投与群の雄の1例に心筋細胞の変性が認められた。腎臓では、溶媒対照群の雌雄および1000 mg/kg投与群の雌の1ないし3例に再生尿細管が、溶媒対照群の雌の1例に腎盂の拡張が、1000 mg/kg投与群の雌の3例に結石の形成が、溶媒対照群および1000 mg/kg投与群の雄の1ないし2例にeosinophilic bodyがそれぞれ認められた。脾臓では、溶媒対照群および1000 mg/kg投与群の雌雄全例に髄外造血がみられ、両群とも雌の全例には褐色色素の沈着が認められたが、両群間に程度の差はみられなかった。副腎では、溶媒対照群および1000 mg/kg投与群とも異常はみられなかった。

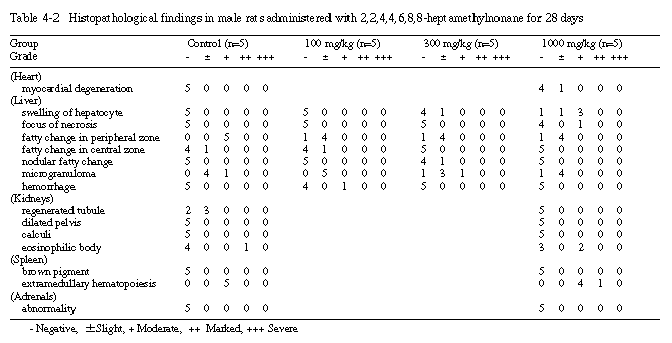
その他、投与期間終了時屠殺例のうち剖検時に肉眼的変化がみられた例について、各器官の主な組織所見を以下に示す。皮膚から皮下にかけては、潰瘍あるいは痂皮形成に伴う細胞浸潤のほか、毛根の変性がみられ、顎下リンパ節では胚中心のリンパ球の増加があり、胸腺では、出血あるいは嚢胞形成が認められた。また、胃では、腺胃における前胃粘膜の異所形成あるいは毛細血管の拡張がみられ、子宮では管腔の拡張があり、精巣では間質の出血が認められた。さらに、肺では、出血あるいは出血および水腫に伴う細胞浸潤、泡沫状細胞の集簇巣、異物周囲の線維化と色素沈着、炎症巣、肺胞領域の血管内の細胞数の増加が認められた。
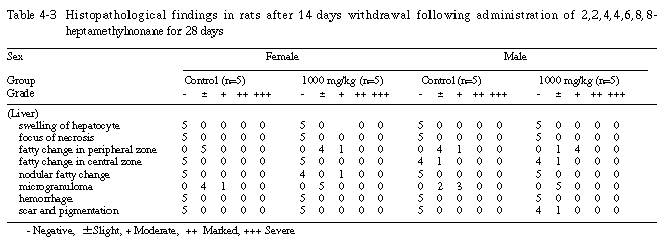
回復試験期間終了時屠殺例では、1000 mg/kg投与群の雄の1例の肝臓に色素沈着を伴う瘢痕の形成がみられたが、投与期間終了時屠殺例にみられた肝細胞の腫脹は認められなかった。
その他、回復試験期間終了時屠殺例のうち剖検時に肉眼的変化がみられた例について組織学的検査を行った結果、腺胃における前胃粘膜の異所形成、肺の出血あるいは出血を伴う炎症巣、腎臓の再生尿細管と管腔内の出血および胸腺における出血が認められた。
考察
2, 2, 4, 4, 6, 8, 8−ヘプタメチルノナンの100、300および1000 mg/kgを、雌雄のSprague-Dawley系(Crj:CD)ラットに1日1回、28日間にわたって反復経口投与し、さらに14日間の回復試験を行った。
その結果、一般状態の変化として、雌雄とも1000 mg/kg投与群の全例と溶媒対照群を含む他の投与群の1ないし3例に、投与直後の一過性の流涎がみられ、被験物質投与群では、まれに投与時に保定するだけで認められる例もあった。溶媒対照群の流涎は、連続的にみられることはなく、28日間の投与期間中、1ないし4回であったのに対し、被験物質投与群の特に1000 mg/kg投与群では、その多くが投与第2週以降に連続的にみられる傾向にあり、投与時に保定するだけで認められる例もあったことから、溶媒対照群の流涎の成因とは異なり、被験物質の何らかの刺激によって成立した条件反射によるものと考えられる。
尿検査では、投与期間終了週において、被験物質投与群で散発的にビリルビンの陽性例が認められたが、その出現頻度および程度に用量依存性はなく、偶発的な所見と判断した。また、回復試験期間終了週の尿検査では、1000 mg/kg投与群の雄の1例が糖と潜血反応が陽性であり、他の1例でも潜血反応が陽性であったが、いずれも投与期間終了週の検査では認められなかったことから、これらの所見も偶発的なものと判断した。
投与期間終了時の血液学的あるいは血液生化学的検査では、1000 mg/kg投与群の雄において、プロトロンビン時間および活性部分トロンボプラスチン時間の延長が認められた。また、300および1000 mg/kg投与群の雄では、トリグリセライド濃度が低下し、1000 mg/kg投与群の雌では、GPT活性が上昇したほか、雄では、カリウムおよび塩素濃度が、いずれも低下した。さらに、回復試験期間終了時の検査でも、1000 mg/kg投与群の雄において、プロトロンビン時間および活性部分トロンボプラスチン時間の延長が認められた。しかし、これらの血液学的あるいは血液生化学的検査所見と関連があると考えられる病理学的変化は認められず、今回の試験においては、これらの変化の発生機序を明らかにすることは出来なかった。その他、投与期間終了時および回復試験期間終了時の検査で、溶媒対照群と被験物質投与群の間に有意差が認められる項目があったが、いずれも生理的変動範囲を著しく越えるものではなく、また、用量相関も認められなかったため、被験物質投与に起因した変化ではないと判断した。
投与期間終了時の病理学的検査では、雌雄とも、300 mg/kg以上の投与群の肝臓の絶対重量あるいは相対重量が増加し、組織学的には、1000 mg/kg投与群の雌雄と300 mg/kg投与群の雄に、小葉中心部肝細胞の腫脹がみられる例があり、1000 mg/kg投与群の雄の1例では、肝細胞の壊死巣も認められた。また、回復試験期間終了時の病理学的検査では、1000 mg/kg投与群の雄において、肝臓の相対重量が増加し、組織所見では、1000 mg/kg投与群の雄の1例に色素沈着を伴う瘢痕の形成がみられたが、投与期間終了時屠殺例にみられた肝細胞の腫脹は認められなかった。これらの肝臓の変化は、溶媒対照群および100 mg/kg投与群で認められなかったことから、被験物質投与に起因したものと考えられるが、今回の試験では、その成因を明らかにすることは出来なかった。なお、その他の器官の変化については、いずれも用量依存性はなく、被験物質投与に起因した変化ではないと判断した。
以上のことから、本試験条件下における2, 2, 4, 4, 6, 8, 8−ヘプタメチルノナンの無影響量は、雌雄とも100 mg/kg以下と考えられる。
文献
| 連絡先: |
| 試験責任者 | 今井清 |
| (財)食品薬品安全センター秦野研究所 |
| 〒257 神奈川県秦野市落合 729-5 |
| Tel 0463-82-4751 | Fax 0463-82-9627 | |
| Correspondence: |
| Imai, Kiyoshi |
| Hatano Research Institute, Food and Drug Safety Center |
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257, Japan |
| Tel 81-463-82-4751 | Fax 81-463-82-9627 | |





 方法で多重比較を行った。一方、分散が一様でない場合はKruskal-Wallisの順位検定を行い、有意(有意水準:5%)ならばDunnett型あるいはScheff
方法で多重比較を行った。一方、分散が一様でない場合はKruskal-Wallisの順位検定を行い、有意(有意水準:5%)ならばDunnett型あるいはScheff 型の方法で多重比較を行った。また、試験群が溶媒対照群を含め2群となる場合には、溶媒対照群と被験物質投与群の各平均値の差の検定は、等分散であればStudentのt検定、不等分散であればAspin-Welch検定を行った。
型の方法で多重比較を行った。また、試験群が溶媒対照群を含め2群となる場合には、溶媒対照群と被験物質投与群の各平均値の差の検定は、等分散であればStudentのt検定、不等分散であればAspin-Welch検定を行った。













