4-(1-メチルエテニル)フェノールの
チャイニーズ・ハムスター培養細胞を用いる染色体異常試験
In Vitro Chromosomal Aberration Test
of 4-(1-Methylethenyl)phenol in Cultured Chinese Hamster Cells
要約
4-(1-メチルエテニル)フェノールの培養細胞に及ぼす細胞遺伝学的影響について,チャイニーズ・ハムスター培養細胞(CHL/IU)を用いて染色体異常試験を実施した.
細胞増殖抑制試験結果をもとに,短時間処理法-S9処理ならびに+S9処理で500 μg/mLを最高処理濃度とした38.9~500 μg/mLの濃度範囲で6用量を設定した.S9 mix存在下および非存在下で6時間処理(18時間の回復時間)後,標本を作製し,検鏡することにより染色体異常誘発性を検討した.-S9処理ならびに+S9処理とも64.8,108,180 μg/mLの3用量(公比5/3)について顕微鏡観察を実施した.
その結果,S9 mix非存在下および存在下のいずれにおいても用量相関性を伴い,統計学的に有意な染色体異常の誘発が認められた.
以上の結果より,本試験条件下では4-(1-メチルエテニル)フェノールは,染色体異常を誘発する(陽性)と結論した.
方法
1. 試験細胞株
哺乳類培養細胞を用いる染色体異常試験に広く使用されていることから,試験細胞株としてチャイニーズ・ハムスターの肺由来の線維芽細胞株(CHL/IU)を選択した.昭和59年11月15日に国立衛生試験所(現:国立医薬品食品衛生研究所)から分与を受け,ジメチルスルホキシド(DMSO:MERCK KGaA)を10 vol%添加した後,液体窒素中に保存した.試験に際しては凍結細胞を融解し3~5日ごとに継代したものを使用した.なお,細胞増殖抑制試験では継代数34,染色体異常試験では同37の細胞を用いた.
2. 培養液の調製
Eagle-MEM液体培地(旭テクノグラス(株))に,メンブランフィルター(0.45 μm:Featuring Corning and Costar Products)を用いて加圧濾過除菌した非働化(56 ℃,30分)済み仔牛血清(GIBCO Life Technologies, Inc)を最終濃度で10 vol%になるよう加えた後,試験に使用した.調製後の培養液は冷暗所(4 ℃)に保存した.
3. 培養条件
CO2インキュベーター(Formaおよび三洋電機メディカシステム(株))を用い,CO2濃度5 %,37 ℃の条件で細胞を培養した.
4. S9 mix
製造後6ヵ月以内のキッコーマン(株)製S9 mixを試験に使用した.S9 mix中のS9は誘導剤としてフェノバルビタールおよび5,6-ベンゾフラボンを投与したSprague-Dawley系雄ラットの肝臓から調製した.また,S9 mixの組成は松岡らの方法1)に従った.S9 mixの組成を以下に示す.
-
| 成分 | S9 mix 1 mL中の量 |
| S9 | 0.3 mL |
| MgCl2 | 5 μmol |
| KCl | 33 μmol |
| G-6-P | 5 μmol |
| NADH | 4 μmol |
| HEPES緩衝液(pH 7.2) | 4 μmol |
| 蒸留水 | 残量 |
5. 被験物質
4-(1-メチルエテニル)フェノール(ロット号:001109)は純度99 %以上の白~淡黄色粉体である.本剤は水に難溶,アセトンおよびエタノールに可溶,DMSOに易溶であり,DMSO溶液中で安定である.三井化学(株)(東京)から提供された被験物質を使用した.被験物質は,使用時まで冷凍庫で保管した.試験終了後,被験物質提供元において残余被験物質を分析した結果,安定性に問題はなかった.
6. 被験物質液の調製
試験の都度,モレキュラーシーブを用いて脱水処理を行ったDMSO(MERCK KGaA)で被験物質を溶解して調製原液とした.調製原液を使用溶媒を用いて順次所定濃度に希釈した後,速やかに処理を行った.
7. 細胞増殖抑制試験(予備試験)
12ウエルの細胞培養用マルチプレートに細胞を播種し,培養3日後に被験物質液を処理した.S9 mix非存在下(-S9 mix)あるいは存在下(+S9 mix)で6時間処理した後,新鮮な培養液に交換してさらに18時間培養を続けた.
細胞を10 vol%中性緩衝ホルマリン液(和光純薬工業(株))で固定した後,0.1 w/v%クリスタル・バイオレット(関東化学(株))水溶液で10分間染色した.色素溶出液(30 vol%エタノール,1 vol%酢酸水溶液)を適量加え,5分間程度放置して色素を溶出した後,580 nmでの吸光度を測定した.各用量群について溶媒対照群での吸光度に対する比,すなわち細胞生存率を算出し,さらにプロビット法を用いて50 %細胞増殖抑制濃度を算出した.
その結果,細胞増殖を50 %抑制する濃度は,短時間処理法-S9処理で97.8 μg/mLおよび+S9処理で107 μg/mLと算出された(Fig. 1).
なお,被験物質処理開始時,短時間処理法-S9処理および+S9処理の939 μg/mL以上の用量において白色粉末状の析出物が観察されたが,pHの変動はいずれの処理においても観察されなかった.また被験物質処理終了時,短時間処理法-S9処理および+S9処理の1342 μg/mLの用量において白色粉末状の析出物が観察されたが,pHの変動はいずれの処理においても観察されなかった.
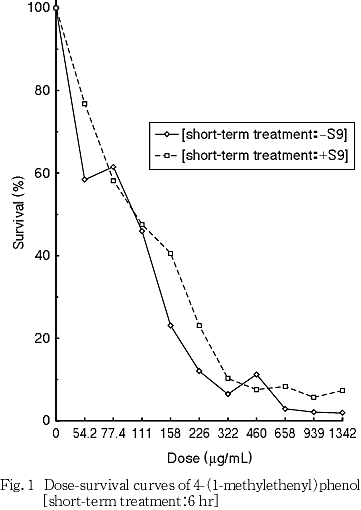
8. 試験用量および試験群の設定
細胞増殖抑制試験結果をもとに,染色体異常試験では短時間処理法-S9処理ならびに+S9処理とも500 μg/mLを最高処理濃度とし,以下公比5/3で減じたそれぞれ計6用量ならびに溶媒対照群を設定した.
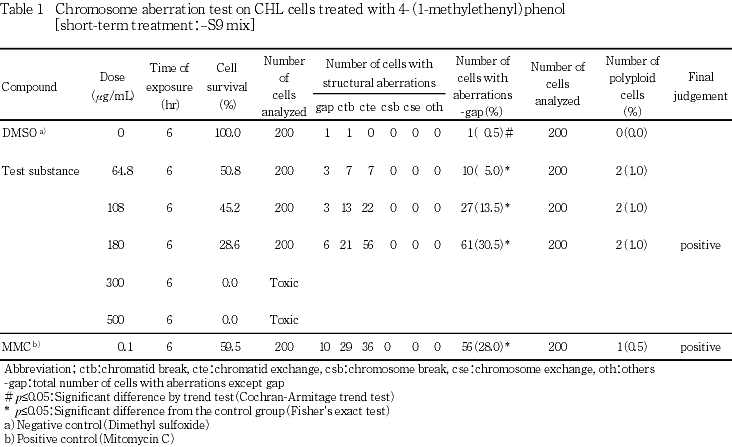
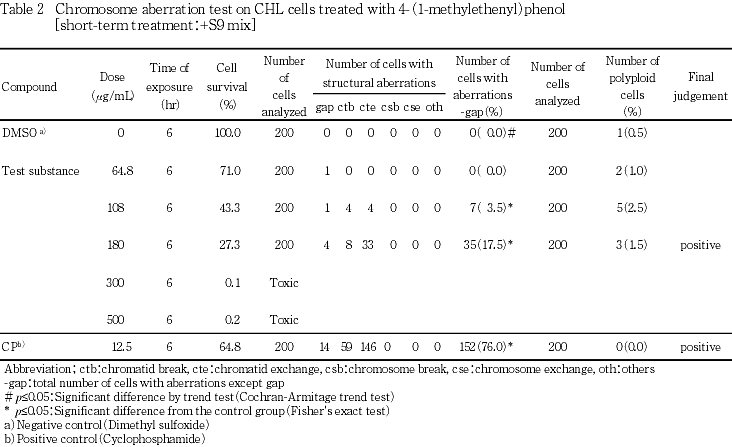
なお,陽性対照として,-S9処理でマイトマイシンC(MMC:協和醗酵工業(株))を0.1 μg/mL,+S9処理でシクロホスファミド(CP:塩野義製薬(株))を12.5 μg/mLの用量で試験した.
9. 染色体標本の作製
直径60 mmのプレートを用い,細胞増殖抑制試験と同様に被験物質等の処理を行った.培養終了2時間前に,最終濃度で0.2 μg/mLとなるようコルセミド(GIBCO Life Technologies, Inc)を添加した.トリプシン処理で細胞を剥離させ,遠心分離により細胞を回収した.75 mmol/L塩化カリウム水溶液で低張処理を行った後,固定液(メタノール3容:酢酸1容)で細胞を固定した.空気乾燥法で染色体標本を作製した後,1.2 vol%ギムザ染色液で12分間染色した.
10. 染色体の観察
各プレートあたり100個,すなわち用量当たり200個の分裂中期像を顕微鏡下で観察し,染色体の形態的変化としてギャップ(gap),染色分体切断(ctb),染色体切断(csb),染色分体交換(cte),染色体交換(cse)およびその他(oth)の構造異常に分類した.同時に,倍数性細胞の出現率を記録した.染色体の分析は日本環境変異原学会・哺乳動物試験分科会による分類法2)に従って実施した.
すべての標本をコード化した後,染色体分析を実施した.
11. 結果の解析
ギャップのみ保有する細胞を含めない場合(-gap)について染色体構造異常の出現頻度を表示した.
各試験群の構造異常を有する細胞あるいは倍数性細胞の出現頻度を,Fisherの直接確率計算法(有意水準0.05)を用いて検定した.また用量依存性については,Cochran Armitageの傾向検定(有意水準0.05)を用いて検定した.溶媒対照群と比較し被験物質処理群において有意差が認められ,かつ,再現性あるいは用量に依存性が認められた場合に陽性と判定した.
また,分裂中期像の20 %にいずれかの異常を誘発するのに必要な被験物質濃度であるD20値を最小二乗法により算出し,一定濃度(mg/mL)あたりの交換型異常(cte)出現数を示す比較値であるTR値を,染色分体交換の出現頻度(%)を被験物質濃度(mg/mL換算)で割ることにより算出した.
結果および考察
短時間処理法での試験結果をTable 1~2に示した.4-(1-メチルエテニル)フェノール処理群の場合,染色体構造異常出現頻度は,S9 mix非存在下では64.8 μg/mLで5.0 %(p≦0.05),108 μg/mLで13.5 %(p≦0.05),180 μg/mLで30.5 %(p≦0.05)を示し,S9 mix存在下では64.8 μg/mLで0.0 %,108 μg/mLで3.5 %(p≦0.05),180 μg/mLで17.5 %(p≦0.05)を示した.倍数性細胞の誘発傾向については,S9 mix非存在下ならびに存在下のいずれの用量においても観察されなかった.また,試験用量に依存した細胞生存率の減少が観察され,S9 mix非存在下では染色体異常評価群中の高用量である180 μg/mLでの細胞生存率が28.6 %であった.高用量群の300および500 μg/mLでの生存率はそれぞれ0.0および0.0 %であった.S9 mix存在下では染色体異常評価群中の高用量である180 μg/mLでの細胞生存率は27.3 %であり,高用量群の300および500 μg/mLでの生存率はそれぞれ0.1および0.2 %であった.一方,S9 mix非存在下における陽性対照物質MMCで処理した細胞,およびS9 mix存在下における陽性対照物質CPで処理した細胞では染色体構造異常の顕著な誘発が認められた.
変異原性の強さに関する相対的比較値であるD20値の最小値は0.124(mg/mL),TR値の最大値は156(mg当たり)と算出された.なお,被験物質処理開始および終了時,pHの変動,析出等の特筆すべき変化は,いずれの処理法ならびに試験用量においても観察されなかった.
以上の試験結果から,本試験条件下において4-(1-メチルエテニル)フェノールのチャイニーズ・ハムスター培養細胞に対する染色体異常誘発性に関し,陽性と判定した.
なお,本被験物質[4-(1-メチルエテニル)フェノール]の変異原性に関する文献報告はなかった.類縁体である2,4,6-trichlorophenolはV79培養細胞を用いたhprt突然変異試験で陽性との報告があった3).しかしながら,類縁体である4-alkylphenolsの変異原性に関する報告はなかった.
文献
| 1) | A. Matsuoka, M. Hayashi and M. Ishidate Jr., Mutat. Res., 66, 277(1979). |
| 2) | 日本環境変異原学会・哺乳動物試験分科会編,"化学物質による染色体異常アトラス,"朝倉書店,東京,1988, pp. 31-35. |
| 3) | K. Jansson, V. Jansson, Mutat. Res., 280(3), 175 (1992). |
| 連絡先 |
| 試験責任者: | 益森勝志 |
| 試験担当者: | 尾伸也,梶原玲子,嶋田佐和子,水橋福太郎,鈴木雅也 |
| (財)食品農医薬品安全性評価センター |
| 〒437-1213 静岡県磐田郡福田町塩新田582-2 |
| Tel 0538-58-1266 | Fax 0538-58-1393 | |
| Correspondence |
| Authors: | Shoji Masumori(Study director)
Shin-ya Ozaki, Reiko Kajihara, Sawako Shimada, Fukutaro Mizuhashi, Masaya Suzuki |
| Biosafety Research Center, Foods, Drugs and Pesticides (An-pyo Center) |
| 582-2 Shioshinden, Fukude-cho, Iwata-gun, Shizuoka, 437-1213, Japan |
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | |



