一般状態では,300および400 mg/kg投与群の雌雄ともに外尿道口周囲被毛の汚れがみられ,雌で流涎も認められた.
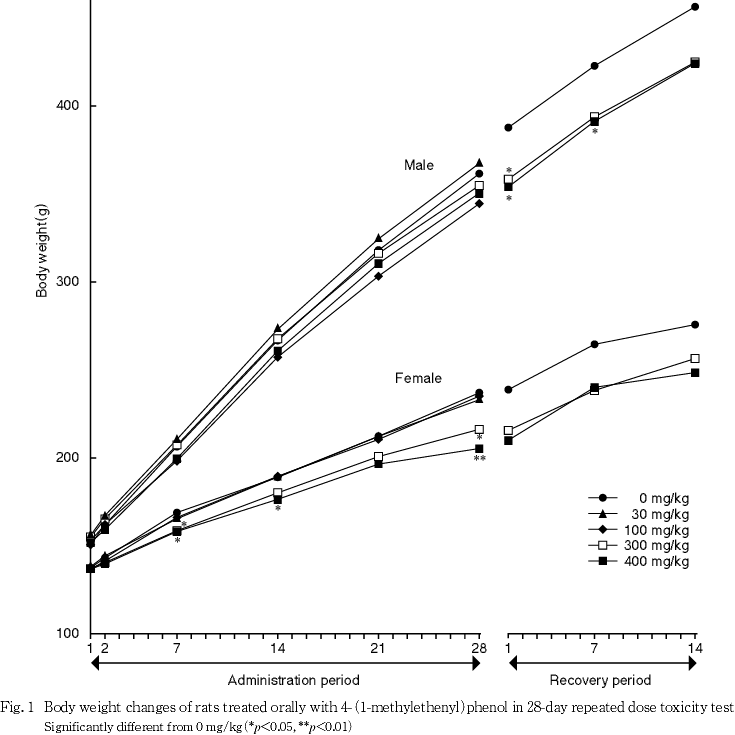
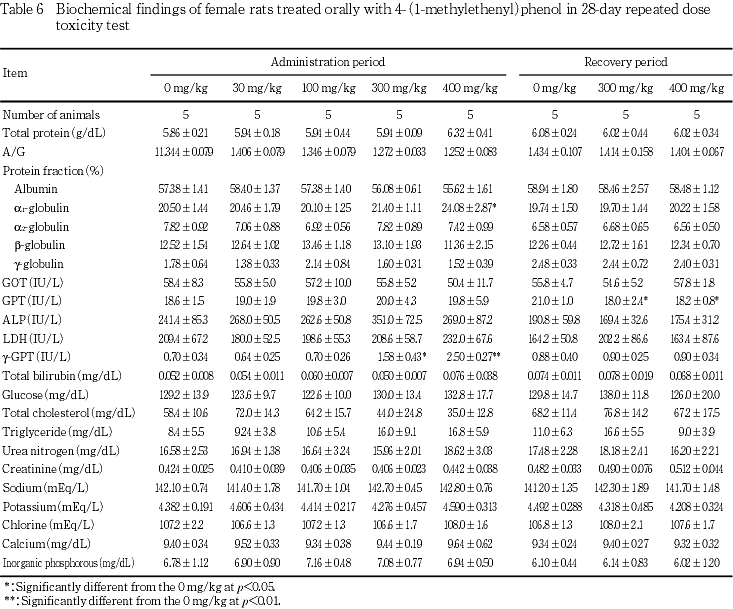
体重および摂餌量では,300および400 mg/kg投与群の雌で投与7日以降に体重増加抑制がみられ,摂餌量の低値も認められた.
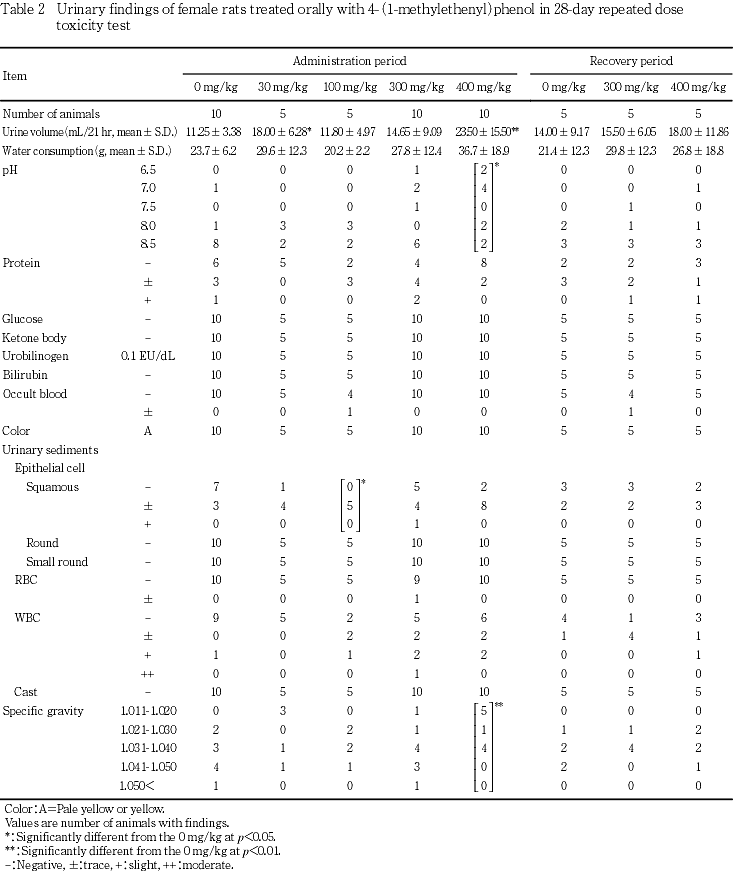
尿検査では,300 mg/kg投与群の雄および400 mg/kg投与群の雌雄で尿量の高値,400 mg/kg投与群の雌雄で尿pHの低下,雄で飲水量の高値,雌で尿比重の低値が認められた.
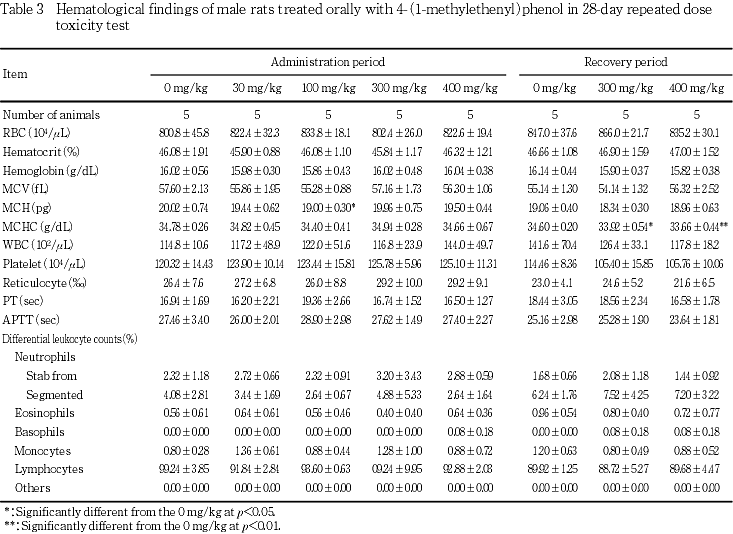
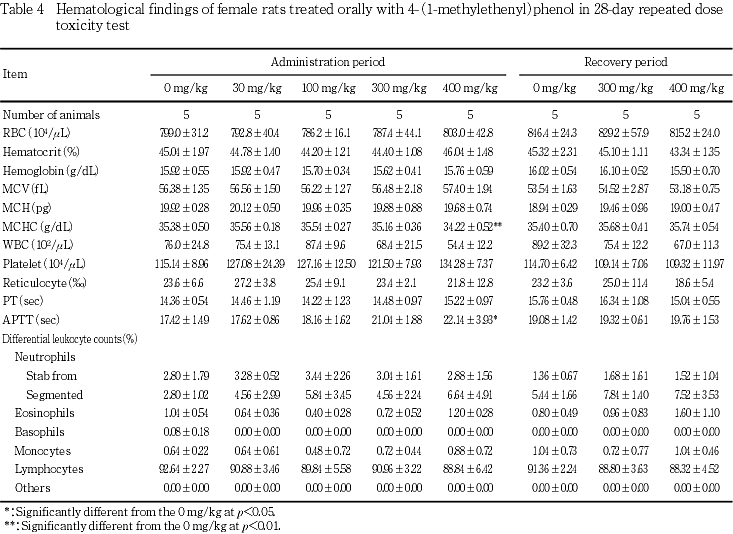
血液学検査では,400 mg/kg投与群の雌で平均赤血球ヘモグロビン濃度の低値および活性化部分トロンボプラスチン時間の延長が認められた.また,雄の300および400 mg/kg投与群で回復終了時に平均赤血球ヘモグロビン濃度の低値が認められた.
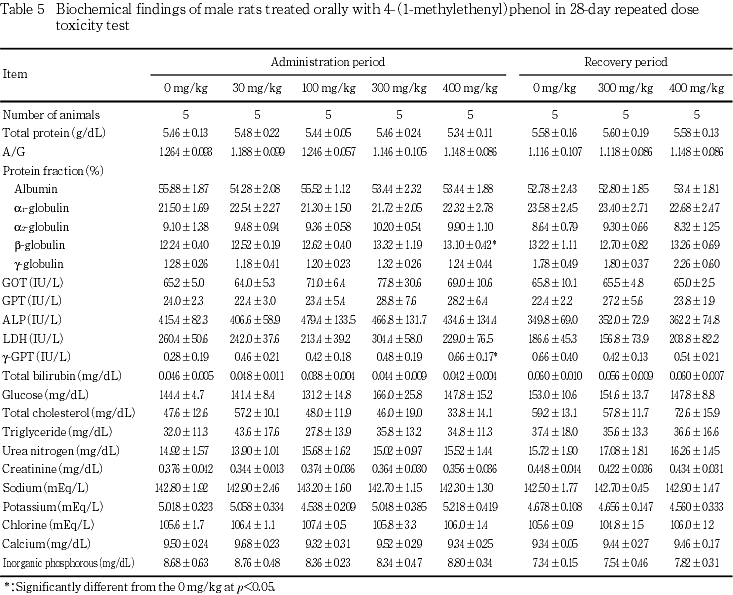
血液生化学検査では,300 mg/kgの投与群の雌および400 mg/kg投与群の雌雄でγ-GTPの高値が認められた.また,400 mg/kg投与群の雄でβ-グロブリン比の高値,雌でα1-グロブリン比の高値が認められた.
剖検所見では,400 mg/kg投与群の雌雄で前胃粘膜の肥厚,さらに雌1例で盲腸の拡張および水様内容物,脾臓および胸腺の萎縮が認められた.
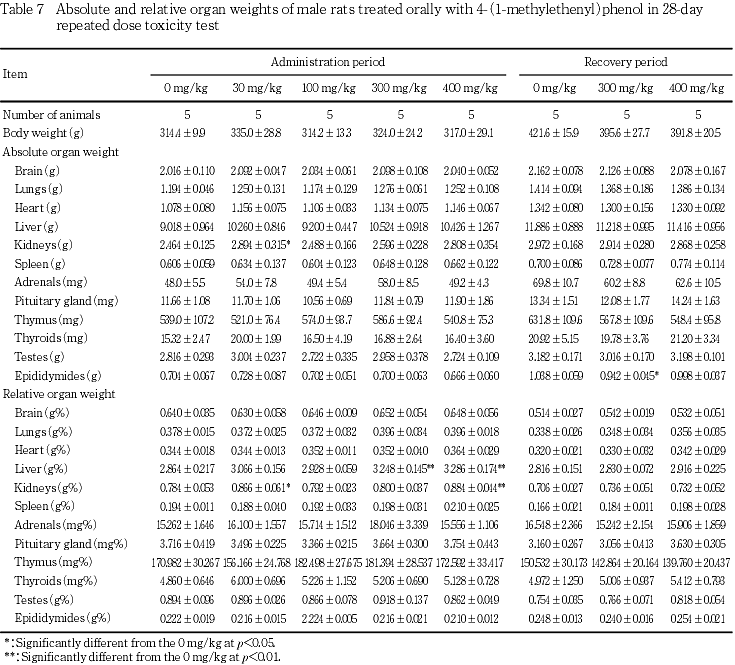
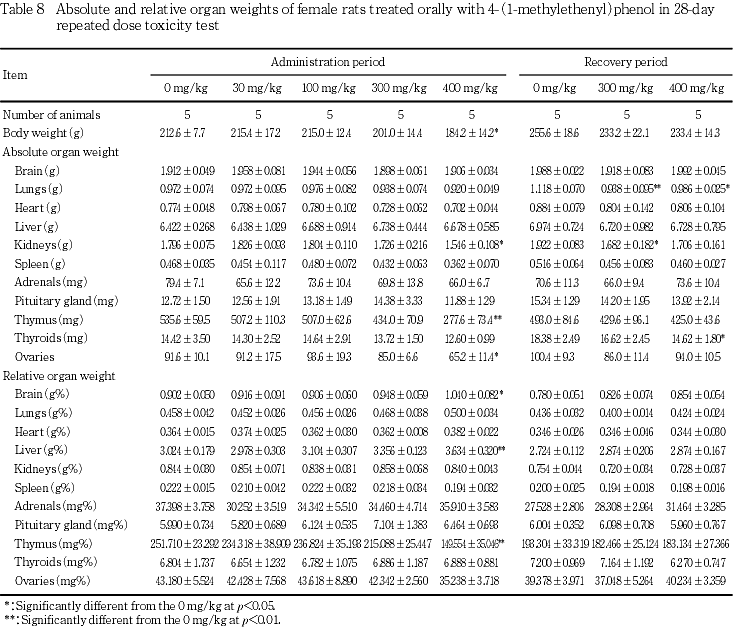
器官重量では,100 mg/kg投与群の雌,300 mg/kg以上の投与群の雌雄ともに肝臓の絶対重量の高値または高値傾向,300 mg/kg投与群の雄および400 mg/kg投与群の雌雄ともに肝臓の相対重量の高値,400 mg/kg投与群の雄で腎臓の絶対および相対重量の高値または高値傾向,さらに400 mg/kg投与群の雌で胸腺の絶対および相対重量の低値も認められた.
病理組織学検査では,100 mg/kg以上の投与群の雌で前胃の扁平上皮過形成が,100 mg/kg以上の投与群の雌雄で胃の境界縁における扁平上皮過形成が認められた.一方,400 mg/kg投与群の雄にのみ腎臓の近位尿細管上皮に硝子滴および好酸性小体が認められ,400 mg/kg投与群の雌では胸腺の萎縮が認められた.
投与期間中にみられたいずれの変化も,14日間の休薬により軽減または回復が認められ,可逆的な変化と考えられた.
以上により,本試験条件下における4-(1-メチルエテニル)フェノールの無影響量(NOEL)は,雌雄ともに30 mg/kg/dayと考えられた.
0.5 %カルメロースナトリウム水溶液を用いて被験物質を懸濁した.調製液は調製後速やかに遮光気密容器に入れ,冷暗所に保存し調製後1週間以内に投与に用いた.
投与に先立って1および120 mg/mL調製液中の4-(1-メチルエテニル)フェノールの均一性および安定性ならびに投与に用いる各濃度の調製液中の4-(1-メチルエテニル)フェノール濃度を分析して確認した.
動物は温度22〜23 ℃,湿度45〜59 %,換気回数10〜15回/時間,照明時間8〜20時でブラケット式金属製金網床ケージに,群分け前は2あるいは3匹,群分け後は1匹収容した.飼料はg線照射固型飼料CRF-1(オリエンタル酵母工業(株))を金属製給餌器により,飲料水は札幌市水道水を自動給水装置により,それぞれ自由摂取させた.
1日1回,28日間,9:00から11:30の間に胃ゾンデを用いて強制的に胃内に10 mL/kgの投与容量で経口投与した.なお,投与は調製終了後1時間以内に行った.
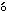 blewski-La Due法)およびグルコース(ヘキソキナーゼ法)を測定し,分離剤入り試験管に血液を採取し,3000回転/分で10分間の遠心分離により得られた血清を用いて,GPT(IFCC法),アルカリホスファターゼ(GSCC法),γ-GTP(L-γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),総コレステロール(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff
blewski-La Due法)およびグルコース(ヘキソキナーゼ法)を測定し,分離剤入り試験管に血液を採取し,3000回転/分で10分間の遠心分離により得られた血清を用いて,GPT(IFCC法),アルカリホスファターゼ(GSCC法),γ-GTP(L-γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),総コレステロール(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff 法),カルシウム(OCPC法),無機リン(Fiske-Subba Row法),総蛋白(ビウレット法)(以上,自動分析装置7150形,日立製作所),ナトリウムおよびカリウム(炎光光度法)(以上,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),蛋白分画およびA/G比(セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
法),カルシウム(OCPC法),無機リン(Fiske-Subba Row法),総蛋白(ビウレット法)(以上,自動分析装置7150形,日立製作所),ナトリウムおよびカリウム(炎光光度法)(以上,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),蛋白分画およびA/G比(セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
体重,体重増加量および増加率,摂餌量,尿検査の定量的項目(尿比重を除く),血液学検査(白血球百分比を除く),血液生化学検査,器官の絶対および相対重量の成績についてBartlettの検定法によって等分散性を解析し,等分散の場合は一元配置分散分析法,不等分散の場合はKruskal-Wallisの検定法で解析した.一元配置分散分析の結果,有意差がみられた場合は,Dunnettの検定法を用いて,Kruskal-Wallis法の解析の結果,有意差がみられた場合は,Mann-WhitneyのU-検定法を用いてそれぞれ対照群との比較を行った.
尿検査の定性的項目,尿比重および白血球百分比の成績については,群毎の傾向をKruskal-Wallisの検定法で解析し,有意差がみられた場合はMann-WhitneyのU-検定法を用いて対照との比較を行った.なお,白血球百分比については毎の平均値および標準偏差も算出した.対照群との比較検定については,危険率5 %未満を統計学的に有意とした.
回復期間中では,雄の300 mg/kg投与群で回復1日に有意な低値がみられたが,回復7日以降には有意差は認められなかった.同様に,雄の400 mg/kg投与群で回復1および7日に有意な低値がみられたが,回復14日には有意差は認められなかった.一方,雌の各投与群ともに有意差はみられず,回復期間中の体重増加量および体重増加率にも各投与群の雌雄ともに有意差は認められな かった.

回復期間中には各投与群の雌雄ともに有意差は認められなかった.
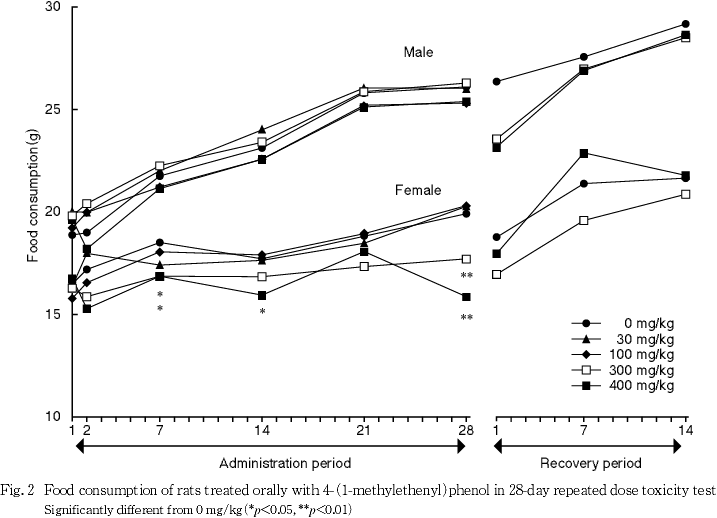
回復期間中には各投与群の雌雄ともに有意な変化は認められなかった.
回復期間終了時の300および400 mg/kg投与群の雄で平均赤血球ヘモグロビン濃度の有意な低値が認められた.
回復期間終了時の雌で各投与群にGPTの有意な低値が認められた.
回復期間終了時の各投与群の雌雄ともに異常所見は認められなかった.
回復期間終了時に300 mg/kg投与群の雄で精巣上体の絶対重量に有意な低値,雌で腎臓および肺の絶対重量に低値,400 mg/kg投与群の雌で肺および甲状腺の絶対重量に有意な低値がみられたが,投与終了時にはみられていない変化であり,被験物質投与との関連はないと考えられた.
回復期間終了時の300 mg/kg投与群の雌1例に軽度な前胃の扁平上皮過形成が認められた.300 mg/kg投与群の雄1例の肝臓で軽度な限局性壊死が認められた.400 mg/kg投与群の雄2例,雌4例で軽度な前胃の扁平上皮過形成が認められた.400 mg/kg投与群の雄の腎臓で軽度な近位尿細管上皮の硝子滴が1例,軽度な尿細管上皮の再生が2例,軽度な硝子円柱が1例,さらに軽度なリンパ球浸潤が1例に認められた.
体重および摂餌量では,300および400 mg/kg投与群の雌で投与7日以降に体重増加抑制がみられ,摂餌量にも低値が認められた.この体重増加抑制は投与期間中の体重増加量および増加率の有意差を伴うものであり,被験物質投与の影響と考えられた.
尿検査では,300 mg/kg投与群の雄および400 mg/kg投与群の雌雄に尿量の高値がみられ,400 mg/kg投与群では雌雄に尿pHの低下,雄で飲水量の高値,雌で尿比重の低値も認められた.これらの変化には相互に関連性がみられ,被験物質投与の影響と考えられた.
血液学検査では,400 mg/kg投与群の雌で平均赤血球ヘモグロビン濃度の低値および活性化部分トロンボプラスチン時間の延長がみられ,被験物質投与の影響と考えられた.一方,雄の300および400 mg/kg投与群で回復終了時に平均赤血球ヘモグロビン濃度の低値がみられ,雌と同様に被験物質投与の影響が遅れて発現したものと考えられた.
血液生化学検査では,300 mg/kgの投与群の雌および400 mg/kg投与群の雌雄でγ-GTPに高値,400 mg/kg投与群の雄でβ-グロブリン比の高値,雌でα1-グロブリン比の高値が認められた.これらの変化は被験物質投与の影響と考えられた.
剖検では,400 mg/kg投与群の雌雄で前胃粘膜の肥厚がみられ,本被験物質が粘膜に対する刺激性を有する1)ことから,被験物質の刺激性に起因するものと考えられた.また雌1例に盲腸の拡張と水様内容物および脾臓と胸腺の萎縮が認められた.この変化は一般状態における外尿道口周囲被毛の汚れや体重増加抑制等による全身状態の悪化に関連したものと考えられた.
器官重量では,300 mg/kg投与群の雄および400 mg/kg投与群の雌雄ともに肝臓の相対重量に高値,400 mg/kg投与群の雄では腎臓の絶対および相対重量に高値または高値傾向がみられ,いずれの変化も被験物質投与との関連が考えられた.また,400 mg/kg投与群の雌では胸腺の絶対および相対重量の有意な低値がみられ,剖検時に1例で胸腺の萎縮がみられていることからこの変化にも被験物質投与との関連が考えられた.
病理組織学検査では,剖検時には400 mg/kg投与群にのみ認められた前胃の肥厚に関連して,100 mg/kg以上の投与群の雌で前胃の扁平上皮過形成が,同様に100 mg/kg以上の投与群の雌雄で胃の境界縁における扁平上皮過形成が認められた.
400 mg/kg投与群の雄でみられた腎臓重量の高値に関連して,400 mg/kg投与群の雄にのみ腎臓の近位尿細管上皮に硝子滴および好酸性小体が認められた.300 mg/kg投与群の雌および400 mg/kg投与群の雌雄にみられた肝臓の相対重量の高値に関連する変化は認められず,その原因については明らかでなかった.
血液学検査における平均赤血球ヘモグロビン濃度の低値を除くいずれの変化も,休薬により回復あるいは回復傾向がみられ可逆性の変化と考えられた.
以上のことより,本試験条件下における4-(1-メチルエテニル)フェノールの無影響量(NOEL)は,雌雄ともに30 mg/kg/dayと考えられた.
| 1) | 三井化学(株)社内資料. |
| 連絡先 | |||
| 試験責任者: | 須永昌男 | ||
| 試験担当者: | 木口雅夫,咲間正志,笠原みゆき,平田真理子,古川正敏 | ||
| (株)化合物安全性研究所 | |||
| 〒004-0839 札幌市清田区真栄363-24 | |||
| Tel 011-885-5031 | Fax 011-885-5313 | ||
| Correspondence | ||||
| Authors: | Masao Sunaga(Study director) Masao Kiguchi, Masashi Sakuma, Miyuki Kasahara, Mariko Hirata, Masatoshi Furukawa | |||
| Safety Research Institute for Chemical Compounds Co., Ltd. | ||||
| 363-24 Shin-ei, Kiyota-ku, Sapporo-shi, Hokkaido, 004-0839, Japan | ||||
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | |||