雄の血液学検査では,100 mg/kg群で赤血球数およびヘマトクリット値の減少および網状赤血球数の増加ならびにプロトロンビン時間および活性化部分トロンボプラスチン時間の短縮が認められた.
雄の骨髄検査では,100 mg/kg群で有核細胞数およびM/E比の減少がみられ,細胞分画では,好中球系細胞,好酸球およびリンパ球の減少ならびに好塩基性赤芽球,多染性および正染性赤芽球の減少が認められた.
雄の血液生化学検査では,20 mg/kg以上の群でアルカリ性フォスファターゼの減少,100 mg/kg群でアルブミン,A/G比,トリグリセライド,リン脂質,総ビリルビン,尿素窒素,クレアチニン,無機リンおよびカルシウムの増加ならびにグルコ-ス,GOT,GPTおよびカリウムの減少が認められた.
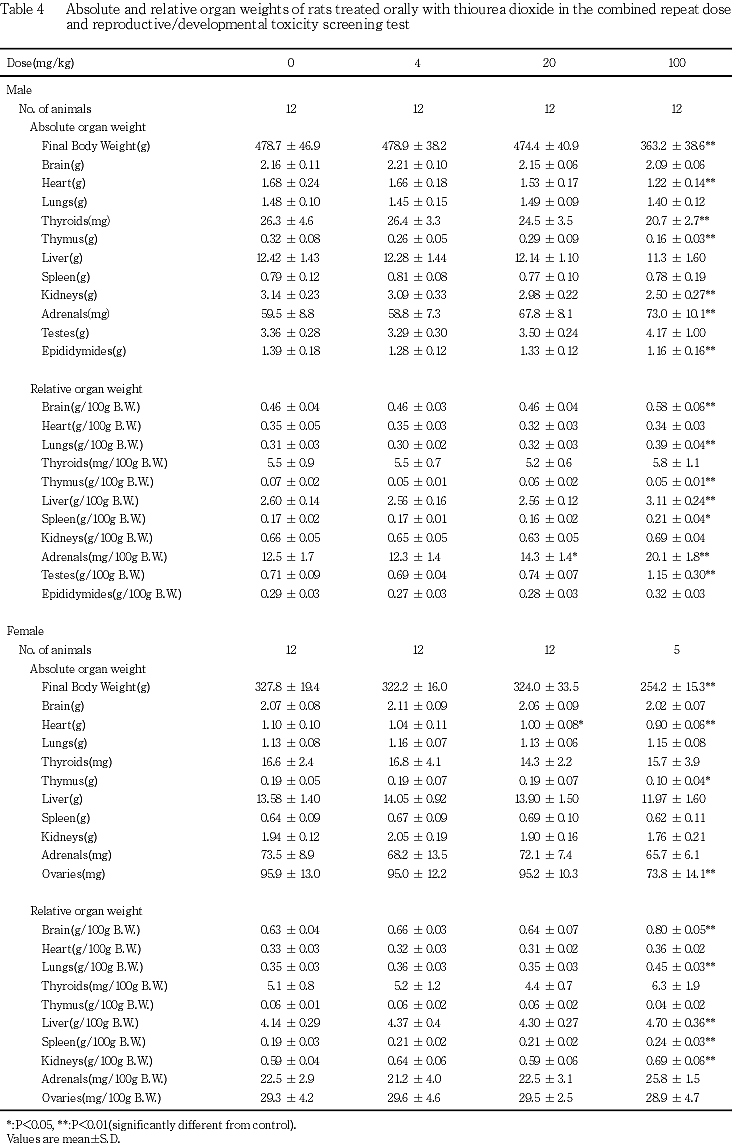
器官重量では,100 mg/kg群の雌雄で肝臓および脾臓重量の増加,雄で精巣重量の増加が認められた.
病理組織学検査では,肝臓において100 mg/kg群の雌雄で小葉中心性の肝細胞肥大,胆管内の好塩基性物(胆汁色素染色陰性)および肝細胞の空胞変性(脂肪染色陰性)が認められたほか,クッパー細胞へのヘモジデリン沈着が認められた.腎臓では,100 mg/kg群の雌で尿細管壊死および雌雄で尿細管上皮の好塩基性化がみられ,これらのなかにはリンパ球を主体とした細胞浸潤または尿細管の拡張を伴うものも認められた.胃では,100 mg/kg群雌雄で腺胃のびらんまたは潰瘍が認められた.脾臓では,100 mg/kg群の雌雄で髄外造血の亢進および赤脾随へのヘモジデリン沈着の増強が認められた.大腿骨骨髄では,100 mg/kg群の雄で造血低下が認められた.更に,雄の生殖器では,100 mg/kg群で,精巣において精細管拡張,多核巨細胞の出現を伴う生殖細胞の変性およびセルトリ細胞の空胞変性がみられたほか,精巣上体において管腔内の生殖細胞残屑,浮腫およびリンパ球性細胞浸潤が認められた.
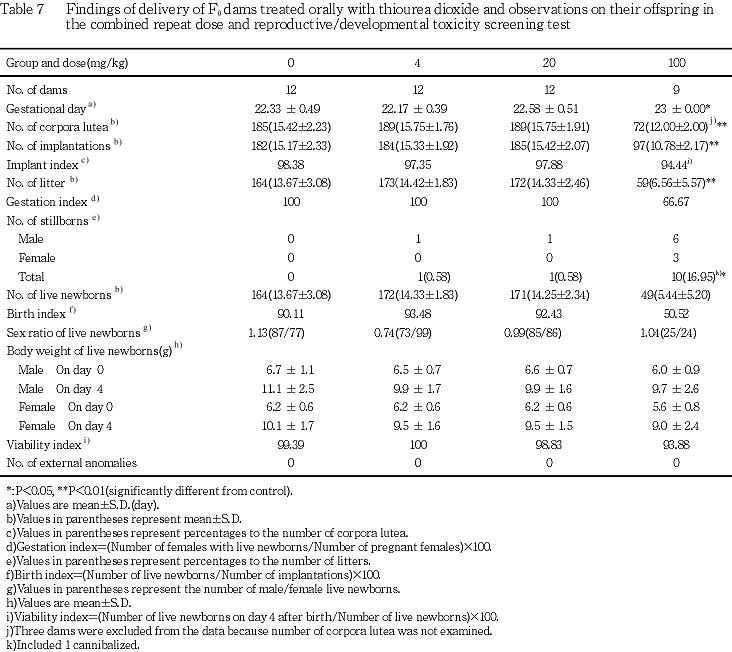
また,100 mg/kg群では3母動物で全胚吸収がみられたほか,新生児に対する影響として出産児数,新生児数および出生率の減少または減少傾向が認められた.性比,新生児の体重および生存性に被験物質投与の影響はみられず,新生児の外表検査においても異常はなかった.
以上のことから,本試験条件下における反復投与毒性に関する無影響量は雌で20 mg/kg/day,雄で4 mg/kg/day,生殖発生毒性に関する無影響量は親動物に対しては雄で100 mg/kg/day,雌で20 mg/kg/day,児動物に対しては20 mg/kg/dayと推察された.
投与経路は経口とし,雄では交配前14日間およびその後交配期間を含む35日間の合計49日間,雌では交配前14日間,交配期間(最長14日間),妊娠期間および哺育3日までの期間,1日1回,胃管を用いて投与した.投与容量は2.5 mL/kgとし,雄ならびに交配前および交配期間中の雌については最新の体重を基に,交尾成立後の雌については妊娠0日の体重を基にそれぞれ算出した.
更に,血液の一部は塗抹標本とし,May-Gr殤wald-Giemsa染色を施して白血球百分比を算出するとともに,ニューメチレンブルー超生体染色を施したのち,光学顕微鏡下で網状赤血球率を算出した.また,3.8 %クエン酸ナトリウム加血液を3000回転/分で15分間遠心分離し,得られた血漿を用いて,全自動血液凝固測定装置(Sysmex CA-5000,東亜医用電子(株))によりプロトロンビン時間(散乱光検出方式),活性化部分トロンボプラスチン時間(APTT,散乱光検出方式)およびフィブリノーゲン量(散乱光検出方式)を測定した.
 法),無機リン(PNP・XOD法/モリブデン酸直接法)およびカルシウム(MXB法)を測定した.また,総蛋白質およびアルブミンからA/G比を算出した.また,電解質分析装置(PVA-a
法),無機リン(PNP・XOD法/モリブデン酸直接法)およびカルシウム(MXB法)を測定した.また,総蛋白質およびアルブミンからA/G比を算出した.また,電解質分析装置(PVA-a ,(株)アナリティカル・インスツルメンツ)によりナトリウム(電極法),カリウム(電極法)およびクロール(電量滴定法)を測定した.
,(株)アナリティカル・インスツルメンツ)によりナトリウム(電極法),カリウム(電極法)およびクロール(電量滴定法)を測定した.
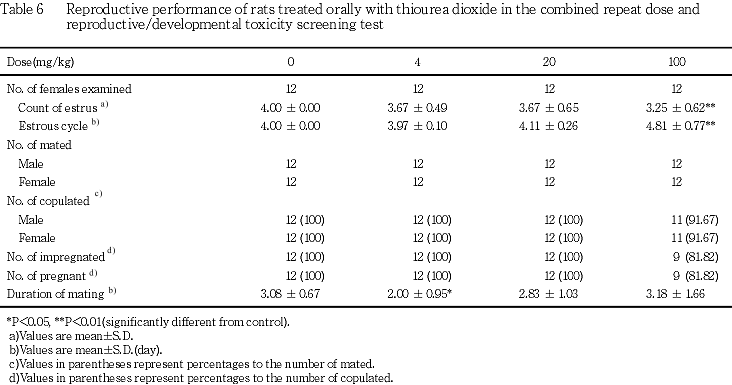
交配は雌雄(12週齢)1対1で一晩同居させる方法で行い,翌朝膣垢中の精子または膣栓が確認された日を妊娠0日とした.また,交配は同一群内で行い,交配期間は最長2週間とした.交配期間終了後,交尾所要日数,交尾率[(交尾動物数/同居動物数)×100]および授(受)胎率[(受胎動物数/交尾動物数)×100]を算出した.
雌について,投与開始日(投与1日)から15日間,毎日午前の一定時間に膣垢を採取し,性周期検査を行った.性周期検査では,発情回数を算出するとともに,発情期から次の発情期までの間の日数を発情周期日数とし,平均発情周期を算出した.
交配は投与15日の午後4時頃から,雌雄(12週齢)1対1で一晩同居させる方法で行い,翌朝膣垢中の精子または膣栓の存在により交尾を確認し,その日を妊娠0日とした.また,交配は同一群内で行い,交配期間は最長2週間とした.交配期間終了後,交尾所要日数,交尾率[(交尾動物数/同居動物数)×100]および授(受)胎率[(妊娠動物数/交尾動物数)×100]を算出した.
雄では,100 mg/kg群の1例で投与8〜47日に腰部に脱毛が認められた.
雌では,100 mg/kg群の1例で投与8〜17日および妊娠0〜19日,同群の別の1例(未交尾例)で投与21〜37日に腹部あるいは腰部に脱毛が認められた.

このほか,4 mg/kg群の雌で投与4および8日に減少がみられたが,一過性の軽微な変動であり,20 mg/kg群に同様な傾向がなかったことから,被験物質投与との関連性はないと判断した.
雌では,100 mg/kg群で心臓,胸腺および卵巣の絶対重量の減少,脳,肺,肝臓,脾臓および腎臓の相対重量の増加が認められた.このほか,20 mg/kg群では心臓の絶対重量の減少が認められた.
哺育4日に剖検した雌では,100 mg/kg群の1例で胸腺の萎縮が認められた.
全児死亡のため剖検した100 mg/kg群の雌1例では,腺胃粘膜の黒赤色点および腎臓の灰白色化が認められた.
妊娠24日になっても分娩を開始しなかったため剖検した100 mg/kg群の雌5例では,いずれの例にも異常はみられなかった.
雄の剖検日に剖検した100 mg/kg群の未交尾の雌1例では,異常はみられなかった.
胃では,対照群の雄1例および100 mg/kg群の雄3例で腺胃のびらん,100 mg/kg群の雌1例で腺胃の潰瘍が認められた.
腎臓では,100 mg/kg群の雌1例で腎臓の尿細管壊死,対照群および20 mg/kg群の雄各2例,100 mg/kg群の雌雄全例で尿細管上皮の好塩基性化がみられ,そのうち100 mg/kg群の雄9例および雌8例がリンパ球を主体とした細胞浸潤,雌1例が好中球を主体とした細胞浸潤を,また,同群の雌雄各1例が尿細管の拡張を伴っていた.
脾臓では,100 mg/kg群の雄3例および雌9例で髄外造血の亢進,100 mg /kg群の雌雄全例で赤脾髄へのヘモジデリン沈着の増強が認められた.
骨髄では,100 mg/kg群の雄11例で大腿骨骨髄の造血低下が認められた.
胸腺では,100 mg/kg群の雄1例および雌4例で萎縮が認められた.
副腎では,100 mg/kg群の雌1例で副腎の皮質全域の壊死が認められた.
精巣では,100 mg/kg群の雄4例で精巣の精細管拡張,雄2例でセルトリ細胞の空胞変性,雄1例で限局性の生殖細胞の変性および多核巨細胞の出現が認められた.
精巣上体では,100 mg/kg群の雄2例で精巣上体のリンパ球性細胞浸潤,雄1例で精巣上体の管腔内の生殖細胞残屑および水腫が認められた.
以上のほか,自然発生の変化として,対照群を含む各群を通して肝細胞の巣状壊死,肺の泡沫細胞集簇および動脈壁への鉱質沈着,胸腺または肺の出血,心臓の心筋変性/線維化,精巣の精細管萎縮,精巣および精巣上体の精子肉芽腫が散見された.

哺育期の検査では,前述した100 mg/kg群の1母動物で児の回集,授乳および保温など哺育行動の不良がみられ,分娩後2日には全児が死亡した.新生児の4日の生存率および体重については,各群とも対照群との間に差は認められなかった.
雄の血液学検査では,100 mg/kg群で赤血球数およびヘマトクリット値の減少,MCV,MCHおよびMCHCの増加が認められた.これらの変化は,血清中の総ビリルビンの増加と肝臓および脾臓へのヘモジデリン沈着が認められたことから,赤血球の破壊亢進に起因したものであろうと考えられた.更に,100 mg/kg群では骨髄検査で顆粒球系細胞,リンパ球および赤芽球系細胞の減少による有核細胞数の減少およびM/E比の低下,病理組織学検査で大腿骨骨髄の造血低下がみられたことから,上述した血液学検査パラメータの変動は赤血球の破壊亢進に加え,骨髄での造血抑制が影響していると考えられた.なお,末梢血中の白血球数および白血球百分比には変動はなく,本試験の投与期間においては,骨髄での顆粒系細胞の減少が末梢血中に反映されることはなかった.このほか,赤血球数の減少に伴う反応性の変化として,網状赤血球率の増加ならびに脾臓での髄外造血およびそれに伴う脾臓重量の増加傾向が認められた.20 mg/kg群においてもMCHおよびMCHCの増加が認められた.また,100 mg/kg群ではプロトロンビン時間および活性化部分トロンボプラスチン時間の短縮がみられたが,短縮した場合にみられる血栓等の変化はみられず,毒性学的意義は低いものと考えられた.
雄の血液生化学検査では,100 mg/kg群でアルブミン,A/G比,トリグリセライドおよびリン脂質の増加ならびにグルコースの減少がみられ,本被験物質の肝臓への影響が示唆された.更に,100 mg/kg群では尿素窒素,クレアチニンおよび無機リンの増加ならびにカリウムの減少がみられ,後述する病理組織学検査とともに本被験物質の腎臓への影響が示唆された.このほか,20 mg/kg以上の群でアルカリ性フォスファターゼの減少,100 mg/kg群でGOTおよびGPTの減少が認められた.また,100 mg/kg群でカルシウムの増加がみられたが,血清中のカルシウムの一部はアルブミンと結合している1)ことから,アルブミンの増加に伴った二次的な変化と考えられた.
病理学検査では,上述した造血器系の変化のほか,肝臓では,100 mg/kg群の雌雄で重量の増加がみられ,組織学的に小葉中心性の肝細胞の肥大および胆汁色素染色で陰性を示す起源不明の好塩基性物が胆管内に認められた.また,100 mg/kg群の雌1例では肝細胞の空胞変性が認められた.腎臓では,100 mg/kg群の雌雄で対照群と比較して尿細管上皮の好塩基性化の発生頻度が増加し,これらのなかにはリンパ球を主体とした細胞浸潤および尿細管の拡張を伴うものも認められた.更に,100 mg/kg群の雌1例では尿細管壊死が認められた.なお,20 mg/kg群の雄においても尿細管上皮の好塩基性化がみられたが,その発生頻度および程度も対照群と同等であったことから,被験物質投与との関連性はないものと考えられた.胃では,100 mg/kgの雌雄で腺胃のびらんおよび潰瘍がみられ,本被験物質が胃粘膜に対する刺激性を有するものと考えられた.また,雄では100 mg/kg群で精巣重量の増加傾向がみられ,組織学的には精巣の精細管腔拡張,多核巨細胞の出現を伴う生殖細胞の変性,セルトリ細胞の空胞変性,精巣上体の管腔内の生殖細胞残屑,浮腫およびリンパ球性細胞浸潤が認められ,本被験物質の雄性生殖器への影響が示唆された.これらの変化については,生殖細胞の変性にステージ特異性および細胞特異性がなく,局所的に生殖上皮の全層が変性を起こしており,塩化カドミウム投与による血行障害時の初期の変化2)に類似していること,更に,精巣上体にも浮腫が認められたことから,循環障害に起因した可能性が高いと推察されたが,授胎能に影響を及ぼすほど強い変化ではなかった.雌では,100 mg/kg群の全児死亡の母動物で副腎の皮質全域に及ぶ壊死がみられたが,同群の雄および他の母動物には同様な組織学的変化がなかったこと,本母動物では分娩および哺育行動の不良がみられていることから,妊娠あるいは分娩に起因したストレスに起因したものであり3),被験物質投与との関連はないものと考えられた.なお,20 mg/kg以上の群の雄で副腎重量の増加,100 mg/kg群の雌雄で胸腺重量の減少傾向がみられ,胸腺では組織学的にも萎縮が認められた.これらの変化はストレスが負荷された動物で観察されるものであり,本試験においても同様にストレスに起因したものと考えられた.これらのほか,器官重量では,20 mg/kg以上の群の雌雄で脳,肺,心臓,甲状腺等の重量変動がみられたが,絶対重量のみの減少および相対重量のみの増加であり,対応する組織学的変化もなかったことから,毒性学的な意義はないものと考えられた.
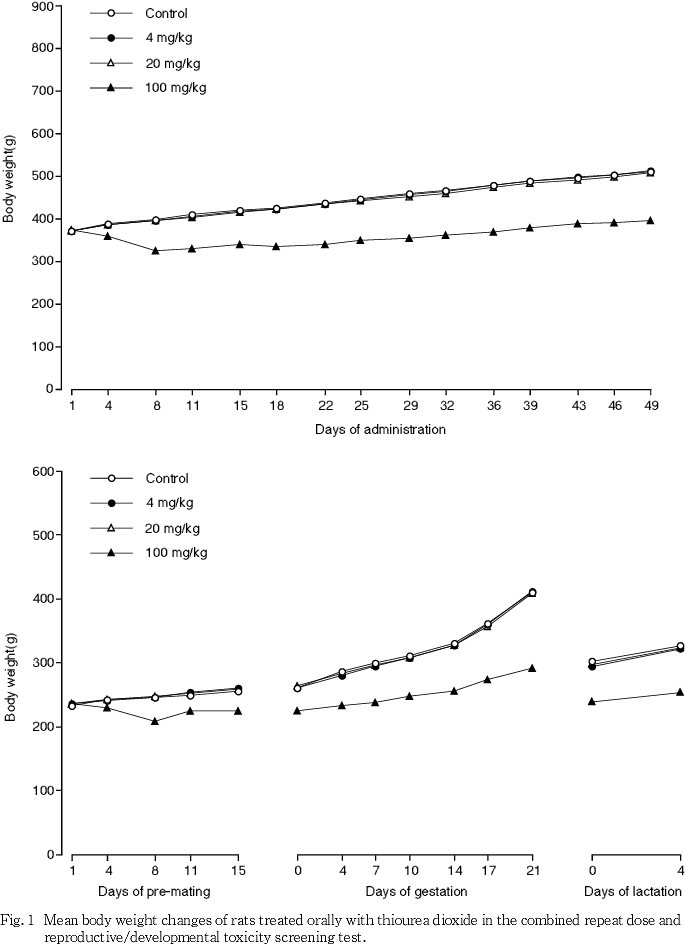
以上のように,100 mg/kg群の雌雄で体重の増加抑制,摂餌量の減少ならびに肝臓および腎臓に及ぼす影響がみられたほか,20 mg/kg以上の群の雄でアルカリ性フォスファターゼの減少が認められたことから,本試験条件下における反復投与毒性に関する無影響量は雄で4 mg/kg,雌で20 mg/kgと推察された.
分娩時の検査では,100 mg/kg群で母動物において妊娠期間の延長および出産率の減少傾向,出生児において出産児数,新生児数および出生率の減少または減少傾向が認められた.出産率の減少傾向については,全胚吸収が3例みられたことに起因したものであり,これらの例では黄体数の算定も困難であったことから,妊娠の早期に胚致死が誘発されたものと考えられた.妊娠期間の延長については,産児数が少ない場合に妊娠期間が長くなることが知られており4),本試験においてみられた出産児数の減少に起因している可能性が考えられた.出産児数および新生児数の減少については,上述の黄体数の減少ならびに出生率の減少傾向を反映したものと考えられた.このほか,100 mg/kg群では死産率の増加が認められたが,これは全児死亡の母動物1例で分娩直後の児の回集および保温の不良がみられ,死産児数が増加したことに起因したものであり,分娩直後の哺育行動の不良はそのほかの例ではみられていないことから,被験物質投与との関連性はないものと考えられた.性比,新生児の体重および新生児の外表検査ならびに新生児の生存性においては被験物質投与の影響は認められなかった.
以上のように,雄の生殖機能に被験物質投与の影響はみられなかったが,100 mg/kg群の雌で発情回数の減少および発情周期の延長,黄体数および着床痕数の減少ならびに妊娠期間の延長および出産率の減少傾向がみられ,100 mg/kg群では新生児に対する影響として出産児数,新生児数および出生率の減少または減少傾向が認められたことから,本試験条件下における生殖発生毒性に関する無影響量は,親動物に対しては雄で100 mg/kg,雌で20 mg/kg,児動物に対しては20 mg/kgと推察された.
| 1) | 谷本義文,"実験動物の臨床化学,"清至書院,東京,1981, pp. 163-164. |
| 2) | 高橋道人編,"精巣毒性評価のための精細管アトラス ―ラット,マウス,イヌ―,"ソフトサイエンス社,東京,1994, p. 66. |
| 3) | 笹野公伸,笹野伸昭,"現代病理学体系17(B)巻 副甲状腺 副腎 胃腸膵内分泌系副腎皮質,6.変性・壊死・炎症・ストレスに伴う変化,"飯島宗一ら編,中山書店,東京,1991, pp. 139-154. |
| 4) | 佐久間勇次監,"ウサギ-生殖生理と実験手技,"近代出版,東京,1988, p. 24. |
| 連絡先 | |||
| 試験責任者: | 和泉宏幸 | ||
| 試験担当者: | 木村栄介,幸 邦憲,千々波智子,鍬先恵美子,一鬼 勉 | ||
| (株)パナファーム・ラボラトリーズ 安全性研究所 | |||
| 〒869-0425 熊本県宇土市栗崎町1285 | |||
| Tel 0964-23-5111 | Fax 0964-23-2282 | ||
| Correspondence | ||||
| Authors: | Hiroyuki Izumi(Study director) Eisuke Kimura, Kuninori Yuki, Tomoko Chijiwa, Emiko Kuwasaki, Tsutomu Ichiki | |||
| Safety Assessment Laboratory, Panapharm Laboratories Co., Ltd. | ||||
| 1285 Kurisaki-machi, Uto-shi, Kumamoto, 869-0425, Japan | ||||
| Tel +81-964-23-5111 | Fax +81-964-23-2282 | |||