C.I. フルオレセントブライトナー271について,細菌を用いる復帰変異試験を実施した.
試験菌株として,Salmonella typhimurium (TA100,TA98,TA1535,TA1537)およびEscherichia coli (WP2 uvrA)の5菌株を用いた.用量設定試験においてはS9 mix無添加群および添加群の各試験菌株において8.19〜5000 μg/plateの8用量,本試験ではS9 mix無添加群および添加群のTA100,TA1535,WP2 uvrAおよびTA98ならびにS9 mix添加群の全菌株において156〜5000 μg/plateの6用量,S9 mix無添加群のTA1537において78.1〜5000 μg/plateの7用量で試験を実施した.
その結果,S9 mix無添加群および添加群のいずれにおいても,溶媒対照に比べ復帰変異コロニー数の明確な増加は認められなかった.これらの試験結果は,用量設定試験および本試験において再現性が確認された.
以上の結果より,本試験条件下ではC.I. フルオレセントブライトナー271は,変異原性を有しない(陰性)と結論した.
細菌を用いる復帰変異試験に広く使用されていることから,試験菌株としてヒスチジン要求性のSalmonella typhimurium TA100,TA98,TA1535およびTA1537 1)ならびにトリプトファン要求性のEscherichia coli WP2 uvrA 2)の5種類の菌株を選択した.
ネズミチフス菌は昭和58年9月9日にカリフォルニア大学のAmes BN教授から,また,大腸菌については昭和58年3月16日に国立衛生試験所(現:国立医薬品食品衛生研究所)から分与を受けた.平成15年9月16日〜9月19日に菌株の特性検査を実施し,当該試験に用いた菌株が規定の特性を保持していることを確認した.
各菌株の菌懸濁液はジメチルスルホキシド(DMSO,Merck)を添加した後,凍結保存用チューブに0.2 mLずつ分注した.これを液体窒素を用いて凍結し,超低温フリーザーに-80℃で保存した.
オリエンタル酵母工業製のテスメディアAN培地を購入し,試験に用いた.本プレートは,Vogel-Bonnerの最少培地Eを含む水溶液(0.02 %硫酸マグネシウム・7水塩,0.2 %クエン酸・1水塩,1 %リン酸二カリウム・無水塩,0.192 %リン酸一アンモニウム,0.066 %水酸化ナトリウム'いずれも最終濃度")に2 %のグルコース(和光純薬工業)と1.1 %の寒天(伊那寒天BA-30A)を加え,径90 mmのシャーレに1枚当たり30 mLを分注したものである.
塩化ナトリウム0.5 w/v%を含む0.6 w/v% Bacto-agar (BD Diagnostic Systems)水溶液10容量に対し,ネズミチフス菌を用いる試験の場合,0.5 mmol/L L-ヒスチジン(関東化学)-0.5 mmol/L D-ビオチン(関東化学)水溶液を1容量加え,大腸菌を用いる試験の場合,0.5 mmol/L L-トリプトファン(関東化学)水溶液を同じく1容量加え用いた.
内容量200 mLのバッフル付三角フラスコに2.5 w/v%ニュートリエントブロス(Nutrient Broth No.2,Oxoid)溶液を25 mL分注し,これに融解した菌懸濁液を50 μL接種した.ウォーターバスシェーカー(MM-10,タイテック)を用い,37℃の条件で8時間振盪(往復振盪:100回/分)培養し,菌濃度を確認した後試験に使用した.
製造後6ヵ月以内のキッコーマン製S9 mixを試験に使用した.S9 mix中のS9は誘導剤としてフェノバルビタールおよび5,6-ベンゾフラボンを投与したSprague- Dawley系雄ラットの肝臓から調製されたものである.S9 mixの組成を以下に示す.
| 成分 |
S9 mix 1 mL中の量 |
|
| S9 | 0.1 mL | |
| MgCl2 | 8 μmol | |
| KCl | 33 μmol | |
| G-6-P | 5 μmol | |
| NADPH | 4 μmol | |
| NADH | 4 μmol | |
| Na-リン酸緩衝液(pH 7.4) | 100 μmol |
被験物質のC.I. フルオレセントブライトナー271(ロット番号:040303)は純度91.0 %〔不純物としてNaCl:0.32 %,Na2SO4:0.01 %,水:6.3 %(残り2.37 %不明,各成分1 %未満)を含有する〕の淡黄色結晶である.本剤は水に可溶である.日本化薬(東京)から提供された被験物質を使用した.被験物質は,使用時まで室温で保管した.試験終了後,被験物質提供元において残余被験物質を分析した結果,安定性に問題はなかった.
試験の都度,被験物質を注射用水(大塚製薬工場)を用いて溶解し,調製原液とした.なお,本被験物質の純度は95 %未満(91.0 %)であるため,最高用量の被験物質秤量の際に純度換算を実施した.調製原液を使用溶媒を用いて順次所定濃度に希釈した後,速やかに処理を行った.
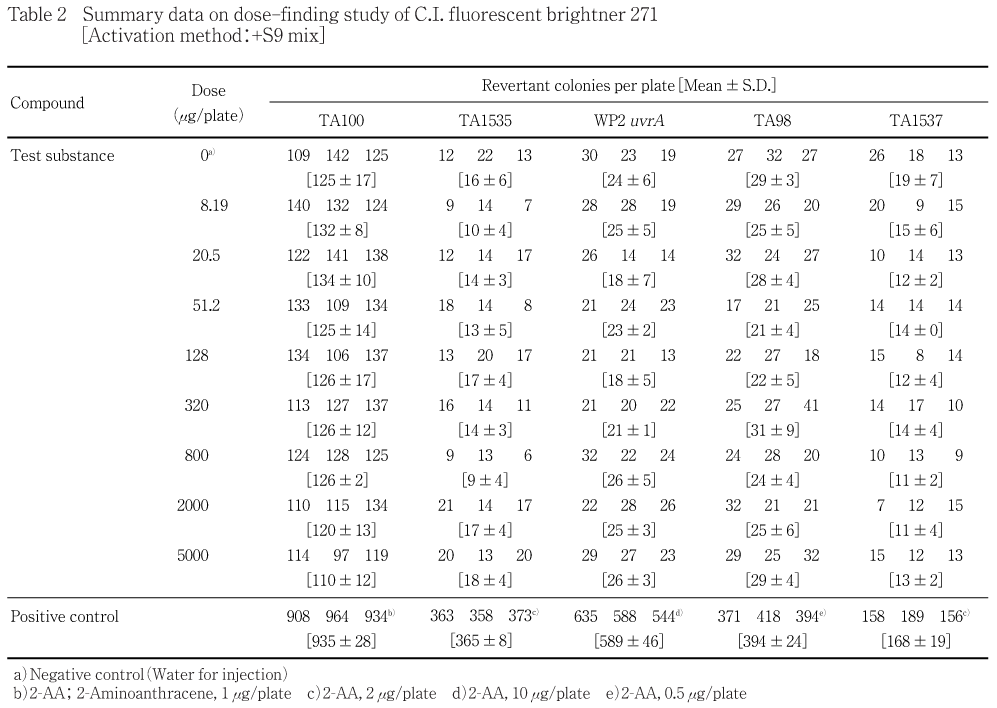
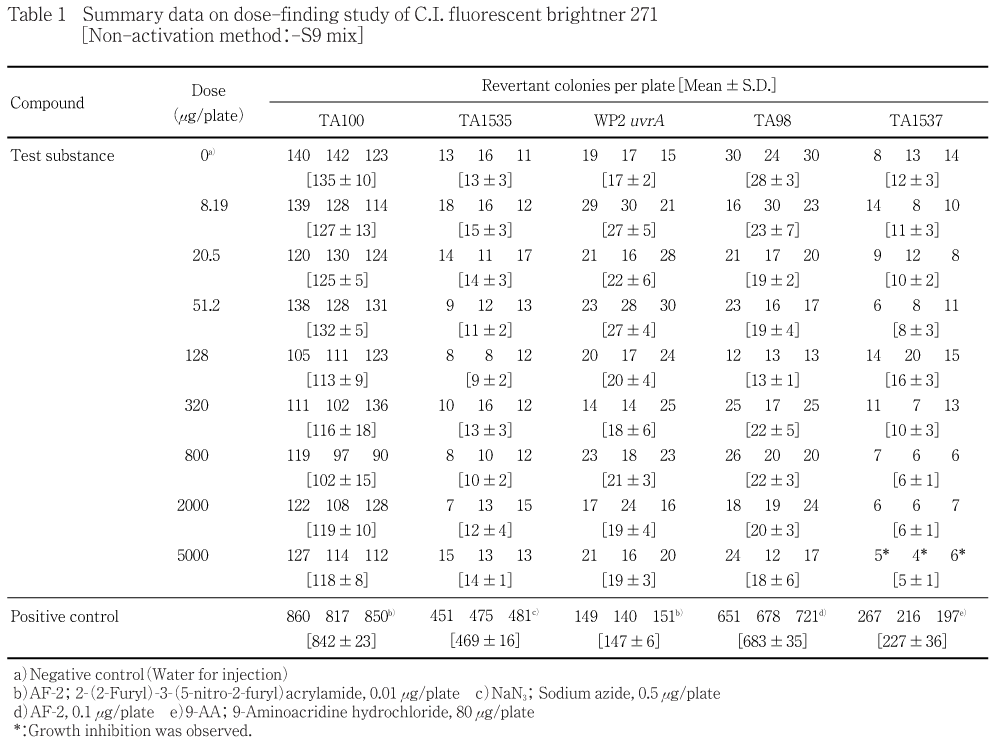
8.19〜5000 μg/plateの8用量(公比2.5)を用いて用量設定試験を実施した.その結果,S9 mix無添加群および添加群の各試験菌株でいずれの用量においても復帰変異コロニー数の明確な増加傾向は認められなかった.また,S9 mix無添加群のTA1537株において,5000 μg/plateで試験菌株に対する生育阻害作用が観察され,コロニー数が減少した.被験物質処理時およびコロニー数計測時,析出等の特筆すべき変化は観察されなかった.
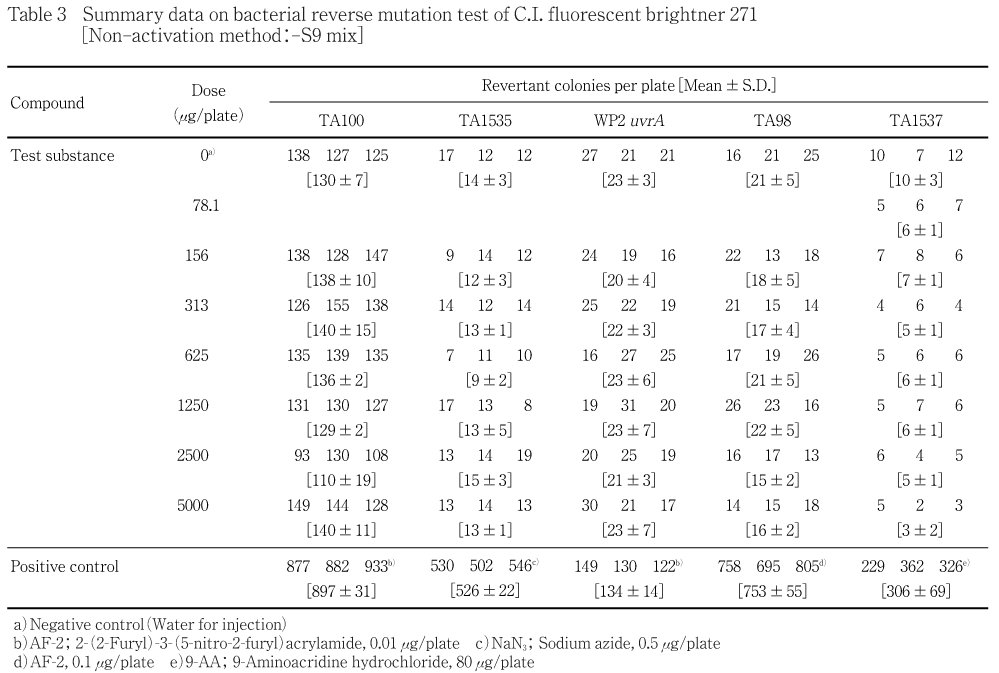
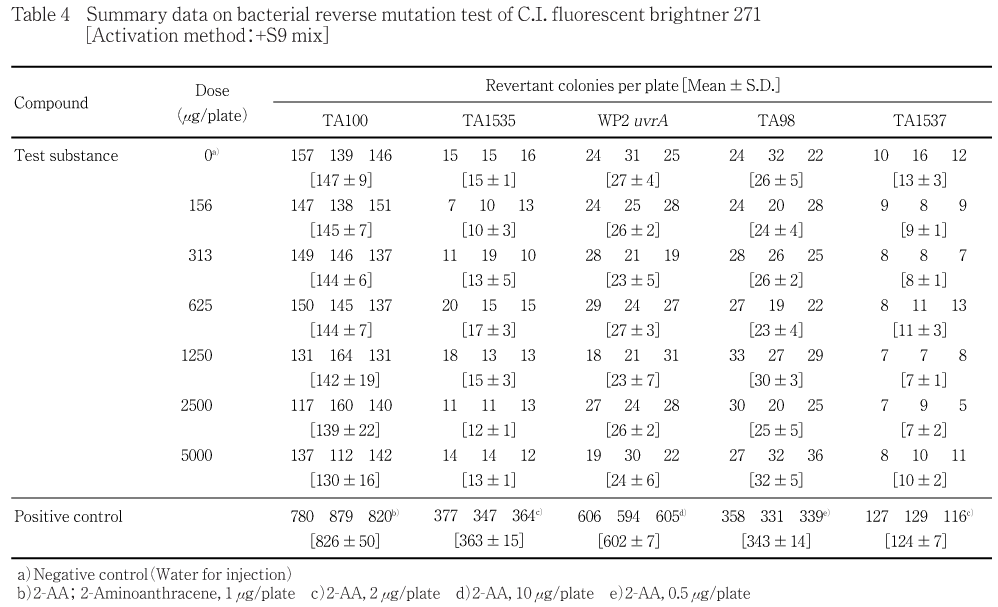
従って,本試験ではS9 mix無添加群および添加群とも,すべての試験菌株において5000 μg/plateを最高用量とし,それぞれ6〜7用量(公比2)を設定した.
陽性対照物質として下記に示した調製済み陽性対照物質溶液(オリエンタル酵母工業)を使用した.
| 2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリルアミド | (AF-2) | |
| アジ化ナトリウム | (NaN3) | |
| 9-アミノアクリジン塩酸塩 | (9-AA) | |
| 2-アミノアントラセン | (2-AA) |
Amesらの原法 1)の改良法であるプレインキュベーション法に準じて,S9 mix無添加群および添加群それぞれについて試験を実施した.試験管に,使用溶媒,被験物質液あるいは陽性対照物質溶液を100 μL,次いでS9 mix無添加群の場合,0.1 mol/L ナトリウム・リン酸緩衝液(pH 7.4)を500 μL,S9 mix添加群の場合,S9 mixを500 μL添加し,さらに試験菌液100 μLを加え,37℃で20分間振盪培養(プレインキュベーション)した.培養終了後,あらかじめ45℃に保温したトップアガーを2 mL添加し,混合液をプレート上に重層した.37℃の条件で48時間各プレートを培養した後,被験物質の試験菌株に対する生育阻害作用を確認するため,実体顕微鏡(×40)を用いてプレート上の試験菌株の生育状態を観察した.次いで,復帰変異により生じたコロニーを計測した.計測に際してはコロニーアナライザー(CA-11,システムサイエンス)を用いた.各濃度につき3枚のプレートを使用した.
復帰変異コロニー数が溶媒対照の2倍以上に増加し,かつ,再現性あるいは被験物質の用量に依存性が認められた場合に,陽性と判定した.
統計学的手法を用いた検定は実施しなかった.
用量設定試験の結果をTable 1〜2に,本試験の結果をTable 3〜4に示した.S9 mix無添加群および添加群とも,いずれの試験菌株においてもC.I. フルオレセントブライトナー271処理による復帰変異コロニー数の明確な増加傾向は認められなかった.また,S9 mix無添加群のTA1537株を除き,各試験菌株のいずれの処理群においても試験菌株に対する生育阻害作用は観察されなかった.S9 mix無添加群のTA1537株においては,5000 μg/plateで生育阻害が認められ(用量設定試験のみ),コロニー数が減少した.一方,陽性対照物質はそれぞれの試験菌株において,溶媒対照群の2倍以上の復帰変異コロニーを誘発した.なお,被験物質処理時およびコロニー数計測時,析出等の特筆すべき変化は観察されなかった.
以上の試験結果から,当該試験条件下において,C.I. フルオレセントブライトナー271の微生物に対する遺伝子突然変異に関し,陰性と判定した.
なお,本被験物質(C.I. フルオレセントブライトナー271)の遺伝毒性ならびに発がん性に関する報告は現在までない.
類縁体であるFluorescent brightener 24,Fluorescent brightener 225およびFluorescent brightener 260についてはCHL細胞を用いた染色体異常試験,Don細胞を用いた染色体異常試験およびDon細胞を用いた姉妹染色分体交換試験で陰性 3, 4)と報告されている.また,Fluorescent brightener 84についてもCHL細胞を用いた染色体異常試験で陰性 3)と報告されている.
| 1) | Maron DM, Ames BN: Revised methods for the Salmonella mutagenicity test. Mutation Res, 113: 173-215(1983). |
| 2) | Green MH, Muriel WJ: Mutagen testing using TRP+ reversion in Escherichia coli. Mutation Res, 38: 3-32(1978). |
| 3) | 賀田恒夫,石館基(監修):「環境変異原性データ集1」サイエンティスト社,東京(1980)pp.199-200. |
| 4) | 祖父尼俊雄(監修):「染色体異常試験データ集」改訂1998年版,エル・アイ・シー,東京(1999) pp.238- 239. |
| 連絡先 | |||
| 試験責任者: | 嶋田佐和子 | ||
| 試験担当者: | 田中 仁,古屋有佳子,木下裕加, 上田摩弥,永井美穂,仲村渠奈美子, 夏目匡克,赤星まゆみ | ||
| (財)食品農医薬品安全性評価センター | |||
| 〒437-1213 静岡県磐田市塩新田582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | |||
| Authors: | Sawako Shimada (Study Director) Jin Tanaka, Yukako Furuya, Yuka Kishita, Maya Ueda, Miho Nagai, Namiko Nakandakari, Masakatsu Natsume, Mayumi Akahoshi |
||
| Biosafety Research Center, Foods, Drugs and Pesticides (An-pyo Center) | |||
| 582-2 Shioshinden, Iwata-shi, Shizuoka, 437-1213, Japan | |||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | ||