既存化学物質の毒性学的性質を評価するため,C.I.フルオレセントブライトナー271の0(溶媒の注射用水のみ投与),20,60および200 mg/kg/dayをラットの交配前14日から交配期間14日間を通じて経口投与し,さらに雄では交配期間終了後15日間,雌では妊娠期間を通じて分娩後の哺育4日まで連続投与し,反復投与毒性および生殖発生毒性に及ぼす影響を検討した.また,対照群および200 mg/kg群の雌雄各5例についてサテライト群を設け,43日間の反復投与後,14日間の休薬による毒性の回復性についても検討した.
被験物質投与に関連する一般状態の変化,機能観察総合検査おける観察項目および測定項目の変化は認められなかった.
体重では,200 mg/kg群の雄で投与期間の後半に体重減少,雌で妊娠・哺育期間に体重増加抑制が認められた.摂餌量では,200 mg/kg群の雄で投与期間の後半,雌で妊娠期間に低値が認められた.これらの体重および摂餌量の変化は,雌雄ともに被験物質投与の影響と考えられた.ただし,回復期間における体重増加量および摂餌量は,対照群と200 mg/kg群で同程度であり,休薬による回復傾向が示唆された.
血液凝固能検査では,投与期間終了時の雄の200 mg/kg群でプロトロンビン時間が延長する傾向が認められ,被験物質投与との関連性は不明であったが,回復期間終了時には短縮したことから,回復性のある変化と判断された.
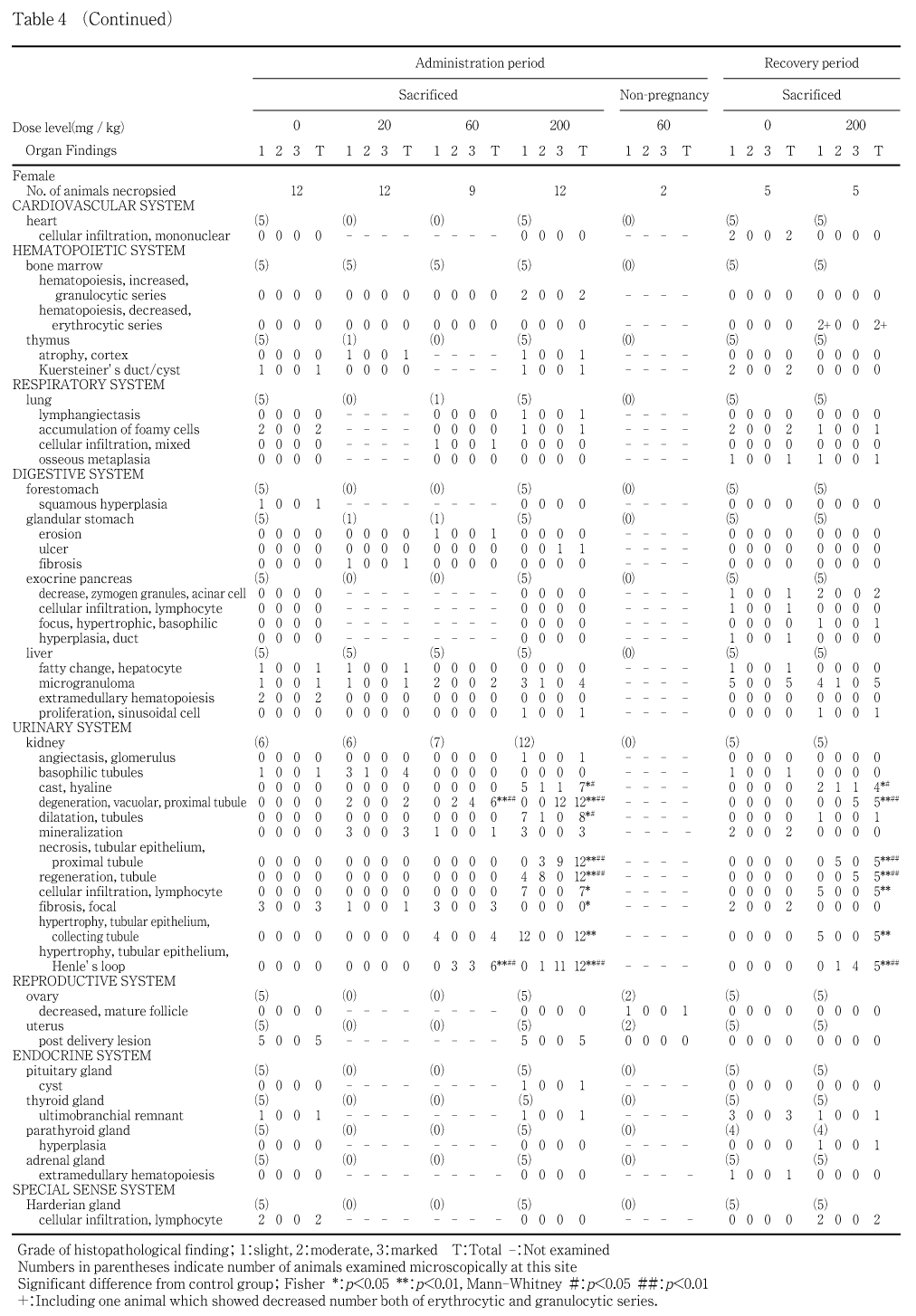
病理学検査では,雌雄の60 mg/kg以上の投与群で腎臓の淡色化,200 mg/kg群で腎臓の肥大が認められ,腎臓重量が高値を示した.病理組織学検査では,全ての投与群で腎臓の近位尿細管上皮に空胞変性が認められ,用量の増加に伴って所見の程度が増強し,200 mg/kg群では近位尿細管の壊死が認められた.他にも腎臓で,近位尿細管の空胞変性・壊死に付随した再生性,炎症性反応の所見が多数認められた.さらに,200 mg/kg群では,腎臓障害を反映した血液生化学検査および尿検査値の変化が認められ,血液学検査で認められた貧血も,腎臓障害に伴う二次的変化と推察された.
回復期間終了時においても,腎障害を示唆する臨床検査値の変化は,投与期間終了時より増強していたが,腎臓の皮質領域では再生性尿細管が優勢となり,休薬により腎障害が回復傾向にあることが明らかになった.
平均性周期,交尾能および受胎能に被験物質投与の影響は認められなかった.分娩時観察では,分娩状態の異常はいずれの投与群でも認められなかった.新生児の外表検査および哺育4日の剖検では,被験物質投与に関連した異常は認められなかった.200 mg/kg群で出生児の哺育0日の体重低値が認められたが,哺育4日の体重値に差は認められなかった.その他,妊娠期間,妊娠黄体数,着床数,出産児数,出産生児数,性比および出産率に被験物質投与の影響は認められなかった.
以上のことから,当該試験条件下におけるC.I.フルオレセントブライトナー271の無毒性量(NOAEL)は,雌雄とも20 mg/kg/day投与により腎臓に対する影響が認められたことから,20 mg/kg/day未満と判断された.
親動物の生殖能に及ぼす影響は,雌雄とも200 mg/kg/day投与でも認められず,無毒性量は200 mg/kg/dayと判断された.児動物の発生・発育に及ぼす影響は,200 mg/kg/day投与で哺育0日に低体重が認められ,無毒性量は60 mg/kg/dayと判断された.
C.I.フルオレセントブライトナー271(日本化薬(東京)製造,Lot No. 040303,純度91.0 %)は淡黄色の結晶であり,使用時まで被験物質保管庫(室温)に保存した.残余被験物質を製造元で再分析することにより,本ロットが投与期間中安定であったことを確認した.被験物質は注射用水(大塚製薬工場)に溶解し,2,6および20 mg/mLの投与液を調製した.調製に際しては被験物質の純度補正を行った.投与液は投与まで冷暗所に保存し,調製後7日以内に使用した.投与液中の被験物質は,2および20 mg/mLの濃度について,遮光条件下で8日間の室温放置後においても安定であることを確認した.投与液の濃度/均一性分析は,初回調製時に調製した全ての試験群の投与液について行った.その結果,基準範囲内(設定濃度の90〜110 %以内)であった.
試験には,日本チャールス・リバーから購入した生後8週齢のSprague-Dawley(Crl:CD(SD),SPF)系ラット雌雄各58匹を使用した.購入した動物は7日間検疫・馴化飼育した後,体重推移および一般状態に異常が認められなかったものを選出し,8日間の予備飼育に移行した.予備飼育後,10週齢で群分けして試験に用いた.群分け時の体重は,雄で345〜403 g,雌で211〜238 gの範囲であった.
動物は,温度24 ± 3℃,湿度55 ± 20 %,換気回数15回/時間,照度150〜300 lux,照明時間12時間(午前7時点灯,午後7時消灯)に管理されたバリアシステムの飼育室でアルミ製前面・床ステンレス網目飼育ケージに1匹ずつ収容し飼育した.妊娠18日以降の母動物は,哺育4日までアルミ製前面・床ステンレス網目飼育ケージに哺育トレーおよび巣作り材料(サンフレーク,日本チャールス・リバー製造)を入れて飼育した.
飼料は,オリエンタル酵母製造のCRF-1固型飼料(放射線滅菌飼料)を使用し,飼育期間中自由に摂取させた.飲水は,水道水を自由に摂取させた.
動物は投与開始日の体重をもとに層別化し,無作為抽出法により対照群および高用量群に各17匹(サテライト群の5匹を含む),低および中用量群に各12匹を振り分けた.なお,雌は群分け前に8日間の性周期観察を行い,正常な性周期(4または5日の発情期日数)を有する動物を群分けに用いた.
2週間投与予備試験を,0,30,100,300および1000 mg/kgの用量で実施した.その結果,雌雄の1000 mg/kg群では体重および摂餌量の低値に加え,病理学検査(剖検,器官重量)および臨床検査(血液学検査,血液凝固能検査,血液生化学検査)においても様々な変化が認められた.さらに,雌の300 mg/kg群では体重増加抑制が,雌雄の300 mg/kg以上の投与群では腎臓の淡色化が,雌の100 mg/kg以上の投与群で血清カリウムの低値が観察された.
したがって,本試験では明らかな毒性徴候が現れることが予想され,長期の投与期間でも死亡動物が多発しないと考えられる200 mg/kg/dayを高用量とし,以下公比約3で除し,60および20 mg/kg/dayを中および低用量に設定した.
投与液量は,体重100 g当たり1 mLとし,交配前および交配期間ならびに交配期間終了後の投与期間の雌雄では,個体別に測定した最新体重に基づいて算出した.また,妊娠期間および哺育期間中の雌は,妊娠0,7,14,20および哺育0日に測定した個体別体重に基づいて算出した.投与液は,胃ゾンデを用いて1日1回強制経口投与した.対照群には注射用水のみを投与した.
投与期間は,雄は交配前14日間と交配期間14日間および交配期間終了後14日間の連続42日間とした.雌は交配前14日間と交配期間中(最長14日間)および交尾した雌は妊娠期間を通じて分娩後の哺育4日まで(41〜55日間)とした.また,交配期間中に交尾しなかった雌は,交配期間終了後24日間の連続52日間投与し,交尾後分娩しない雌は妊娠25日の解剖前日まで(43および53日間)とした.サテライト群の動物は投与期間を連続43日間とし,その後の休薬期間は14日間とした.
雌雄とも,全例について試験期間中毎日2回以上(回復期間中および剖検日は1回)行い,異常および死亡の有無を記録した.
雄は投与1(投与開始日),8,15,22,29,36,43および44日(剖検日あるいは回復1日)に測定し,投与1から43日までの体重増加量を算出した.サテライト群の雄は,投与終了後回復1,8,14および15日(剖検日)に測定し,回復1から14日までの体重増加量を算出した.
雌は投与1(投与開始日),8および15日に測定し,投与1から15日までの体重増加量を算出した.交尾が確認されなかった雌はそれ以降の投与22,29,36,43,50および53日(剖検日)に測定した.また,交尾が確認された雌は,妊娠0,7,14および20日に,分娩した雌は分娩後0,4および5日(剖検日)に測定し,それぞれ妊娠0から20日および分娩後0から4日までの体重増加量を算出した.サテライト群の雌は,サテライト群の雄と同日に測定し,投与1から43日および回復1から14日までの体重増加量を算出した.
雄は投与1(投与開始日),8,15,22,29,36および43日(剖検前日)に餌重量を測定し,測定日から次の測定日までの摂餌量を求め平均1日摂餌量を算出するとともに投与1から15日および投与22から42日までの累積摂餌量を算出した.サテライト群の雄は,投与終了後回復1,8および14日(剖検前日)に測定し,測定日から次の測定日までの摂餌量を求め平均1日摂餌量を算出するとともに投与1から43日および回復1から14日までの累積摂餌量を算出した.
雌は投与1(投与開始日),8および15日に餌重量を測定し,測定日から次の測定日までの摂餌量を求め平均1日摂餌量を算出するとともに投与1から15日までの累積摂餌量を算出した.交尾が確認されなかった雌はそれ以降の投与29,36,43,50および53日に餌重量を測定し,測定日から次の測定日までの摂餌量を求め,平均1日摂餌量を算出した.また,交尾が成立した雌は妊娠0,7,14および20日に,分娩した雌は分娩後0および4日に餌重量を測定し,測定日から次の測定日までの摂餌量を求め平均1日摂餌量を算出するとともに妊娠0から20日までの累積摂餌量を算出した.サテライト群の雌は,サテライト群の雄と同日に餌重量を測定し,測定日から次の測定日までの摂餌量を求め平均1日摂餌量を算出するとともに投与1から43日および回復1から14日までの累積摂餌量を算出した.なお,交配期間中の同居動物の摂餌量は測定しなかった.
機能観察総合検査は,全生存動物について行った.以下の機能観察総合検査の内,詳細な症状観察は群分け前に1回,投与開始後は週1回行った(回復期間を含む).ただし,交尾した雌は妊娠7および14日,分娩した雌は哺育4日に行った.種々の刺激に対する運動感覚反応の観察,握力測定および自発運動量測定は,雄は各群5例について投与43日に,雌は各群5例について分娩後4日に行った.サテライト群の動物は投与43日および回復14日に行った.群分け前の詳細な症状観察は,仮動物番号の若い順に実施した.投与期間中の検査は,投与後30分から開始し,群により検査の時間帯が偏らないよう配慮して行った.
詳細な症状観察では,ケージ内の姿勢について観察し,身悶え,旋回,咬み行動,痙攣および異常発声の有無を確認し,記録した.また,ケージ外へ動物を取り出し,出し易さ,扱い易さ,異常発声,筋緊張,立毛,被毛の状態,眼瞼状態,咬傷,流涙,流涎,呼吸,眼球,可視粘膜,尿失禁およびカタレプシーについて観察し,記録した.さらにオープンフィールド装置の中央で30 cmの高さからの空中正向反射を観察し,動物が着地した時点から3分間オープンフィールド内での動物の呼吸,協調運動,痙攣,毛繕い,歩行,歩行異常,眼瞼状態,常同行動,異常行動,異常発声,覚醒度および移動量について観察し,立ち上がり回数,脱糞回数および排尿回数を数え,記録した.
瞳孔反射,接近反応,触覚反応,聴覚反応および痛覚反応を検査し,記録した.
前後肢の握力についてはデジタルプッシュプルゲージ(アイコーエンジニアリング)を用いてそれぞれ2回測定し,平均値を記録した.
CAS(東洋産業)を用いて個別に測定した.上記a)からc)項の検査終了後(投与後約40分)に測定を開始した.データの収集間隔は1分毎とし,集計時間は10分毎の1時間とした.測定環境は,照明は点灯状態,測定室の騒音レベルはホワイトノイズ発生装置PA-1(永島医科機械)でおよそ70 dBに保ち,普通騒音計NA20(RION)を用いて測定し,記録した.
交配は交配前14日間の性周期観察を行った雌と同群内の雄を1対1で最長14日毎晩同居させた.交尾の確認は,同居させた翌朝,腟栓または腟垢中の精子確認により行い,交尾が確認された雌はその日を妊娠0日とした.性周期観察は交尾確認日まで行い,発情期から次の発情期までの間の日数を性周期日数として平均性周期を算出した.また,性周期観察期間中の異常性周期(4または5日以外の性周期)発現率〔(異常性周期を示す雌動物数/観察雌動物数)×100〕を算出した.交配結果から各群について交尾率〔(交尾動物数/同居動物数)×100〕を算出した.なお,サテライト群については,性周期観察および交配を実施しなかった.
妊娠動物は全て自然分娩させた.自然分娩時に分娩状態の観察を行った.分娩の確認を妊娠20から25日の午前8時30分〜10時の間に行い,この時間帯に分娩が完了していることを確認した動物および分娩を開始した動物は分娩完了まで待ち,その日を哺育0日とした.午前10時を過ぎて分娩を開始した場合は翌日を哺育0日とした.哺育5日に母動物は病理解剖し,黄体数および着床痕数を調べ肉眼的に異常の有無を調べた.また,妊娠期間(哺育0日の年月日から妊娠0日の年月日を減じた日数),受胎率〔(受胎動物数/交尾動物数)×100〕,出産率〔(生児出産雌数/妊娠雌数)×100〕,着床率〔(着床痕数/妊娠黄体数)×100〕,分娩率〔(総出産児数/着床痕数)×100〕,出生率〔(出産生児数/総出産児数)×100〕を算出した.妊娠25日の午前9時までに分娩のみられない動物は病理解剖し,子宮に着床痕の認められない場合,妊娠不成立と判定した.
新生児については哺育0日に出産児数(生存児+死亡児)を調べ,性別を判定し,性比(雄/雌)を算出するとともに,外表異常の有無を調べた.出生後4日までの哺育期間は,毎日出生児の生存および死亡数を確認し,生存児については一般状態を観察した.また,哺育0および4日に雌雄個体別の体重を測定し,1腹の雌雄別平均体重を算出した.哺育4日の体重測定後,エーテル麻酔下で放血安楽死させ,器官・組織の肉眼観察を行った.哺育期間中の死亡児はブアン液に固定し,器官・組織の肉眼観察を実施した.また,新生児の4日の生存率〔(哺育4日生児数/出産生児数)×100〕を算出した.
血液学検査,血液凝固能検査および血液生化学検査は,雄および自然分娩した雌の剖検時(雄:投与44日,雌:哺育5日)およびサテライト群の剖検時(回復15日)に実施した.動物は約16時間の絶食後,エーテル麻酔下で開腹し,腹大動脈から採血した.
抗凝固剤(EDTA-2K)入り採血管インセパック-II- D(積水化学工業)に新鮮血を採取し,総合血液学検査装置ADVIA120(バイエル)を用いて白血球数(WBC:2角度レーザーフローサイトメトリー法),赤血球数(RBC:2角度レーザーフローサイトメトリー法),ヘモグロビン量(HGB:シアンメトヘモグロビン法),ヘマトクリット値(HCT:RBC,MCVより算出),平均赤血球容積(MCV:2角度レーザーフローサイトメトリー法),平均赤血球血色素量(MCH:HGB,RBCより算出),平均赤血球色素濃度(MCHC:HGB,HCTより算出),血小板数(PLT:2角度レーザーフローサイトメトリー法),白血球百分率(ペルオキシダーゼ染色によるフローサイトメトリー法および2角度レーザーフローサイトメトリー法)および好中球数(NEUT),リンパ球数(LYMPH),単球数(MONO),好酸球数(EOSN),好塩基球数(BASO),大型非染色球数(LUC)および網赤血球率(Reticulocyte:RNA染色によるレーザーフローサイトメトリー法)を測定した.
白血球百分率は前述の機器で測定したが,別途血液塗抹標本を作製し,メイ・グリュンワルド・ギムザ染色して保存した.
抗凝固剤(3.13 %クエン酸ナトリウム水溶液)入り採血管ベノジェクトII(テルモ)に血液を採取した後,約1680×gで13分間遠心分離して得た血漿を検査に用いた.全自動血液凝固線溶測定装置STA Compact(ロシュ)を用いてプロトロンビン時間(PT:粘度変化検知方式)および活性化部分トロンボプラスチン時間(APTT:粘度変化検知方式)を測定した.
高速凝固促進剤・分離剤入り採血管インセパックII-D(積水化学工業)に血液を採取した後,常温,約1680×gで7分間遠心分離して得た血清を検査に用いた.多項目生化学自動分析装置日立7170(日立製作所)を用いて総蛋白(Biuret法),アルブミン(BCG法),A/G(総蛋白およびアルブミンより算出),血糖(HK-G-6-PDH法),中性脂肪(GK-GPO遊離グリセロール消去法),総コレステロール(コレステロールオキシダーゼHDAOS法),尿素窒素(BUN:ウレアーゼGLDH法),クレアチニン(酵素法),総ビリルビン(バナジン酸酸化法),アスパラギン酸アミノトランスフェラーゼ(AST:酵素-UV法),アラニンアミノトランスフェラーゼ(ALT:酵素-UV法),アルカリホスファターゼ(ALP:P-ニトロフェニルリン酸基質法),γ-グルタミルトランスペプチダーゼ(Gamma-GTP:L-γ-グルタミル-3-カルボキシ-4-NA法),カルシウム(MXB法),無機リン(PNP-XDH法)および総胆汁酸(酵素サイクリング法)を,全自動電解質分析装置EA06R(アットウィル)を用いてナトリウム(イオン選択電極法),カリウム(イオン選択電極法)および塩素(イオン選択電極法)を測定した.
投与39日に,各群それぞれ5例の雄動物について検査を行った.
採尿に先立ち,水道水を20 mL/kgの容量で強制経口投与し,絶食・絶水の条件下で採尿ケージを用いて一夜尿(午後4時から翌日午前9時まで)を採取した.
pH,潜血,糖,蛋白,ケトン体,ビリルビンおよびウロビリノーゲンについては,エームス尿検査試験紙N-マルティスティックスSG(バイエル メディカル)を用い,尿分析装置CLINITEK500(バイエル)で判定を行った.
尿量(計量),色調(目視)および試験紙法による検査後,卓上多本架遠心機(LC-06PS)を用いて尿を約420×gで5分間遠心し,上清および残渣に分離した.上清を用いて全自動電解質分析装置(EA06R)でナトリウム,カリウムおよび塩素を測定した.さらに尿量を用いてナトリウム,カリウムおよび塩素の総排泄量を算出した.尿浸透圧(氷点降下法)は,自動浸透圧測定装置Osmotic Pressure AUTO&STAT OM-6030(アークレイファクトリー)で測定した.
剖検では動物の外観,口腔,鼻孔および頭蓋腔,骨格,脳および脊髄の外観と切断面,胸腔,腹腔および骨盤腔とその内臓,頸部の組織および器官を検査した.全ての肉眼的異常について,部位,大きさ,硬さなどを記録した.また,解剖した全ての動物について皮膚,乳腺,リンパ節(腸間膜,下顎),唾液腺(舌下腺,下顎腺),胸骨,大腿骨,骨髄(胸骨,大腿骨),胸腺,気管,肺(気管支を含む:左側注入固定),心臓,甲状腺,上皮小体,舌,食道,胃,十二指腸,空腸,回腸,盲腸,結腸,直腸,肝臓,膵臓,脾臓,腎臓,副腎,膀胱,精嚢,前立腺,卵巣,子宮,腟,眼球(視神経を含む),ハーダー腺,脳(大脳,小脳,橋を含む),下垂体,脊髄(頸部,胸部,腰部),骨格筋,坐骨神経,大動脈および肉眼で異常病変が認められた器官・組織を10 vol%中性緩衝ホルマリン液に,精巣および精巣上体をブアン液で前固定した後,10 vol%中性緩衝ホルマリン液に固定した.
重量を測定した器官については,器官重量/体重比(相対重量)を得られた剖検日の体重および器官重量から算出した〔(器官重量/剖検日の体重)×100〕.
43日間投与後,夕刻から約16時間絶食させた後にエーテル麻酔下で採血あるいは放血安楽死させた.器官・組織の肉眼観察を行った後,脳,胸腺,心臓,肝臓,腎臓,脾臓,副腎,精巣および精巣上体重量を測定した.
分娩後4日の投与後,夕刻から約16時間絶食させた後にエーテル麻酔下で採血あるいは放血安楽死させた.器官・組織の肉眼観察を行った後,脳,胸腺,心臓,肝臓,腎臓,脾臓,副腎および卵巣重量を測定した.なお,剖検時に黄体数および着床痕数を調べた.
52日間投与の翌日,エーテル麻酔下で放血安楽死させ,器官・組織の肉眼観察を行った.
妊娠25日に相当する日に,エーテル麻酔下で放血安楽死させ,器官・組織の肉眼観察を行った.子宮内を調べ,着床痕が認められなかったため妊娠不成立と判定した.
回復14日の夕刻から約16時間絶食させた後にエーテル麻酔下で採血後,放血安楽死させた.器官・組織の肉眼観察を行った後,脳,胸腺,心臓,肝臓,腎臓,脾臓,副腎,精巣および精巣上体重量を測定した.
回復14日の夕刻から約16時間絶食させた後にエーテル麻酔下で採血後,放血安楽死させた.器官・組織の肉眼観察を行った後,脳,胸腺,心臓,肝臓,腎臓,脾臓,副腎および卵巣重量を測定した.
下記に該当する動物について病理組織学検査を実施した.
組織は常法に従ってパラフィン切片を作製し,ヘマトキシリン・エオジン染色した.鏡検では病変の種類,程度について記録した.
なお,精巣についてはPAS・ヘマトキシリン染色およびヘマトキシリン・エオジン染色した後,ヘマトキシリン・エオジン染色標本で一般的病変を検査し,(1),(3),(4)および(5)についてはPAS・ヘマトキシリン染色標本で精子形成サイクル(VIIまたはVIII)を検査した1).また,(1)および(2)については高用量群の肝臓,腎臓,脾臓および骨髄に被験物質投与の影響が疑われたため,これらの器官については低および中用量群も各5例ずつ検査を実施した.
対照群と高用量群の各5例の全固定器官,および全群の剖検時に認められたそれ以外の異常病変部組織について実施した.
対照群と高用量群の各5例の全固定器官,および全群の剖検時に認められたそれ以外の異常病変部組織について実施した.
腟,子宮,卵巣,精巣,精巣上体,精嚢および前立腺.
腟,子宮,卵巣,精巣,精巣上体,精嚢および前立腺.
全固定器官について実施した.
体重,体重増加量,摂餌量,累積摂餌量,平均性周期,黄体数,着床痕数,妊娠期間,出産児数,死産児数,性比,着床率,出生率,分娩率,外表異常発現率,新生児の4日の生存率,FOB検査値(握力,自発運動量,立ち上がり回数,脱糞回数,排尿回数),血液学検査値,血液凝固能検査値,血液生化学検査値,尿検査値(尿量,尿中電解質および尿浸透圧),器官重量および相対重量については自動判別方式に従い,最初にBartlettの等分散検定 2)を実施した.等分散の場合はDunnettの多重比較検定 3)で対照群と各投与群間の有意差を検定した.Bartlettの等分散検定で不等分散の場合はSteelの検定 4)で対照群と各投与群間の有意差を検定した.
出産率,交尾率および受胎率についてはχ2検定を用いた.
異常性周期発現率,立ち上がり,脱糞および排尿を除く詳細な症状観察ならびに種々の刺激に対する運動感覚反応の観察の各項目,剖検所見および病理組織所見の発生率についてはFisherの直接確率検定法 5)で検定した.病理組織所見のうち程度の増強が認められた所見は−を「1」,+1を「2」,+2を「3」,+3を「4」に割り当て,また,精子形成サイクルのセルトリ細胞当たりの各ステージの細胞比率についてはMann-WhitneyのU検定を実施した.
一般状態の所見についての統計解析は行わなかった.
有意水準はBartlettの等分散検定については5 %,その他の検定は5 %および1 %の両側検定で実施した.
なお,哺育期間中の出生児に関する成績は1母体当たりの平均を1標本として集計した.
雌雄とも,死亡動物は認められなかった.一般状態の変化として,雄では,投与期間中に軟便が60 mg/kg群で1例,眼分泌物がサテライト群の対照群で1例に観察された.雌では,投与期間中に痂皮および外傷が20 mg/kg群で同一の1例,60 mg/kg群で2および1例に観察された.なお,回復期間中には雌雄とも一般状態の変化は認められなかった.観察された一般状態の変化のいずれもが,少数例での発現であり,また,高用量群では発現が認められないことから,被験物質投与に関連しない自然発生性の変化と考えられた.
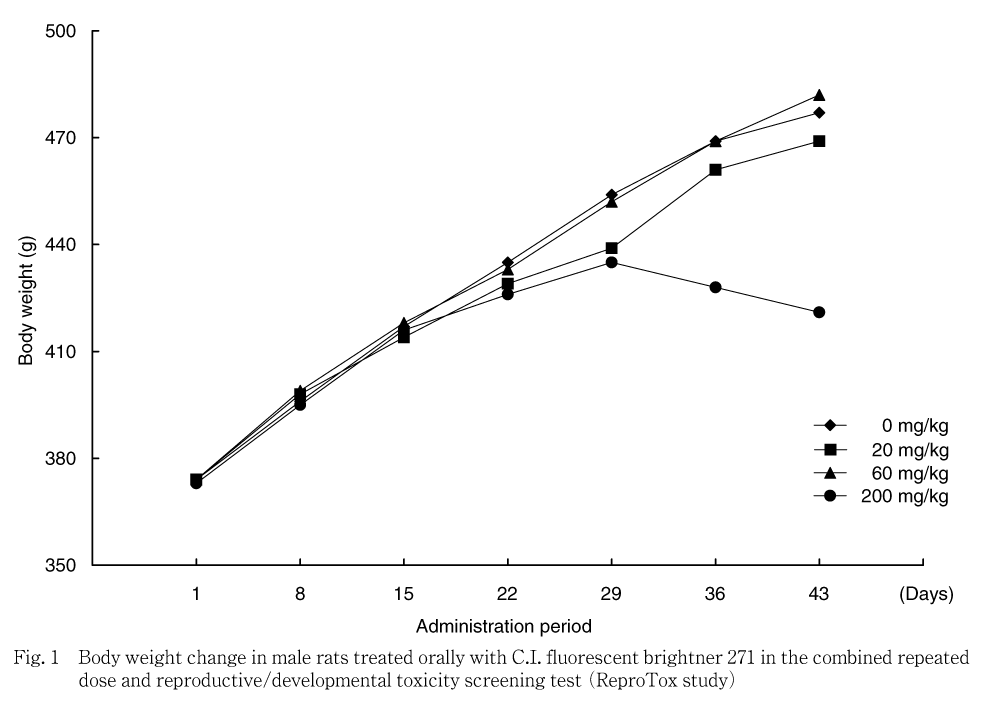
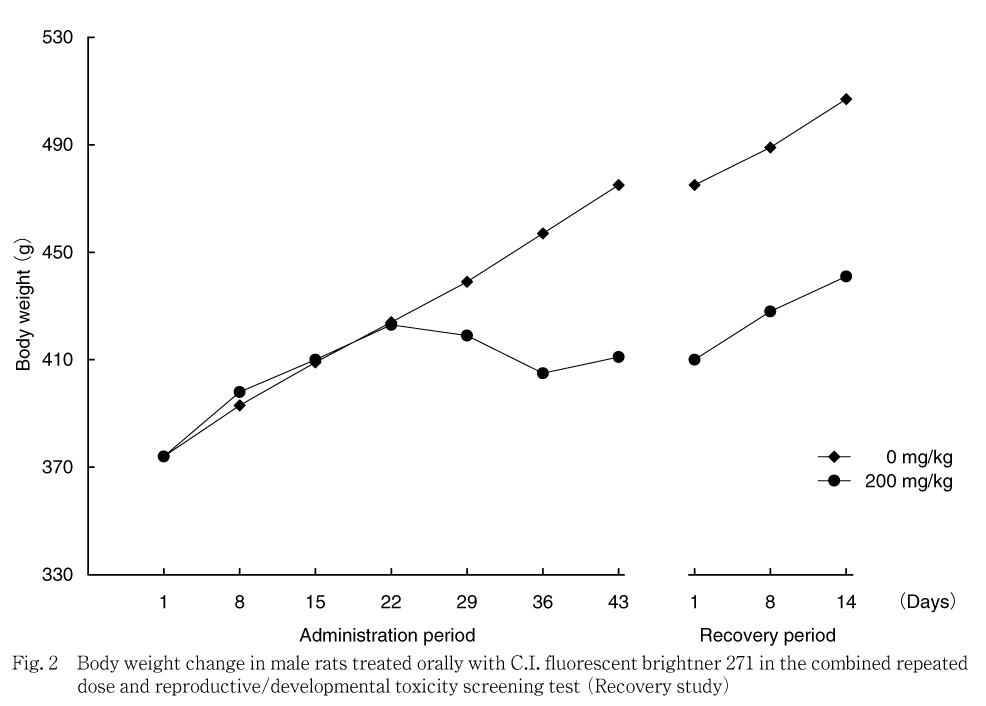
雄では,対照群と比べ200 mg/kg群で投与36日以降投与期間終了時まで統計学的に有意な低値が認められ,投与1から43日の体重増加量も低値を示した.サテライト群では,200 mg/kg群で投与29日以降,回復期間終了まで低値傾向または有意な低値を示した.しかし,回復期間中の体重増加量は対照群と同程度であった.
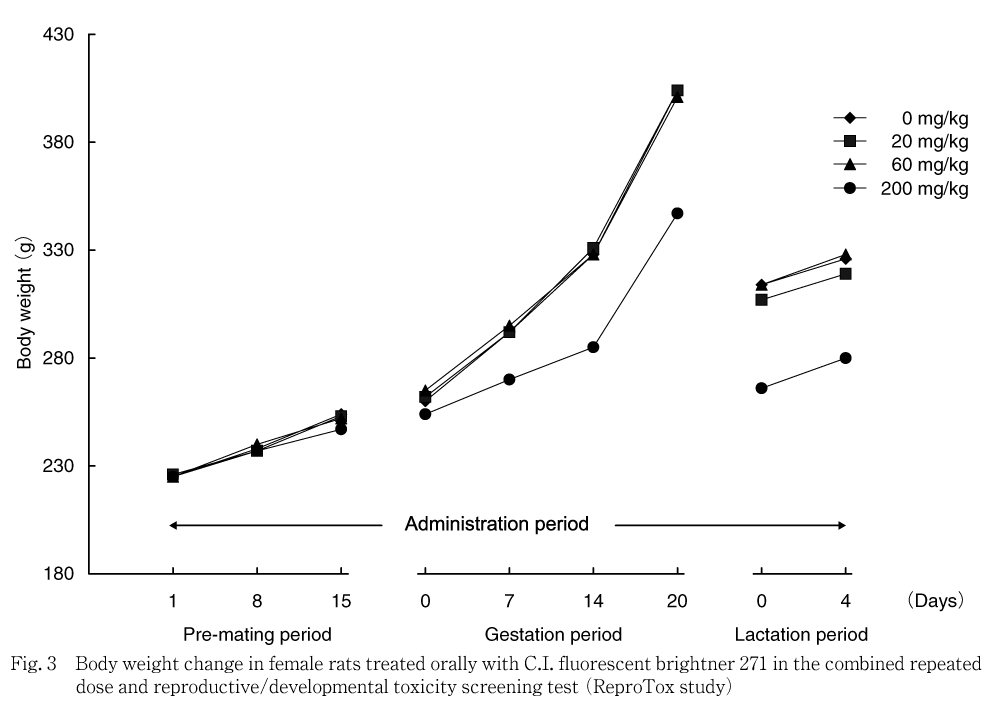
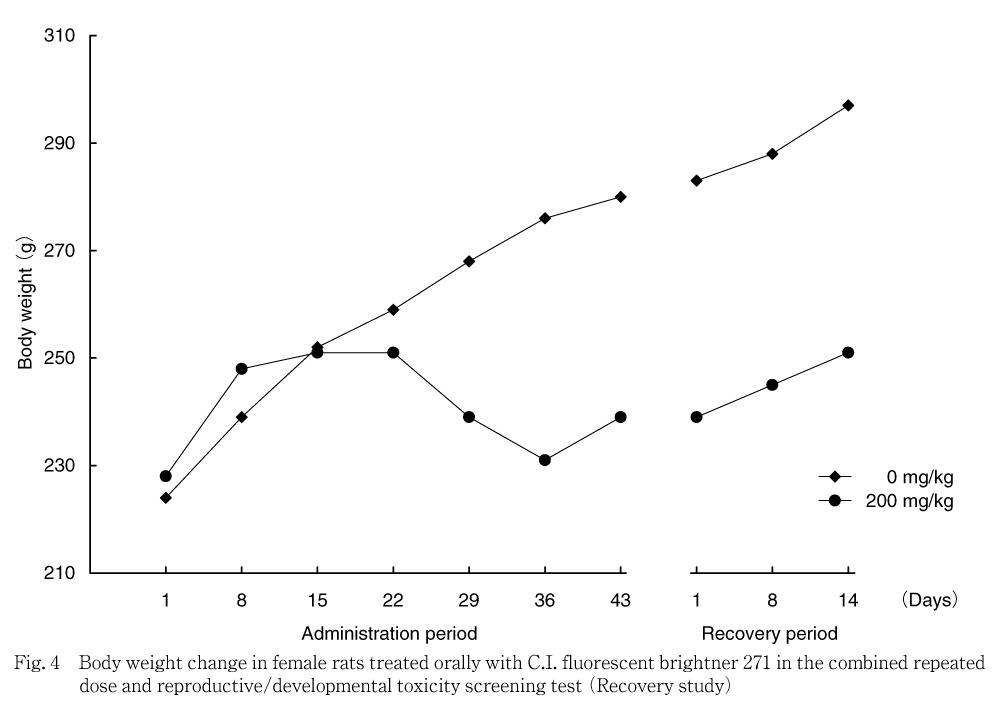
雌では,対照群と比べ200 mg/kg群で投与15日に低値傾向が認められ,投与1から15日の体重増加量も低値傾向を示した.妊娠期間および哺育期間では,対照群と比べ200 mg/kg群で低値傾向または統計学的に有意な低値が認められ,妊娠期間の体重増加量も有意な低値を示した.しかし,哺育期間の体重増加量には対照群と差は認められなかった.サテライト群では,200 mg/kg群で投与29日以降,回復期間終了まで有意な低値を示し,投与期間の体重増加量も低値を示した.回復期間の体重増加量には対照群と差は認められなかった.

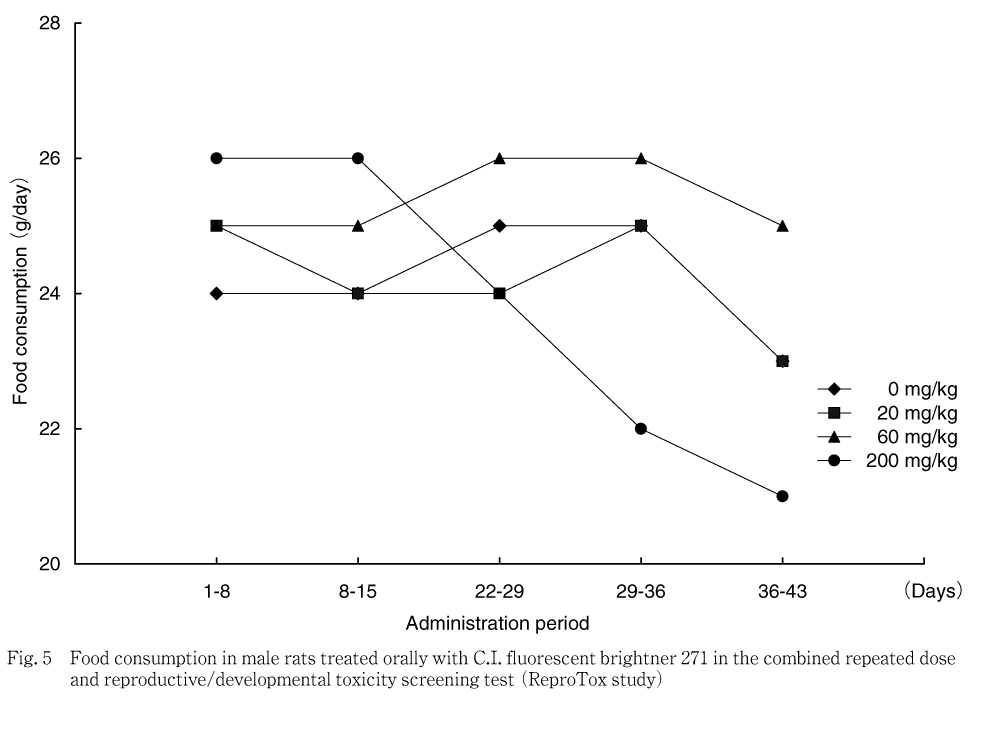
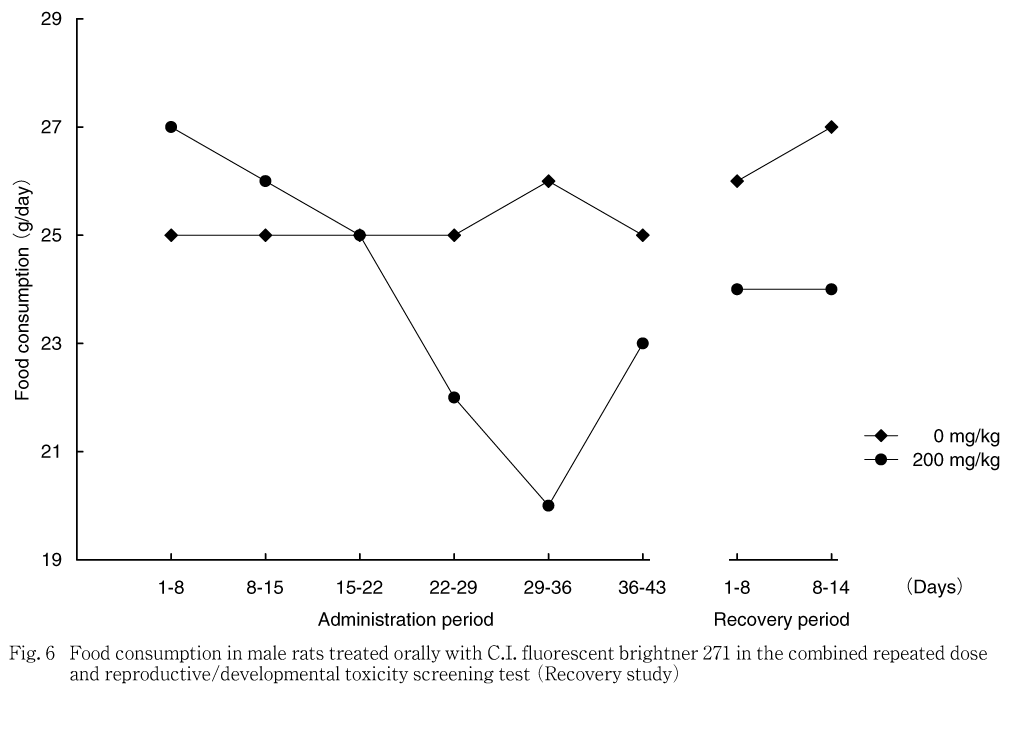
雄では,対照群と比べ200 mg/kg群で投与8-15日の平均1日摂餌量が統計学的に有意な高値,投与29-36日の平均1日摂餌量が有意な低値を示し,投与1-15日の累積摂餌量が有意な高値,投与22-43日の累積摂餌量が低値傾向を示した.サテライト群では,200 mg/kg群で投与22-29日および29-36日の平均1日摂餌量が有意な低値を示し,投与期間中の累積摂餌量が低値傾向を示した.回復期間では,平均1日摂餌量および累積摂餌量ともに差は認められなかった.
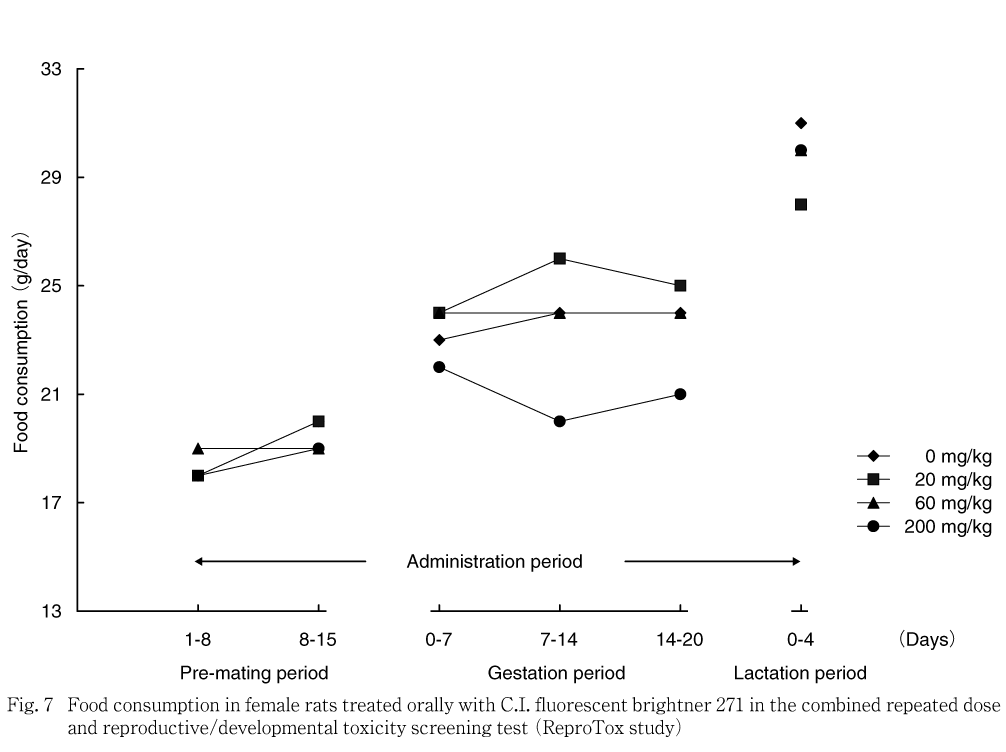
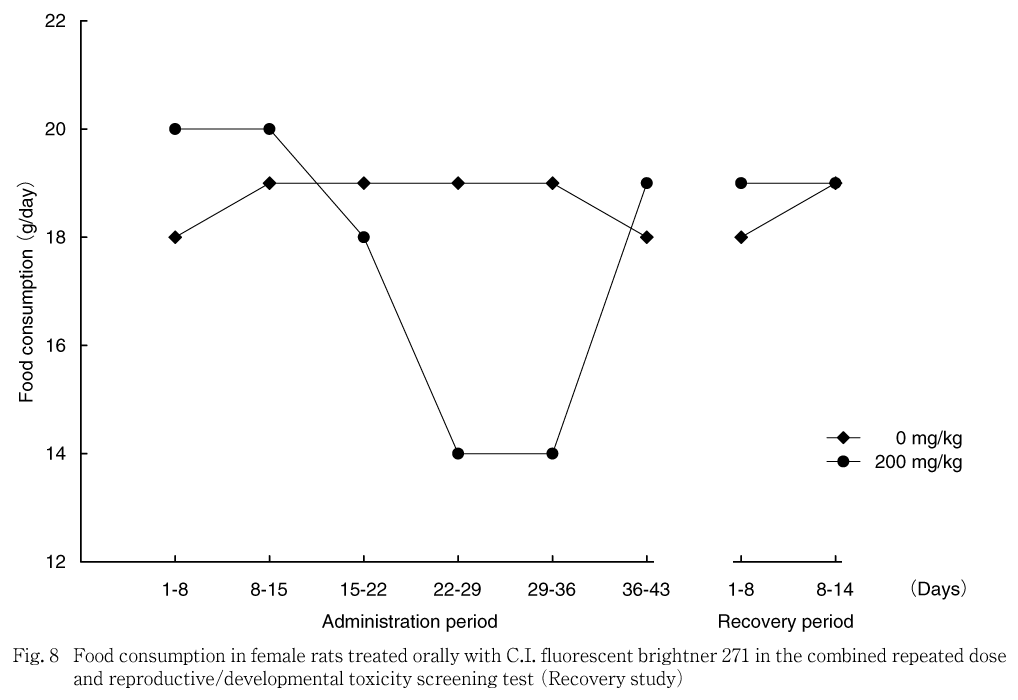
雌の交配前期間および哺育期間では,対照群と被験物質投与群との間に統計学的な有意差は認められなかった.妊娠期間では,対照群と比べ200 mg/kg群で妊娠7-14日および14-20日の平均1日摂餌量および妊娠期間中の累積摂餌量が有意な低値を示した.サテライト群では,200 mg/kg群で投与22-29日および29-36日の平均1日摂餌量が有意な低値を示し,投与期間中の累積摂餌量が低値傾向を示した.回復期間では,対照群との間に統計学的な有意差は認められなかった.
詳細な症状観察において,雄では,200 mg/kg群で投与37日のケージ内姿勢の観察時に観察者に注目して立ったり座ったりする動物の発現数が対照群と比べ統計学的に有意な高値を示した.オープンフィールド内の観察で,つかまり立ちの回数が20 mg/kg群の雄で投与2および37日,200 mg/kg群の雄で群分け前に有意な高値,支えなしでの立ち上がり回数が,200 mg/kg群の雌で哺育4日に有意な低値を示した.排尿数は,20 mg/kg群の雄で投与23日,200 mg/kg群の雄で投与43日に有意な低値,脱糞数は,60 mg/kg群の雄で投与16日に有意な高値を示した.サテライト群では,200 mg/kg群の雌で,オープンフィールドでの観察において,つかまり立ちの回数が投与37日,支えなしでの立ち上がり回数が投与2および9日に,いずれも有意な低値を示した.これら詳細な症状観察において有意な変化が認められた項目は,いずれも発現日がばらついており,また,毒性試験群とサテライト群で共通していないため,被験物質投与との関連はないと判断された.
種々の刺激に対する運動感覚反応の観察では,サテライト群を含め雌雄ともに被験物質投与の影響と考えられる反応の変化は認められなかった.
サテライト群を含め雌雄のいずれにおいても,対照群と被験物質投与各群との間で前肢および後肢の握力に差は認められなかった.
雄の投与期間終了時では,対照群と比べ60 mg/kg群で測定開始後50-60分の自発運動量が統計学的に有意な高値を示した.サテライト群では,対照群と比べ200 mg/kg群で投与期間終了時の測定開始後30-40分および回復期間終了時の測定開始後20-30分の自発運動量が有意な低値を示した.
雌では,哺育4日の測定では対照群と被験物質投与群との間に統計学的な有意差は認められなかった.サテライト群では,対照群と比べ200 mg/kg群で投与期間終了時の測定開始後10-20分および30-40分の自発運動量が有意な低値,回復期間終了時の測定開始後50-60分の自発運動量が有意な高値を示した.
これらの雌雄で認められた有意な変化については,毒性試験群とサテライト群で共通して認められず,また,いずれも継続性がないことから,被験物質投与に関連のない偶発的な変化と判断された.
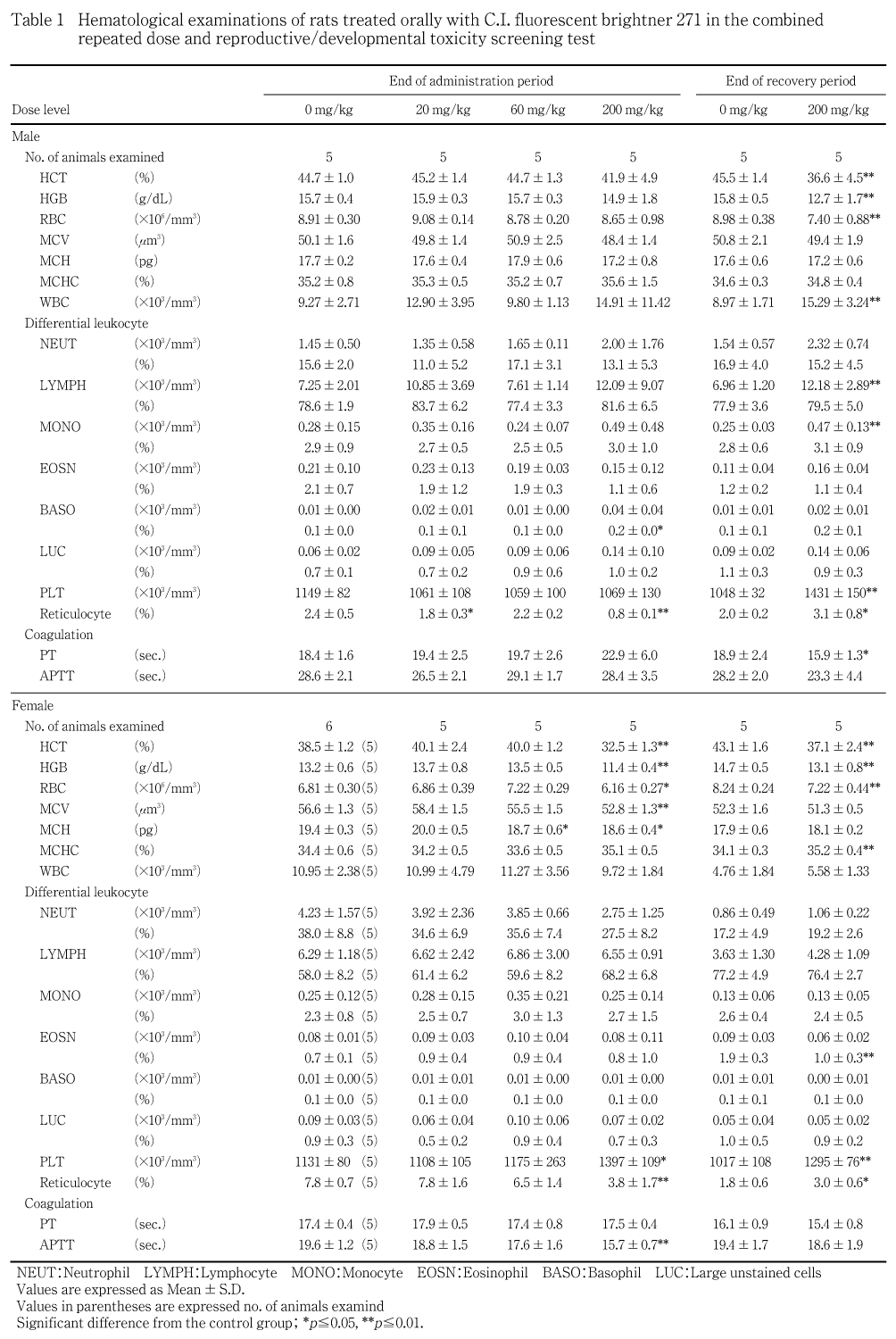
雄では,投与期間終了時で,対照群と比べ200 mg/kg群で網赤血球率が統計学的に有意な低値を示した.その他,20 mg/kg群においても網赤血球率が有意な低値を示したが,用量に対応しない変化であった.また,200 mg/kg群で好塩基球比率が有意な高値を示したが,好塩基球数に変化が認められないため,被験物質投与の影響とは判断しなかった.回復期間終了時では,サテライト群の200 mg/kg群でヘマトクリット値,ヘモグロビン量および赤血球数が統計学的に有意な低値,白血球数,リンパ球数,血小板数および網赤血球率が統計学的に有意な高値を示した.また,200 mg/kg群で単球数が有意な高値を示したが,軽微な変化であり,被験物質投与の影響とは判断しなかった.
哺育5日の雌では,対照群と比べ200 mg/kg群でヘマトクリット値,ヘモグロビン量,赤血球数,平均赤血球容積,平均赤血球血色素量および網赤血球率が統計学的に有意な低値,血小板数が有意な高値を示した.60 mg/kg群では平均赤血球血色素量が有意な低値を示した.回復期間終了時では,サテライト群の200 mg/kg群でヘマトクリット値,ヘモグロビン量および赤血球数が有意な低値,平均赤血球血色素濃度,血小板数および網赤血球率が有意な高値を示した.また,200 mg/kg群で好酸球比率が有意な低値を示したが,好酸球数に変化は認められなかったことから,被験物質投与の影響とは判断しなかった.
雄では,投与期間終了時で,対照群と比べ200 mg/kg群でプロトロンビン時間が延長傾向を示した.回復期間終了時では,サテライト群の200 mg/kg群でプロトロンビン時間が統計学的に有意な短縮を示した.
哺育5日の雌では,対照群と比べ200 mg/kg群で活性化部分トロンボプラスチン時間が有意な短縮を示した.回復期間終了時では,いずれの検査項目にもサテライト群の対照群と200 mg/kg群の間に差は認められなかった.
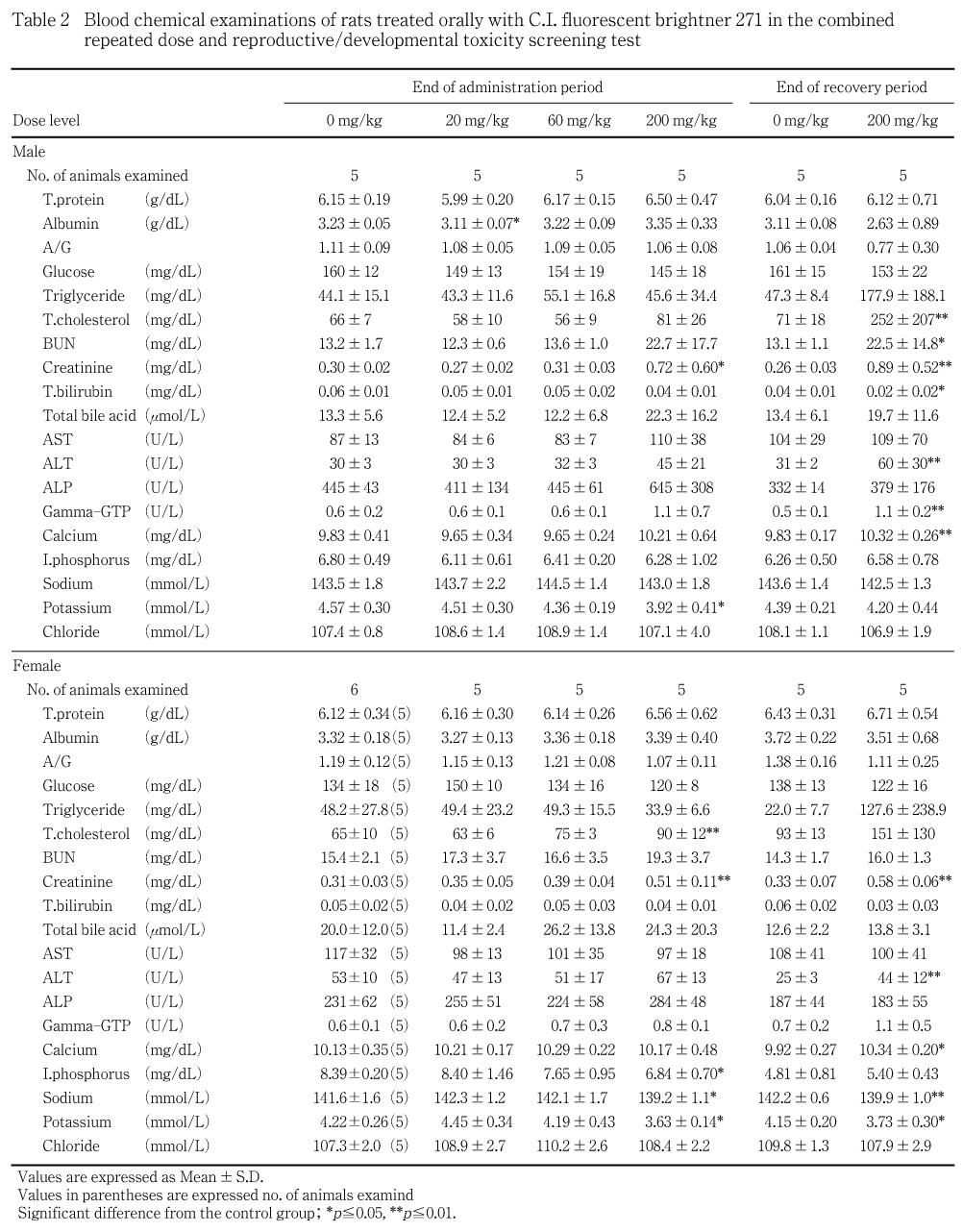
雄では,投与期間終了時で,対照群と比べ200 mg/kg群でクレアチニンが統計学的に有意な高値,アスパラギン酸アミノトランスフェラーゼおよびアラニンアミノトランスフェラーゼが高値傾向,カリウムが有意な低値を示した.また,200 mg/kg群で総コレステロール,尿素窒素およびアルカリフォスファターゼが高値傾向を示したが,いずれも1例の測定値が著しく大きいことに起因していると考えられ,被験物質投与の影響とは考えなかった.その他,20 mg/kg群でアルブミンが統計学的に有意な低値を示したが,用量に対応しない変化であり,被験物質投与の影響とは考えなかった.回復期間終了時では,サテライト群の200 mg/kg群で総コレステロール,尿素窒素,クレアチニン,アラニンアミノトランスフェラーゼ,γ-グルタミルトランスペプチダーゼおよびカルシウムが有意な高値を示した.また,200 mg/kg群で総ビリルビンが有意な低値を示したが,軽微な変化であり,被験物質投与の影響とは判断しなかった.
哺育5日の雌では,対照群と比べ200 mg/kg群で総コレステロールおよびクレアチニンが統計学的に有意な高値,無機リン,ナトリウムおよびカリウムが有意な低値を示した.回復期間終了時では,サテライト群の200 mg/kg群でクレアチニン,アラニンアミノトランスフェラーゼおよびカルシウムが有意な高値,ナトリウムおよびカリウムが有意な低値を示した.
対照群と比べ雄の200 mg/kg群で尿量,ナトリウム濃度および総排泄量,塩素総排泄量が統計学的に有意な高値または高値傾向を示した.さらに,雄の200 mg/kg群では試験紙検査において尿糖および蛋白が検出された.その他,雄の20 mg/kg群でカリウム総排泄量が有意な低値を示したが,用量に対応しない変化であり,被験物質投与の影響とは考えなかった.
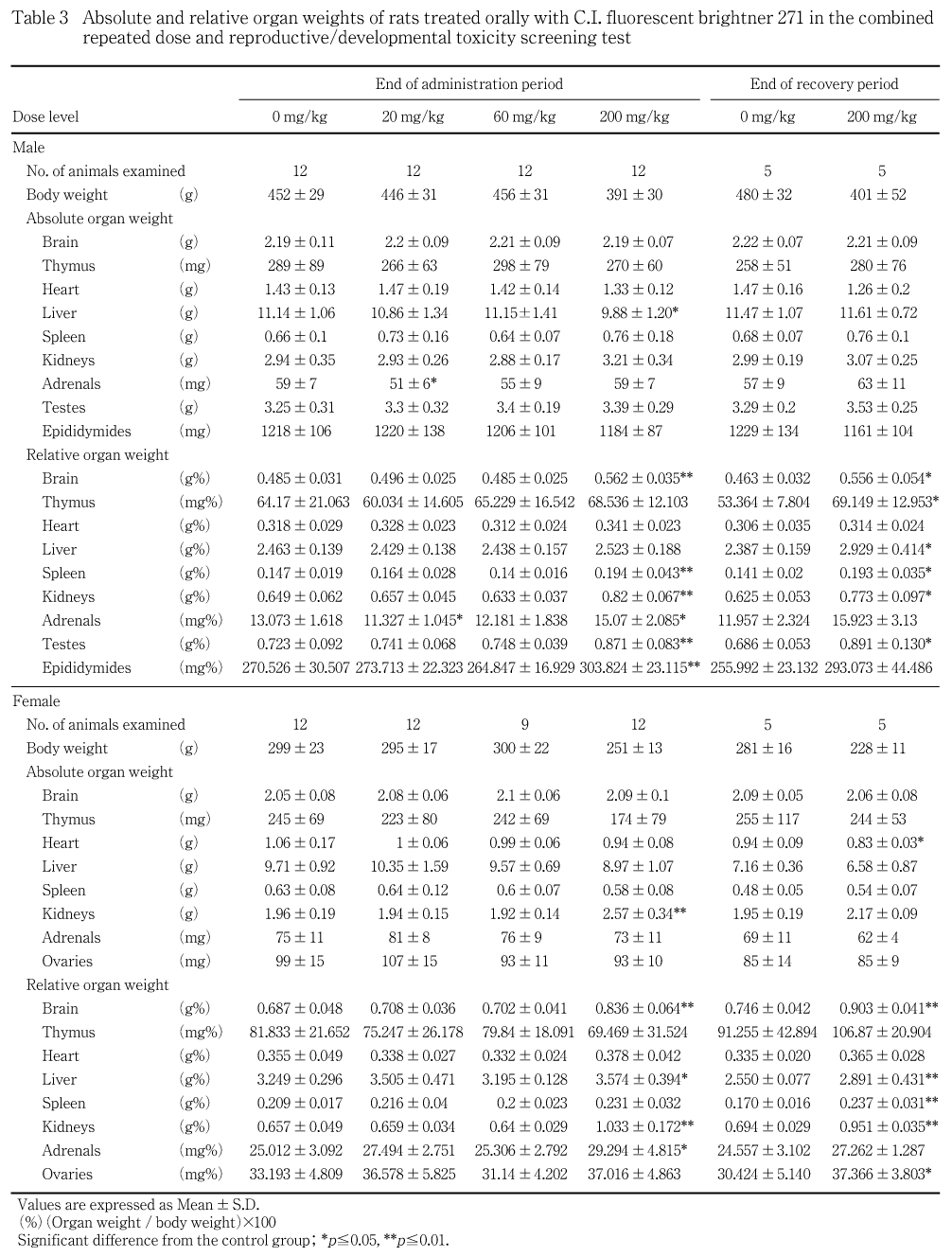
雄では,投与期間終了時で,対照群と比べ200 mg/kg群で腎臓の実重量が高値傾向,相対重量が統計学的に有意な高値を示した.また,20 mg/kg群で副腎の実重量および相対重量が統計学的に有意な低値を示したが,用量に関連しない変化であった.その他,200 mg/kg群では肝臓の実重量が有意な低値,脳,脾臓,副腎,精巣および精巣上体の相対重量が有意な高値を示したが,いずれも剖検日の低体重に起因する変化であり,被験物質投与の影響とは判断しなかった.回復期間終了時では,対照群と比べ200 mg/kg群で,脳,胸腺,肝臓,脾臓,腎臓および精巣の相対重量が有意な高値を示したが,いずれも剖検日の低体重に起因した変化と判断した.
哺育5日の雌では,対照群と比べ200 mg/kg群で腎臓の実重量および相対重量が有意な高値を示した.その他,200 mg/kg群で脳,肝臓および副腎の相対重量が有意な高値を示したが,いずれも剖検日の低体重に起因する変化であり,被験物質投与の影響とは判断しなかった.回復期間終了時では,対照群と比べ200 mg/kg群で,心臓の実重量が有意な低値,脳,肝臓,脾臓,腎臓および卵巣の相対重量が有意な高値を示したが,いずれも剖検日の低体重に起因した変化と判断した.
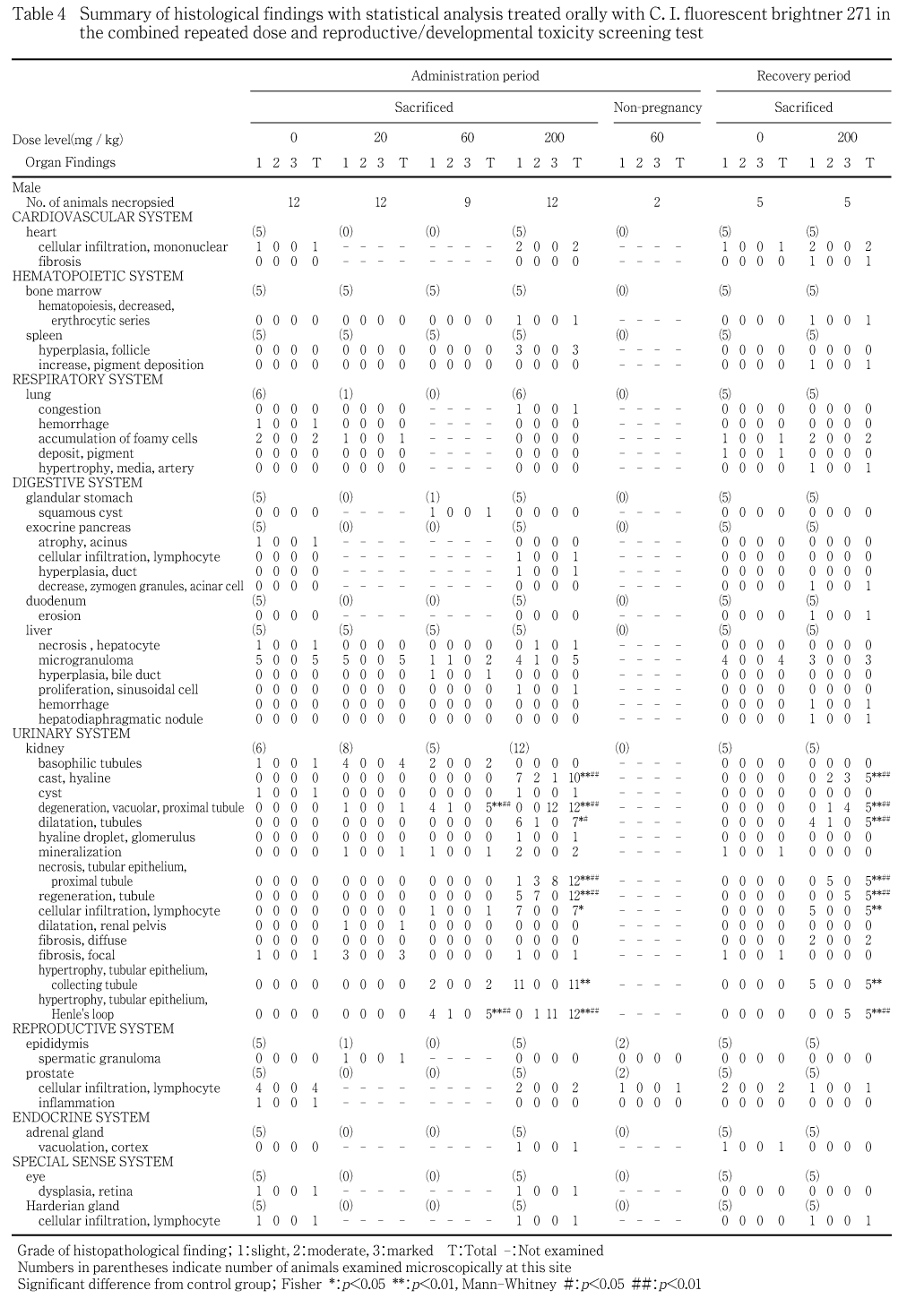
投与期間終了時の雄および哺育5日の雌では,主な変化として腎臓の肥大が200 mg/kg群の雄6例および雌8例に,淡色化が60 mg/kg群の雌雄で各1例,200 mg/kg群の雄12例(全例)および雌11例に観察され,いずれの所見も200 mg/kg群の雌雄で対照群と比べ統計学的に有意な発現数の高値を示した.さらに200 mg/kg群の雄では,腎臓の結節および脾臓の肥大が同一の1例に観察された.雌では,胸腺の萎縮が20および200 mg/kg群で各1例に観察された.
60 mg/kg群で認められた交尾しなかった雌雄各1例,妊娠させなかった雄2例および妊娠不成立の雌2例では,異常所見は認められなかった.
回復期間終了時の雌雄では,腎臓の淡色化が200 mg/kg群の雄5例および雌4例に観察され,有意な発現数の高値が認められた.さらに200 mg/kg群の雄では,腎臓の肥大および肝臓の赤色斑点がそれぞれ1例に観察された.
その他,投与期間終了時および回復期間終了時剖検で観察された所見は,いずれも単発あるいは散発性変化であるか,対照群にも認められる所見であり,自然発生性の変化と考えた.
妊娠を成立させた雄および哺育5日の雌では,腎臓において近位尿細管上皮の空胞変性が20,60および200 mg/kg群の雄でそれぞれ1,5および12例,雌でそれぞれ2,6および12例に観察され,60 mg/kg以上の投与群で,対照群と比べ統計学的に有意な発現数の高値を示し,所見の程度が有意に増強した.加えて,近位尿細管上皮壊死および尿細管再生が200 mg/kg群の雌雄で12例全例に観察され,有意な発現数の高値および程度の増強が認められた.尿細管再生の一部では時おり核の大きさあるいはクロマチン量が不均一である等,奇怪な核形態と好塩基性に富む細胞質を有する再生上皮が観察され,後述する回復期間終了時では同様の細胞学的特徴を有する再生上皮細胞がより優勢に観察された.さらに腎臓では,ヘンレ係蹄尿細管上皮肥大が60および200 mg/kg群の雄で5および12例,雌で6および12例に,乳頭部集合管上皮の好酸性化を伴う肥大が60および200 mg/kg群の雄で2および11例,雌で4および12例に,硝子円柱が200 mg/kg群の雄10例および雌7例に,尿細管拡張が200 mg/kg群の雄7例および雌8例に観察された.これらの所見は200 mg/kg群で有意な発現数の増加が認められ,60 mg/kg群でもいくつかの所見が有意な増加を示し,所見の程度についても有意に増強した.この他,リンパ球浸潤が60 mg/kg群の雄で1例,200 mg/kg群の雌雄で各7例に,糸球体への硝子滴沈着が200 mg/kg群の雄1例に,糸球体血管拡張が200 mg/kg群の雌1例にいずれも軽度の変化として観察された.また,鉱質沈着が20,60および200 mg/kg群の雌雄に観察されたが,いずれも軽度な変化であり回復期間終了時では対照群の雌雄にも同質の変化が観察された.尿細管の変化については,概ね10 %以下のネフロンに認められた場合を軽度,10〜40 %を中等度,40 %以上の場合を高度として評価した.肝臓では,肝細胞壊死が対照群および200 mg/kg群の雄で各1例に,類洞細胞増殖が200 mg/kg群の雌雄で各1例に,微小肉芽腫が対照群,20,60および200 mg/kg群の雄でそれぞれ5,5,2および5例,雌でそれぞれ1,1,2および4例に観察された.60および200 mg/kg群での少数例では,これらの所見の程度が増強していた.骨髄では,赤血球系造血の減少が200 mg/kg群の雄で1例に,顆粒球系造血の亢進が200 mg/kg群の雌で2例に観察された.骨髄の顆粒球系造血亢進を示した200 mg/kg群の雌の1例では,腺胃の筋層を越える高度の潰瘍が観察された.脾臓では,リンパ濾胞増生が200 mg/kg群の雄の3例に観察された.また,胸腺の皮質萎縮が20および200 mg/kg群の雌の各1例に観察されたが,用量に対応しない発生であり,無処置妊娠雌にしばしば観察される変化と同質の所見と考えられた.
交尾しなかった雌雄では,異常所見は観察されなかった.
妊娠を成立させなかった雄では,60 mg/kg群の1例に前立腺の軽度なリンパ球浸潤が観察された.妊娠不成立の雌では,60 mg/kg群の1例で卵巣の成熟卵胞減少が観察された.
回復性試験群では,腎臓において近位尿細管上皮の空胞変性,近位尿細管上皮壊死,尿細管再生,ヘンレ係蹄尿細管上皮肥大,乳頭部集合管上皮の好酸性化を伴う肥大,硝子円柱およびリンパ球浸潤が200 mg/kg群の雌雄でほぼ全例に観察され,有意な発現数の高値および程度の増強が認められた.さらに,200 mg/kg群では尿細管拡張が雄5例および雌1例,びまん性の間質線維化が雄2例に観察され,尿細管の拡張は雄で程度の増強が認められた.なお,近位尿細管上皮の空胞変性およびヘンレ係蹄尿細管上皮肥大は,投与期間終了時と所見の程度が同等で,回復期間終了時において程度の軽減はほとんど認められなかったが,近位尿細管上皮壊死には程度の軽減が認められた.一方,雌雄の尿細管再生および雄の硝子円柱には程度の増強が認められた.肝臓では,類洞細胞増殖が200 mg/kg群の雌1例に,微小肉芽腫が対照群および200 mg/kg群の雄で4および3例,雌で各5例に観察され,200 mg/kg群の雌の1例では程度の増強を伴っていた.また,十二指腸のびらんが200 mg/kg群の雄で1例に,上皮小体の増生が200 mg/kg群の雌で1例に観察された.
その他に観察された所見は,いずれも単発あるいは散発性の軽度な変化であるか,対照群にも認められる所見であり,被験物質投与との関連はないと判断された.
毒性試験群の精子形成サイクルの観察では,200 mg/kg群のセルトリ細胞数あたりの精粗細胞数,プレレプトテン期精母細胞数,パキテン期精母細胞数および精子細胞数はいずれも対照群と同程度であり,被験物質投与の影響は認められなかった.また,交尾しなかった雄および妊娠を成立させなかった雄においても各細胞比率は対照群と同程度であった.
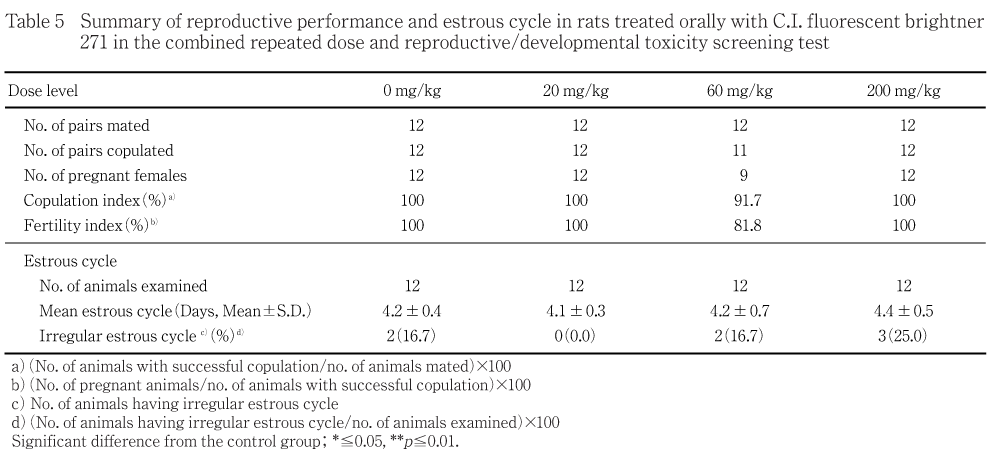
交尾は60 mg/kg群の1組で成立せず,交尾率は91.7 %であった.他の群ではいずれも全例交尾し,交尾率は100 %であった.受胎は60 mg/kg群で2例が成立せず,受胎率は81.8 %であった.他の群ではいずれも全例受胎し,受胎率は100 %であった.
性周期観察では,異常性周期を示す動物が対照群,60および200 mg/kg群でそれぞれ2,2および3例に認められたが,異常性周期発現率には差は認められなかった.なお,異常性周期が認められた60 mg/kg群の1例は偽妊娠の状態を示していた.また,平均性周期にも対照群と被験物質投与各群との間に差は認められなかった.
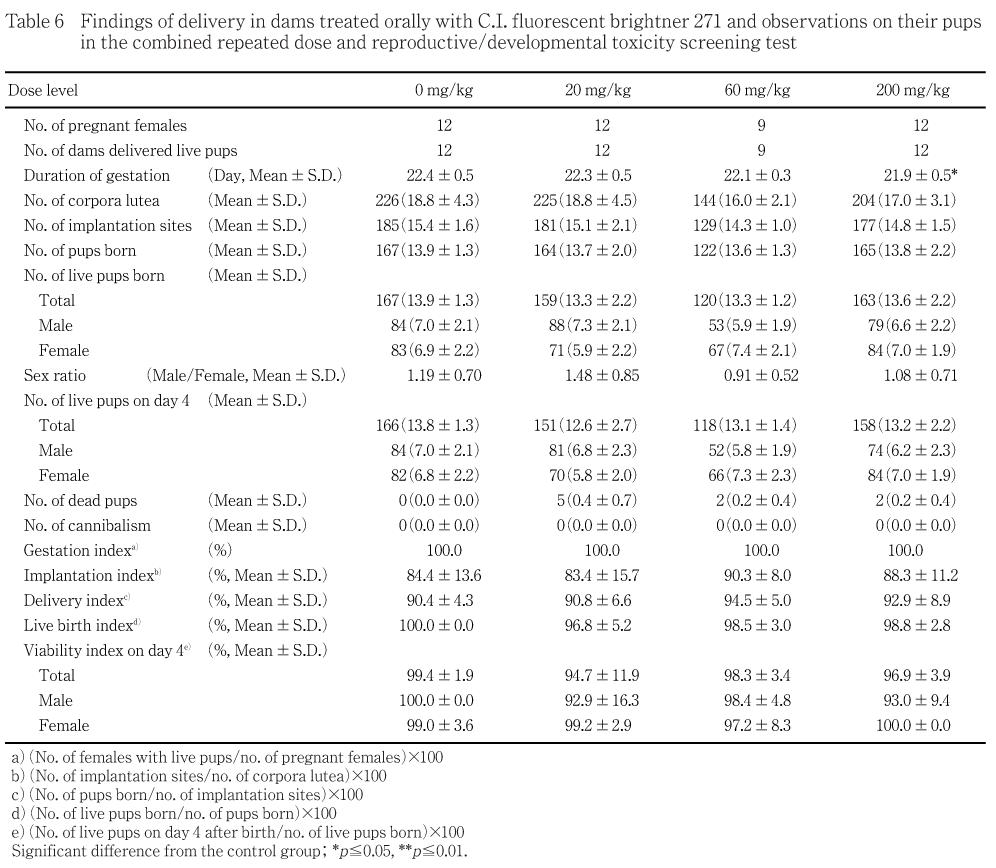
対照群を含むいずれの投与群でも分娩状態に異常は観察されなかった.200 mg/kg群の妊娠期間が21.9 ± 0.5日と対照群と比べ統計学的に有意な短縮を示したが,個体別には21〜23日の妊娠期間を示しており,ラットの一般的な妊娠期間の範囲であることから被験物質投与の影響とは考えなかった.各群の黄体数,着床痕数,出産児数,出産生児数および哺育4日の生存胎児数はほぼ同様な値を示し,出産率,着床率,分娩率,出生率,性比および生後4日生存率に群間差は認められなかった.哺育0日に死亡児が20,60および200 mg/kg群でそれぞれ5,2および2例に観察されたが,発生数に群間差は認められなかった.喰殺児はいずれの群にも観察されなかった.
新生児の外表検査では,200 mg/kg群で索状尾および鎖肛が雌の1例に観察されたが,他には外表異常が認められなかったことから,被験物質投与の影響とは判断しなかった.
体重変化では,対照群と比べ200 mg/kg群で,哺育0日の体重が雌雄とも統計学的に有意な低値を示した.
哺育期間中の死亡児の剖検では,20 mg/kg群の雌で胸腺頸部残留が1例,200 mg/kg群の雄で完全内臓逆位が1例に認められたが,死因との関連性はなかった.他の死亡児には異常所見は認められなかった.
哺育4日の剖検では,痂皮が対照群,20,60および200 mg/kg群の雄でそれぞれ5,4,0および10例,雌でそれぞれ5,3,0および7例に観察された.認められた痂皮の内,200 mg/kg群の雄1例が頭部の痂皮で,他は全て四肢の痂皮であり,四肢の痂皮は対照群,20および200 mg/kg群でいずれも1母体の出生児に認められたものであった.腎臓の腎盂拡張が対照群,20,60および200 mg/kg群の雄でそれぞれ5,2,7および2例,雌で2,3,2および1例に観察された.その他,雄では心臓の赤色斑点および腎臓の嚢胞,雌では肝臓の白色斑点が被験物質投与群で散見された.
被験物質投与に関連する一般状態の変化は認められなかった.機能観察総合検査においても,被験物質投与の影響と考えられる観察項目および測定項目の変化は認められなかった.
体重では,200 mg/kg群の雄では投与期間の後半から減少し,雌では妊娠・哺育期間に低値を示し,妊娠期間では体重増加抑制が認められた.サテライト群においても,200 mg/kg群の雌雄で,毒性試験群の雄と同様に投与期間の後半に被験物質投与による体重減少が認められたことから,200 mg/kg群での体重減少および増加抑制は被験物質投与の影響と考えられた.その後の回復期間の体重増加量は対照群と同程度であったことから,休薬による体重値の回復傾向が示唆された.
摂餌量では,200 mg/kg群の雄で投与期間の前半に高値を示したが,体重推移には反映しておらず,また,サテライト群では明らかではない変化であることから,被験物質投与の影響とは考えなかった.200 mg/kg群の雄で投与期間の後半に認められた摂餌量の低値および200 mg/kg群の雌で妊娠期間に認められた低値については,サテライト群においても200 mg/kg群の雌雄で同様に認められており,被験物質投与の影響と考えられた.サテライト群における回復期間の摂餌量は対照群と200 mg/kg群で同程度であることから,休薬による回復と判断された.
血液学検査において,雄では投与期間終了時に200 mg/kg群で網赤血球率が低値を,回復期間終了時では,200 mg/kg群でヘマトクリット値,ヘモグロビン量および赤血球数が低値,網赤血球率が高値を示した.一方,雌では200 mg/kg群で投与期間終了時にヘマトクリット値,ヘモグロビン量,赤血球数,平均赤血球容積,平均赤血球血色素量および網赤血球率が低値,回復期間終了時ではヘマトクリット値,ヘモグロビン量および赤血球数が低値,平均赤血球血色素濃度および網赤血球率が高値を示した.これらのことから,被験物質投与により,造血抑制に伴う貧血が特に雌に強く発現し,14日間の休薬によっても完全な回復は認められないものの網赤血球比率が増加していることから,休薬により造血機能が回復しつつあると推察された.また,60 mg/kg群で平均赤血球血色素量が低値を示したが,ヘマトクリット値,ヘモグロビン量および赤血球数に変化はなく,被験物質投与による貧血傾向とは判断しなかった.
血液凝固能検査において,200 mg/kg群の雄では投与期間終了時にプロトロンビン時間が延長し,被験物質投与との関連性は不明であるが,回復期間終了時では短縮したことから,回復性を有する変化と考えられた.一方,200 mg/kg群の雌では投与期間終了時に活性化部分トロンボプラスチン時間が短縮したが,短縮方向への変化は毒性学的意義が低く,回復期間終了時では対照群と同程度であったことから,被験物質投与の影響はないと判断された.
病理学検査において,雌雄で腎臓に対する影響が顕著に認められた.剖検所見では60 mg/kg以上の投与群で腎臓の淡色化,200 mg/kg群で肥大が投与・回復期間終了時ともに観察され,200 mg/kg群では投与終了時に腎臓重量が高値を示した.組織学検査では,近位尿細管上皮の空胞変性が全ての被験物質投与群において観察され,用量の増加に対応した発生数の増加および程度の増強を伴っていることから,被験物質投与による腎臓に対する直接的な毒性影響と考えられた.200 mg/kg群では,近位尿細管の空胞変性の進行に伴って近位尿細管上皮の壊死が認められた.他にも,近位尿細管の空胞変性・壊死に付随した変化として,尿細管再生,ヘンレ係蹄尿細管上皮あるいは乳頭部集合管上皮の肥大,硝子円柱,尿細管拡張,糸球体への硝子滴沈着,糸球体血管拡張,リンパ球浸潤あるいは線維化が認められた.再生性尿細管の一部では時おり核の大きさあるいはクロマチン量が不均一である等,奇怪な核形態と好塩基性に富む細胞質を有する再生上皮細胞が観察されたが,腫瘍性変化への進展を示唆する所見は認められなかった.血液生化学検査では,投与期間終了時の200 mg/kg群の雄で,クレアチニンが高値,カリウムが低値,雌では総コレステロールおよびクレアチニンが高値,無機リン,ナトリウムおよびカリウムが低値を示した.回復期間終了時では,200 mg/kg群の雄で総コレステロール,尿素窒素,クレアチニンおよびカルシウムが高値,雌でクレアチニンおよびカルシウムが高値,ナトリウムおよびカリウムが低値を示した.さらに,200 mg/kg群の雄では,投与期間終了時の尿検査において,尿量,ナトリウム濃度および総排泄量,塩素総排泄量の高値,尿糖および蛋白の陽性が認められた.これらはいずれも腎臓での変化を反映した所見と考えられた.腎臓の組織障害所見の多くは,回復期間終了時にも依然として高度の変化を示しており,血液生化学検査結果も,投与期間終了時より強い変化を示したが,腎臓の皮質領域では再生性尿細管が優勢となり,回復傾向にあることが認められた.なお,前述の血液学検査において認められた貧血傾向および組織学的な骨髄の赤血球系造血減少および回復期間終了時に認められた白血球数,リンパ球数および血小板数の増加は,いずれも腎尿細管障害に伴う二次的変化と推察された.
肝臓では,投与期間終了時に200 mg/kg群で肝細胞壊死あるいは微小肉芽腫の程度の増強,主にクッパー細胞と考えられる類洞細胞増殖が観察された.血液生化学検査においても,雄の200 mg/kg群でアスパラギン酸アミノトランスフェラーゼおよびアラニンアミノトランスフェラーゼが高値傾向を示し,肝細胞への障害性変化あるいは修復機転と考えられた.しかしながら,少数例のみに認められた変化であり,血液生化学検査値との明らかな連動を示さない変化であることから,明らかな被験物質投与の影響とは断定できなかった.また,回復期間終了時では,200 mg/kg群の雌雄でアラニンアミノトランスフェラーゼ,雄でg-グルタミルトランスペプチダーゼが上昇したが,その上昇の程度は小さく,病理組織学検査においても肝臓に毒性所見が認められなかったことから,毒性学的意義は乏しいと判断された.
なお,骨髄の顆粒球系造血亢進および脾臓の濾胞増生は,いずれも腎障害に対する反応性変化と推察されたが,このうちの顆粒球系造血亢進を示した1例では腺胃の潰瘍との関連も示唆された.
交尾しなかった雌雄各1例では,交尾が成立しなかった原因を推定しうる所見は観察されなかった.
妊娠を成立させなかった雄2例には妊娠不成立の原因は認められなかったが,相手雌2例の内1例では卵巣の成熟卵胞減少が認められ,妊娠不成立の原因に関連した変化と考えられた.
以上のことから,当該試験条件下において,C.I. フルオレセントブライトナー271は20 mg/kg/day以上の反復投与により腎臓に対する影響が認められたことから,その無毒性量は雌雄ともに確認できず,20 mg/kg/day未満と判断された.
平均性周期に被験物質投与の影響は認められなかった.交尾能および受胎能については,60 mg/kg群で1組が交尾せず,交尾した雌の内2例が妊娠不成立であった.病理組織学検査で,妊娠不成立と判定された雌2例中1例に卵巣の成熟卵細胞の減少が認められ,この変化が妊娠不成立の原因と推察された.しかし,交尾しなかった1組および妊娠不成立の他の1例では,病理検査においても原因と考えられる所見は認められず,200 mg/kg群を含め他の群では全例交尾および受胎していることから,60 mg/kg群の妊娠不成立雌1例に観察された卵巣の所見も偶発的と考えられ,交尾能および受胎能に被験物質投与との関連性はないと判断された.
分娩時観察では,分娩状態の異常はいずれの投与群でも認められなかった.新生児の外表検査および哺育4日の剖検では,被験物質投与に関連した異常は認められなかった.
出生児の体重変化については,200 mg/kg群で出生児の哺育0日の体重が雌雄とも低値を示した.しかし,哺育4日の体重値には差は認められなかった.
その他,妊娠期間,妊娠黄体数および着床数には被験物質投与の影響は認められず,出産児数,出産生児数,性比および出産率にも影響は認められなかった.
以上のことから,C.I. フルオレセントブライトナー271の親動物の生殖能に及ぼす影響は,雌雄親動物には200 mg/kg/day投与でも認められず,無毒性量は200 mg/kg/dayと判断された.児動物の発生・発育に及ぼす影響は200 mg/kg/dayで哺育0日に低体重が認められ,無毒性量は60 mg/kg/dayと判断された
| 1) | 高橋道人(編):「精巣毒性評価のための精細管アトラス」ソフトサイエンス,東京(1994)pp.15-20. |
| 2) | Snedecor GW, Cochran WG: "Statistical Methods", 8th ed., Iowa State University Press, Ames (1989) pp.251-252. |
| 3) | Yoshida M: Exact probabilities associated with Tukey's and Dunnett's multiple comparisons procedures in imbalanced one- way ANOVA. Japanese Soc Comp Stat, 1: 111-122(1988). |
| 4) | Steel RGD: A multiple comparison rank sum test: Treatments versus control. Biometrics, 15: 560-572 (1959). |
| 5) | Hollander M, Wolfe DA: Nonparametric Statistical Methods, Second edition, John Wiley & Sons, New York(1999)pp.124-129. |
| 連絡先 | |||
| 試験責任者: | 伊藤圭一 | ||
| 試験担当者: | 木戸亮子,田中 翔,川口友和, 稲垣成憲,芝田真希,木原 亨 | ||
| (財)食品農医薬品安全性評価センター | |||
| 〒437-1213 静岡県磐田市塩新田582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | |||
| Authors: | Keiichi Itoh(Study director) Ryoko Kido, Sho Tanaka, Tomokazu Kawaguchi, Shigenori Inagaki, Maki Shibata, Tohru Kihara |
||
| Biosafety Research Center, Foods, Drugs and Pesticides(An-Pyo Center) | |||
| 582-2 Shioshinden, Iwata-shi, Shizuoka, 437-1213, Japan | |||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | ||