塩基性炭酸ニッケル(II) 四水和物の培養細胞に及ぼす細胞遺伝学的影響について,チャイニーズ・ハムスター培養細胞(CHL/IU)を用いて染色体異常試験を実施した.
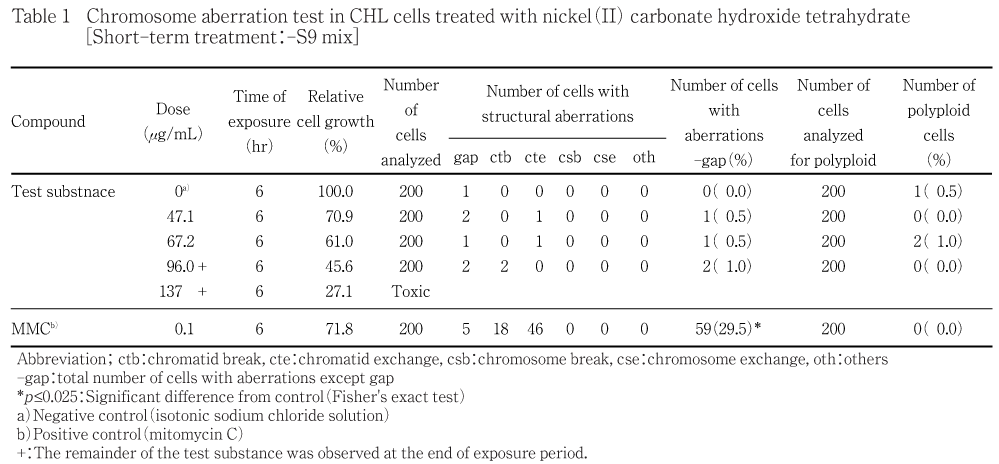
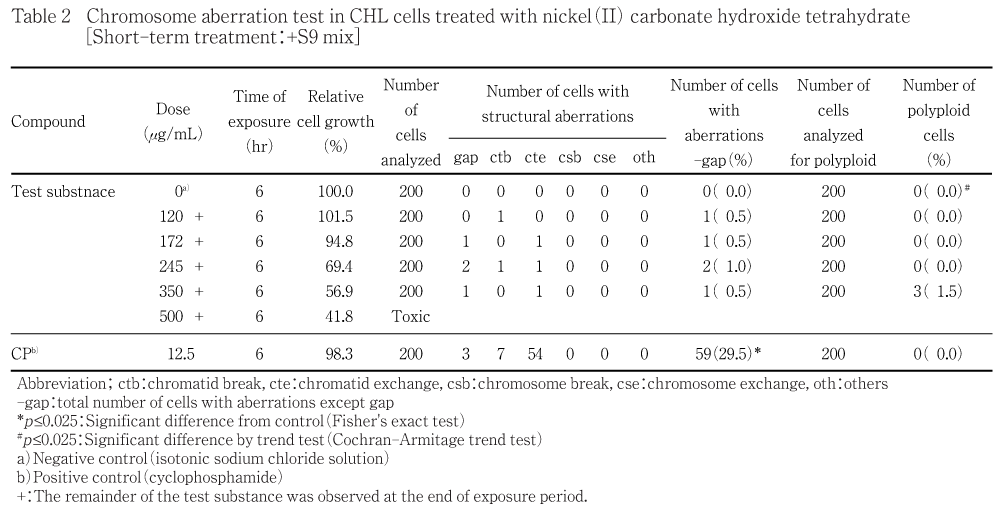
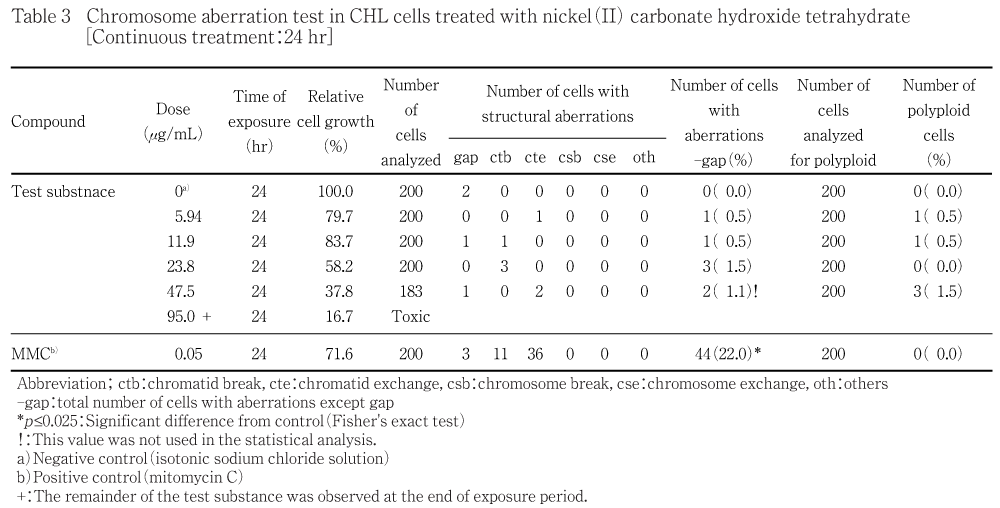
細胞増殖抑制試験結果をもとに,短時間処理法S9 mix非存在下では400 μg/mLを最高処理濃度とした47.1〜400 μg/mLの濃度範囲で7用量,S9 mix存在下では3040 μg/mLを最高処理濃度とした95.0〜3040 μg/mLの濃度範囲で6用量,連続処理法では190 μg/mLを最高処理濃度とした5.94〜190 μg/mLの濃度範囲で6用量を設定した.しかしながら短時間処理法S9 mix存在下では評価対象群が3用量得られなかったことから追加試験を実施し,500 μg/mLを最高処理濃度とした84.0〜500 μg/mLの濃度範囲で6用量を設定した.短時間処理法においてはS9 mix非存在下および存在下で6時間処理(18時間の回復時間)後,連続処理法においてはS9 mix非存在下で24時間連続処理後,標本を作製し,検鏡することにより染色体異常誘発性を検討した.短時間処理法S9 mix非存在下では47.1,67.2,96.0 μg/mLの3用量(公比10/7),S9 mix存在下では120,172,245,350 μg/mLの4用量(公比10/7),連続処理法では5.94,11.9,23.8,47.5 μg/mLの4用量(公比2)について顕微鏡観察を実施した.
その結果,いずれの処理群においても,染色体異常(構造異常ならびに数的異常)の誘発作用は認められなかった.倍数性細胞については,短時間処理法S9 mix存在下においてCochran Armitageの傾向検定で有意差が認められたが,最大の出現頻度でも1.5 %と低く,生物学的に有意な増加ではないと判断した.
以上の結果より,本試験条件下では塩基性炭酸ニッケル(II) 四水和物は,染色体異常を誘発しない(陰性)と結論した.
哺乳類培養細胞を用いる染色体異常試験に広く使用されていることから,試験細胞株としてチャイニーズ・ハムスターの肺由来の線維芽細胞株(CHL/IU)を選択した.昭和59年11月15日に国立衛生試験所(現:国立医薬品食品衛生研究所)から分与を受け,ジメチルスルホキシド(DMSO,Merck)を10 vol%添加した後,液体窒素中に保存した.試験に際しては凍結細胞を融解し3〜5日ごとに継代したものを使用した.なお,細胞増殖抑制試験では継代数27,染色体異常試験では継代数2,染色体異常試験(追加試験)では継代数7の細胞を用いた.
Eagle-MEM液体培地(旭テクノグラス)に,非働化(56℃,30分)済み仔牛血清(Invitrogen)を最終濃度で10 vol%になるよう加えた後,試験に使用した.調製後の培養液は冷暗所(4℃)に保存した.
CO2インキュベーター(三洋電機バイオメディカ)を用い,CO2濃度5 %,37℃の条件で細胞を培養した.
製造後6ヵ月以内のキッコーマン製S9 mixを試験に使用した.S9 mix中のS9は誘導剤としてフェノバルビタールおよび5,6-ベンゾフラボンを投与したSprague- Dawley系雄ラットの肝臓から調製した.また,S9 mixの組成は松岡らの方法1)に従った.S9 mixの組成を以下に示す.
| 成分 | S9 mix 1 mL中の量 | |
| S9 | 0.3 mL | |
| MgCl2 |
5 μmol/0.1 mL |
|
| KCl | 33 μmol/0.1 mL | |
| G-6-P |
5 μmol/0.1 mL |
|
| NADP | 4 μmol/0.1 mL | |
| HEPES緩衝液(pH 7.2) |
4 μmol/0.2 mL |
|
| 蒸留水 | 0.1 mL |
被験物質の塩基性炭酸ニッケル(II) 四水和物(ロット番号:PKN2539)は純度94.7 %のうすい緑の粉末である.本剤は水,DMSOに不溶,酸に可溶である.和光純薬工業(大阪)から提供された被験物質を使用した.被験物質は,使用時まで室温,密閉で保管した.なお,他の試験機関(食品薬品安全センター秦野研究所)にて保管されていた同一ロットの被験物質について実施した品質分析の結果(平成17年1月15日付報告),安定性に関して問題はなかった.
試験の都度,生理食塩液(大塚製薬工場)で被験物質を懸濁し,調製原液とした.調製原液を使用溶媒を用いて順次所定濃度に希釈した後,速やかに処理を行った.
12ウエルの細胞培養用マルチプレートに細胞を播種し,培養3日後に被験物質液を処理した.短時間処理法ではS9 mix非存在下(-S9処理)あるいは存在下(+S9処理)で6時間処理した後,新鮮な培養液に交換してさらに18時間培養を続けた.連続処理法の場合,24時間連続して処理を実施した.
細胞を10 vol%中性緩衝ホルマリン液(和光純薬工業)で固定した後,0.1 w/v%クリスタル・バイオレット(関東化学)水溶液で10分間染色した.色素溶出液(30 vol%エタノール,1 vol%酢酸水溶液)を適量加え,5分間程度放置して色素を溶出した後,分光光度計(105-50型,日立製作所)を用いて580 nmでの吸光度を測定した.各用量群について溶媒対照群での吸光度に対する比,すなわち相対細胞増殖率を算出し,さらにプロビット法を用いて50 %細胞増殖抑制濃度を算出した.
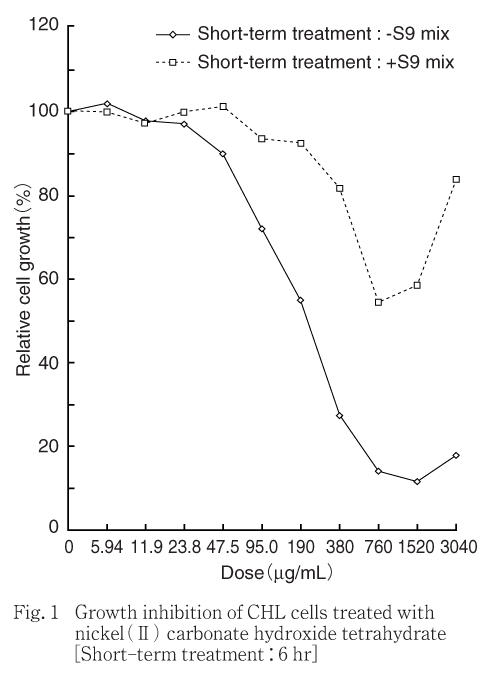
その結果,細胞増殖を50 %抑制する濃度は,短時間処理法-S9処理で215 μg/mL,同+S9処理では1495 μg/mL,連続処理法24時間処理では114 μg/mLであった.ただし,高用量群においては,培養終了後に残存していた被験物質の懸濁物が染色されたため,吸光度が増加し,結果として細胞生存率が高く算出された.本事象は特に+S9処理で顕著に認められた(Fig. 1〜2).
被験物質処理開始および終了時,いずれの処理においても95.0 μg/mL以上の用量でうすい緑色の被験物質の懸濁物が認められた.

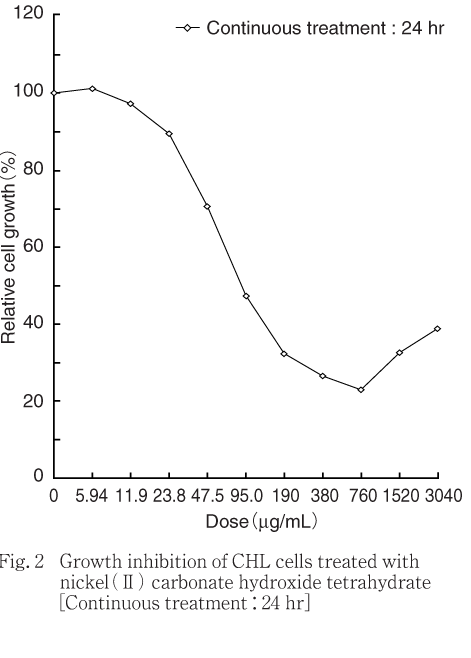
細胞増殖抑制試験結果をもとに,染色体異常試験では,短時間処理法-S9処理および連続処理法24時間処理では細胞の増殖を50 %以上抑制すると予想される用量を最高処理濃度とした.すなわち,短時間処理法-S9処理では400 μg/mLを最高処理濃度とし,公比10/7で減じた7用量,連続処理法24時間処理では190 μg/mLを最高処理濃度とし,公比2で減じた6用量ならびに溶媒対照群を設定した.短時間処理法+S9処理では被験物質懸濁物の影響により,正確な細胞増殖抑制作用が確認できなかったため,無水物10 mM相当の3040 μg/mLを最高処理濃度とし,公比2で減じた6用量ならびに溶媒対照群を設定した.しかし,細胞毒性作用の評価対照群が3用量得られなかったことから,追加試験を実施し,500 μg/mLを最高処理濃度とし,公比10/7で減じた7用量および溶媒対照群を設定し,そのうち6用量について処理した.
なお,陽性対照として,短時間処理の場合,-S9処理でマイトマイシンC(MMC,協和醗酵工業)を0.1 μg/mL,+S9処理でシクロホスファミド(CP,塩野義製薬)を12.5 μg/mLの用量で,連続処理の場合MMCを0.05 μg/mLの用量で試験した.
直径60 mmのプレートを用い,細胞増殖抑制試験と同様に被験物質等の処理を行った.培養終了2時間前に,最終濃度で0.2 μg/mLとなるようコルセミド(Invitrogen)を添加した.トリプシン処理で細胞を剥離させ,遠心分離により細胞を回収した.75 mmol/L塩化カリウム水溶液で低張処理を行った後,固定液(メタノール3容:酢酸1容)で細胞を固定した.空気乾燥法で染色体標本を作製した後,1.2 vol%ギムザ染色液で12分間染色した.
各プレートあたり100個,すなわち用量当たり200個の分裂中期像を顕微鏡下で観察し,染色体の形態的変化としてギャップ(gap),染色分体切断(ctb),染色体切断(csb),染色分体交換(cte),染色体交換(cse)およびその他(oth)の構造異常に分類した.同時に,倍数性細胞の出現率を記録した.染色体の分析は日本環境変異原学会・哺乳動物試験分科会による分類法2)に従って実施した.
短時間処理法-S9処理および連続処理法24時間処理の標本ならびに短時間処理法+S9処理の追加試験における標本をコード化し,染色体分析を実施した.
ギャップを含めない場合(-gap)について染色体構造異常の出現頻度を表示した.
各試験群の構造異常を有する細胞あるいは倍数性細胞の出現頻度を,Fisherの直接確率計算法(有意水準片側2.5 %)を用いて検定した.また用量依存性については,Cochran Armitageの傾向検定(有意水準片側2.5 %)を用いて検定した.溶媒対照群と比較し被験物質処理群において有意差が認められ,かつ,再現性あるいは用量に依存性が認められた場合に陽性と判定した.ただし,最終的な判定は試験条件下での生物的な妥当性も考慮して行った.
染色体標本作製時に各プレートの低張処理した細胞液を一定量採取し,ATP測定用試薬キット(ルシフェール250,キッコーマン)およびATPフォトメーター(ルミテスター C-100LU,キッコーマン)を用いて相対発光量(Relative Light Unit:RLU)を求めATP含量を測定した.溶媒対照群におけるRLUに対する比(=相対細胞増殖率)を各用量群について求め,細胞増殖抑制度とした.
短時間処理法での試験結果をTable 1〜2に,連続処理法24時間処理の試験結果をTable 3に示した.塩基性炭酸ニッケル(II) 四水和物処理群の場合,染色体構造異常出現頻度は,短時間処理法-S9処理では47.1 μg/mLで0.5 %,67.2 μg/mLで0.5 %,96.0 μg/mLで1.0 %,+S9処理では120 μg/mLで0.5 %,172 μg/mLで0.5 %,245 μg/mLで1.0 %,350 μg/mLで0.5 %,連続処理法24時間処理では5.94 μg/mLで0.5 %,11.9 μg/mLで0.5 %,23.8 μg/mLで1.5 %,47.5 μg/mLで1.1 %を示し,溶媒対照群と同等であった.ただし,連続処理法24時間処理の47.5 μg/mLにおいては,観察細胞が規定数の200個に満たなかったため,統計検定から除外した.倍数性細胞の出現頻度は,短時間処理法+S9処理で有意差が認められたが,出現頻度は最大でも1.5 %と低い値であった.また,いずれの処理法においても試験用量に依存した相対細胞増殖率の減少が観察され,短時間処理法-S9処理では染色体異常評価群中の高用量である96.0 μg/mLでの相対細胞増殖率は45.6 %であった.+S9処理では350 μg/mLで56.9 %,500 μg/mLで41.8 %,連続処理法24時間処理では47.5 μg/mLで37.8 %であった.一方,S9 mix非存在下における陽性対照物質MMCで処理した細胞,およびS9 mix存在下における陽性対照物質CPで処理した細胞では染色体構造異常の顕著な誘発が認められた.
被験物質処理開始および終了時,短時間処理法-S9処理の96.0 μg/mL以上の用量,+S9処理の120 μg/mL以上の用量,連続処理法24時間処理の95.0 μg/mL以上の用量でうすい緑色の被験物質懸濁物の残存が認められた.
以上の試験結果から,本試験条件下において塩基性炭酸ニッケル(II) 四水和物のチャイニーズ・ハムスター培養細胞に対する染色体異常誘発性に関し,陰性と判定した.
なお,本被験物質〔塩基性炭酸ニッケル(II) 四水和物〕について,RTECSでは,ハムスター卵巣に姉妹染色分体交換を誘発すると報告している3)が,発がん性の報告は現在までない.
また,IARCではニッケル化合物の発がん性をグループ1(ヒトに対して発がん性がある)としている3).類縁体であるスルファミン酸ニッケル,硫酸ニッケルおよび塩化ニッケルについては,細菌を用いた復帰突然変異試験で陰性4)と報告されている.
| 1) | Matsuoka A, Hayashi M, Ishidate M Jr: Chromosomal aberration tests on 29 chemicals combined with S9 mix in vitro. Mutation Res, 66: 277-290(1979). |
| 2) | 日本環境変異原学会・哺乳動物試験分科会(編):「化学物質による染色体異常アトラス」朝倉書店,東京(1988)pp. 31-35. |
| 3) | 「製品安全データシート(MSDS No. JW140103)」和光純薬工業,大阪(2002). |
| 4) | 労働安全衛生法有害性調査制度に基づく既存化学物質変異原性試験データ集,日本化学物質安全・情報センター,東京(1996)pp.142-147. |
| 連絡先 | |||
| 試験責任者: | 菊池正憲 | ||
| 試験担当者: | 嶋田佐和子,上田摩弥,田中 仁, 仲村渠奈美子,鈴木ゆみ子, 古屋有佳子,永井美穂,木下裕加, 鈴木雅也 | ||
| (財)食品農医薬品安全性評価センター | |||
| 〒437-1213 静岡県磐田市塩新田582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | |||
| Authors: | Masanori Kikuchi (Study director) Sawako Shimada, Maya Ueda, Jin Tanaka, Namiko Nakandakari, Yumiko Suzuki, Yukako Furuya, Miho Nagai, Yuka Kishita, Masaya Suzuki |
||
| Biosafety Research Center, Foods, Drugs and Pesticides (An-pyo Center) | |||
| 582-2 Shioshinden, Iwata-shi, Shizuoka, 437-1213, Japan | |||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | ||