塩基性炭酸ニッケル(II) 四水和物は,主としてメッキに用いられる化学物質である.今回,OECD既存化学物質安全性点検等に係る毒性調査の一環として,塩基性炭酸ニッケル(II)の雌雄動物に対する反復投与による影響とその回復性,親動物の生殖・発生および新生児の発育に及ぼす影響を検討するために,0(溶媒対照,0.5 % CMC Na水溶液),0.4,2.0および10 mg/kg(無水物換算)の塩基性炭酸ニッケル(II) 四水和物を雌雄のSprague- Dawley系ラット(各12匹/群)に反復経口投与した.投与2週間目に2週間を限度として交配させ,雄は交配期間終了2週間目に剖検した.雌は交配後,自然分娩させて母動物は哺育5日に,出生児は哺育4日に剖検した.また,0および10 mg/kg投与群の各雄5匹および雌のサテライト群(0および10 mg/kg)は42日間投与した後,14日間休薬させて剖検した.その結果を以下に要約した.
10 mg/kg投与群の雌の1例においては,40回投与後の妊娠23日の朝,出産中の死亡が発見され,剖検の結果,外陰部周囲の被毛の汚れ,脾臓ならびに胸腺の小型化が認められた.この動物では組織検査の結果,肺に水腫がみられ,肺胞内に限局性の泡沫細胞の集簇が観察されたほか,脾臓では白脾髄領域の減少,胸腺では萎縮が認められた.これらの病理組織所見はいずれも直接の死因とは考えられなかったものの,被験物質投与の影響を否定し得なかった.詳細な症状観察では,投与期間末期の観察において,雄ではケージからの取り出し時や動物の取り扱いに対して,抵抗を示す動物が若干増加する傾向が認められたが被験物質の投与による影響であると断定できなかった.
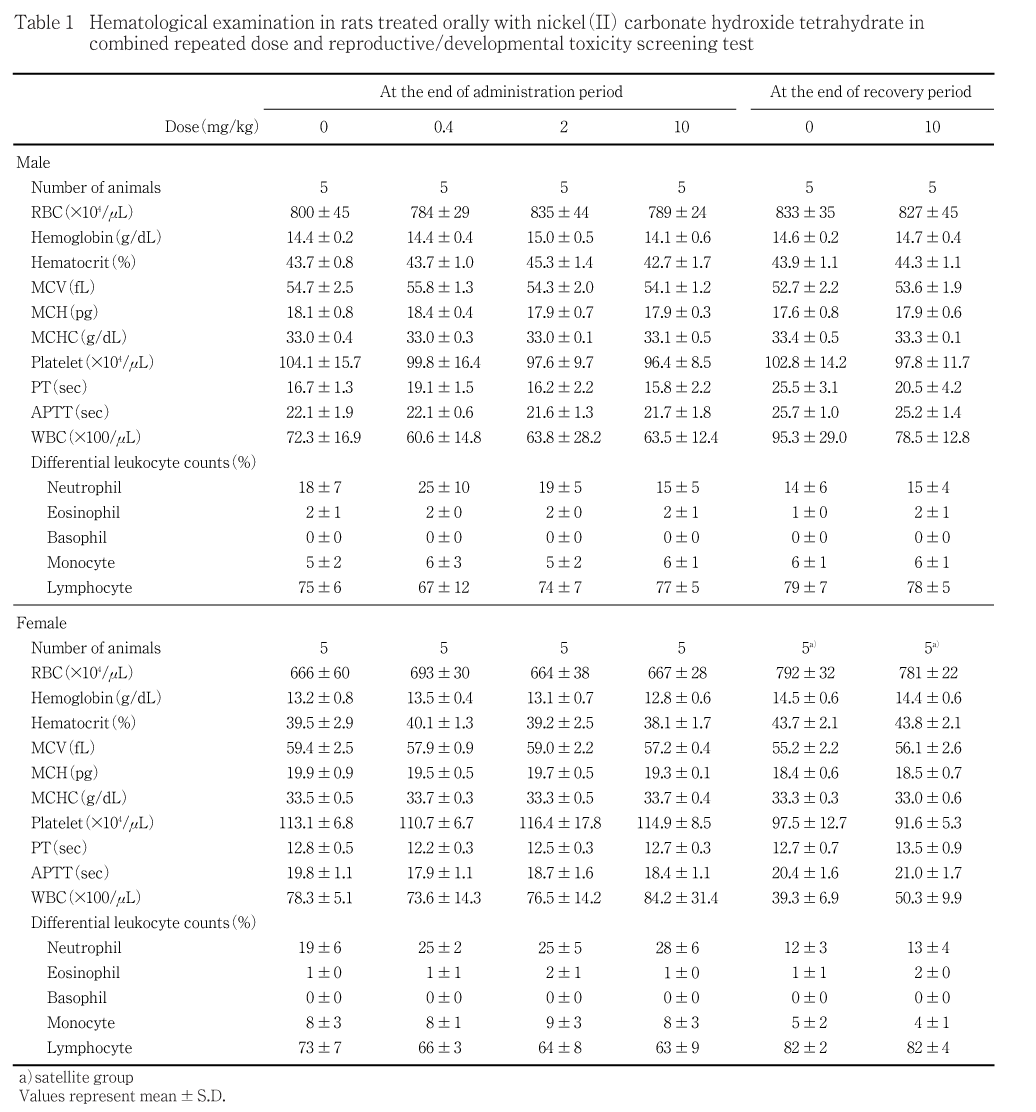
その他,機能検査の結果,体重推移ならびに摂餌量の測定結果,血液学検査,血液生化学検査および病理学検査の結果に,被験物質投与による影響は認められなかった.
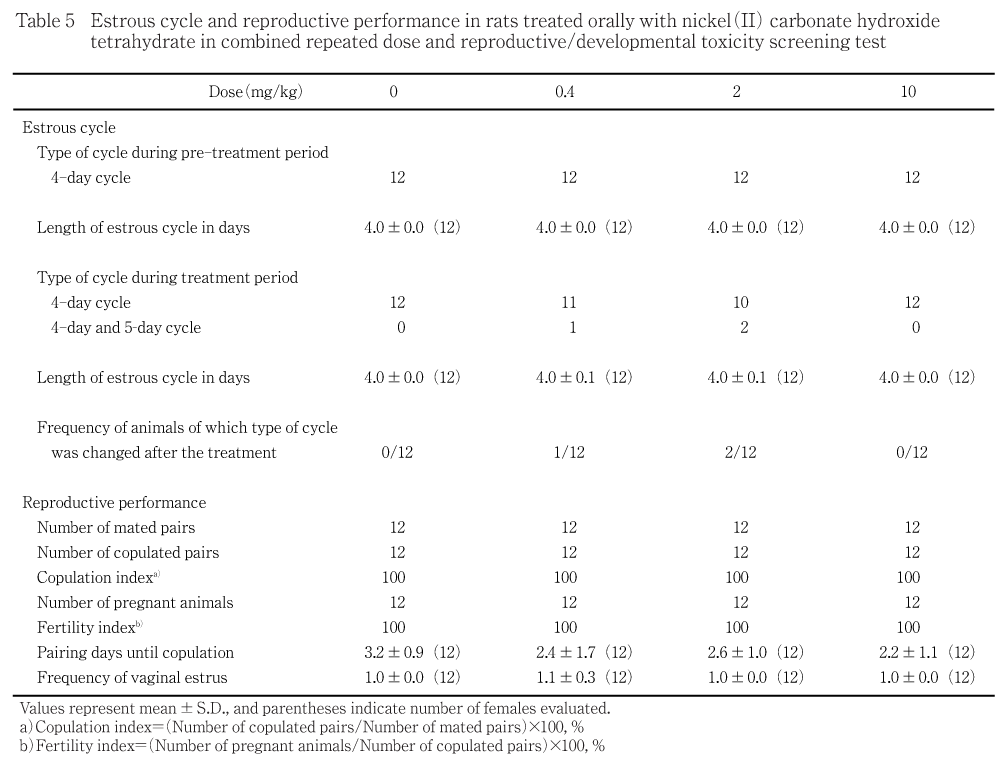
交配前の投与期間中,異常な性周期を示す動物は認められず,いずれの群においても全例が交尾し受胎した.また,妊娠動物の全例が生児を出産し,妊娠期間には対照群と投与群との間で有意差は認められなかった.分娩/哺育状態が不良であると判断された動物は認められなかった.分娩翌日以降の哺育状態に異常は認められず,出産した全出生児が死亡した例もなかった.
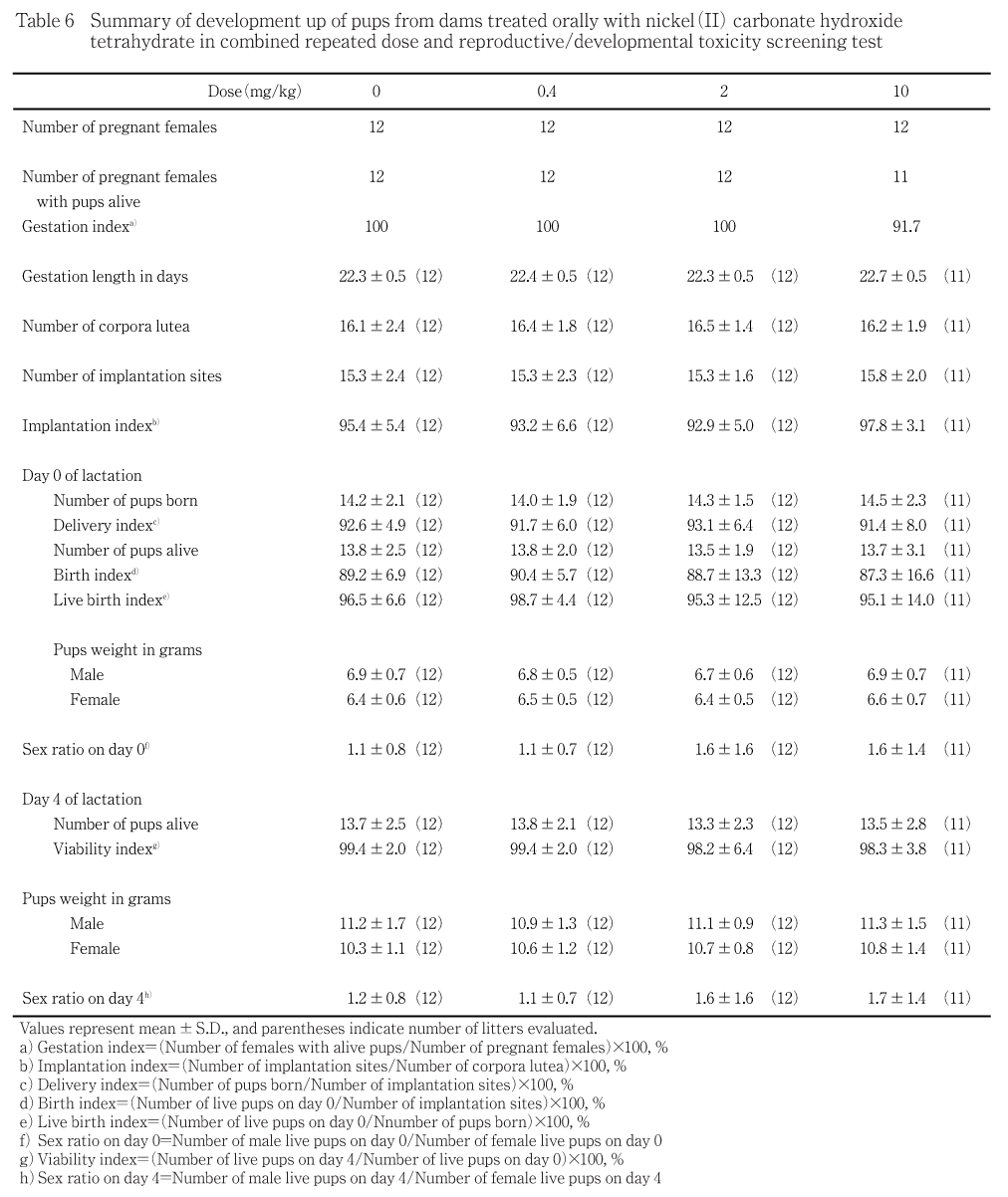
出生児の一般状態には異常が認められず,児の生存性にも,被験物質投与の影響は認められなかった.また,対照群と投与群との間で,哺育児体重に差は認められなかった.生存産児および哺育4日の剖検時の形態観察では,被験物質投与に起因したと考えられる異常は認められなかった.死亡児では,いずれの動物にも形態異常は観察されなかった.
以上の結果より,本試験条件下での塩基性炭酸ニッケル(II) 四水和物の無毒性量は以下の通りと推定された.
反復投与毒性に関しては10 mg/kg投与群の雌の1例で死亡が認められ,剖検所見ならびに病理組織検査の結果から被験物質の影響を否定できないことにより,雌については2.0 mg/kg/day(無水物換算)と推定される.雄については,詳細な症状観察でケージからの取り出し時や動物の取り扱い時において,抵抗を示す動物が若干増加する傾向が認められたことから2.0 mg/kg/day(無水物換算)と推定される.
一方,雌雄の生殖発生毒性ならびに出生児に関しては,10 mg/kg投与群においても塩基性炭酸ニッケル(II) 四水和物投与に起因した影響が認められなかったことから,10 mg/kg/day(無水物換算)以上と判断された.
被験物質として用いた塩基性炭酸ニッケル(II) 四水和物はうすい緑色の粉末で,分解温度は230℃である.
本試験には,和光純薬工業(大阪)から購入した,ロット番号PKN2539,含量 94.7 %(Ni含量の測定結果44.3 %より算出)の塩基性炭酸ニッケル(II) 四水和物を用いた.被験物質は受領後使用時まで密閉して室温で保管した.また,本試験の投与終了後に残余被験物質を被験物質購入先に送付し,購入先にて再度品質試験を実施し,試験期間中,安定であったことを確認した.
8週齢のSprague-Dawley(SD)系〔Crj:CD(SD)IGS,SPF〕の雌雄ラットを,日本チャールス・リバー厚木飼育センターから購入し,飼育環境への馴化と検疫を兼ねて入荷日を含めて14日間予備飼育した.検疫・馴化期間中,毎日一般状態を観察し,入荷日および検疫終了日に体重を測定した.また,雌全例の性周期を入荷翌日から毎日観察したほか,検疫期間中に雌雄全例の詳細な症状観察を実施した.その結果,検疫・馴化期間中に,一般状態の異常や4日周期以外の性周期を示した動物を全て群分けの対象から除外し,体重別層化無作為抽出法により,雄は各群12匹に,雌は対照群と10 mg/kg投与群は各17匹に,0.4ならびに2.0 mg/kg投与群は各群12匹に群分けした.投与開始時の週齢は雌雄とも10週齢であった.
全飼育期間を通じ,動物を金属製金網床ケージに1匹ずつ(交配時は2匹/ケージ)収容し,許容温度21.0〜25.0℃,許容湿度40.0〜75.0%,換気回数約15回/時間,照明12時間(7時〜19時点灯)に制御された飼育室で,固型飼料(CE-2,日本クレア)および水道水(秦野市水道局給水)を自由に摂取させて飼育した.妊娠18日(腟栓あるいは精子発見日=妊娠0日)以降の母動物は,ラット用プラスチック製繁殖ケージに収容し,哺育4日(哺育0日=分娩日)まで紙パルプ製チップ(ペパークリーン,日本エスエルシー)を床敷として供給して飼育した.また,供給した飼料,水および床敷には試験に支障を来す可能性のある混入物は認められなかった.
まず,0.5 % CMC Na溶液に被験物質を均一に懸濁させ,無水物換算で0.2 w/v %の懸濁液を調製した.試験に使用する四水和物としての調製濃度は,無水物の分子量が304.11,四水和物の分子量が376.18であることをもとに,さらに含量 94.7 %から換算によって求め,換算比率1.306を乗じた.0.2 w/v %液は安定性試験の結果に基づき,冷蔵条件下に連続的に攪拌して保管し,調製後8 日以内に使用した.一方,0.04および0.008 w/v %液は,投与直前に0.2 w/v %液を媒体で段階希釈して調製した.
投与に先立ち,被験物質の0.008および0.2 w/v %液について,冷蔵条件下における10日間の安定性を確認した.その結果,0.2 w/v %液については,10日間の安定性が認められたが,0.008 w/v %液においてはみられなかった.そのため本試験においては高用量群の検体を冷蔵保管し,中ならびに低用量群の検体は投与当日,投与の直前に調製することとした.この結果に先立ち以下の検討を行い,保存する0.2 w/v %液は攪拌し続けることとした.まず冷蔵条件下に静置した状態での0.008および0.2 w/v %液についての10日間の安定性を求めたが,検体中の被験物質含量は調製時に比較して変化がなかったものの,0.008 w/v %液,0.2 w/v %液とも均一性が認められなかったことから,冷蔵,静置した状態では安定性はないものと判断した.次に,0.008および0.2 w/v %液について室温3日間の安定性を求めたが,冷蔵条件下に静置した場合と同様に保管後の均一性は確認できなかった.このため冷蔵条件下に,連続的に検体を攪拌した状態における安定性を求めた.
一方,調製した各濃度の調製検体について含量および均一性を測定し,平均含量については調製指示濃度の100〜111 %であったこと,各濃度の3回の測定値の均一性はそれぞれの平均測定濃度の89.2〜112 %の範囲であったことを確認した.
調製検体中の被験物質濃度の測定は,各調製検体を1 mLずつ採取し,105℃で3時間乾燥後,硝酸0.2 mLを加えた.室温で原則として一晩放置後,高圧分解るつぼを用いて90℃で2時間,ついで145℃で3時間加熱分解した.放冷後,分解液に水を加えて50 mLとし,さらに薄めた硝酸(1→250)で適宜希釈して試料溶液(ニッケルとして約0.5 μg/mL)を調製した.試料溶液のニッケル濃度を原子吸光光度法(標準添加法)により測定し,これらの測定値から調製検体中の被験物質濃度を算出した.測定ランプにはニッケル中空陰極ランプを使用し,測定波長232.1 nmで可燃性ガスにはアセチレンを,支燃性ガスには空気を用いた.
情報検索の結果,本被験物質の単回投与時の50 %致死量が840 mg/kgであるとするデータが認められた.このことから,秦野研究所にて実施した本被験物質の反復経口投与毒性・生殖発生毒性併合予備試験の投与量を,単回投与時の50 %致死量の10分の1量である100 mg/kgを中心に公比約3で300ならびに30 mg/kgに設定し,妊娠母動物に対して妊娠中期以降,分娩直後まで反復投与した.その結果,100 mg/kg以上の投与量では投与した全母動物の,30 mg/kgの投与量では3例中1例の母動物の死亡がいずれも分娩前後に認められ,これらの投与量は本試験スケジュールにおける最大耐量を凌駕する投与量であると推定された.そこで,本試験における高用量を本予備試験における死亡発現量である30 mg/kgの3分の1量である10 mg/kgに設定し,中用量以下を公比5で除して2.0ならびに0.4 mg/kgとした.なお,死亡例の剖検結果では,脾臓の著しい小型化ならびに腸管内の餌の貯留の減少以外の所見は認められず,死亡原因に結びつくと考えられる所見は得られなかった.
動物への投与は,雄では交配前2週間から最長2週間の交配期間を経て剖検前日に至るまでの連続42日間,雌は交配前2週間,交尾までの交配期間,妊娠期間および哺育4日まで,回復試験用サテライト群の雌は連続42日間,それぞれ毎日1回午前中にラット用胃管を用いて強制的に経口投与した.個体別の投与液量は雌雄とも最近時の体重をもとに算出し,0 mg/kg投与群には0.5 % CMC Na水溶液を同条件で投与した.回復試験動物として雄は対照群および高用量群の各5例,雌はサテライト群の全例を最終投与翌日(回復1日)から14日間休薬した.
全例について飼育期間中および回復期間中は毎日1回,投与期間中は投与前後の毎日2回観察した.
雄の全例について検疫期間中(全入荷動物対象)1回,投与7,14,21,28,35および42日,回復試験動物ではさらに回復7および14日にスコアリング法による詳細な症状観察を行った.雌の全例については,検疫期間中(全入荷動物対象)1回,投与7,14,21,28,35および42日に詳細な症状観察を実施した.なお,観察日が分娩中であった例は哺育0日に観察した.その他の分娩例は哺育0日から4日の間に1回観察し,さらに回復群は回復7および14日に観察した.詳細な症状観察は,まずケージ越しでの観察(姿勢・体位,自発運動,発声,振戦,痙攣)を行った後,ケージから取り出す際に外表を観察し(取り出し易さ,扱い易さ,心拍動,体温,被毛,皮膚色,可視粘膜,流涙,眼球突出,瞳孔径,流涎),作業台上での行動の正常性を観察(姿勢・体位,探索行動,身づくろい,発声,挙尾反応,歩行,常同行動,奇妙な行動,振戦,痙攣,立毛,眼裂)した.
雄では投与42日の詳細な症状観察に引き続き,各群の5例および雄の回復試験動物について,また,回復14日の詳細な症状観察の後,雄の回復試験動物全例について機能検査を実施した.雌では哺育4日に機能検査を実施したが,実施日における投与日数が近い各群5匹について行った.雌の回復試験動物では投与42日および回復14日のそれぞれ詳細な症状観察に引き続き全例の機能検査を実施した.機能検査はプライエル反応,瞳孔反射,視覚定位,驚愕反応,後肢引込み反射,眼瞼(瞬目)反射,正向反射の有無を観察した.
雄および雌の回復試験動物は全例について投与1(投与開始日),7,14,21,28,35および42日ならびに解剖日(最終投与翌日)に体重を測定し,雌雄の回復試験動物はさらに回復1,7および14日ならびに解剖日(回復15日)にも体重を測定した.母動物は,投与1,7および14日,交尾確認後は妊娠0(交尾確認日),7,14および20日,分娩後は哺育0(分娩日)および4日ならびに解剖日に体重を測定した.
雄および雌の回復試験動物は全例について投与1,7,14,29,35および41日に餌の重量を測定し翌日までの差をもって摂餌量とした.雌雄の回復試験動物はさらに回復6〜7および13〜14日に摂餌量を測定した.母動物は投与1〜2,7〜8および14〜15日,交尾確認後は妊娠0〜1,7〜8,14〜15および20〜21日,分娩後は哺育3〜4日に摂餌量を測定した.
回復試験動物を除く雌全例について,群分け前日までの性周期観察に引き続いて投与開始以降,腟スメア標本を毎日採取し,各動物の同居後,交尾が確認されるまで性周期を観察した.
性周期は発情期,発情前期および発情休止期に分類した.これらの分類に基づき性周期の型を4日あるいは5日間隔で発情を回帰するものをそれぞれの周期に,それ以外を不正周期に分類し,投与開始後,4あるいは5日間隔の性周期がそれ以外の性周期に変化した動物の頻度を群毎に算出した.
投与15日から回復試験動物の雌を除く雌雄全例を,同群内の雌雄の組み合わせで連日1:1で同居させ交配を行った.交配は交尾を確認するまで2週間を限度として実施し,交尾の確認は腟スメアの中の精子の存在あるいは腟栓を確認することにより行った.交尾が確認された雌は,交尾確認日を妊娠0日と起算して雄から分離し個別に飼育した.
交配結果から,雌雄同居開始日から交尾確認日までの日数およびその間に回帰した発情期の回数,各群の交尾率〔(交尾動物数/交配動物数)×100,%〕および受胎率〔(妊娠動物数/交尾動物数)×100,%〕を算出した.
各群とも交尾した雌は全例を自然分娩させて哺育させた.
分娩の確認は妊娠21日から分娩が確認されるまで毎日行い,午前11時までに分娩が完了した例についてその日を哺育0日とした.分娩状態を直接観察できた例は異常の有無を断続的に観察し,直接観察できなかった例は分娩前後の一般状態および産児の状態から異常の有無を判断した.
分娩した全例の妊娠期間(妊娠0日から分娩日までの日数)を求め,各群の出産率〔(生児出産雌数/妊娠動物数)×100,%〕を算出した.また,哺育1日から毎日,哺育状態を観察し,哺育5日の剖検時に観察した着床数および妊娠黄体数から着床率〔(着床数/妊娠黄体数) ×100,%〕を算出した.
哺育0日に生存児数および死亡児数を雌雄別に数え,性別および外表奇形の有無を観察し,分娩率〔(産児数/着床痕数)×100,%〕,生児出産率〔(出産生児数/着床痕数)×100,%〕および出生率〔(出産生児数/産児数) ×100,%〕を算出した.哺育1〜4日まで毎日,一般状態を観察し,生児数と死亡児数を雌雄別に数え新生児生存率〔(哺育4日の生児数/哺育0日の生児数)×100,%〕を算出した.生存児については哺育0および4日に個別の体重を測定し,各腹ごとに雌雄別の平均値を算出するとともに,哺育0および4日における性比〔哺育0あるいは4日の雄生児数/哺育0あるいは4日の雌生児数〕を算出した.
雄の投与終了時剖検例は投与42日の翌日に,雌雄の回復試験動物は回復15日に,母動物は哺育4日の翌日にそれぞれ解剖した.全例いずれも解剖前18〜24時間絶食させた後,ペントバルビタールナトリウム麻酔下で放血致死あるいは採血後に放血致死させて解剖するとともに,血液学検査,血液生化学検査および病理学検査を実施した.なお,採血は腹部後大静脈から行い,雄の投与終了時剖検では各群の5例を,雌の投与終了時剖検では投与期間が近接した各群5例を選んで,雌雄の回復試験動物は全例を対象として実施した.
出生児のうち,死亡児は発見後すみやかに剖検し,0.1Mリン酸緩衝10 vol%ホルマリン溶液に固定して保存した.生存児は全例を哺育4日にエーテル吸入により致死させ剖検した.
プロトロンビン時間および活性部分トロンボプラスチン時間は抗凝固剤として10分の1容のクエン酸ナトリウムを用いて採取した血液から血漿を分離し,全自動血液凝固測定装置(CA-1000,東亜医用電子)を用いて光散乱法によって測定した.また,抗凝固剤としてEDTA-2 Kを用いて採取した血液により,血液自動分析装置(CELL-DYN3500SL,ダイナボット)を用いて白血球数をフローサイトメトリー・レーザ光散乱法あるいは電気抵抗法で,白血球分類はフローサイトメトリー・レーザ光散乱法で,血小板は電気抵抗法でそれぞれ測定した.同時に赤血球数ならびに平均赤血球容積を電気抵抗法で,血色素量を吸光度法により測定し,ヘマトクリット値,平均赤血球血色素濃度および平均赤血球血色素量を計算した.
抗凝固剤としてヘパリンを用いて採取した血液から血漿を分離し,遠心方式生化学自動分析装置(COBAS MIRA plus,ロッシュダイアグノスティックス)を用いて,総蛋白濃度はビュウレット法で,アルブミン濃度はBCG法で,総コレステロール濃度はコレステロールオキシダーゼ・HDAOS法で,グルコース濃度はヘキソキナーゼ・G-6-PDH法で,尿素窒素濃度はウレアーゼGlDH法で,クレアチニン濃度はJaff事@で,アルカリフォスファターゼ(ALP)活性はGSCC法で,AST(GOT)活性,ALT(GPT)活性およびg-グルタミルトランスペプチダーゼ(g-GTP)活性はIFCC法で,トリグリセライド濃度はGPO・HDAOS法で,無機リン濃度はモリブデン酸直接法で,総ビリルビン濃度はアゾビリルビン法で,カルシウム濃度はOCPC法で測定し,A/G比は算出した.また,ヘパリン加血液からの血漿について全自動電解質分析装置(EA05, A&T)を用い,イオン電極法によってナトリウム,カリウムおよび塩素の各濃度を測定した.
全例を剖検し,器官・組織の肉眼的観察を行った.雌雄ともに血液学検査および血液生化学検査を実施した動物の脳,心臓,胸腺,肝臓,腎臓,脾臓,副腎,精巣および精巣上体の重量(実重量)を測定し,相対重量を算出した.また,全例の脳,下垂体,脊髄,心臓,気管,肺(気管支を含む),肝臓,腎臓,胸腺,脾臓,副腎,甲状腺および上皮小体,胃,十二指腸,空腸,回腸,盲腸,結腸,直腸,精巣,精巣上体,前立腺腹葉,凝固腺を含む精嚢,卵巣,子宮,腟,膀胱,下顎リンパ節,腸間膜リンパ節,坐骨神経,大腿骨髄,病変部を採取し,保存した.肺は0.1 Mリン酸緩衝10 vol %ホルマリン溶液で注入固定してから採取した.子宮は着床数を数えて,分娩例の卵巣は実体顕微鏡下で妊娠黄体数を数えた.採取した器官・組織のうち,精巣ならびに精巣上体はブアン液(長期保存は0.1 Mリン酸緩衝10 vol %ホルマリン溶液を使用)に固定し,その他は0.1 Mリン酸緩衝10 vol %ホルマリン溶液に固定した.
卵巣,精巣および精巣上体は全例について,肉眼的観察で変化がみられた病変部は該当動物のみについて,これ以外の器官・組織は雄の投与終了時剖検および母動物では対照群と高用量群のうち血液学検査および血液生化学検査を実施した各5例について,それぞれ病理組織学検査を実施した.また,肉眼的観察の結果,被験物質投与によると推定される異常が認められた胃については,投与終了時剖検した動物のうち雌雄の低用量および中用量群の各5例,ならびに回復試験対象動物の全例について病理組織学検査を追加して実施した.これらの器官・組織はパラフィン包埋して薄切しヘマトキシリン・エオジン染色標本を作製して,光学顕微鏡を用いて検査した.
機能検査結果,性周期の変化した動物の頻度,交尾率,受胎率ならびに出生児の形態異常の出現頻度についてはFisherの直接確率検定を行った.
病理組織学検査所見では,グレード分けしたデータはMann-WhitneyのU検定により,陽性グレードの合計値はFisherの直接確率の片側検定により対照群と被験物質投与群との間で有意差検定を行った.その他のデータのうち解析の対象が3群以上の場合は多重比較検定を行った.すなわち,個体ごとに得られた値あるいはlitterごとの平均値を1標本とし,パラメトリックなデータは先ず,Bartlettの方法により等分散性の検定を行い,分散が一様である場合は一元配置分散分析を行った.いずれかの群で分散が0となった場合,分散が等しくない場合およびノンパラメトリックデータはKruskal-Wallisの順位検定を行った.群間に有意性が認められた場合は,Dunnett法またはDunnett型の検定法により群間の比較を行った.回復試験等,解析の対象が2群の場合にはまずF検定を行い,有意差が認められなければStudent's-t検定を,有意差が認められた場合はAspin-Welchの検定を行った.有意水準はいずれも5 %とした.
10 mg/kg投与群の雌の1例においては,40回投与後の妊娠23日の朝,出産中の死亡が発見されたが,前日には一般状態の異常は観察されなかった.この動物以外の死亡ならびに瀕死の動物はいずれの群でも認められず,一般状態の異常は投与期間中,回復期間中とも雌雄いずれの動物においても認められなかった.
投与期間末期の観察において,雄ではケージからの取り出し時や動物の取り扱い時において,抵抗を示す動物が若干増加する傾向が認められた.雄の他の項目,雌の各項目においては投与期間,回復期間中ともにいずれの群においても特記すべき変化は認められず,神経毒性を示唆する所見は観察されなかった.
投与期間終了時および回復期間終了時ともに,いずれの群においても異常は認められなかった.
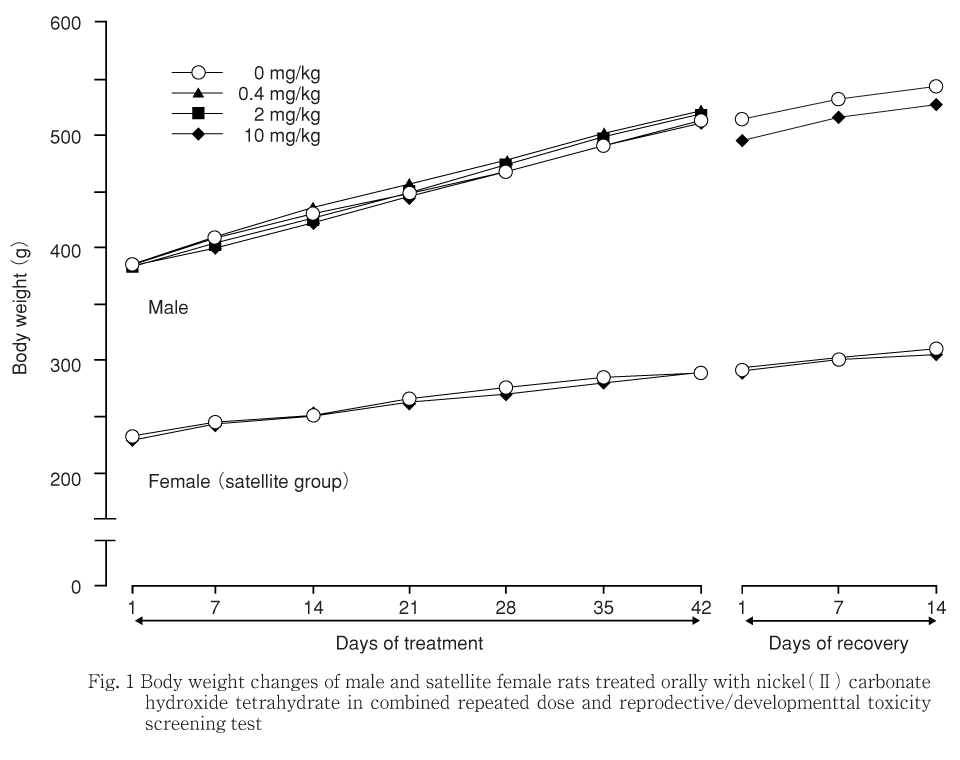
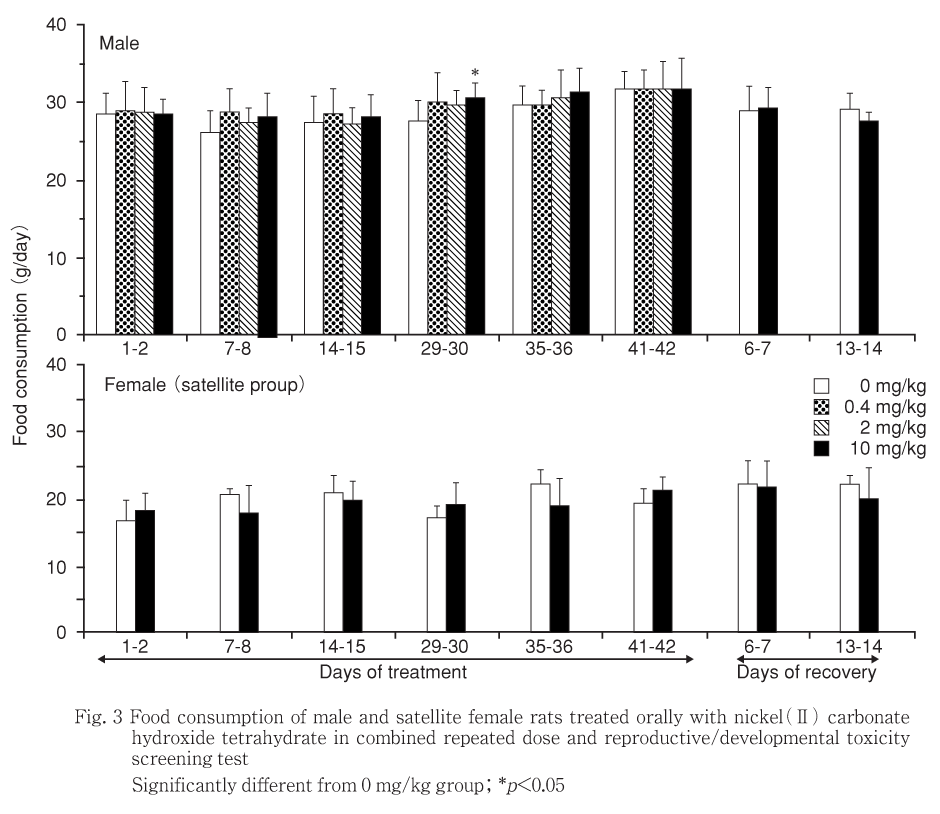
2.0 mg/kg投与群の雄では投与第14〜21日の体重増加量が,雌の10 mg/kg投与のサテライト群では投与第7〜14日の体重増加量がそれぞれ有意に増加したが,実体重には変化がなく,一過性の変化でそれぞれ翌週以降には変化が認められないことから,いずれも偶発的な有意差と判断した.一方,雌の10 mg/kg投与のサテライト群では回復第7〜14日の体重増加量が有意に低下したが,実体重には変化がないことから被験物質投与による影響ではないと判断した.
以上の他には体重の変化は認められなかった.

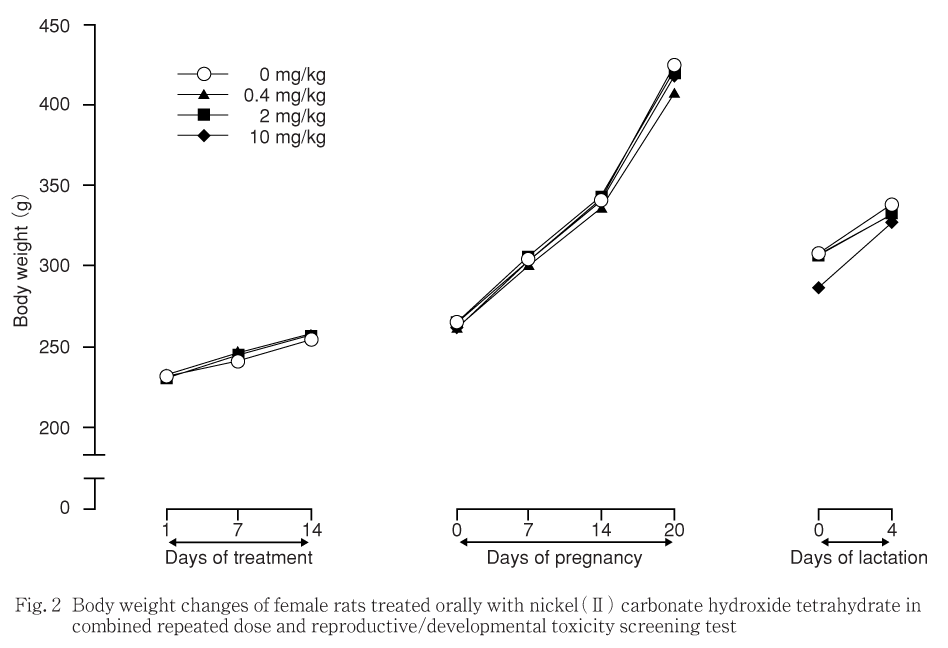
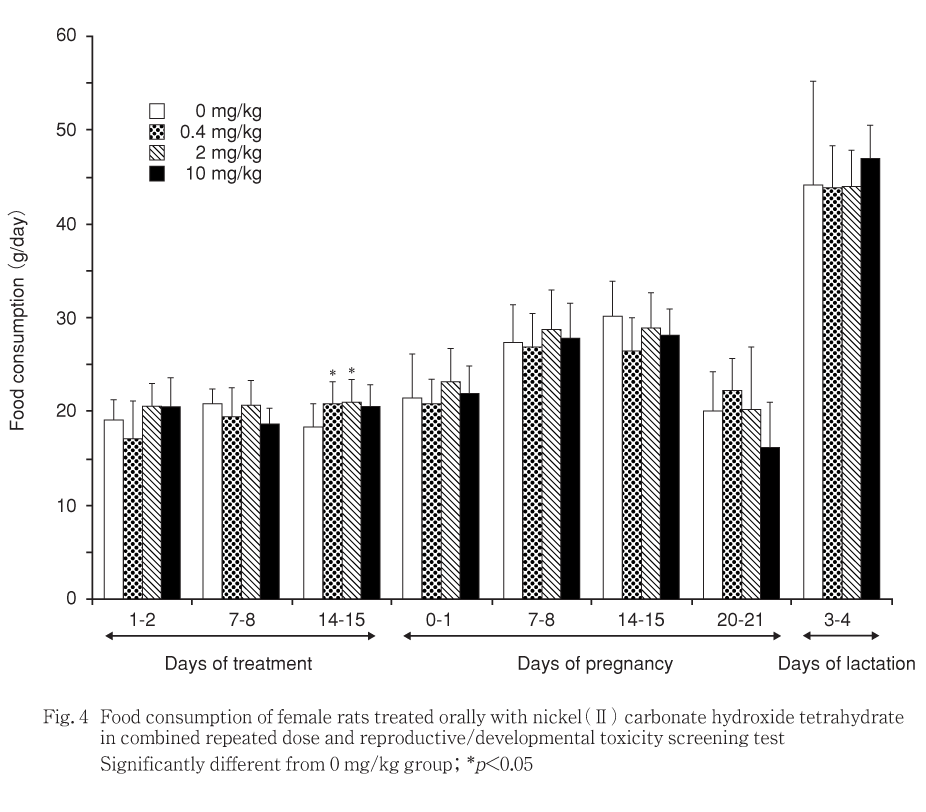
10 mg/kg投与群の雄の摂餌量は投与29〜30日に,雌の0.4ならびに2.0 mg/kg摂餌量では投与14〜15日に,いずれも対照群に比較して有意な増加を示したが,一過性で翌週には有意差はみられず,体重にも該当する時期に意味のある変化が認められなかったことから,被験物質投与による影響とは考えられなかった.
回復期間中には,雌雄いずれの投与群の摂餌量においても対照群との間に有意差は認められなかった.
投与期間終了時,回復期間終了時とも,いずれの投与群においても,雌雄とも血液学検査の各検査項目には対照群との間に有意差は認められなかった.
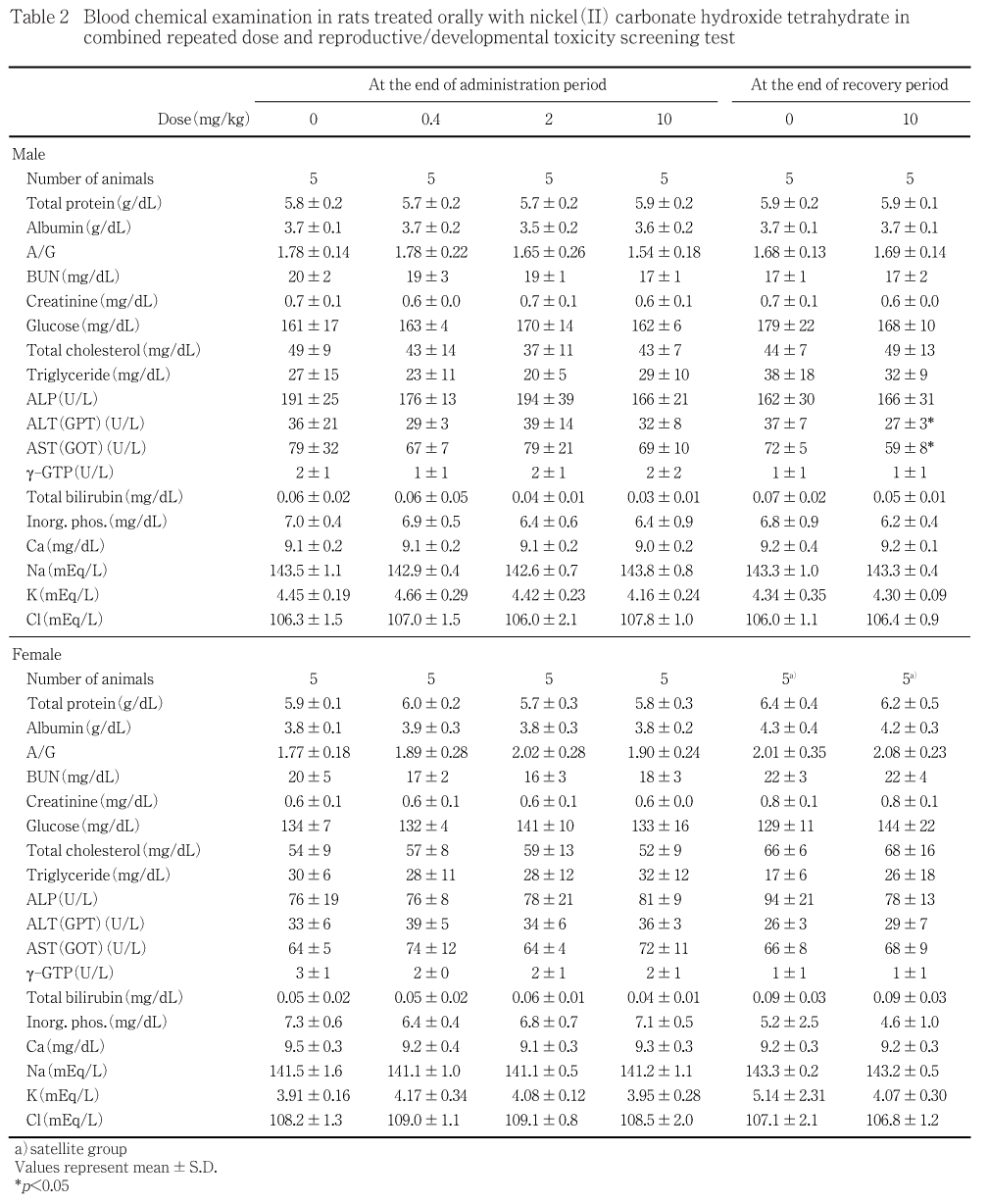
投与期間終了時の検査では,雌雄とも血液生化学検査の各検査項目に,いずれの投与群においても対照群との間で有意差は認められなかった.
回復期間終了時の検査では,10 mg/kg投与群の雄でAST活性ならびにALT活性に有意差がみられたが,いずれも活性の低下であり,他の血液生化学検査項目に変化はなかった.雌においてはいずれの投与群においても対照群との間に有意差は認められなかった.
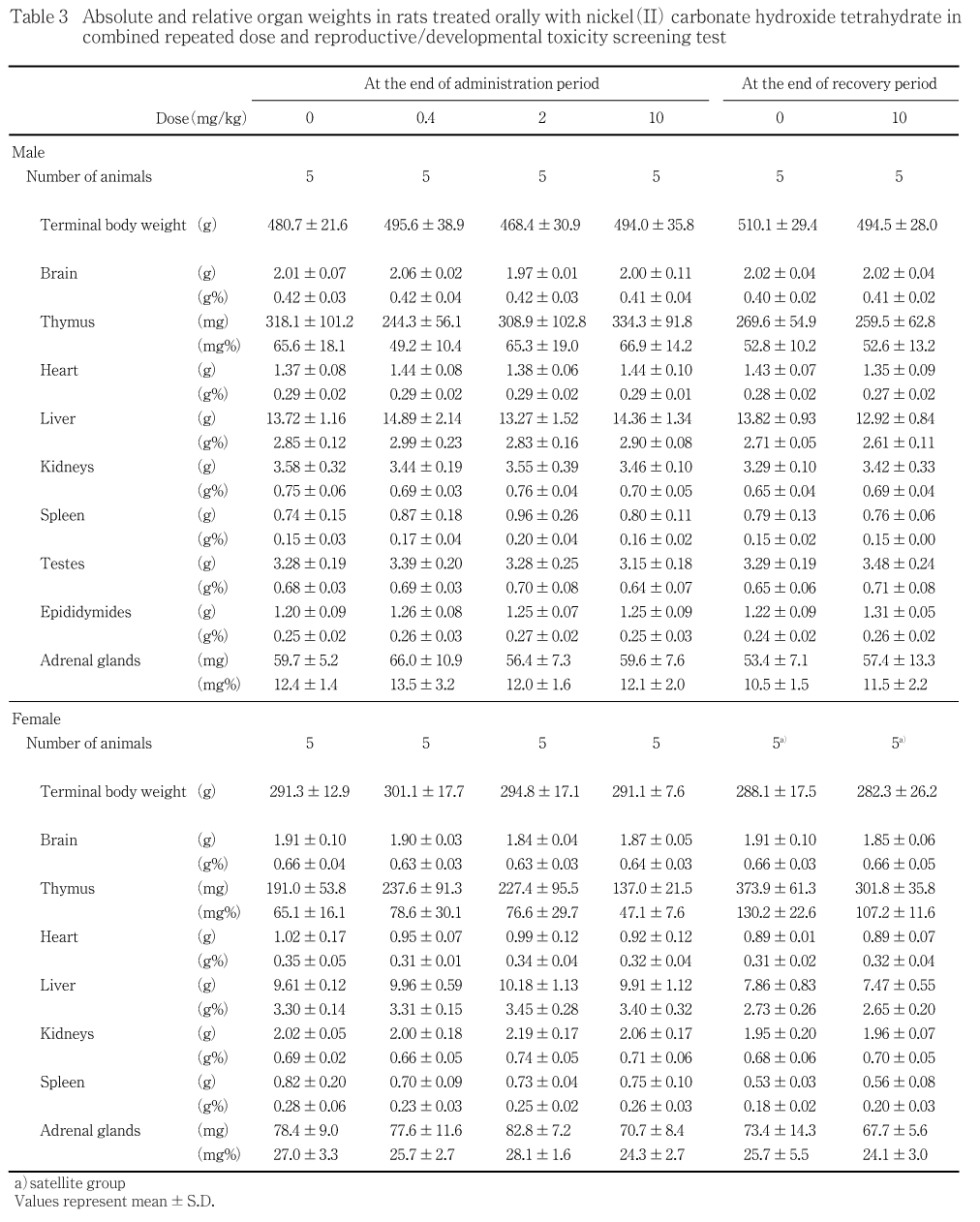
投与期間終了時および回復期間終了時における,雌雄各投与群の器官絶対重量および相対重量に,対照群と比較して有意差はなかった.
10 mg/kg投与群の雌の1例の死亡例では,剖検の結果,外陰部周囲の被毛に汚れが観察された他,脾臓ならびに胸腺の小型化が認められた.
0.4 mg/kg 投与群の雌の1例では下腹部皮下に腫瘤がみられた.雄では剖検所見に異常は認められなかった.
雌雄とも剖検所見に異常は認められなかった.
死亡動物では肺水腫がみられ,肺胞内に限局性の泡沫細胞の集簇が観察されたほか,脾臓では白脾髄領域の減少,胸腺では萎縮が認められた.この動物ではこの所見の他に,門脈周囲性の肝細胞の脂肪化ならびに脾臓における髄外造血および褐色色素の沈着が観察された.
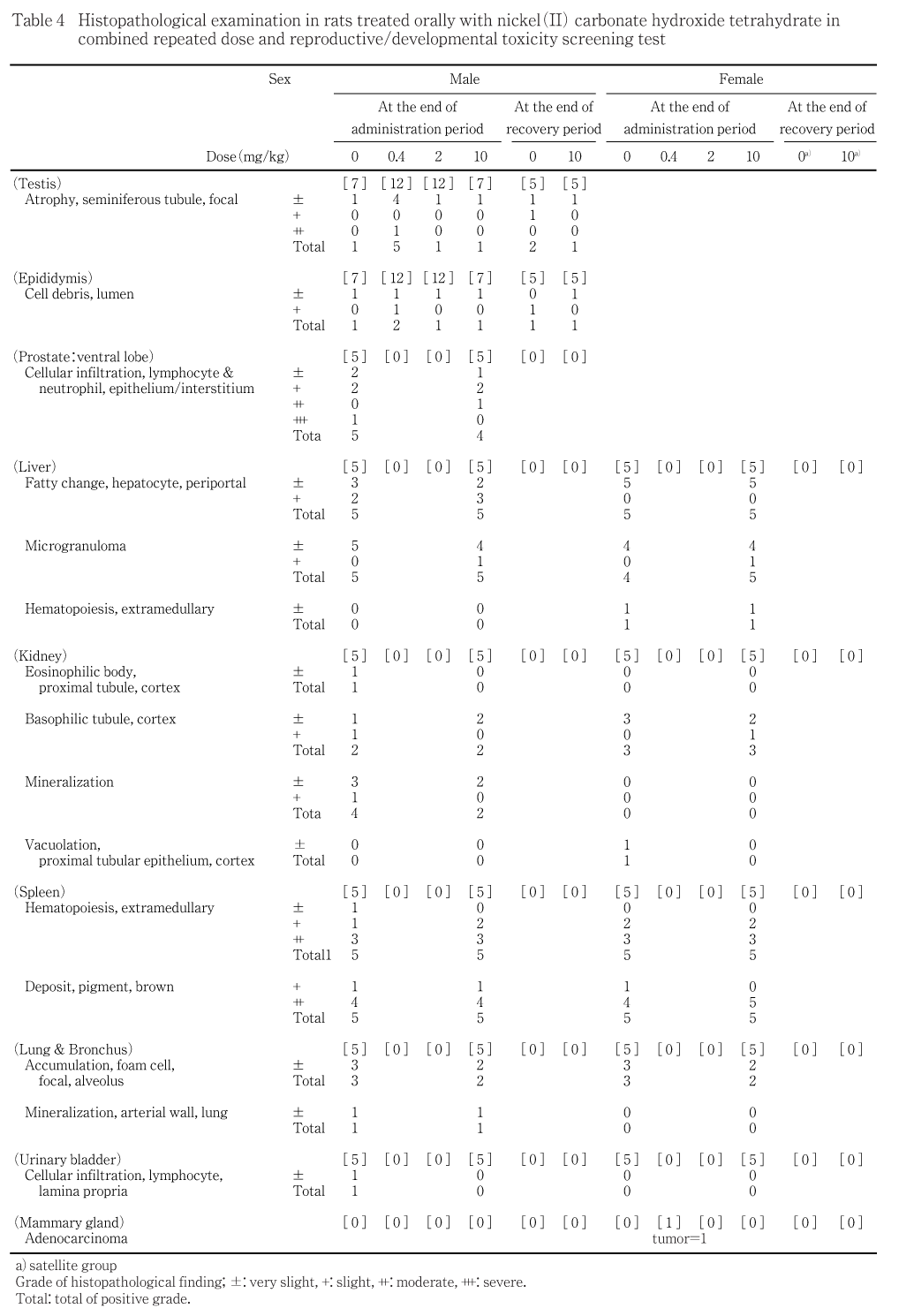
精巣では,0.4 mg/kg 投与群の5例,10ならびに2.0 mg/kg 投与群および対照群の各1例に限局性の精細管萎縮が認められ,このうち対照群の1例,0.4 mg/kg 投与群の2例,2.0 mg/kg 投与群の1例ならびに10 mg/kg 投与群の1例の精巣上体では管腔内に細胞残屑が観察されたが,発現頻度には有意差が認められなかった.
肝臓では10 mg/kg 投与群および対照群の検査対象動物の全例に門脈周囲性の肝細胞の脂肪化および小肉芽腫がみられたが,両群間に程度および頻度の差は認められなかった.
腎臓では10 mg/kg 投与群および対照群の皮質で好塩基性尿細管あるいは鉱質沈着がみられたが,いずれの所見も両群間に程度および頻度の有意な差は認められなかった.その他,対照群の1例の皮質の近位尿細管に好酸性小体が観察された.
脾臓では,10 mg/kg 投与群および対照群の検査対象動物の全例に髄外造血および褐色色素の沈着がみられたが,両群間に程度および頻度の差は認められなかった.
前立腺では,10 mg/kg 投与群および対照群の検査対象動物のほとんどの例で,間質や上皮に好中球およびリンパ球の浸潤がみられたが,両群間に程度および頻度の有意な差は認められなかった.
肺では,10 mg/kg 投与群および対照群の肺胞に限局性の泡沫細胞の集簇あるいは動脈壁に鉱質沈着がみられたが,いずれの所見も両群間に程度および頻度の差は認められなかった.
膀胱では,対照群の1例の粘膜固有層にリンパ球の浸潤が観察された.
他の病理組織学検査実施器官に,異常所見は認められなかった.
卵巣では,異常所見は認められなかった.
肝臓では,10 mg/kg 投与群および対照群の検査対象動物の全例に門脈周囲性の肝細胞の脂肪化,ほとんどの例に小肉芽腫がみられたが,いずれの所見も両群間に程度および頻度の差は認められなかった.その他,両群の各1例でごく軽度な髄外造血が観察されたが,発現頻度に差は認められなかった.
腎臓では,10 mg/kg 投与群および対照群の各3例の皮質で好塩基性尿細管がみられたが,両群間に程度の差はみられなかった.また,対照群の1例の皮質に近位尿細管上皮の空胞化が観察された.
脾臓では,10 mg/kg 投与群および対照群の検査対象動物の全例に髄外造血および褐色色素の沈着がみられたが,両群間に所見の程度の差は認められなかった.
肺では,10 mg/kg 投与群および対照群の肺胞に限局性の泡沫細胞の集簇がみられたが,両群間に程度および頻度の差は認められなかった.
剖検時,腫瘤が観察された0.4 mg/kg投与群の雌1例の下腹部皮下には,類円形の核を有し,淡明な細胞質を持つ大型の細胞と円形〜楕円形でクロマチンに富む核を有し細胞質に乏しい小型の細胞が腺管構造を呈して増殖していた.これらの細胞増殖部位では,細胞分裂像および多層化した腺管構造部も多くみられ,線維性結合組織も豊富であることから,悪性の乳腺腫瘍と診断された.しかし,この所見は1例のみに認められた変化であり,用量相関性も認められないことから,偶発所見と判断した.
雄の精巣には,10 mg/kg 投与群で1例,対照群で2例の限局性の精細管萎縮が認められ,このうち両群の各1例の精巣上体には,管腔内に細胞残屑が観察されたが,いずれの所見も発現頻度に有意差は認められなかった.
雌の卵巣には,異常はみられなかった.
交配前の投与期間中,異常な性周期を示す動物は認められず,いずれの投与群においても投与による性周期への影響は認められなかったと判断した.
いずれの群においても全例の交尾が成立し,受胎した.また,0.4 mg/kg投与群の1例を除き,いずれも交尾は初回の発情期に行われた.
妊娠動物の全例が生児を出産し,妊娠期間には対照群と投与群との間で有意差は認められなかった.分娩/哺育状態が不良であると判断された動物は認められなかった.分娩翌日以降の哺育状態の異常は認められず,出産した全出生児が死亡した例もなかった.
黄体数および着床数ともに,対照群と投与群との間に有意差は認められなかった.
出生児の一般状態には異常が認められず,児の生存性にも,被験物質投与の影響は認められなかった.
対照群と投与群との間で,哺育児体重に差は認められなかった.
生存産児および哺育4日の剖検児の形態観察では,2.0 mg/kg投与群の1例の雄生存産児1例が矮小であったが,同腹の他の生存産児には形態異常は認められず,内部器官を観察した結果,異常はみられなかったことから,被験物質投与の影響ではないと判断した.死亡児では,いずれの動物にも形態異常は観察されなかった.
10 mg/kg投与群の雌の1例では,出産中の死亡が発見され,剖検の結果,外陰部周囲の被毛に汚れが観察された他,脾臓ならびに胸腺の小型化が認められた.この動物では組織検査の結果,肺に水腫がみられ,肺胞内に限局性の泡沫細胞の集簇が観察されたほか,脾臓では白脾髄領域の減少,胸腺では萎縮が認められた.本試験の投与量設定のための予備試験においては,妊娠中期以降の母動物に塩基性炭酸ニッケル(II)四水和物の300,100ならびに30 mg/kgを反復投与した結果,300ならびに100 mg/kg投与群においてはおのおの3例全例の,10 mg/kg投与群においては3例中1例の動物で,妊娠20日から出産翌日にかけて死亡が認められ,死亡例では全例で脾臓の小型化が観察された.また,その程度は用量相関的に増強した.30 mg/kg投与群の生存例の1例においても脾臓の小型化がみられ,さらに,100 mg/kg投与群では腸内容物の減少がみられた.本試験の10 mg/kg投与群の死亡例においても,胸腺の小型化とならんで,脾臓の小型化が認められ,剖検所見が予備試験での死亡例と同様であることから,死亡の原因は被験物質投与による可能性が高い.この死亡例では組織学検査の結果,白脾髄領域の減少が認められたが,脾臓の小型化が死因に直接結びつく可能性はないと考えられた.また,門脈周囲性の肝細胞の脂肪化ならびに脾臓における髄外造血および褐色色素の沈着が観察されたが,他の投与期間終了時屠殺例にも認められる所見であり,被験物質投与による変化とは考えられなかった.
一方,生存例においては投与期間終了時剖検,回復期間終了時剖検のいずれにおいても,雌雄ともいずれの器官の絶対重量,相対重量とも対照群との間に有意差を認めず,被験物質投与によると考えられる剖検時の肉眼的異常もみられなかった.また,病理組織学的検査の結果,雌雄ともいずれの器官にも被験物質投与によると考えられる異常は認められなかった.その他,投与期間終了時および回復期間終了時ともに,いずれの群においても機能検査の結果に異常はみられず,体重の推移ならびに摂餌量の測定結果には被験物質投与によると考えられる変化は認められなかった.また,投与期間終了時,回復期間終了時のいずれも,雌雄とも血液学検査の各検査項目に,いずれの投与群においても対照群と比較して有意差は認められず,血液生化学検査の結果にも,被験物質投与によると考えられる異常はみられなかった.ニッケルは経口投与で,呼吸器,循環器,消化器,血液系,筋骨格系,肝臓,腎臓,皮膚および体重に影響があるとされ,また,ヒトがニッケルに曝露されると,中枢神経系および肺組織への直接的な毒性に基づく肺への副作用が最も多く発生するとされている1).本試験においては脾臓以外に標的と考えられる器官はなく,死亡原因に直接結びつく可能性のある標的器官は特定できなかった.
一方,詳細な症状観察の結果,雄では投与期間末期の観察においてケージからの取り出し時や動物の取り扱い時において,抵抗を示す動物が若干増加する傾向が認められた.これらの所見は雌では認められない変化であり,通常の一般状態に異常がみられないことから偶発的な差である可能性も考えられるが,動物の一般状態の悪化に伴いヒトとの接触を忌避する行動である可能性が示唆されること,雌においては妊娠している等,動物の状態の変化に伴い,感覚や行動が通常の状態とは異なり異常が検出されなかった可能性が推定される事から,被験物質の投与による影響である可能性を否定できなかった.
血液生化学検査において,回復期間終了時に10 mg/kg投与群の雄でAST活性ならびにALT活性に有意差がみられたが,いずれも活性の低下であり,他の血液生化学検査項目に変化はなく,肝臓や腎臓の病理学検査所見にも著明な変化は認められないことから,偶発的な有意差と判断した.
いずれの投与群においても投与による性周期への影響は認められず,交配の結果,全例が交尾し受胎した.また,妊娠動物の全例が生児を出産し,妊娠期間には対照群と投与群との間で有意差を認めなかった.分娩/哺育状態ならびに分娩翌日以降の哺育の状態に異常は認められなかった.また,病理組織学検査の結果,投与終了時,回復試験期間終了時とも,雄の精巣ならびに雌の卵巣に,被験物質投与によると考えられる異常は認められなかった.
出生した児の一般状態には異常が認められず,児の生存性ならびに体重推移にも,被験物質投与の影響はみられなかった.生存児および死亡児の形態観察結果に,被験物質投与の影響は認められなかった.
以上の結果,雌雄の生殖発生毒性ならびに出生児に関しては,本試験においては塩基性炭酸ニッケル(II) 四水和物投与に起因した毒性学的影響は認められないものと判断した.
投与経路は異なるが,Bensonらによれば硫酸ニッケルをニッケル量として1.6 mg/m3の割合で1日6時間,12日間にわたってラットに吸入曝露させた時,精巣の精上皮細胞に変性が認められるとする報告があり2),同様の変化は二硫化三ニッケルをニッケル量として1.8 mg/m3,吸入で曝露させた時にも生じるとも報告されている3).また,3世代繁殖試験において,新生児死亡率の増加が認められたとする報告もある4).しかし,本試験においては雌雄とも生殖発生毒性学的影響は観察されなかった.
以上の結果より,反復投与毒性に関し雌では,10 mg/kg投与群の1例で死亡が認められ,剖検所見ならびに病理組織検査の結果から被験物質の影響を否定できない一方で,2.0 mg/kg以下の投与群ではなんらの毒性学的変化がみられないことから,本試験条件下での塩基性炭酸ニッケル(II)四水和物の雌の無毒性量は2.0 mg/ kg/day(無水物換算)と推定される.一方,雄については,詳細な症状観察で10 mg/kg投与群においてケージからの取り出し時や動物の取り扱い時において抵抗性を示す動物が若干増加する傾向が認められ,2.0 mg/kg 以下の投与群ではなんらの毒性学的変化がみられないことから,本試験条件下での雄の無毒性量も2.0 mg/kg/day (無水物換算)と推定される.塩化ニッケルをニッケル量として35 mg/kg ,92日間にわたり強制経口投与されたラットにおいては死亡がみられ,硫酸ニッケルの50 mg/kgを混餌投与された雄ラットでは体重低下がみられ,いずれも無毒性量は50 mg Ni/kg/dayであるとされている4).IARCはニッケル化合物の健康影響評価を化学的分類に従い,グループ化して記載しているが,最終的な安全性の観点において,ニッケルの化学形態が多様であり,生体内の代謝によってニッケル化合物の化学形態が移行する可能性があることから,全てのニッケル化合物を一つのグループとして扱っている5).本試験での塩基性炭酸ニッケル(II) 四水和物の無毒性量を塩化ニッケルの成績と比較すると,本試験における無毒性量は塩基性炭酸ニッケル(II) として2.0 mg/kgであることから,ニッケル量に換算すると約1.2 mg/kgとなり,本試験の投与群を考えるとき,既報の結果と大きな隔たりは認められなかった.
一方,雌雄の生殖発生毒性ならびに出生児に対する毒性に関しては,10 mg/kg投与群においても塩基性炭酸ニッケル(II) 四水和物投与に起因した影響が認められなかったことから,無毒性量は10 mg/kg/day(無水物換算)以上と判断された.
| 1) | Burns-Naas LA, Meade J, Munson AE:Toxic Responses of the Immune System. In “Casarett & Doull's Toxicology. The Basic Science of Poisons”, Klassen C(ed.), McGraw-Hill, New York (2001) p.457. |
| 2) | Benson JM, Carpenter RL, Hahn FF et al.: Comparative Inhalation Toxicity of Nickel Subsulfide to F344/N Rats and B6C3F1 Mice Exposed for 12 Days. Fundamental and Applied Toxicology, 9:251-265(1987). |
| 3) | Benson JM, Burt DG, Carpenter RL et al.: Comparative Inhalation Toxicity of Nickel Subsulfide to F344/N Rats and B6C3F1 Mice Exposed for Twelve Days. Fundamental and Applied Toxicology, 10:164-178(1988). |
| 4) | Haber LT, Allen BC, Kimmel CA: Non-Cancer Risk Assessment for Nickel Compounds: Issues Associated with Dose Response Modeling of Inhalation and Oral Exposures. Toxicological Sciences, 43:213-229(1998). |
| 5) | International Agency for Research on Cancer:In “IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Vol. 49 Chromium, Nickel and Welding”, World Health Organization, Lyon(1989). |
| 連絡先 | |||
| 試験責任者: | 高島宏昌 | ||
| 試験担当者: | 田子和美,野口早苗,堀内伸二, 関 剛幸,三枝克彦,古谷真美, 丸茂秀樹,稲田浩子,安生孝子 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | |||
| Authors: | Hiromasa Takashima (Study Director) Kazumi Tago, Sanae Noguchi, Shinji Horiuchi, Takayuki Seki, Katsuhiko Saegusa, Mami Furuya, Hideki Marumo, Hiroko Inada, Takako Anjo |
||
| Hatano Research Institute, Food and Drug Safety Center | |||
| 729-5 Ochiai, Hadano, Kanagawa, 257-8523, Japan | |||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | ||