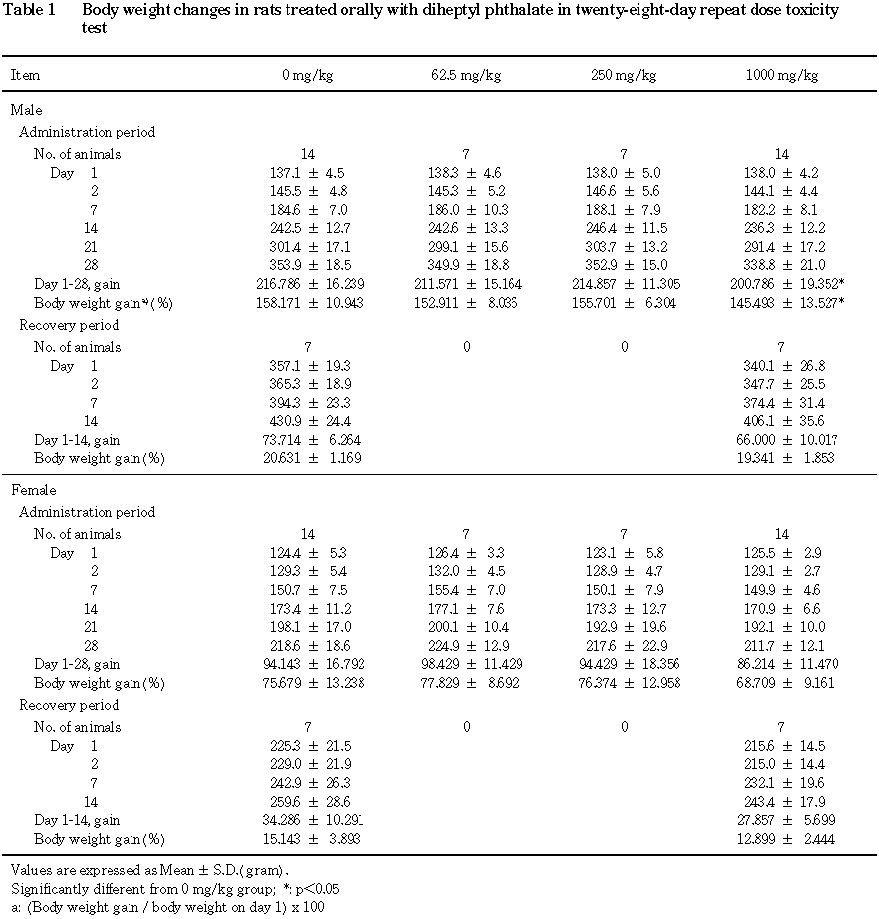
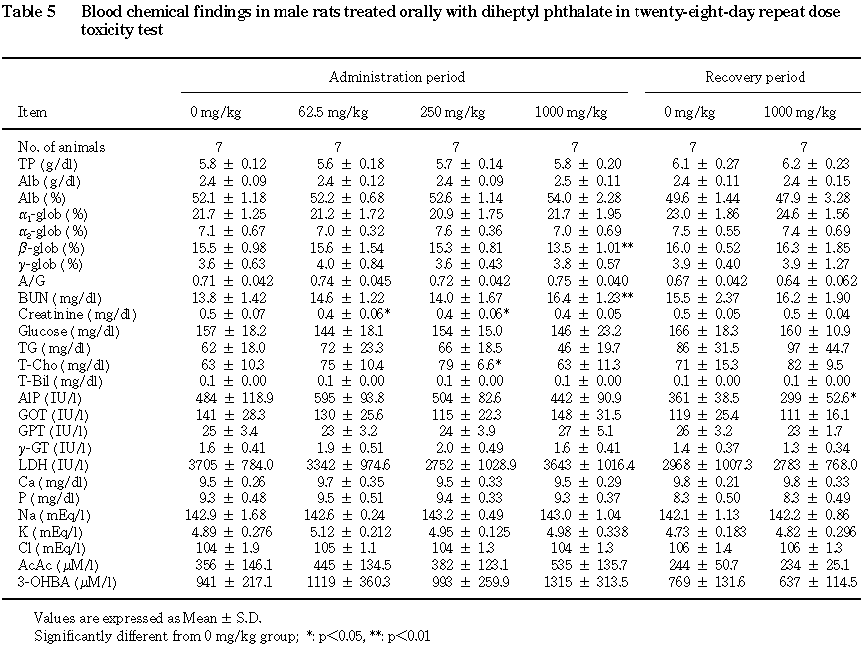
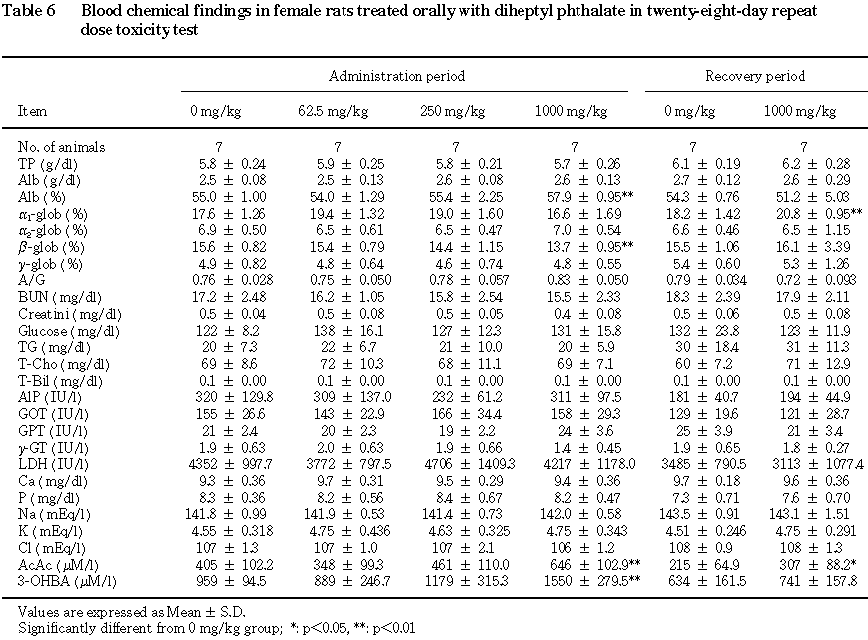
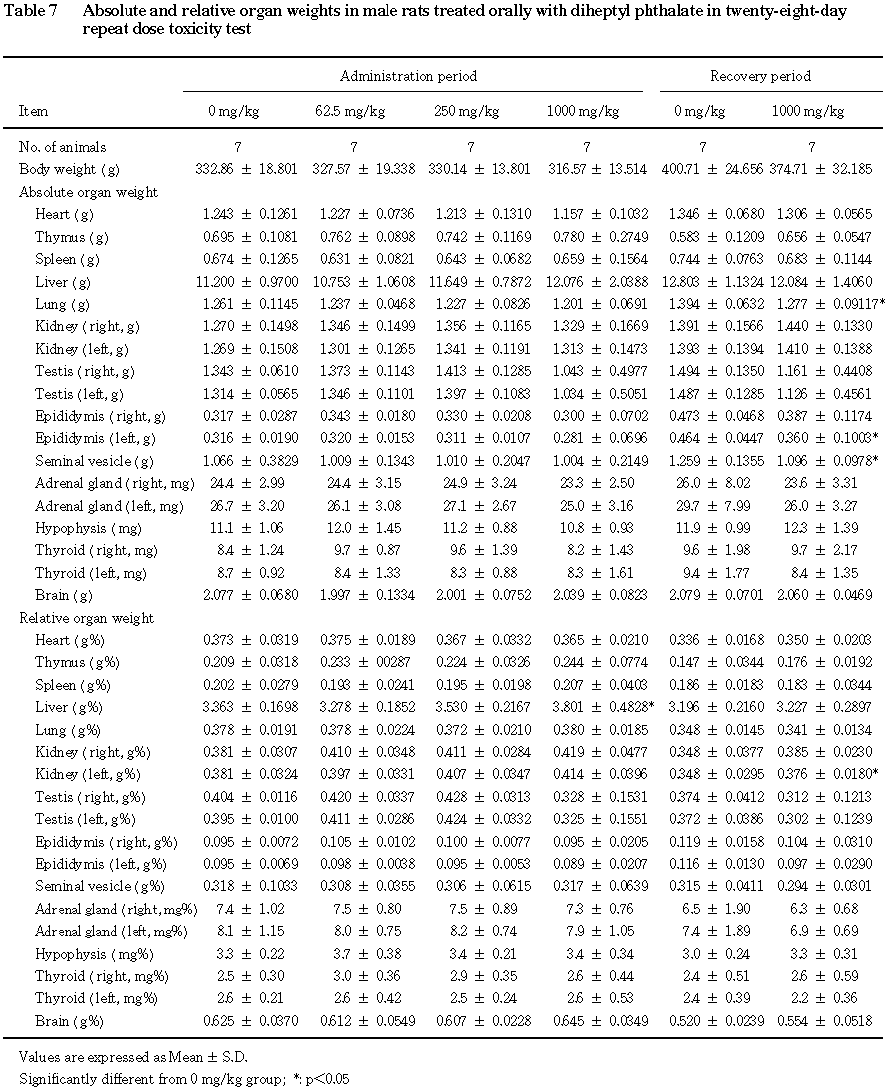
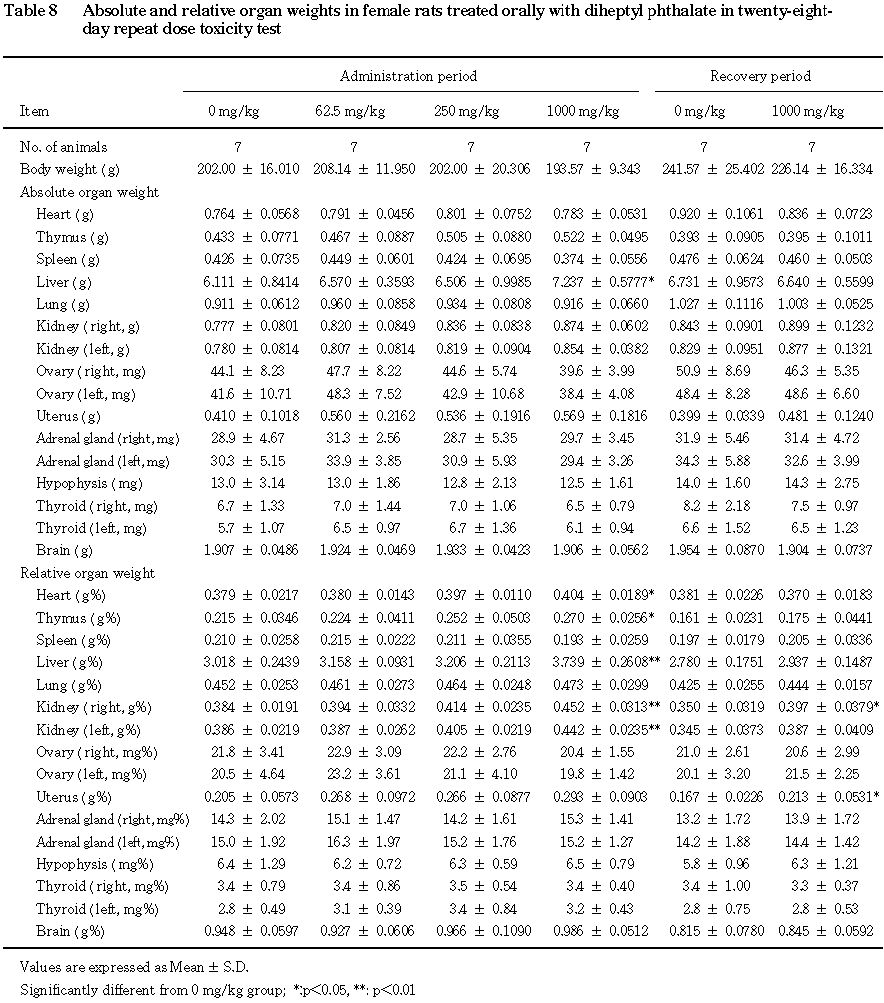
投与期間中の体重の増加量および増加率の減少が 1000 mg/kg群の雄で認められた.尿検査では,1000 mg/kg群の雌で蛋白陽性例の増加が認められた.血液学検査では,250mg/kg以上の群の雄でプロトロンビン時間および活性化部分トロンボプラスチン時間の延長,1000 mg/kg群の雌で活性化部分トロンボプラスチン時間の延長が認められた.血液生化学検査では,1000 mg/kg群の雄でβ-グロブリン分画の低下,尿素窒素の増加,同群の雌でアルブミン分画の上昇,β-グロブリン分画の低下が認められた.器官重量では,1000 mg/kg群の雄で肝臓の体重重量比の上昇と同群の2例で精巣重量および精巣上体重量の減少が,1000 mg/kg群の雌で肝臓の重量の増加および体重重量比の上昇,腎臓の体重重量比の上昇が認められた.剖検では,1000 mg/kg群の雄で小型の精巣および精巣上体が認められた.病理組織学検査では,1000 mg/kg群の雄で肝臓に小葉中心性肝細胞肥大,小葉中心性肝細胞脂肪化,小葉中心帯における単細胞性肝細胞壊死が,精巣に精子形成細胞の消失が,精巣上体に管内精子減少,剥離性精子形成細胞の出現が認められた.
上述の変化のうち,精巣および精巣上体の変化については 14日間の回復期間では回復は認められなかったが,その他の変化については多くが14日間の回復期間終了時には消失した.
以上より,雄では 250 mg/kg群でプロトロンビン時間および活性化部分トロンボプラスチン時間の延長が認められ,1000 mg/kg群で肝臓,腎臓および生殖器への影響が認められたこと,雌では1000 mg/kg群で肝臓および腎臓への影響が認められたことから,本試験におけるフタル酸ジヘプチルエステル投与による無影響量は,雄で62.5 mg/kg/day,雌で 250 mg/kg/dayであると考えられた.
投与には,被験物質を 12.5,50および200 mg/mlの濃度となるようにオリーブ油(日本薬局方,ヤクハン製薬(株))で用時溶解したものを用いた.各濃度の調製液は規定の濃度であることが確認されている.
動物は,温度 23±3℃,湿度55±10%,換気回数10〜15回/時および照明12時間/日に設定したバリアシステムの飼育室で,ブラケット式金属製金網床ケージに群分け前は5匹以内,群分け後は1匹を収容して飼育した.飼料は固型飼料 (CRF-1,オリエンタル酵母工業(株)),飲料水は水道水(札幌市水道水)をそれぞれ自由に摂取させた.
動物数は,対照群で雌雄各 14匹,62.5および250 mg/kg群で雌雄各7匹,1000 mg/kg群で雌雄各14匹とし,そのうち回復性試験のために対照群および1000 mg/kg群の雌雄各7匹をあてた.群分けは,馴化期間の最終日に体重別層化無作為抽出法により行った.
回復期間では,雌雄ともに対照群と比較して有意差は認められなかった.

回復期間では,雌の 1000 mg/kg群で摂餌量の減少が回復14日に認められた.
回復期間最終週には,雌雄ともに対照群と比較して有意差は認められなかった.
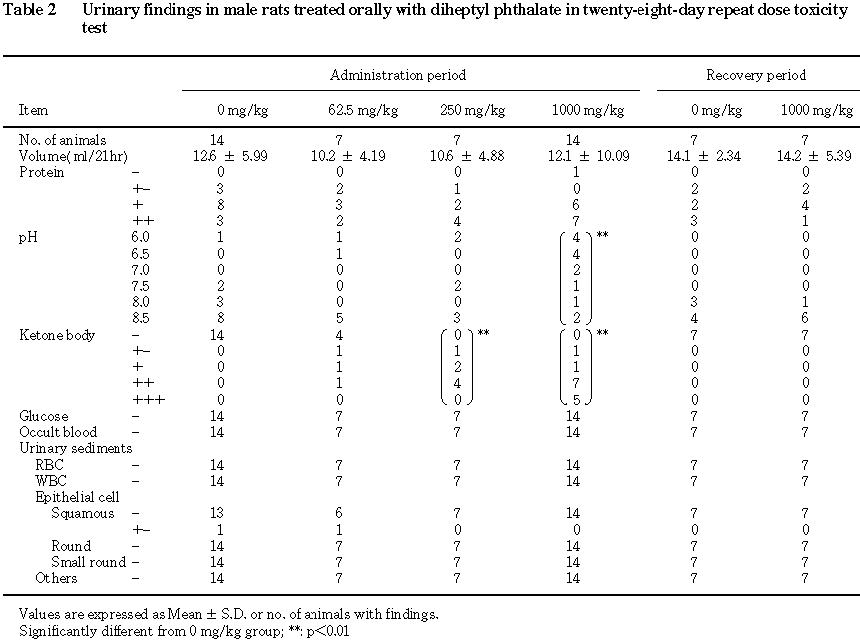
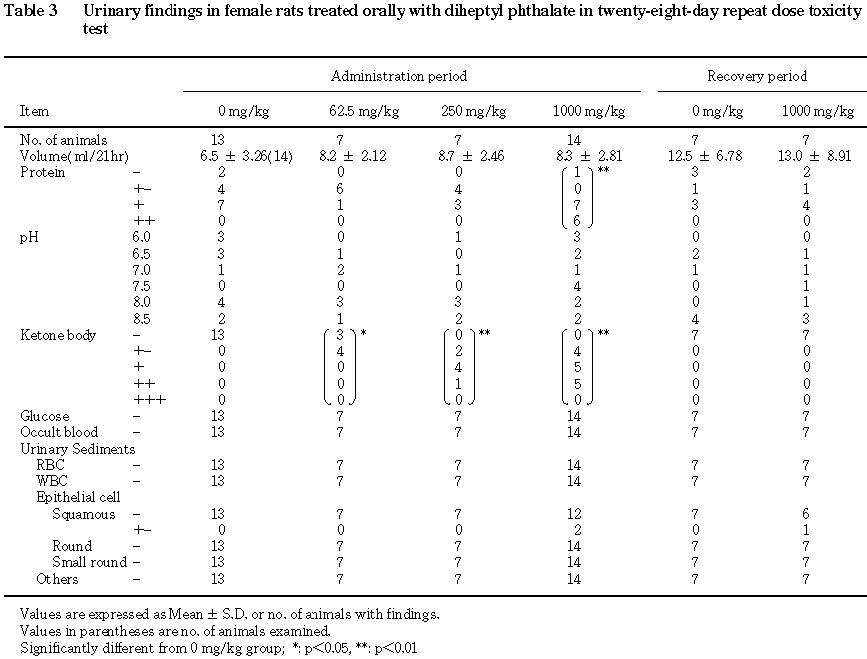
回復期間終了時には,雌雄ともに対照群と比較して有意差は認められなかった.
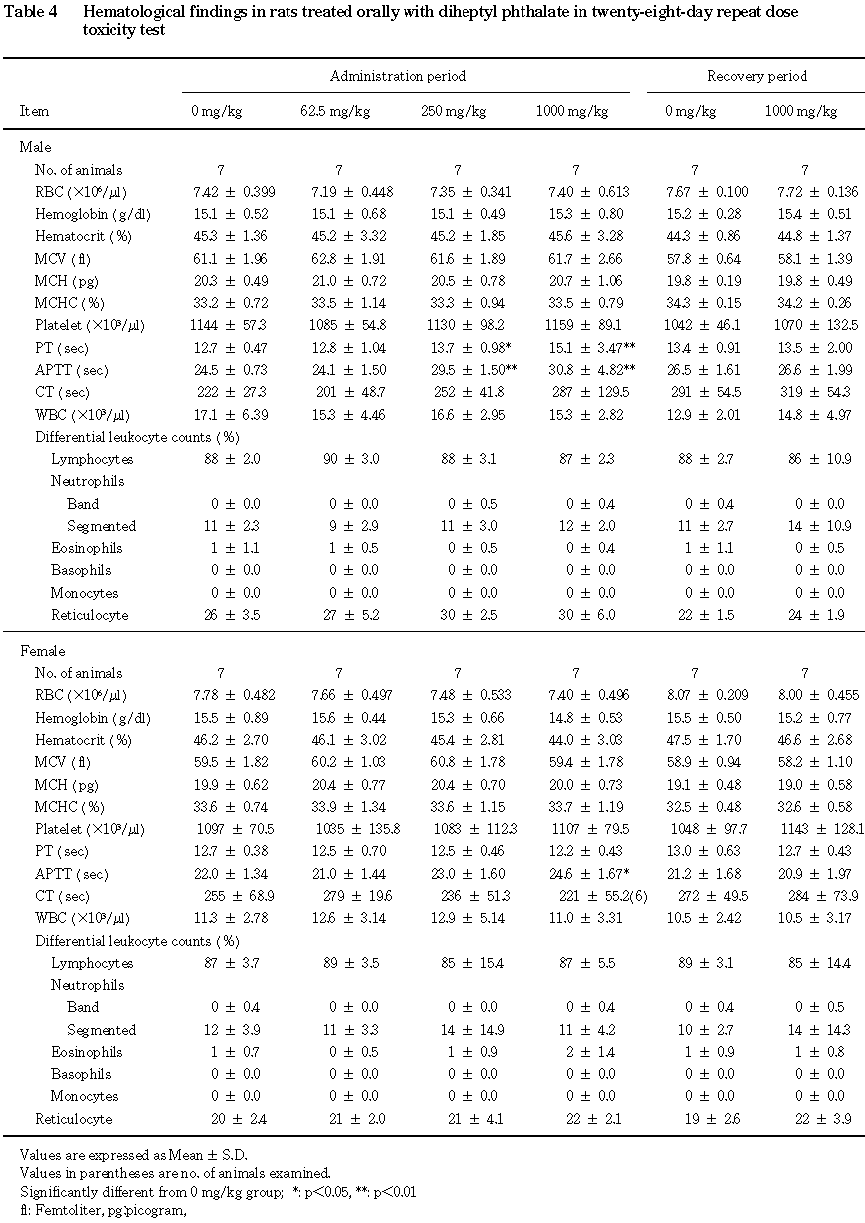
回復期間終了時には,投与期間終了時に認められた変動のうち,アセト酢酸の増加が雌の 1000 mg/kg群で認められた.その他,雄の1000 mg/kg群でアルカリフォスファターゼの減少,雌の1000 mg/kg群でa1-グロブリン分画の上昇が認められた.
回復期間終了時には,雄では, 1000 mg/kg群で精巣上体重量の減少が認められ,個体別には1000 mg/kg群の2例に精巣および精巣上体の重量の低値が認められた.雌では,1000 mg/kg群で腎臓の体重重量比の上昇が認められた.その他,雄の1000 mg/kg群で肺および精嚢重量の減少,腎臓の体重重量比の上昇,雌の1000 mg/kg群で子宮の体重重量比の上昇が認められた.
回復期間終了時には,小型の精巣および精巣上体が 1000 mg/kg群の雄2例に認められた.
回復期間終了時には,肝臓では,軽度の小葉中心性肝細胞肥大が 1000 mg/kg群の雄1例に認められた.精巣では,軽度,中等度および重度の精子形成細胞の消失が1000 mg/kg群の雄3例に認められた.精巣上体では,重度の管内精子減少が1000 mg/kg群の雄2例に,中等度の剥離性精子形成細胞の出現が1000 mg/kg群の雄2例に認められた.
その他,フタル酸ジヘプチルエステル投与による異常は認められなかった.
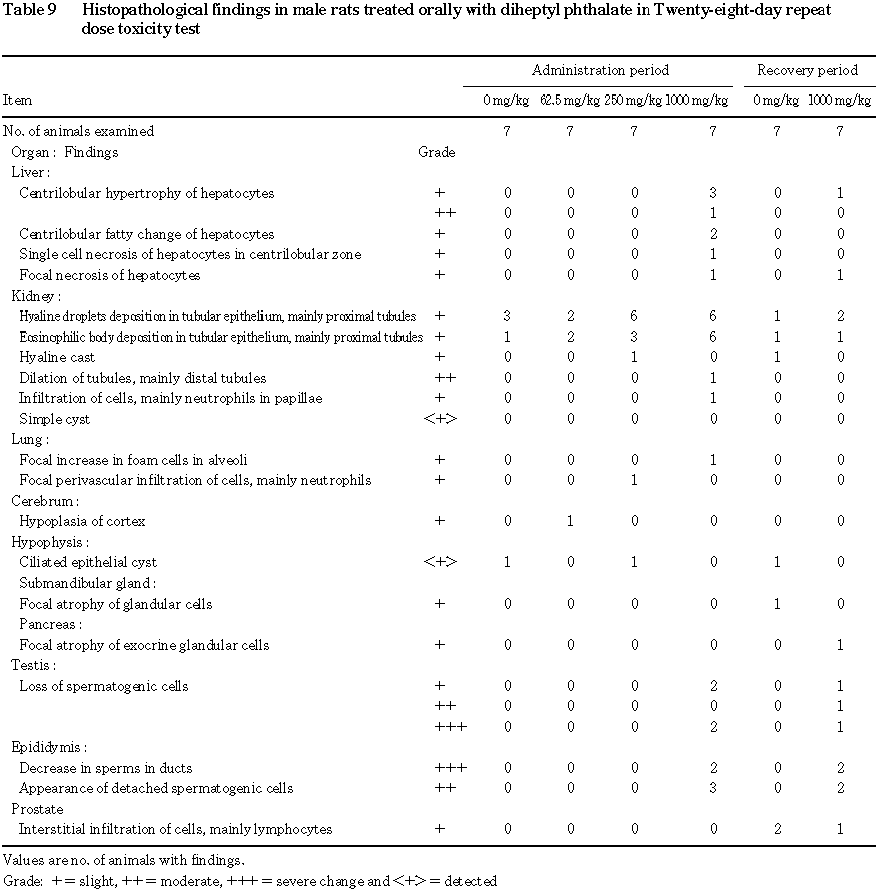

腎臓に対する影響として雌の 1000 mg/kg群で尿蛋白陽性例の増加および腎臓の体重重量比の上昇,雄の1000 mg/kg群で血清尿素窒素の増加が認められ,病理組織学的に形態の変化は認められないものの,フタル酸ジヘプチルエステル投与による腎臓への影響があるものと考えられた.
肝臓に対する影響として,雄では, 250 mg/kg以上の群でプロトロンビン時間および活性化部分トロンボプラスチン時間の延長,1000 mg/kg群で血清β-グロブリン分画の低下,肝臓体重重量比の上昇が認められた.さらに雄の1000 mg/kg群では,肝臓の病理組織学検査において小葉中心性肝細胞肥大,小葉中心性肝細胞脂肪化および小葉中心帯における肝細胞の単細胞性壊死が認められ,フタル酸ジヘプチルエステル投与による肝臓への影響が示唆された.雌では,1000 mg/kg群で活性化部分トロンボプラスチン時間の延長,血清アルブミン分画の上昇とβ-グロブリン分画の低下,肝臓重量の増加および体重重量比の上昇が認められたが,病理組織学的に肝臓の異常は認められず,影響の程度に雌雄差が認められた.
雄性生殖器に対する影響として,雄の 1000 mg/kg群で精巣および精巣上体の重量が減少して肉眼的にこれらの器官の小型が認められ,病理組織学検査では精巣に精子形成細胞の消失,精巣上体に管内精子減少および剥離性精子形成細胞の出現が認められた.雄性生殖器に対する影響は他のフタル酸エステルでも認められており1, 2),フタル酸ジヘプチルエステル投与でも同様の影響が確認された.
尿へのケトン体の排泄が雌雄のフタル酸ジヘプチルエステル投与群で認められ,雌の 1000 mg/kg群ではさらに血清中のアセト酢酸および3-デヒドロ酪酸の増加も認められた.尿へのケトン体の排泄および血中のケトン体の増加は飢餓,糖尿病,高脂肪−低炭水化物食等の際にみられるものであるが,本試験では糖尿病等の代謝異常を示唆する変化は認められず,飢餓等の状態にもなかった.一方,他のフタル酸エステルの代謝過程においてケトン体の生成が考えられること2, 3)から,フタル酸ジヘプチルエステルの代謝過程でもケトン体が生成・排泄された可能性が高く,本試験で認められた尿へのケトン体の排泄等はこれに起因するものと考えられた.また,雄の1000 mg/kg群におけるpHの低下は,前述したように血中に比較的強い酸の増加が認められることから,被験物質の代謝に関連したものと考えられた.
上述の変化のうち,精巣および精巣上体の変化は回復期間終了時にもほぼ同程度に認められ, 14日間の回復期間では回復は認められなかった.しかし,その他はその多くが14日間の回復期間終了時には消失し,回復傾向があるものと考えられた.
その他,血液生化学検査では,回復期間終了時に 1000 mg/kg群でアルカリフォスファターゼおよびa1-グロブリン分画に変動が認められたが,いずれも投与期間終了時に認められず,フタル酸ジヘプチルエステル投与との関連はないと考えられた.器官重量では,投与期間終了時に1000 mg/kg群で心臓および胸腺の体重重量比に上昇が認められたが,心臓については背景データの範囲内であり,胸腺についても実測重量は背景データの範囲内にあり,同群の体重が対照群と比較して低い傾向にあることによるものであり,フタル酸ジヘプチルエステル投与によるものではないと考えられた.また,回復期間終了時には1000 mg/kg群で肺,精嚢,腎臓および子宮の重量あるいは体重重量比に変動が認められたが,いずれも投与期間終了時には認められず,フタル酸ジヘプチルエステル投与によるものではないと考えられた.
以上より,雄では 250 mg/kg群でプロトロンビン時間および活性化部分トロンボプラスチン時間の延長が認められ,1000 mg/kg群で肝臓,腎臓および生殖器への影響が認められたこと,雌では1000 mg/kg群で肝臓および腎臓への影響が認められたこと,尿へのケトン体排泄については被験物質の代謝産物に起因すると考えられることから,本試験におけるフタル酸ジヘプチルエステル投与による無影響量は,雄で62.5 mg/kg/day,雌で250 mg/kg/dayであると考えられた.
| 1) | 和田 攻 編,"毒性試験講座 18.産業化学物質,環境化学物質",地人書館,東京,1991,pp.165-166. |
| 2) | K. N. Woodward eds., "Toxicity Review 14 Review of the toxicity of the esters of ophthalmic acid (phthalate esters)", Health and Safety Executive,London, p.183. |
| 3) | B. D. Astill, Drug metabolism reviews, 21, 35 (1995). |
| 連絡先 | |||
| 試験責任者: | 小林典子 | ||
| 試験担当者: | 茂野 均,長谷淳一,古川正敏 | ||
| 運営管理者: | 小林茂吉 | ||
| (株)化合物安全性研究所 | |||
| 〒004 北海道札幌市豊平区真栄363番24号 | |||
| Tel 011-885-5031 | Fax 011-885-5313 | ||
| Correspondence | |||
| Authors: | Noriko Kobayashi(Study director) Hitoshi Shigeno, Jun-ichi Nagaya, Masatoshi Furukawa, Shigeyoshi Kobayashi (Management) | ||
| Safety Research Institute for Chemical Compounds Co., Ltd. | |||
| 363-24 Shin-ei, Toyohira-ku, Sapporo, Hokkaido, 004, Japan | |||
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | ||