3-フェノキシトルエンのラットを用いる28日間反復経口投与毒性試験
Twenty-eight-day Repeat Dose Oral Toxicity Test of 3-Phenoxytoluene in Rats
要約
3-フェノキシトルエンは,農薬の原料や感圧複写紙用溶剤として用いられている1).今回,既存化学物質の安全性点検に係わる毒性調査事業の一環として,3-フェノキシトルエンを0,4,20,100および500 mg/kgの用量でSD系ラットの雌雄に28日間反復経口投与し,その毒性について検討した.対照群,100および500 mg/kg群については14日間回復群を設けた.
摂餌量の低値が500 mg/kg群の雌,摂水量の高値が500 mg/kg群の雌雄で認められた.血液学検査では,活性化部分トロンボプラスチン時間の短縮が500 mg/kg群の雄,血小板数の低値が100および500 mg/kg群の雌で認められた.血液生化学検査では,アルブミンおよびA/G 比の高値が500 mg/kg群の雌雄,総コレステロール,トリグリセライド,無機リンの低値が500 mg/kg群の雄,アルカリフォスファターゼおよび尿素窒素の高値とグルコースの低値が500 mg/kg群の雌で認められた.尿検査では,統計学的には有意ではないが明らかな尿量の増加が500 mg/kg群の雌雄で認められた.病理学検査では,肝臓の変化として絶対重量と相対重量の高値および小葉中心性の肝細胞肥大が500 mg/kg群の雌雄で認められた.これらの変化は,投与を止めることにより軽減ないし回復していた.雄の100 mg/kg群と雌の20 mg/kg 群では被験物質投与に起因した変化は認められなかった.
以上の結果より,本試験条件下における3-フェノキシトルエンの無影響量は雄が100 mg/kg/day,雌が20 mg/kg/dayであると判断した.
方法
1.被験物質
3-フェノキシトルエン(関東化学(株),CAS No. 3586-14-9,Lot No. FAW01,純度99.0%)は,沸点271〜273℃,水に不溶の無色透明液体である.本ロットは投与期間中安定であることが確認された.投与液は被験物質を0.1%Tween80水溶液に乳化させ調製し,冷蔵保存した.投与液中の被験物質は冷蔵保存条件下で8日間安定であり,使用した投与液にはほぼ所定量の被験物質が均一に含有されていることを確認した.
2.試験動物および飼育条件
日本チャールス・リバー(株)より入手したSD系ラット(Crj:CD,SPF)の雌雄を8日間検疫・馴化し,試験に使用した.投与開始前に体重別層化無作為抽出法により群分けした.1群の動物数は雌雄各6匹とし,対照群,100 および500 mg/kg群については雌雄各6 匹の14日間回復群を設けた.投与開始時の週齢は5週齢,体重範囲は雄が167〜198 g,雌が132〜163 gであった.
検疫・馴化期間を含めた全飼育期間中,温度20〜25℃,湿度40〜70%,換気約12回/時,照明12時間(7:00〜19:00)に自動調節された飼育室を使用した.動物は,実験動物用床敷(ベータチップ:日本チャールス・リバー(株))を敷いたポリカーボネート製ケージに1 ケージあたり2匹で収容し飼育した.
動物には,実験動物用固型飼料(MF:オリエンタル酵母工業(株))および5μmのフィルター濾過後,紫外線照射した水道水を,それぞれ自由に摂取させた.
3.投与量および投与方法
被験物質を0,100,500および1000 mg/kgの各用量でSD系ラットに14日間反復経口投与した結果,1000 mg/kg群では雌雄各1例が死亡し,剖検で胃に出血が認められた.また,500および1000 mg/kg群では投与後の流涎,1000 mg/kg群の雌雄で自発運動量の減少,500 mg/kg群の雌と1000 mg/kg群の雌雄で体重増加抑制,500および1000 mg/kg群の雌雄で肝臓の絶対重量と相対重量の高値が認められた.従って,本試験では高用量を 500 mg/kgとし,以下公比5で中間量を100および20 mg/kg,低用量を4 mg/kgとした.被験物質は28日間毎日1回,午前中に胃ゾンデを用いて強制経口投与した.投与液量は10 ml/kgとし,至近測定日の体重を基に算出した.対照群には同様に溶媒を投与した.
4.観察および検査方法
1) 一般状態,体重,摂餌量および摂水量
全例について一般状態を毎日観察した.体重,摂餌量および摂水量は投与開始日およびその後週1回測定した.摂餌量と摂水量については,各期間毎の1匹あたりの1日平均摂取量を算出した.
2) 血液学検査
各計画殺時の全例について,チオペンタールナトリウムの腹腔内投与による麻酔下で後大静脈より採血し,赤血球数(シースフローDCインピーダンス検出法),白血球数(RF/DCインピーダンス検出法),血小板数(シースフローDCインピーダンス検出法),ヘモグロビン濃度(SLSヘモグロビン法),ヘマトクリット値(赤血球パルス波高値検出法)を多項目自動血球分析装置(NE-4500:東亞医用電子(株)),白血球百分率(Wright 染色塗抹標本)を血液細胞自動分析装置(MICROX HEG-70A:立石電機(株)),網状赤血球数(アルゴンレーザーを用いたフローサイトメトリー法)を自動網赤血球測定装置(R-2000:東亞医用電子(株)),プロトロンビン時間(PT;Quick 一段法),活性化部分トロンボプラスチン時間(APTT;活性化セファロプラスチン法)を血液凝固自動測定装置(KC10A:アメルング社)により測定した.また,検査の結果から平均赤血球容積(MCV),平均赤血球血色素量(MCH),平均赤血球血色素濃度(MCHC)を算出した.凝固阻止剤として,プロトロンビン時間および活性化部分トロンボプラスチン時間測定には3.13%クエン酸ナトリウム水溶液を,それ以外の項目の測定にはEDTA-2Kを用いた.
3) 血液生化学検査
採取した血液の一部を約30分間静置した後,3000 r.p.m.で10分間遠心分離し,得られた血清を用いて GOT(SSCC改良法),GPT(SSCC改良法),ALP(GSCC改良法),γ-GTP(SSCC改良法),尿素窒素(Urease-GLDH法),グルコース(GK-G6PDH法),総コレステロール(CES-CO-POD法),トリグリセライド(LPL-GK-G3PO-POD法),クレアチニン(Jaff 法),総蛋白(Biuret 法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(O-CPC法),無機リン(UV法),ナトリウム,カリウム,クロール(イオン選択電極法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
法),総蛋白(Biuret 法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(O-CPC法),無機リン(UV法),ナトリウム,カリウム,クロール(イオン選択電極法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
4) 尿検査
投与開始後26日および回復開始後12日に各群雌雄6匹の新鮮尿を採取して,pH,潜血,蛋白,糖,ケトン体,ビリルビン,ウロビリノーゲン(試験紙法,マルティスティックス,マイルス・三共(株))を尿分析器(クリニテック100:マイルス・三共(株)),尿量をメスシリンダー,比重(屈折法)を尿比重計(ユリコン-S:(株) アタゴ社),ナトリウムおよびカリウム(炎光光度法)を全自動炎光光度計(FLAME-30C/AD-3:(株)日本分光メディカル),クロール(電量滴定法)をクロライドメーター(Model 925:コーニングメディカル(株))により測定した.
5) 病理学検査
全例について採血後に腹大動脈を切断して放血致死させ剖検した.剖検後,全例の脳,肝臓,腎臓,副腎,胸腺,脾臓,精巣および卵巣の重量を測定した.また,全例の上記器官に加え,下垂体,眼球,ハーダー腺,肺,胃,甲状腺および上皮小体,心臓,膀胱,骨髄(大腿骨)を採取し,10%中性リン酸緩衝ホルマリン液で固定,保存した.ただし,眼球およびハーダー腺はDavidson 液で固定した.
投与期間終了時解剖動物の対照群および500 mg/kg群の雌雄の心臓,肝臓,脾臓,腎臓,副腎,胃と両群の雌の骨髄(大腿骨)および全例の肉眼的異常部位を対象に,常法に従いヘマトキシリン・エオジン染色標本を作製し鏡検した.その結果,肝臓に被験物質投与に起因すると考えられる変化が認められたため,投与期間終了時解剖動物の他の群と回復期間終了時解剖動物の全例の肝臓を検査した.
6) 統計解析
計量データについては,Bartlett法による等分散の検定を行い,分散が一様の場合は一元配置分散分析を行った後,Dunnett法またはScheff 法により検定した.分散が一様でない場合はKruskal-Wallisの検定を行い,Dunnett型またはScheff
法により検定した.分散が一様でない場合はKruskal-Wallisの検定を行い,Dunnett型またはScheff 型の順位和検定を行った.計数データおよび病理組織所見については,Armitageのχ^2検定を行った.有意水準は 5%未満とした.
型の順位和検定を行った.計数データおよび病理組織所見については,Armitageのχ^2検定を行った.有意水準は 5%未満とした.
結果
1.一般状態
投与後の流涎が100 mg/kg群の雄で投与開始後8日以降,雌で投与開始後12日以降,500 mg/kg群の雄で投与開始後5日以降,雌で投与開始後1日以降に発現した.また,投与前の流涎が500 mg/kg群の雌2例で投与開始後25日に認められた.投与後の流涎は,投与直後に発現する一過性の変化であり,投与前の流涎は動物の体に触れることにより発現した.回復期間中には,これらの変化は認められなかった.
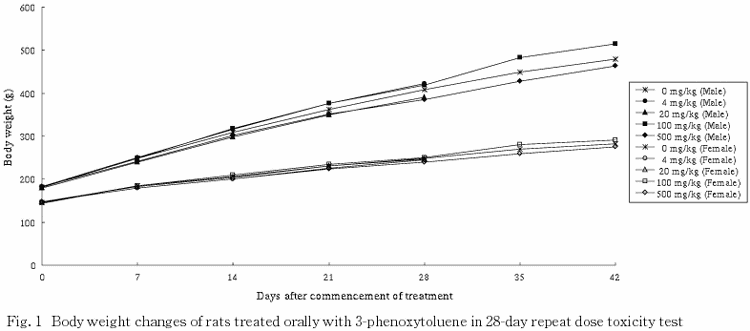
2.体重(Fig.1)
全試験期間を通じて,いずれの投与群も対照群と同様の体重の推移を示した.
3.摂餌量
摂餌量の低値が投与開始週および投与開始後3週に500 mg/kg群の雌で認められた.回復期間中には,本変化は認められなかった.
4.摂水量
摂水量の高値が 500 mg/kg群の雄で投与開始後3週,雌で投与開始後1〜3週に認められた.回復期間中には,本変化は認められなかった.
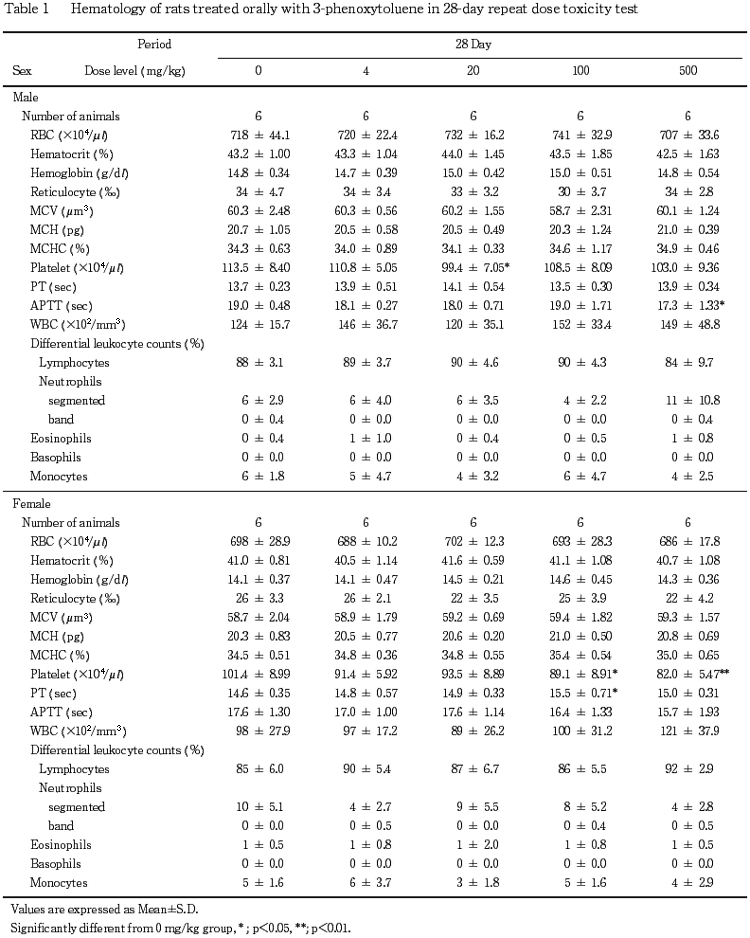
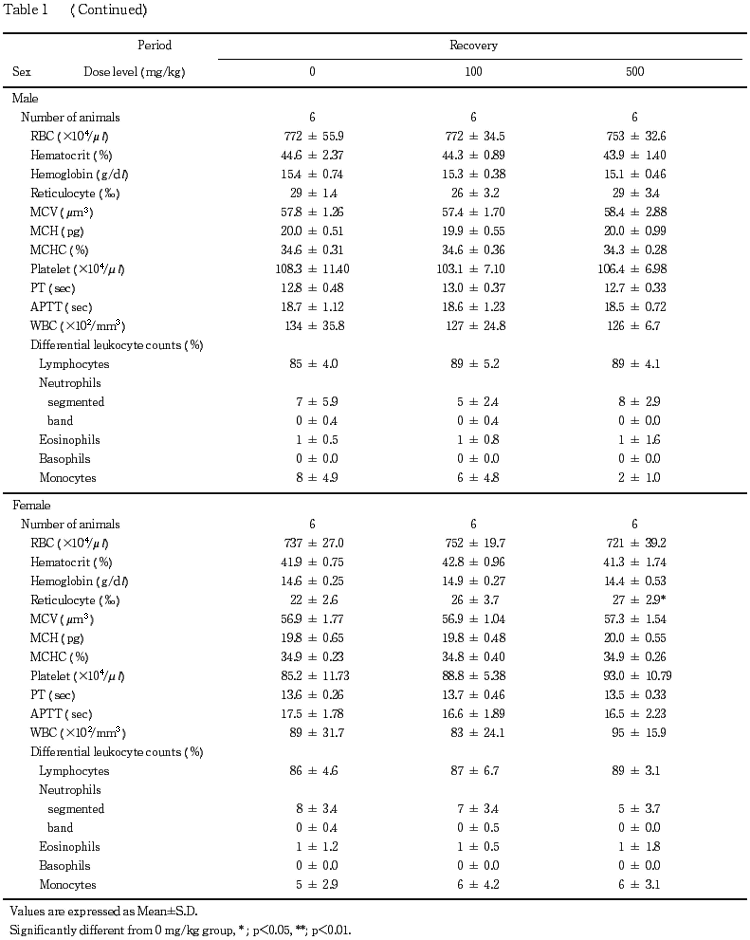
5.血液学検査(Table 1)
投与期間終了時の検査で,活性化部分トロンボプラスチン時間(APTT)の短縮が500 mg/kg群の雄,血小板数の低値が100および500 mg/kg群の雌で認められた.回復期間終了時の検査では,これらの変化は認められなかった.
なお,投与期間終了時の検査で血小板数の低値が20 mg/kg群の雄,プロトロンビン時間(PT)の延長が100 mg/kg群の雌で,また回復期間終了時の検査で網状赤血球数の高値が500 mg/kg群の雌で認められたが,いずれも軽微な変動であることやその発現状況から被験物質に起因した変化ではないと判断した.
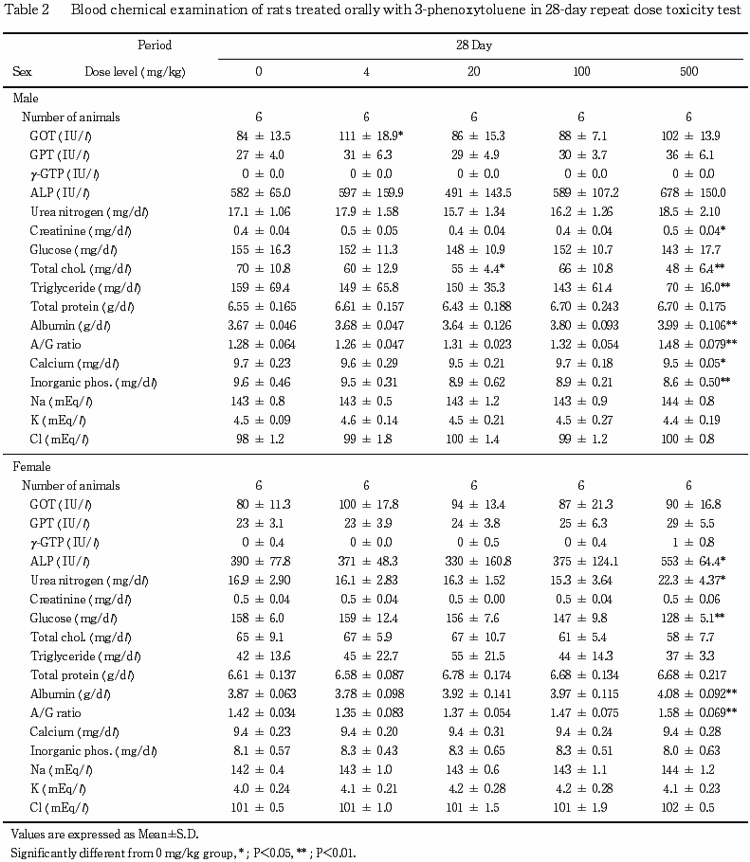
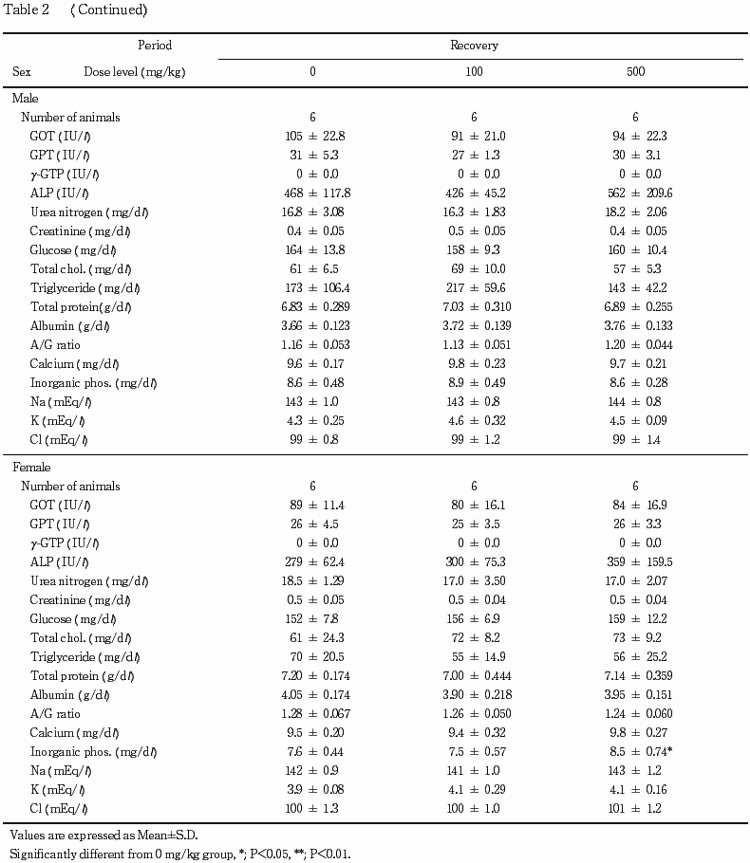
6.血液生化学検査(Table 2)
投与期間終了時の検査で,アルブミンおよびA/G 比の高値が500 mg/kg群の雌雄,総コレステロール,トリグリセライドおよび無機リンの低値が500 mg/kg群の雄,アルカリフォスファターゼと尿素窒素の高値とグルコースの低値が500 mg/kg群の雌で認められた.回復期終了時の検査では,これらの変化は認められなかった.
なお,投与期間終了時の検査でクレアチニンの高値とカルシウムの低値が500 mg/kg群の雄,総コレステロールの低値が20 mg/kg群の雄,GOT の高値が4 mg/kg群の雄で,また回復期間終了時の検査で無機リンの高値が500 mg/kg群の雌で認められたが,いずれも軽微な変動であることやその発現状況から被験物質に起因した変化ではないと判断した.
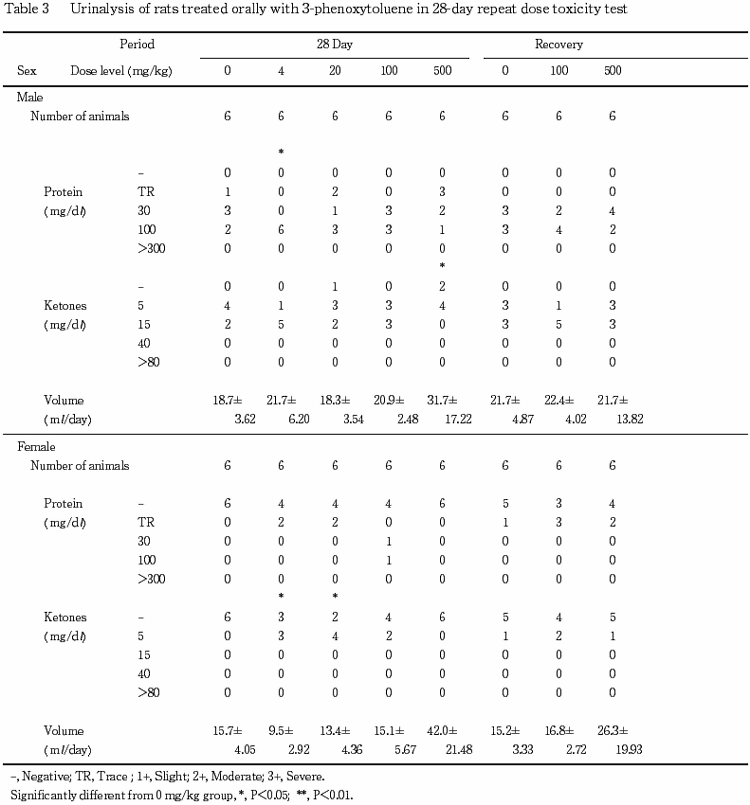
7.尿検査(Table 3)
投与期間中の検査で,統計的には有意でないが明らかな尿量の増加が500 mg/kg群の雌雄で認められた.回復期間中の検査では,500 mg/kg群の雌で尿量の増加傾向がみられたが,その程度は軽減していた.
なお,投与期間中の検査でケトン体の低値が500 mg/kg群の雄,蛋白の高値が4 mg/kg群の雄,ケトン体の高値が4および20 mg/kg群の雌で認められたが,いずれも軽微な変動であることやその発現状況から被験物質に起因した変化ではないと判断した.
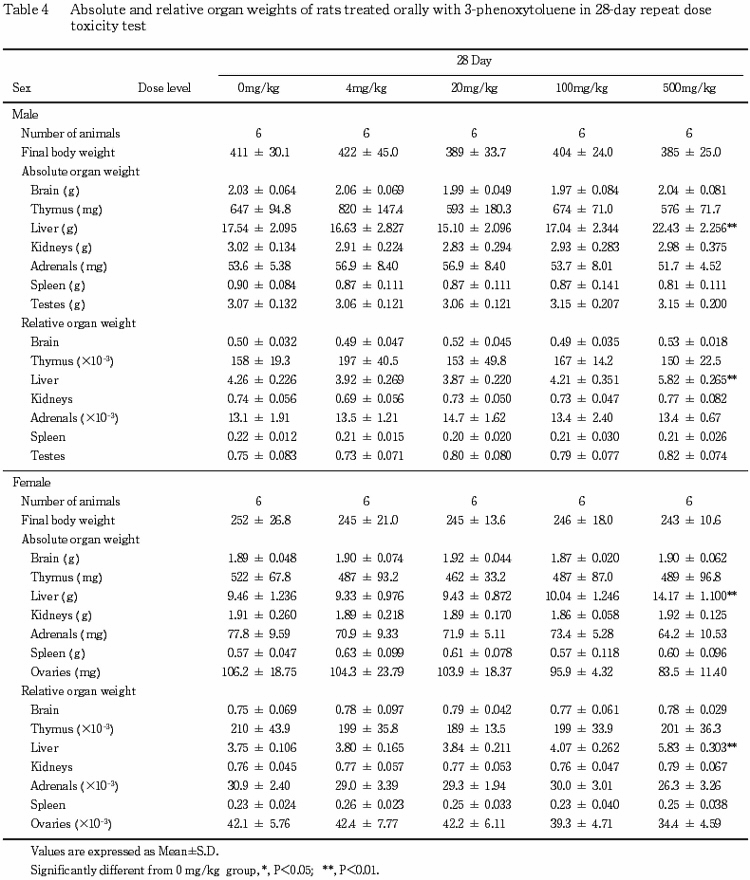
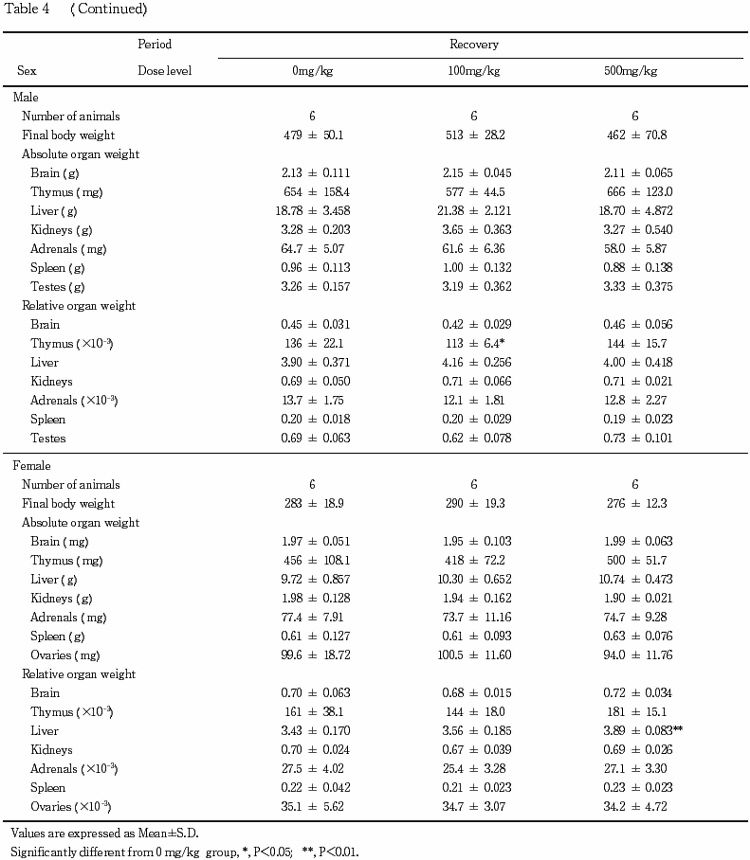
8.器官重量(Table 4)
投与期間終了時の検査で,肝臓の絶対重量および相対重量の高値が500 mg/kg群の雌雄で認められた.回復期間終了時の検査では,肝臓の相対重量の高値が500 mg/kg群の雌で認められたが,その程度は軽減していた.
なお,回復期間終了時の検査で胸腺の相対重量の低値が100 mg/kg群の雄で認められたが,その発現状況から被験物質に起因した変化ではないと判断した.
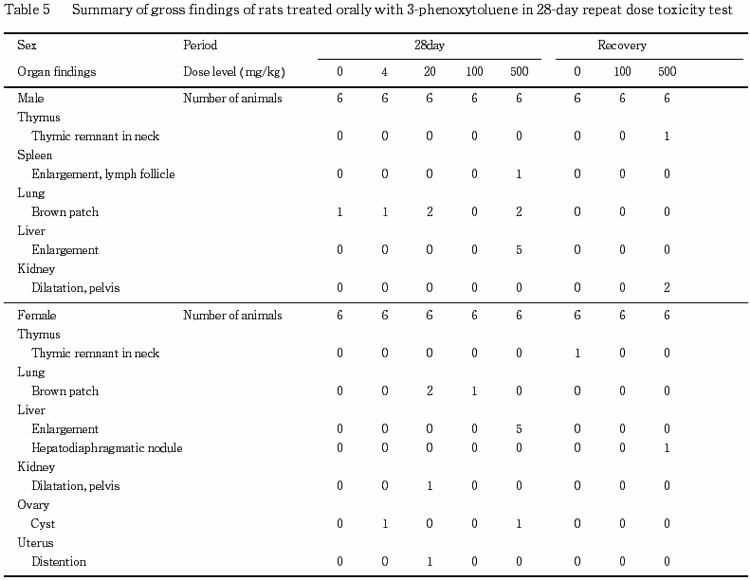
9.剖検所見(Table 5)
投与期間終了時の検査で,肝臓の腫大が500 mg/kg群の雌雄各5例に認められた.回復期間終了時の検査では,本変化は認められなかった.
その他,被験物質投与群に種々の変化がみられたが,その発現状況からいずれも被験物質に起因した変化ではないと判断した.
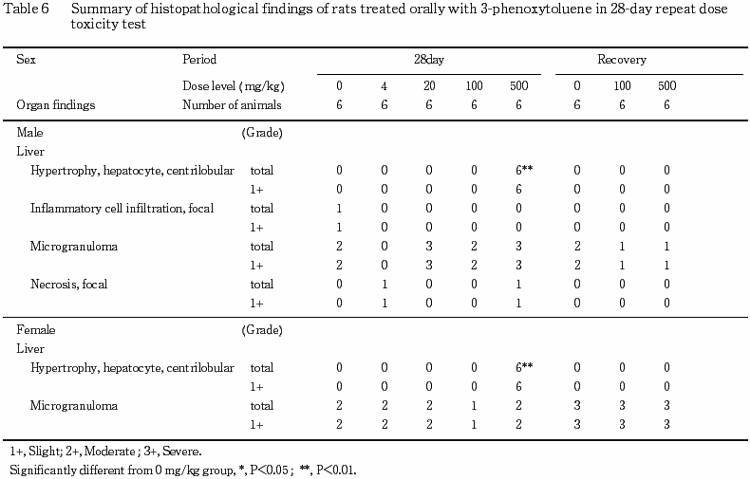
10.病理組織所見(Table 6)
投与期間終了時解剖動物の検査で,肝臓の小葉中心性の肝細胞肥大が500 mg/kg群の雌雄全例に認められた.回復期間終了時解剖動物の検査では,本変化は認められなかった.
その他,被験物質投与群で種々の変化が認められたが,その発現状況からいずれも被験物質に起因した変化ではないと判断した.
考察
3-フェノキシトルエンを0,4,20,100,500 mg/kgの用量でSD系ラットの雌雄に28日間反復経口投与し,その毒性を検討した.
一般症状として,投与後の流涎が100および500 mg/kg群の雌雄,投与前の流涎が500 mg/kg群の雌で発現した.しかし,投与後の流涎は投与直後に発現する一過性の変化であり,投与前の流涎は動物の体に触れることによって発現する条件反射的な変化であることや,これらの変化は投与をやめることにより発現しないことから,被験物質の味等に起因した変化であり,毒性学的意義はないと判断した.従って,本変化は無影響量の評価の対象からは除外した.
体重に変化はみられなかったが,摂餌量の低値が500 mg/kg群の雌で認められた.本変化は,投与を中止することにより回復した.
摂水量の高値と統計的には有意ではないが明らかな尿量の増加が500 mg/kg群の雌雄で認められた.しかし,腎臓には器質傷害性の変化がみられないことから,被験物質の利尿作用が示唆された.これらの変化は,投与を中止することにより回復あるいは軽減した.
血液学検査で,血小板数の低値が100および500 mg/kg群の雌で認められたが,骨髄や脾臓に血小板の産生低下や破壊亢進を示唆する変化は認められなかった.また,活性化部分トロンボプラスチン時間の短縮が500 mg/kg群の雄で認められた.これらの変化は投与を中止することにより回復した.
血液生化学検査で,アルブミンおよびA/G 比の高値が500 mg/kg群の雌雄で認められた.同群では肝肥大が伴われていることから,肝臓での蛋白合成が亢進したことによるものと思われる.また,総コレステロールおよびトリグリセライドの低値が500 mg/kg群の雄で認められ,被験物質の脂質代謝への影響が示唆された.その他,尿量の増加に伴うと思われる無機リンの低値が500 mg/kg群の雄,摂餌量の低下に伴うと思われるグルコースの低値が500 mg/kg群の雌で認められた.また,アルカリフォスファターゼと尿素窒素の高値が 500 mg/kg 群の雌で認められたが,これらの変化に関連すると思われる肝臓あるいは腎臓の器質傷害性変化はみられなかった.これらの変化はいずれも投与を中止することにより回復した.
病理学検査では,肝臓の重量増加,腫大および小葉中心性の肝細胞肥大が500 mg/kg群の雌雄で認められた.小葉中心性の肝細胞肥大は,薬物代謝酵素誘導に伴って発現することが良く知られており,生体の適応現象と考えられている2).これらの変化は投与を中止することにより回復した.
上記の試験結果から,本試験条件下における3-フェノキシトルエンの無影響量は,雄が100 mg/kg/day,雌が20 mg/kg/dayと結論した.
文献
| 1) | 化学工業日報社編,“新化学インデックス," 化学工業日報社,東京,1994,p 537. |
| 2) | C. Gopinath, D.E. Prentis and D.J. Lewis, "Atlas of Experimental Toxicological Pathology," eds. by C. Gopinath, D.E. Prentis, D.J. Lewis, MTP Press, Lancaster, 1987, pp.43-60. |
| 連絡先 |
| 試験責任者: | 須藤雅人 |
| 試験担当者: | 大保真由美,土谷 稔,岡崎欣正,豊田直人,高野克代,井澤 修,鈴木美江 |
| (株)三菱化学安全科学研究所 鹿島研究所 |
| 〒314-02 茨城県鹿島郡波崎町砂山14 |
| Tel 0479-46-2871 | Fax 0479-46-2874 | |
| Correspondence |
| Authors: | Masato Sudo(Study director)
Mayumi Ohbo,Minoru Tsuchitani,Yoshimasa Okazaki,Naoto Toyota,Katsuyo Takano,Osamu Izawa,Yoshie Suzuki |
| Mitsubishi Chemical Safety Institute Ltd., Kashima Laboratory |
| 14 Sunayama,Hasaki-machi,Kashima-gun, Ibaraki,314-02 Japan |
| Tel +81-479-46-2871 | Fax +81-479-46-2874 | |

 法),総蛋白(Biuret 法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(O-CPC法),無機リン(UV法),ナトリウム,カリウム,クロール(イオン選択電極法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
法),総蛋白(Biuret 法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(O-CPC法),無機リン(UV法),ナトリウム,カリウム,クロール(イオン選択電極法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
 法により検定した.分散が一様でない場合はKruskal-Wallisの検定を行い,Dunnett型またはScheff
法により検定した.分散が一様でない場合はKruskal-Wallisの検定を行い,Dunnett型またはScheff 型の順位和検定を行った.計数データおよび病理組織所見については,Armitageのχ^2検定を行った.有意水準は 5%未満とした.
型の順位和検定を行った.計数データおよび病理組織所見については,Armitageのχ^2検定を行った.有意水準は 5%未満とした.









