1,2,4-ベンゼントリカルボン酸トリス(2-エチルヘキシル)エステルの
ラットを用いる経口投与簡易生殖毒性試験
Preliminary Reproduction Toxicity Screening Test of
Tris(2-ethylhexyl) 1,2,4-benzenetricarboxylate by Oral Administration in Rats
要約
1,2,4-ベンゼントリカルボン酸トリス(2-エチルヘキシル)エステルの100,300および1000 mg/kgを雄ラットに対しては交配前,交配期間および交配後の計46日間,雌ラットに対しては交配前,交配および妊娠期間,ならびに哺育3日までの期間,経口反復投与し,雌雄ラットへの反復投与による影響,雌雄ラットの生殖および次世代の発生に及ぼす影響についてスクリーニング試験を実施して,以下の知見を得た.
反復投与毒性では,雄の精巣の病理組織学検査で300 mg/kg群の2例および1000 mg/kg群の12例全例に精母細胞および精子細胞の減少が認められた.雌雄の一般状態,体重推移,摂餌量,剖検所見,生殖器重量および卵巣の病理組織学所見にはいずれの投与群においても被験物質投与による影響は認められなかった.以上のことから,1,2,4-ベンゼントリカルボン酸トリス(2-エチルヘキシル)エステルの反復投与による無影響量は,雄で100 mg/kg/day,雌で1000 mg/kg/dayであると判断された.
生殖発生毒性では,上述の如く雄の精巣に病理組織学的変化が認められたが,生殖能検査,生殖器重量,分娩および母性行動,新生児の生存率,一般状態,体重推移および剖検所見に被験物質投与による影響は認められなかった.以上のことから,1,2,4-ベンゼントリカルボン酸トリス(2-エチルヘキシル)エステルの雄の生殖に対する無影響量は100 mg/kg/day,雌の生殖に対する無影響量は1000 mg/kg/day,次世代の発生に対する無影響量は1000 mg/kg/dayであると判断された.
方法
1. 被験物質
1,2,4-ベンゼントリカルボン酸トリス(2-エチルヘキシル)エステルは,淡黄色透明液体であり,遮光気密容器に入れ,室温で保存した.本試験では,大八化学工業 製造のロット番号N-80301(純度:99.0 %)を使用した.なお,被験物質は投与期間中安定であったことが製造業者の分析により確認された.
製造のロット番号N-80301(純度:99.0 %)を使用した.なお,被験物質は投与期間中安定であったことが製造業者の分析により確認された.
投与には,被験物質を20,60および200 mg/mLの濃度となるようにトウモロコシ油(片山化学工業 )に溶解して調製した.調製頻度は7日間に1回以上とし,投与に用いるまで遮光気密容器に入れ,室温で保存した.各濃度の調製液は規定の濃度であり,かつ均一であることがエヌシー技研
)に溶解して調製した.調製頻度は7日間に1回以上とし,投与に用いるまで遮光気密容器に入れ,室温で保存した.各濃度の調製液は規定の濃度であり,かつ均一であることがエヌシー技研 により確認された.
により確認された.
2. 試験動物および飼育条件
生後8週齢のCrj:CD(SD)系のSPFラットを日本チャールス・リバー から受け入れ,14日間の検疫・馴化を行い,順調な発育を示した動物を試験に用いた.雌については,10日間の性周期検査を併せて行い,性周期に異常の認められない動物を用いた.
から受け入れ,14日間の検疫・馴化を行い,順調な発育を示した動物を試験に用いた.雌については,10日間の性周期検査を併せて行い,性周期に異常の認められない動物を用いた.
動物は,温度23±3℃,湿度55±10 %,換気回数10〜15回/時間および照明時間12時間に設定されたバリアシステムの飼育室において,ブラケット式金属製金網床ケージを用いて飼育した.雌は,妊娠17日から金網床のかわりに実験動物用床敷(ホワイトフレーク,日本チャールス・リバー )を敷いたステンレス製受皿を使用した.ケージ当たりの収容匹数は,群分け前は2匹以内,群分け後は1匹,交配中は雌雄各1匹,妊娠期間中は1母動物,哺育期間中は1腹とした.飼料は固形飼料(CRF-1,オリエンタル酵母工業
)を敷いたステンレス製受皿を使用した.ケージ当たりの収容匹数は,群分け前は2匹以内,群分け後は1匹,交配中は雌雄各1匹,妊娠期間中は1母動物,哺育期間中は1腹とした.飼料は固形飼料(CRF-1,オリエンタル酵母工業 )を金属製給餌器を用いて,飲料水は水道水(札幌市水道水)を自動給水装置を用いて,それぞれ自由に摂取させた.
)を金属製給餌器を用いて,飲料水は水道水(札幌市水道水)を自動給水装置を用いて,それぞれ自由に摂取させた.
3. 投与量の設定,試験群の構成および群分け
1,2,4-ベンゼントリカルボン酸トリス(2-エチルヘキシル)エステルの100,300および1000 mg/kgを雌雄各5例に14日間反復経口投与した予備試験では,雌の100および1000 mg/kg群で摂餌量の低値傾向,雌の1000 mg/kg群で体重の低値傾向がみられた.したがって,最高用量は親動物に対して毒性を与えるが死亡させない量として,予備試験と同じ 1000 mg/kg/dayとし,以下,予備試験と同じく公比約3で,300および100 mg/kg群を設定した.さらに媒体であるトウモロコシ油を投与する対照群を設け,計4群とし,動物数は1群当たり雌雄各12匹を用いた.群分けは,投与開始前日に投与開始前々日の体重値をもとに各群の体重が均一になるように体重別層化無作為抽出法を用いて行った.
4. 投与方法
投与経路は経口投与とし,胃ゾンデを用いて強制的に胃内に投与した.
投与期間は,雄については交配前14日間および交配期間を含む46日間,雌については交配前14日間および交尾までの交配期間,さらに交尾例は妊娠期間および哺育3日までの期間とした.
投与容量は,体重1 kg当たり5 mLとして投与日に当日または最も近い日の体重に基づいて算出した.投与は10週齢から開始し,投与開始時の平均体重(体重範囲)は雄で401.2 g(373〜435 g),雌で 237.4 g(217〜257 g)であった.
5. 観察,測定および検査項目
(1) 一般状態
一般状態は,1日1回以上の頻度で,視診および触診により行動,外観を観察した.
(2) 体重測定
体重は,投与1日(投与前),投与2,5,7,10および14日,その後は雄については7日毎(投与終了日を含む)および剖検日に,雌については妊娠0,1,3,5,7,10,14,17および20日,哺育0,1および4日に,また交配期間中(雄と同居中)は相手雄の測定日と同じ日に電子天秤を用いて体重を測定した.雄については投与1から46日の,雌については投与1から14日,妊娠0から20日および哺育0から4日の体重増加量および体重増加率を算出した.
(3) 摂餌量測定
摂餌量は,雄については交配期間および剖検日を除き,雌については妊娠0日および哺育0日を除き体重測定日と同じ日(投与終了日を除く)に電子天秤を用いて測定した.
(4) 剖検および器官重量測定
雄については交尾成立例は投与46日の翌日に,交尾不成立例は交配期間終了の翌日に,エーテル麻酔下で採血後,放血致死させ,全身の器官および組織を肉眼的に観察した.雌については交尾不成立例は交配期間終了の翌日に,哺育3日まで生存児のみられた例は哺育4日に,妊娠25日まで分娩の認められない例は妊娠26日に,エーテル麻酔下で放血致死させ,全身の器官および組織を肉眼的に観察し,子宮の着床痕および卵巣の妊娠黄体を計数した.さらに,雌雄の全例について,精巣,精巣上体および卵巣の重量を電子天秤を用いて測定するとともに,器官体重重量比を算出した.
(5) 病理組織学検査
雄全例の精巣および精巣上体について,パラフィン包埋後薄切し,ヘマトキシリン・エオジン染色標本あるいは精巣のセルトリ細胞を確認するため,ストレプトアビジン・ビメンチン法を用いた免疫酵素抗体染色標本を作製し,病理組織学検査を行った.また,Matsui et al. の方法1)に従い,精細管上皮の減少傾向がみられた例を優先して各群5例を選び,精子形成サイクルの14ステージのうち,ステージ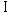 〜
〜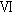 (Group 1),ステージ
(Group 1),ステージ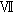 〜
〜 (Group 2),ステージIX〜XI(Group 3),ステージXII〜XIV(Group 4)について各グループに属する精細管を5本ずつ任意に選択して,精上皮細胞数をカウントし,各グループ毎に1精細管あたりの〔生殖細胞(精子細胞および精母細胞)数/セルトリ細胞数〕を算出した.雌については,全例の卵巣をパラフィン包埋後薄切し,ヘマトキシリン・エオジン染色標本を作製し,病理組織学検査を行った.
(Group 2),ステージIX〜XI(Group 3),ステージXII〜XIV(Group 4)について各グループに属する精細管を5本ずつ任意に選択して,精上皮細胞数をカウントし,各グループ毎に1精細管あたりの〔生殖細胞(精子細胞および精母細胞)数/セルトリ細胞数〕を算出した.雌については,全例の卵巣をパラフィン包埋後薄切し,ヘマトキシリン・エオジン染色標本を作製し,病理組織学検査を行った.
(6) 生殖能検査
雌全例について,投与開始日の10日前から交尾までの連日,ギムザ染色による腟垢塗抹標本を作製し,光学顕微鏡下で性周期段階(発情前期,発情期前期,発情期後期,発情後期および発情休止期)の判定を行い,性周期の異常の有無を検索した.
投与14日の雌雄について,同試験群内で夕方から1対1(無作為組合わせ)で14日間を限度として同居させた.交尾成立は雌の腟垢中に精子が確認された場合とし,その日を妊娠0日とした.妊娠の成立は雌の子宮に着床痕が確認された場合とした.交尾率〔(交尾動物数/同居動物数)×100〕および受胎率〔(受胎動物数/交尾動物数)×100〕を算出した.
(7) 分娩および母性行動
交尾した雌全例について,妊娠21日から分娩終了日まで分娩状態を観察し,午前9時に分娩が終了していた動物を当該日分娩とし,その日を哺育0日とした.分娩終了が確認された母動物について母性行動,総出産児数,生児数および死亡児数,出産児の性別および外表を観察した.また,妊娠期間〔妊娠0日から哺育0日(分娩終了日)までの日数〕,出産率〔(生児出産雌数/妊娠雌数)×100〕,分娩率〔(総出産児数/着床痕数)×100〕,出生率〔(出産生児数/総出産児数)×100〕,哺育4日時哺育率〔(哺育4日時に哺育児の認められる雌動物数/正常に分娩した雌動物数)×100〕および性比〔雄生児数/雌生児数〕を算出し,解剖時の計測結果から着床率〔(着床痕数/妊娠黄体数)×100〕を算出した.
(8) 新生児の一般状態および生存率
全例について,哺育0日から哺育4日まで1日1回生存および死亡を確認し,一般状態および外表について観察した.観察結果から,新生児の哺育4日の生存率〔(哺育4日生児数/出産生児数)×100〕を1腹を単位として算出した.なお,喰殺を受け死亡あるいは不明例となった新生児は死亡例として扱った.
(9) 新生児の体重測定
測定対象となる全例について,哺育0および4日に電子天秤を用いて測定し,体重値は1腹毎に雌雄別に1匹あたりの平均値で示した.得られた測定値から体重増加量〔(哺育4日体重−哺育0日体重)〕および体重増加率〔(体重増加量/哺育0日体重)×100〕を算出した.
(10) 新生児の剖検
死亡例は発見後直ちに剖検し,その他の例については哺育4日に体外表(口腔内を含む)を観察した後,二酸化炭素吸入法を用いて安楽致死させ,全身の器官および組織を肉眼的に観察した.死亡例および異常所見部位の認められた例については,whole bodyを10 %中性緩衝ホルマリン液で固定し,保存した.
6. 統計解析
性周期,交尾率,受胎率,出産率および哺育率,ならびに病理組織学検査結果のうち1段階の陽性グレードがみられた所見については,多試料c 2-検定を行い,有意な場合2試料c 2-検定を行った.また,これらの検定に不適合の場合はFisherの直接確率検定法を用いた.
その他の項目および病理組織学検査の結果のうち2段階以上の陽性グレードがみられた所見についてはBartlettの等分散性検定後,一元配置分散分析法あるいはKruskal-Wallis法により解析し,有意な場合,Dunnettの検定法あるいはMann-WhitneyのU-検定法により,対照群と1,2,4-ベンゼントリカルボン酸トリス(2-エチルヘキシル)エステル各投与群との比較を行った.
対照群との検定に際しては,有意水準を5および1 %とした.
結果
1. 反復投与毒性
(1) 一般状態
雌雄ともに,いずれの群にも異常は認められなかった.
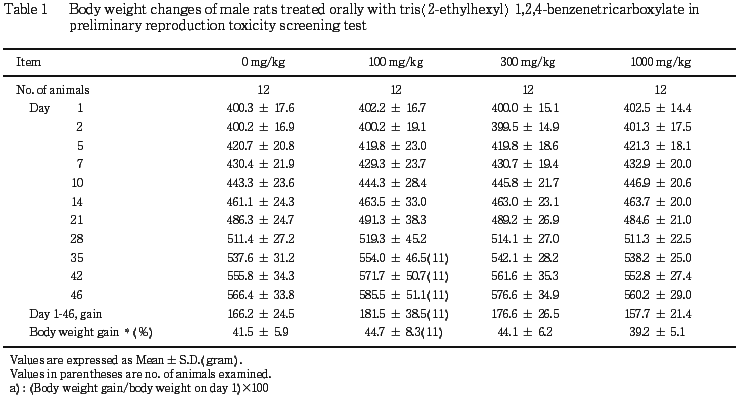
(2) 体重推移(Table 1, 2),摂餌量および器官重量
雌雄ともに,被験物質投与と関連した変化は認められなかった.
(3) 剖検
雄では,腎臓に腎盂の拡張が300 mg/kg群で1例に,嚢胞が1000 mg/kg群で1例に認められた.他に精巣上体に黄白色斑が1000 mg/kg群で1例に認められ,いずれも先天的な異常と考えられた.
雌では,頭頂骨の隆起が100 mg/kg群の交尾不成立の1例に,空腸の憩室が300 mg/kg群の1例に認められた.
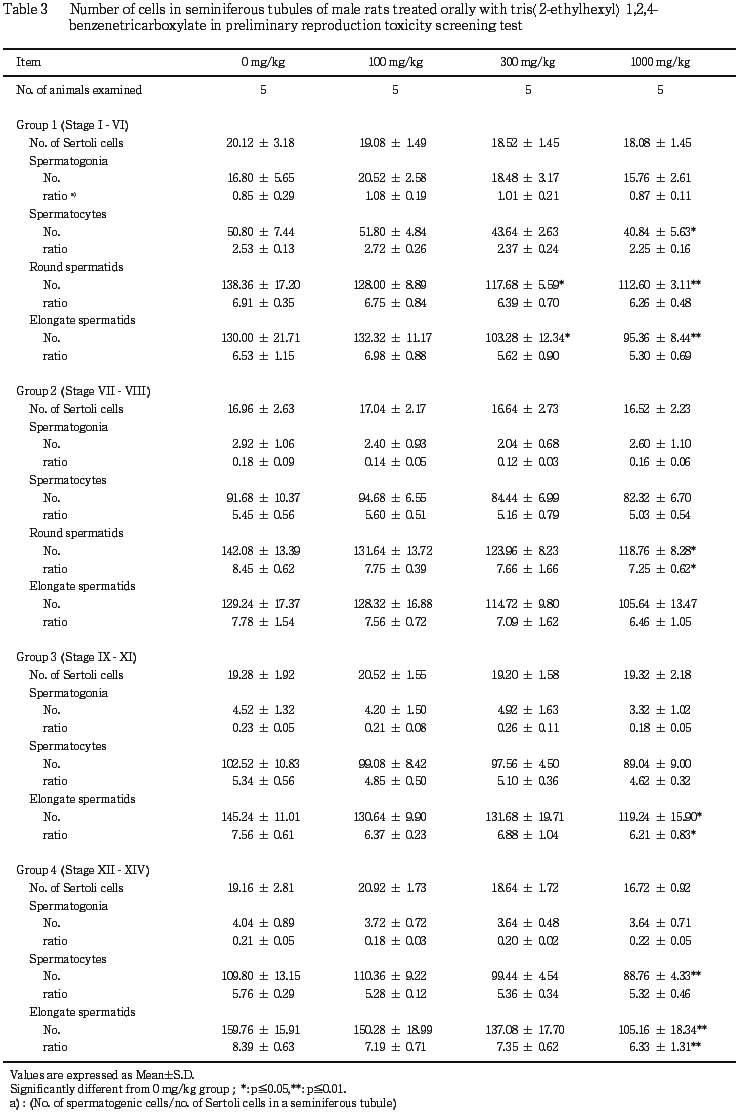
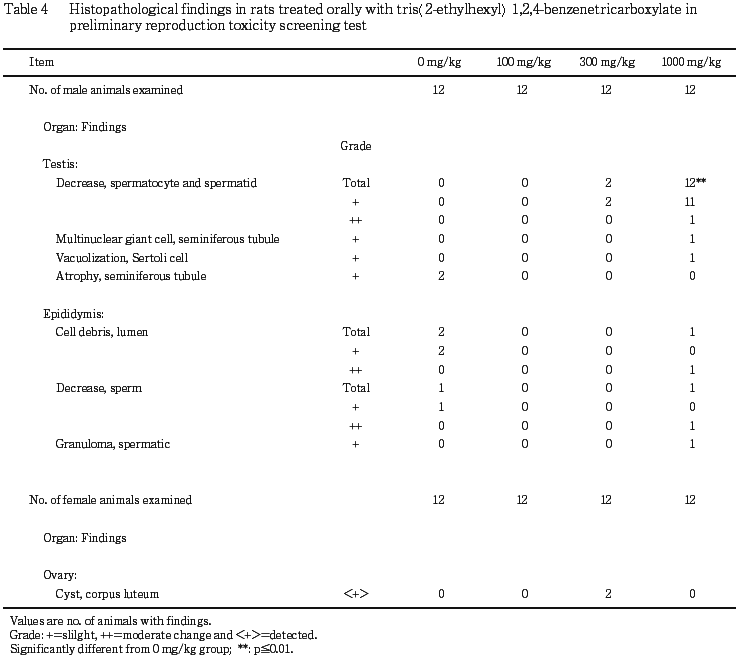
(4) 病理組織学検査(Table 3, 4)
雄では,精巣の病理組織学検査で,精母細胞および精子細胞の軽度の減少が300 mg/kg群で2例,1000 mg/kg群で11例,中等度の同所見が1000 mg/kg群で1例に認められた.中等度の精母細胞および精子細胞の減少が認められた1000 mg/kg群の1例では精細管内に多核巨細胞の軽度の出現およびセルトリ細胞の軽度の空胞化も認められ,精巣上体には管腔内に中等度の細胞残屑ならびに精子の中等度の減少が認められた.また,剖検で精巣上体に黄白色斑が認められた1000 mg/kg群の1例では,精母細胞および精子細胞の軽度の減少の他に,精巣上体に軽度の精子肉芽腫が認められた.対照群でも2例に精巣で精細管の軽度の萎縮が認められ,これら2例では精巣上体の管腔内に軽度の細胞残屑が認められ,そのうち1例で精巣上体管内精子の軽度の減少が認められた.
精巣の精上皮細胞数を計数した結果,Group 1(ステージ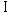 〜
〜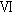 )では300 mg/kg群で精子細胞(roundおよびelongate)の低値,1000 mg/kg群で精母細胞および精子細胞(roundおよびelongate)の低値が認められ,Group 2(ステージ
)では300 mg/kg群で精子細胞(roundおよびelongate)の低値,1000 mg/kg群で精母細胞および精子細胞(roundおよびelongate)の低値が認められ,Group 2(ステージ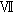 〜
〜 )では1000 mg/kg群で精子細胞(round)および精子細胞(round)のセルトリ細胞比の低値が認められた.Group 3(ステージIX〜XI)では1000 mg/kg群で精子細胞(elongate)および精子細胞の(elongate)のセルトリ細胞比の低値が認められ,Group 4(ステージXII〜XIV)では1000 mg/kg群で精母細胞,精子細胞(elongate)および精子細胞(elongate)のセルトリ細胞比の低値が認められた.雌では,黄体嚢胞が300 mg/kg群の2例に認められた.100 mg/kg群の交尾不成立の1例,対照群および100 mg/kg群の各1例では,卵巣に異常は認められなかった.
)では1000 mg/kg群で精子細胞(round)および精子細胞(round)のセルトリ細胞比の低値が認められた.Group 3(ステージIX〜XI)では1000 mg/kg群で精子細胞(elongate)および精子細胞の(elongate)のセルトリ細胞比の低値が認められ,Group 4(ステージXII〜XIV)では1000 mg/kg群で精母細胞,精子細胞(elongate)および精子細胞(elongate)のセルトリ細胞比の低値が認められた.雌では,黄体嚢胞が300 mg/kg群の2例に認められた.100 mg/kg群の交尾不成立の1例,対照群および100 mg/kg群の各1例では,卵巣に異常は認められなかった.
2. 生殖発生毒性
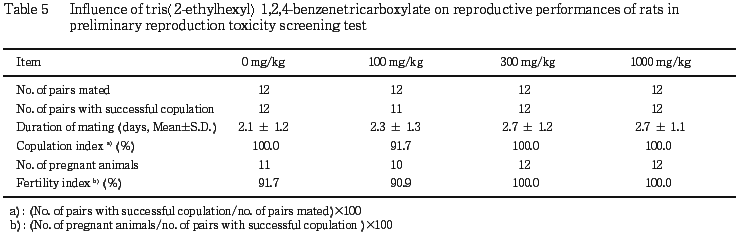
(1) 生殖能検査(Table 5)
いずれの群にも交尾成立までの日数,交尾率および受胎率に有意差は認められなかった.雌の性周期観察では,被験物質投与との関連を示唆する変化は認められなかった.なお,発情休止期の継続が投与期間に 100 mg/kg群の1例で認められ,同例は交尾不成立であった.不妊例が対照群および100 mg/kg群で各1組に認められた.
(2) 分娩および母性行動(Table 6)
いずれの群にも分娩および母性行動の観察項目に被験物質投与と関連した変化は認められなかった.
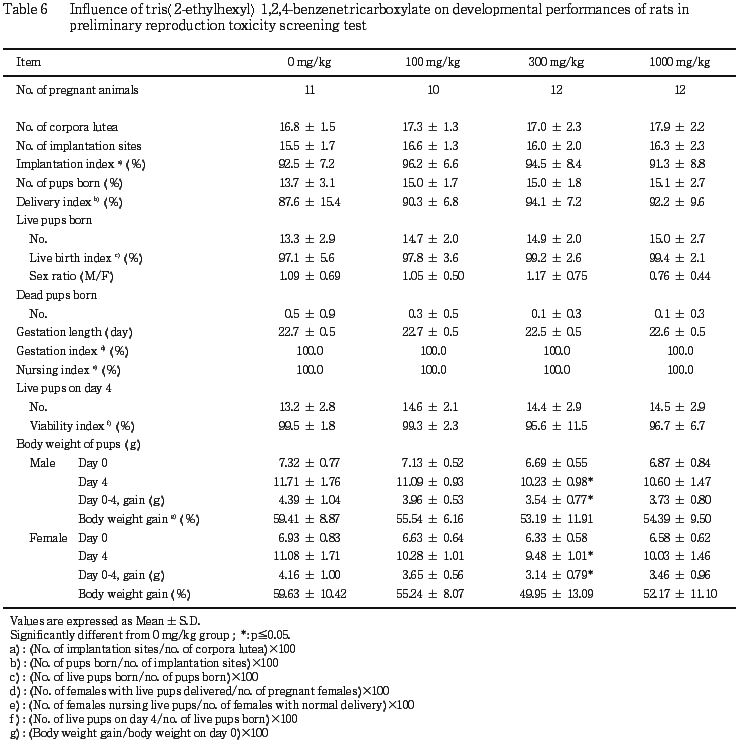
(3) 新生児の生存率(Table 6)
いずれの群にも被験物質投与と関連した変化は認められなかった.
(4) 新生児の一般状態
いずれの例にも被験物質投与との関連を示唆する症状は認められなかった.
(5) 新生児の体重推移(Table 6)
300 mg/kg群の雄で哺育4日体重および哺育4日までの体重増加量に低値が認められ,同群の雌でも哺育1および4日ならびに哺育4日までの体重増加量に低値が認められた.
しかし,100および1000 mg/kg群では対照群と比較して有意差は認められなかった.
(6) 新生児の剖検
死亡例および哺育4日に屠殺した新生児の剖検では,被験物質投与との関連を示唆する所見は認められなかった.
考察
1. 反復投与毒性
雄では,精巣の病理組織学検査で300 mg/kg群の2例,1000 mg/kg群の12例全例に精母細胞および精子細胞の減少が認められた.300 mg/kg群および1000 mg/kg群では体重増加抑制および副生殖器の萎縮性変化は認められないことから,栄養障害あるいはホルモンのアンバランスによるものではなく,被験物質が直接,精母細胞に影響を及ぼした可能性が考えられた.一方,本スクリーニング試験と同じく1,2,4-ベンゼントリカルボン酸トリス(2-エチルヘキシル)エステルの100,300および1000 mg/kg/dayを28日間経口反復投与した試験2)では精細胞に影響は認められていない.今回の試験で精巣上体に精子の減少が認められたのは1000 mg/kg群の1例のみであり,その他の例では精巣上体管内の精子数に異常はみられないことから,本スクリーニング試験において認められた精細胞への影響は46日間の投与期間の後期に発現したと考えられた.
精巣上体では1000 mg/kg群の1例で精子肉芽腫が認められたが,この所見は自然発生的にも認められ,被験物質投与によるものとは考えられなかった.
上記の他に,雌雄の一般状態,摂餌量,剖検所見および生殖器重量ならびに雌の卵巣の病理組織学所見に被験物質投与による影響は認められなかった.
以上のことから,本試験における1,2,4-ベンゼントリカルボン酸トリス(2-エチルヘキシル)エステルの反復投与による無影響量は,雄で100 mg/kg/day,雌で1000 mg/kg/dayであると判断された.
2. 生殖発生毒性
生殖能検査では交尾率および受胎率などに影響は認められず,300 mg/kg群および1000 mg/kg群の全例で交尾および妊娠が成立した.このことから,前述のように46日間の投与で精細胞の減少がみられるものの,本試験における交配前14日間の投与では妊娠の成立に影響を及ぼすものではなかったと考えられた.
なお,100 mg/kg群で認められた交尾不成立例1組では雌で頭頂骨の隆起がみられたが,生殖器に交尾不成立の原因を示唆する病理組織学所見は認められず,発情休止期の継続により交尾不成立となったと考えられ,より高用量の300および1000 mg/kg群で性周期に異常は認められず,全例で交尾が成立していることから,100 mg/kg群の交尾不成立例は被験物質投与との関連はないものと考えられた.
その他,雌の性周期に対して被験物質投与による影響は認められなかった.
新生児の観察では,300 mg/kg群で新生児の雌雄に体重の低値がみられたが,用量依存性は認められないことから,被験物質投与による影響とは考えられなかった.
他に,新生児の生存性,一般状態および剖検所見に被験物質投与による影響は認められなかった.
以上のことから,本スクリーニング試験における1,2,4-ベンゼントリカルボン酸トリス(2-エチルヘキシル)エステルの親世代の生殖に対する無影響量は雄で 100 mg/kg/day,雌で1000 mg/kg/day,次世代の発生に対する無影響量は 1000 mg/kg/dayであると判断された.
文献
| 1) | H. Matsui et al., J. Toxicol. Pathol., 9,285(1996). |
| 2) | 井上博之ら,化学物質毒性試験報告,4,701(1996). |
| 連絡先 |
| 試験責任者: | 吉村浩幸 |
| 試験担当者: | 茂野 均,古川正敏,河村公太郎,武田みよ子,引地のゆみ |
|  化合物安全性研究所 化合物安全性研究所 |
| 〒004-0839 北海道札幌市清田区真栄363番24号 |
| Tel 011-885-5031 | Fax 011-885-5313 | |
| Correspondence |
| Authors: | Hiroyuki Yoshimura(Study director)
Hitoshi Shigeno, Masatoshi Furukawa,
Kohtaro Kawamura, Miyoko Takeda,
Noyumi Hikichi |
| Safety Research Institute for Chemical Compounds Co., Ltd. |
| 363-24 Shin-ei, Kiyota-ku, Sapporo, Hokkaido, 004-0839, Japan |
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | |
 )に溶解して調製した.調製頻度は7日間に1回以上とし,投与に用いるまで遮光気密容器に入れ,室温で保存した.各濃度の調製液は規定の濃度であり,かつ均一であることがエヌシー技研
)に溶解して調製した.調製頻度は7日間に1回以上とし,投与に用いるまで遮光気密容器に入れ,室温で保存した.各濃度の調製液は規定の濃度であり,かつ均一であることがエヌシー技研 により確認された.
により確認された. 製造のロット番号N-80301(純度:99.0 %)を使用した.なお,被験物質は投与期間中安定であったことが製造業者の分析により確認された.
製造のロット番号N-80301(純度:99.0 %)を使用した.なお,被験物質は投与期間中安定であったことが製造業者の分析により確認された. )に溶解して調製した.調製頻度は7日間に1回以上とし,投与に用いるまで遮光気密容器に入れ,室温で保存した.各濃度の調製液は規定の濃度であり,かつ均一であることがエヌシー技研
)に溶解して調製した.調製頻度は7日間に1回以上とし,投与に用いるまで遮光気密容器に入れ,室温で保存した.各濃度の調製液は規定の濃度であり,かつ均一であることがエヌシー技研 により確認された.
により確認された. から受け入れ,14日間の検疫・馴化を行い,順調な発育を示した動物を試験に用いた.雌については,10日間の性周期検査を併せて行い,性周期に異常の認められない動物を用いた.
から受け入れ,14日間の検疫・馴化を行い,順調な発育を示した動物を試験に用いた.雌については,10日間の性周期検査を併せて行い,性周期に異常の認められない動物を用いた. )を敷いたステンレス製受皿を使用した.ケージ当たりの収容匹数は,群分け前は2匹以内,群分け後は1匹,交配中は雌雄各1匹,妊娠期間中は1母動物,哺育期間中は1腹とした.飼料は固形飼料(CRF-1,オリエンタル酵母工業
)を敷いたステンレス製受皿を使用した.ケージ当たりの収容匹数は,群分け前は2匹以内,群分け後は1匹,交配中は雌雄各1匹,妊娠期間中は1母動物,哺育期間中は1腹とした.飼料は固形飼料(CRF-1,オリエンタル酵母工業 )を金属製給餌器を用いて,飲料水は水道水(札幌市水道水)を自動給水装置を用いて,それぞれ自由に摂取させた.
)を金属製給餌器を用いて,飲料水は水道水(札幌市水道水)を自動給水装置を用いて,それぞれ自由に摂取させた.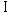 〜
〜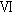 (Group 1),ステージ
(Group 1),ステージ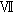 〜
〜 (Group 2),ステージIX〜XI(Group 3),ステージXII〜XIV(Group 4)について各グループに属する精細管を5本ずつ任意に選択して,精上皮細胞数をカウントし,各グループ毎に1精細管あたりの〔生殖細胞(精子細胞および精母細胞)数/セルトリ細胞数〕を算出した.雌については,全例の卵巣をパラフィン包埋後薄切し,ヘマトキシリン・エオジン染色標本を作製し,病理組織学検査を行った.
(Group 2),ステージIX〜XI(Group 3),ステージXII〜XIV(Group 4)について各グループに属する精細管を5本ずつ任意に選択して,精上皮細胞数をカウントし,各グループ毎に1精細管あたりの〔生殖細胞(精子細胞および精母細胞)数/セルトリ細胞数〕を算出した.雌については,全例の卵巣をパラフィン包埋後薄切し,ヘマトキシリン・エオジン染色標本を作製し,病理組織学検査を行った.

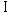 〜
〜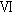 )では300 mg/kg群で精子細胞(roundおよびelongate)の低値,1000 mg/kg群で精母細胞および精子細胞(roundおよびelongate)の低値が認められ,Group 2(ステージ
)では300 mg/kg群で精子細胞(roundおよびelongate)の低値,1000 mg/kg群で精母細胞および精子細胞(roundおよびelongate)の低値が認められ,Group 2(ステージ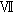 〜
〜 )では1000 mg/kg群で精子細胞(round)および精子細胞(round)のセルトリ細胞比の低値が認められた.Group 3(ステージIX〜XI)では1000 mg/kg群で精子細胞(elongate)および精子細胞の(elongate)のセルトリ細胞比の低値が認められ,Group 4(ステージXII〜XIV)では1000 mg/kg群で精母細胞,精子細胞(elongate)および精子細胞(elongate)のセルトリ細胞比の低値が認められた.雌では,黄体嚢胞が300 mg/kg群の2例に認められた.100 mg/kg群の交尾不成立の1例,対照群および100 mg/kg群の各1例では,卵巣に異常は認められなかった.
)では1000 mg/kg群で精子細胞(round)および精子細胞(round)のセルトリ細胞比の低値が認められた.Group 3(ステージIX〜XI)では1000 mg/kg群で精子細胞(elongate)および精子細胞の(elongate)のセルトリ細胞比の低値が認められ,Group 4(ステージXII〜XIV)では1000 mg/kg群で精母細胞,精子細胞(elongate)および精子細胞(elongate)のセルトリ細胞比の低値が認められた.雌では,黄体嚢胞が300 mg/kg群の2例に認められた.100 mg/kg群の交尾不成立の1例,対照群および100 mg/kg群の各1例では,卵巣に異常は認められなかった.



 化合物安全性研究所
化合物安全性研究所