O,O'-ジエチルジチオリン酸について,細菌を用いる復帰変異試験を実施した.
試験菌株として,Salmonella typhimurium(TA100,TA98,TA1535,TA1537)およびEscherichia coli(WP2 uvrA)の5菌株を用いた.用量設定試験においてはS9 mix無添加群および添加群の各試験菌株において2.29〜5000 μg/plateの8用量,本試験ではS9 mix無添加群のTA100で39.1〜2500 μg/plateの7用量,TA1535で9.77〜625 μg/plateの7用量,WP2 uvrA,TA98およびTA1537で156〜5000 μg/plateの6用量,S9 mix添加群のTA100およびTA1535で78.1〜5000 μg/plateの7用量,WP2 uvrA,TA98およびTA1537で156〜5000 μg/plateの6用量で試験を実施した.本試験においてS9 mix無添加群,TA1535の溶媒対照値の平均値が背景データの範囲から逸脱し,一部の試験において用量の設定が適切でなかったため,S9 mix無添加群のTA100およびTA1537で19.5〜1250 μg/plateの7用量,TA1535で9.77〜625 μg/plateの7用量,S9 mix無添加群および添加群のWP2 uvrAならびにS9 mix添加群のTA98で156〜5000 μg/plateの6用量,S9 mix無添加群のTA98およびS9 mix添加群のTA100で39.1〜5000 μg/plateの8用量,S9 mix添加群のTA1535で78.1〜5000 μg/plateの7用量,TA1537で78.1〜2500 μg/plateの6用量で再試験を実施した.
その結果,S9 mix無添加群のTA100,TA1535,WP2 uvrAならびにS9 mix添加群のTA100,TA1535において用量に依存した復帰変異コロニー数の増加が認められた.用量設定試験,本試験ならびに再試験により試験結果の再現性が確認されたことから陽性反応と判断した.
以上の結果より,本試験条件下ではO,O'-ジエチルジチオリン酸は,変異原性を有する(陽性)と結論した.
細菌を用いる復帰変異試験に広く使用されていることから,試験菌株としてヒスチジン要求性のSalmonella typhimurium TA100,TA98,TA1535およびTA15371)ならびにトリプトファン要求性のEscherichia coli WP2 uvrA2)の5種類の菌株を選択した.
ネズミチフス菌は昭和58年9月9日にカリフォルニア大学のAmes BN教授から,また,大腸菌については昭和58年3月16日に国立衛生試験所(現:国立医薬品食品衛生研究所)から分与を受けた.平成14年9月30日〜10月3日に菌株の特性検査を実施し,本試験に用いた菌株が規定の特性を保持していることを確認した.
各菌株の菌懸濁液はジメチルスルホキシド(DMSO: MERCK KGaA)を添加した後,凍結保存用チューブに0.2 mLずつ分注した.これを液体窒素を用いて凍結し,超低温フリーザーに-80℃で保存した.
オリエンタル酵母工業製のテスメディアAN培地を購入し,試験に用いた.本プレートは,Vogel-Bonnerの最少培地Eを含む水溶液(0.02 %硫酸マグネシウム・7水塩,0.2 %クエン酸・1水塩,1 %リン酸二カリウム・無水塩,0.192 %リン酸一アンモニウム,0.066 %水酸化ナトリウム[いずれも最終濃度])に2 %のグルコース(和光純薬工業)と1.15 %の寒天(伊那寒天BA-30 A)を加え,径90 mmのシャーレに1枚当たり30 mLを分注したものである.
塩化ナトリウム0.5 w/v%を含む0.6 w/v% Bacto- agar(Difco)水溶液10容量に対し,ネズミチフス菌を用いる試験の場合,0.5 mmol/L L-ヒスチジン(関東化学)-0.5 mmol/L D-ビオチン(関東化学)水溶液を1容量加え,大腸菌を用いる試験の場合,0.5 mmol/L L-トリプトファン(関東化学)水溶液を同じく1容量加え用いた.
内容量200 mLのバッフル付三角フラスコに2.5 w/v%ニュートリエントブロス(Oxoid Nutrient Broth No.2:OXOID)溶液を25 mL分注し,これに融解した菌懸濁液を50 μL接種した.ウォーターバスシェーカー(MM-10:タイテック)を用い,37℃で8時間振盪(往復振盪:100回/分)培養し,菌濃度を確認した後試験に使用した.
製造後6ヵ月以内のキッコーマン製S9 mixを試験に使用した.S9 mix中のS9は誘導剤としてフェノバルビタールおよび5,6-ベンゾフラボンを投与したSprague- Dawley系雄ラットの肝臓から調製されたものである.S9 mixの組成を以下に示す.
| 成分 | S9 mix 1 mL中の量 |
| S9 | 0.1 mL |
| MgCl2 | 8 μmol |
| KCl | 33 μmol |
| G-6-P | 5 μmol |
| NADPH | 4 μmol |
| NADH | 4 μmol |
| Na-リン酸緩衝液(pH 7.4) | 100 μmol |
| 蒸留水 | 残量 |
被験物質のO,O'-ジエチルジチオリン酸(ロット番号: TCQ2466)は純度95.1 %の暗灰褐色透明の液体である.本剤はDMSOに易溶である.和光純薬工業(静岡)から提供された被験物質を使用した.被験物質は,使用時まで冷蔵で保管した.試験終了後,被験物質提供元において残余被験物質を分析した結果,安定性に問題はなかった.
試験の都度,被験物質をモレキュラーシーブを用いて脱水処理を行ったDMSOを用いて溶解し,調製原液とした.調製原液を使用溶媒を用いて順次所定濃度に希釈した後,速やかに処理を行った.
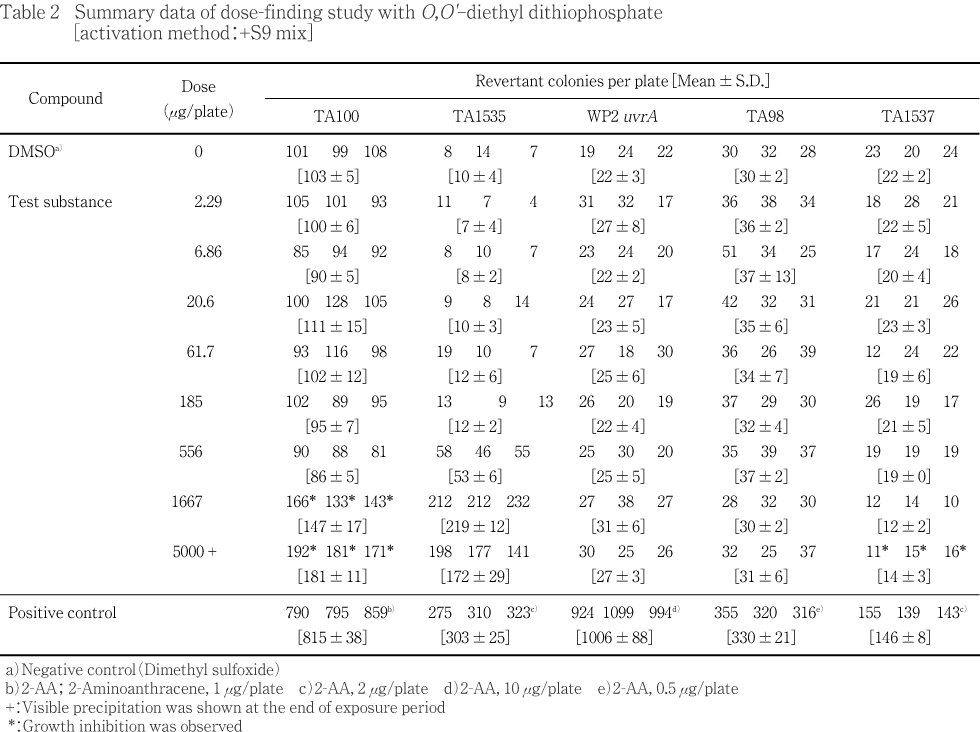
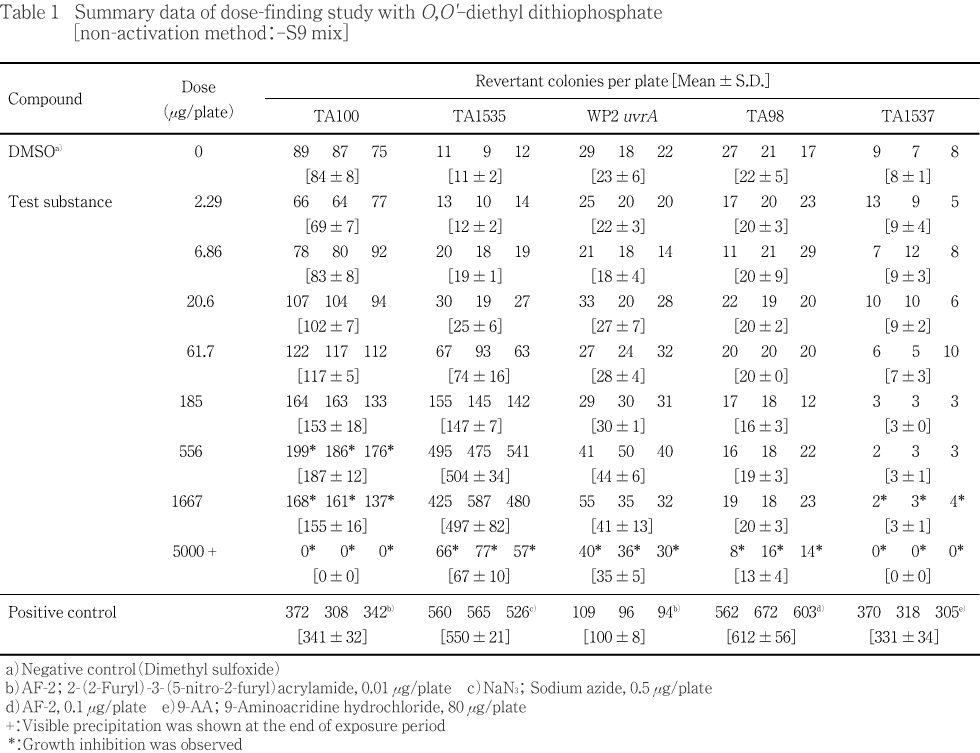
2.29〜5000 μg/plateの8用量(公比3)を用いて用量設定試験を実施した.S9 mix無添加群のTA100,TA1535ならびにS9 mix添加群のTA1535で用量に依存した復帰変異コロニー数の増加が認められ,溶媒対照値の2倍を超えていた.試験菌株に対する生育阻害作用はS9 mix無添加群の場合,TA100の556 μg/plate以上,TA1537の1667 μg/plate以上,他の3菌株の5000 μg/plateで観察された.また,S9 mix添加群の場合はTA100の1667 μg/plate以上,TA1537の5000 μg/plateで観察された.被験物質処理時,S9 mix無添加群および添加群とも556 μg/plate以上の用量で反応液が白濁し,さらに1667 μg/plate以上の用量で白色粉末状の析出物が認められた.コロニー計数時,両群の5000 μg/plateで白色粉末状の析出物が観察された.
従って,本試験においてTA100およびTA1535では,正確な用量反応曲線が得られる用量,すなわち,S9 mix無添加群のTA100において2500 μg/plate,TA1535において625 μg/plateを,S9 mix添加群のTA1535において5000 μg/plateを最高用量とし,それぞれ7用量(公比2)を設定した.他の菌株については,生育阻害作用が認められると考えられる用量あるいは5000 μg/plateを最高用量とし,S9 mix添加群のTA100では7用量(公比2),S9 mix無添加群および添加群のWP2 uvrA,TA98およびTA1537ではそれぞれ6用量(公比2)を設定した.
また,本試験のTA1535(S9 mix無添加群)において,溶媒対照値の平均値が背景データの範囲から逸脱していること,一部の試験において用量の設定が適切でなかったことから再試験を実施し,S9 mix無添加群のTA100およびTA1537において1250 μg/plateを,TA1535において625 μg/plateを最高用量とし,それぞれ7用量(公比2),S9 mix添加群のTA1537において2500 μg/plateを最高用量とし6用量(公比2),他の菌株においては5000 μg/plateを最高用量とし,S9 mix無添加群および添加群のWP2 uvrAならびにS9 mix添加群のTA98ではそれぞれ6用量(公比2),S9 mix無添加群のTA98およびS9 mix添加群のTA100ではそれぞれ8用量(公比2),S9 mix添加群のTA1535では7用量(公比2)を設定した.
陽性対照物質として下記に示した調製済み陽性対照物質溶液(オリエンタル酵母工業)を使用した.
2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリルアミド(AF-2)
アジ化ナトリウム(NaN3)
9-アミノアクリジン塩酸塩(9-AA)
2-アミノアントラセン(2-AA)
Amesらの原法1)の改良法であるプレインキュベーション法に準じて,S9 mix無添加群および添加群それぞれについて試験を実施した.試験管に,使用溶媒,被験物質液あるいは陽性対照物質溶液を100 μL,次いでS9 mix無添加群の場合,0.1 mol/L ナトリウム・リン酸緩衝液(pH 7.4)を500 μL,S9 mix添加群の場合,S9 mixを500 μL添加し,さらに試験菌液100 μLを加え,37℃で20分間振盪培養(プレインキュベーション)した.培養終了後,あらかじめ45℃に保温したトップアガーを2 mL添加し,混合液をプレート上に重層した.37℃の条件で48時間各プレートを培養した後,被験物質の試験菌株に対する生育阻害作用を確認するため,実体顕微鏡(×60)を用いてプレート上の試験菌株の生育状態を観察した.次いで,復帰変異により生じたコロニーを計数した.計測に際してはコロニーアナライザー(CA-11:システムサイエンス)を用いた.なお,本試験におけるS9 mix無添加群,TA100およびTA1535の2500 μg/plate以上,WP2 uvrAおよびTA98ならびにS9 mix添加群,TA1537の5000 μg/plateさらに再試験におけるS9 mix無添加群,TA98の5000 μg/plateでは析出物の影響によりコロニーアナライザーの使用が不適切と判断し,目視でコロニーを計数した.また,本試験のS9 mix無添加群,TA1537の5000 μg/plateでは背景菌が目視できるほどのコロニーを形成していたことから目視でコロニーを計数した.各濃度につき3枚のプレートを使用した.
復帰変異コロニー数が溶媒対照の2倍以上に増加し,かつ,再現性あるいは被験物質の用量に依存性が認められた場合に,陽性と判定した.なお,陽性と判定した菌株については,変異原性の強さの相対的比較値である比変異活性(比活性)を,当該濃度における誘発平均コロニー数(当該濃度での平均コロニー数−溶媒対照での平均コロニー数)を当該濃度値(mg)で除すことにより算出した.コロニー数の平均値は四捨五入する以前の値を用いた.
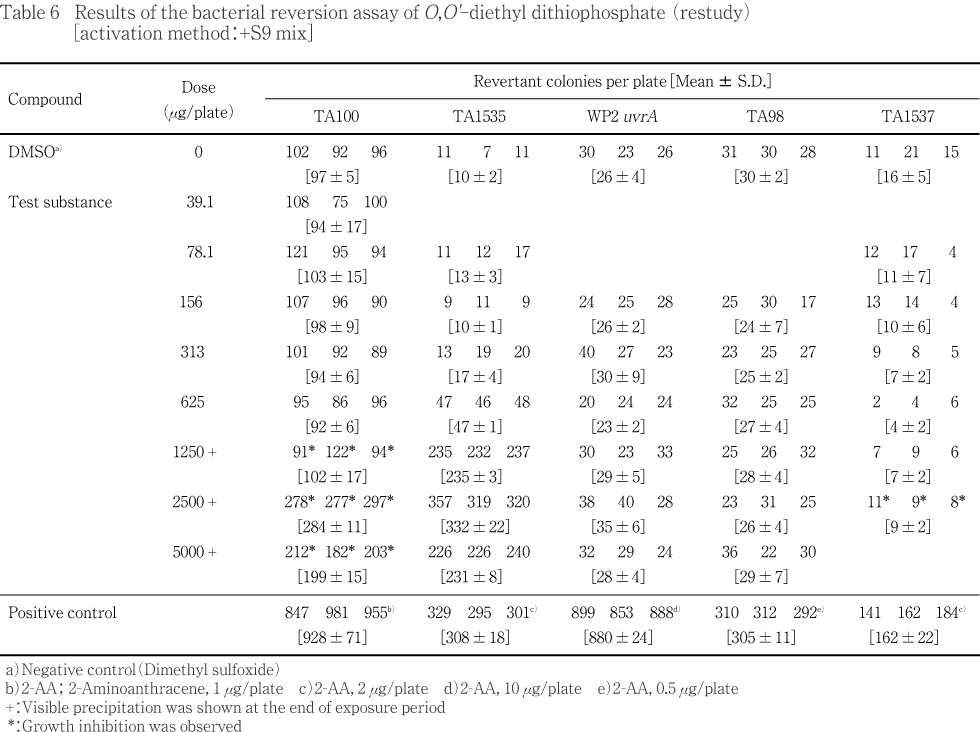
統計学的手法を用いた検定は実施しなかった.
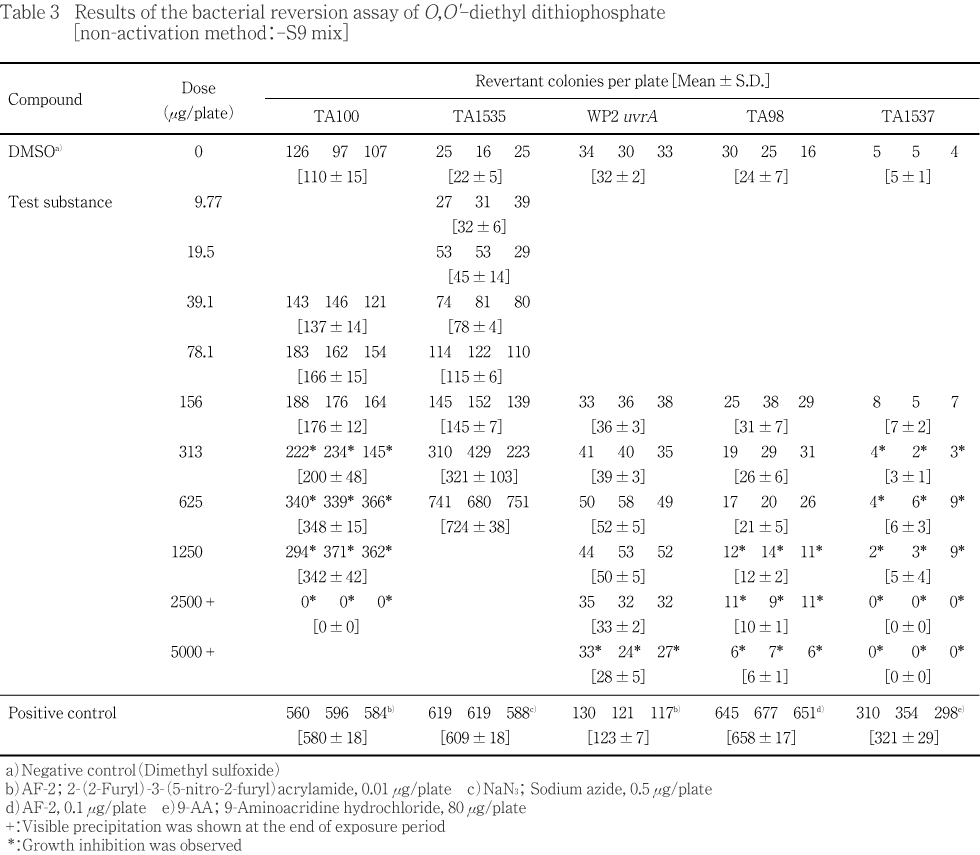
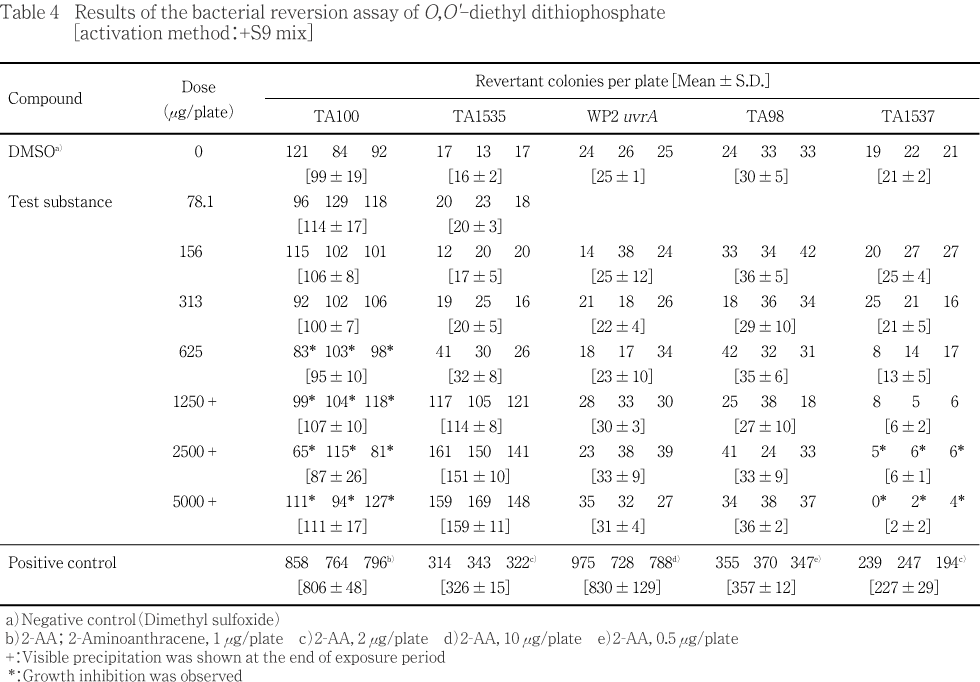
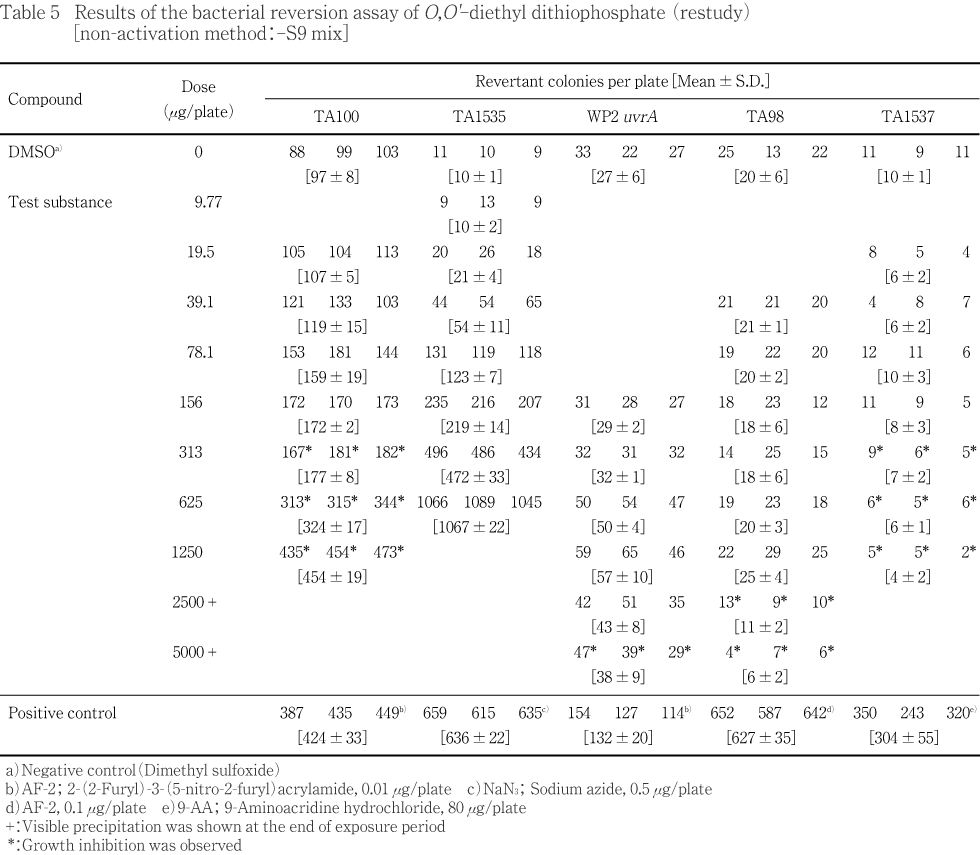
用量設定試験の結果をTable 1〜2に,本試験の結果をTable 3〜4に示した.S9 mix無添加群のTA100,TA1535ならびにS9 mix添加群のTA1535でO,O'-ジエチルジチオリン酸処理による用量に依存した復帰変異コロニー数の増加が認められ,溶媒対照値の2倍を超えていた.試験菌株に対する生育阻害作用はS9 mix無添加群の場合,TA100,TA1537の313 μg/plate以上,TA98の1250 μg/plate以上,WP2 uvrAの5000 μg/plateで観察された.またS9 mix添加群の場合はTA100の625 μg/plate以上,TA1537の2500 μg/plate以上の用量で観察された.一方,陽性対照物質はそれぞれの試験菌株において,溶媒対照群の2倍以上の復帰変異コロニーを誘発した.なお,被験物質処理時,S9 mix無添加群の313 μg/plate以上およびS9 mix添加群の156 μg/plate以上の用量で反応液が白濁し,S9 mix無添加群の2500 μg/plate以上ならびにS9 mix添加群の625 μg/plate以上の用量で白色粉末状の析出物が認められた.コロニー計数時,S9 mix無添加群の2500 μg/plate以上,S9 mix添加群の1250 μg/plate以上の用量で白色粉末状の析出物が観察された.また,S9 mix無添加群のTA1535において,溶媒対照値の平均値が背景データの範囲から逸脱し,一部の試験において用量の設定が適切でなかったため,再試験を実施し,結果をTable 5〜6に示した.S9 mix無添加群のTA100,TA1535,WP2 uvrAならびにS9 mix添加群のTA100,TA1535でO,O'-ジエチルジチオリン酸処理による用量に依存した復帰変異コロニー数の増加が認められ,溶媒対照値の2倍を超えていた.試験菌株に対する生育阻害作用はS9 mix無添加群の場合,TA100,TA1537の313 μg/plate以上,TA98の2500 μg/plate以上,WP2 uvrAの5000 μg/plateで観察された.また,S9 mix添加群の場合はTA100の1250 μg/plate以上,TA1537の2500 μg/plateで観察された.変異原性の強さに関する相対的比較値である比活性の最高値は1691(S9 mix無添加群,TA1535,625 μg/plate)と算出された.一方,陽性対照物質はそれぞれの試験菌株に対し,溶媒対照の2倍以上の復帰変異コロニーを誘発した.なお,被験物質処理時,S9 mix無添加群の156 μg/plate以上およびS9 mix添加群の313 μg/plate以上の用量で反応液が白濁し,S9 mix無添加群の2500 μg/plate以上ならびにS9 mix添加群の1250 μg/plate以上の用量で白色粉末状の析出物が認められた.コロニー計数時,S9 mix無添加群の2500 μg/plate以上,S9 mix添加群の1250 μg/plate以上の用量で白色粉末状の析出物が観察された.
以上の試験結果から,本試験条件下において,O,O'-ジエチルジチオリン酸の微生物に対する遺伝子突然変異に関し,陽性と判定した.
なお,本被験物質(O,O'-ジエチルジチオリン酸)について遺伝毒性ならびに発がん性に関する報告はなかった.類縁体であるO,O-diethyl S-[2-(ethylthio)ethyl] esterについてCHL細胞を用いたin vitro小核ならびにマウスを用いた小核試験で陽性3)との報告があった.O,O-diethyl S-[(ethylthio)methyl] esterについてはCHO細胞を用いた染色体異常試験で陰性4),ラット小核試験で陽性5)との報告があった.また,diethyl dithiophosphate ammonium saltおよびdiethyl dithiophosphate potassium saltの遺伝毒性に関する報告はなかった.
| 1) | Maron DM, Ames BN:Revised methods for the Salmonella mutagenicity test. Mutation Res, 113:173-215(1983). |
| 2) | Green MH, Muriel WJ:Mutagen testing using TRP+ reversion in Escherichia coli. Mutation Res, 38:3-32(1978). |
| 3) | Ni Z, Li S, Liu Y, Tang Y, Pang D:Induction of micronucleus by organophosphorus pesticides both in vivo and in vitro. Hua Xi Yi Ke Da Xue Xue Bao, 24:82-86(1993). |
| 4) | Lin MF, Wu CL, Wang TC:Pesticide clastogenicity in Chinese hamster ovary cells. Mutation Res, 188:241-250(1987). |
| 5) | Grover IS, Malhi PK:Genotoxic effects of some organophosphorous pesticides. I. Induction of micronuclei in bone marrow cells in rat. Mutation Res, 155:131-134(1985). |
| 連絡先 | |||
| 試験責任者: | 中嶋 圓 | ||
| 試験担当者: | 永井美穂,田中 仁, 古屋有佳子,仲村渠奈美子, 赤星まゆみ,尾h伸也, 菊池正憲 | ||
| 7食品農医薬品安全性評価センター | |||
| 〒437-1213 静岡県磐田郡福田町塩新田582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | |||
| Authors: | Madoka Nakajima(Study Director) Miho Nagai, Jin Tanaka, Yukako Furuya, Namiko Nakandakari, Mayumi Akahoshi, Shin-ya Ozaki, Masanori Kikuchi | ||
| Biosafety Research Center, Foods, Drugs and Pesticides(An-pyo Center) | |||
| 582-2 Shioshinden, Fukude-cho, Iwata-gun, Shizuoka, 437-1213, Japan | |||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | ||