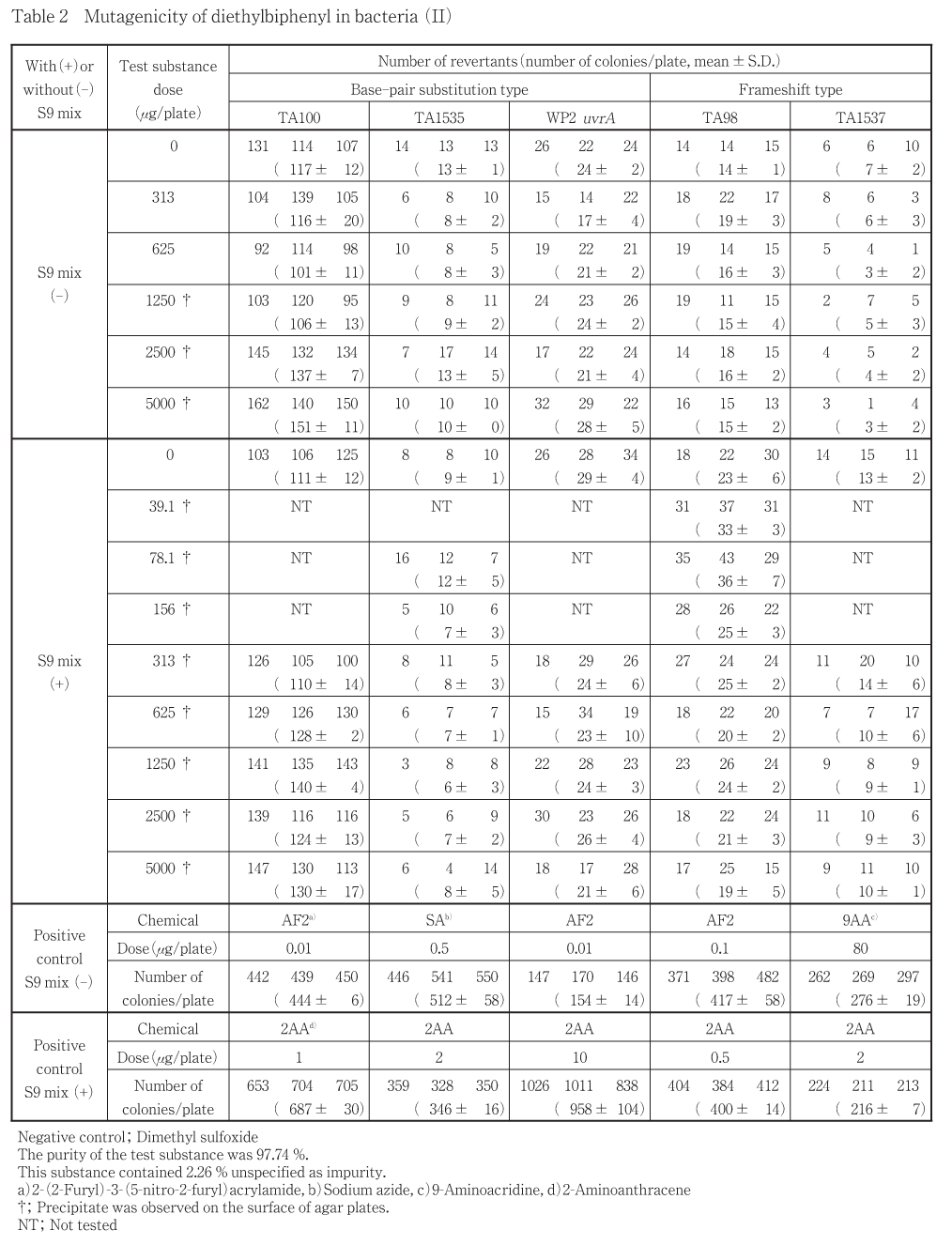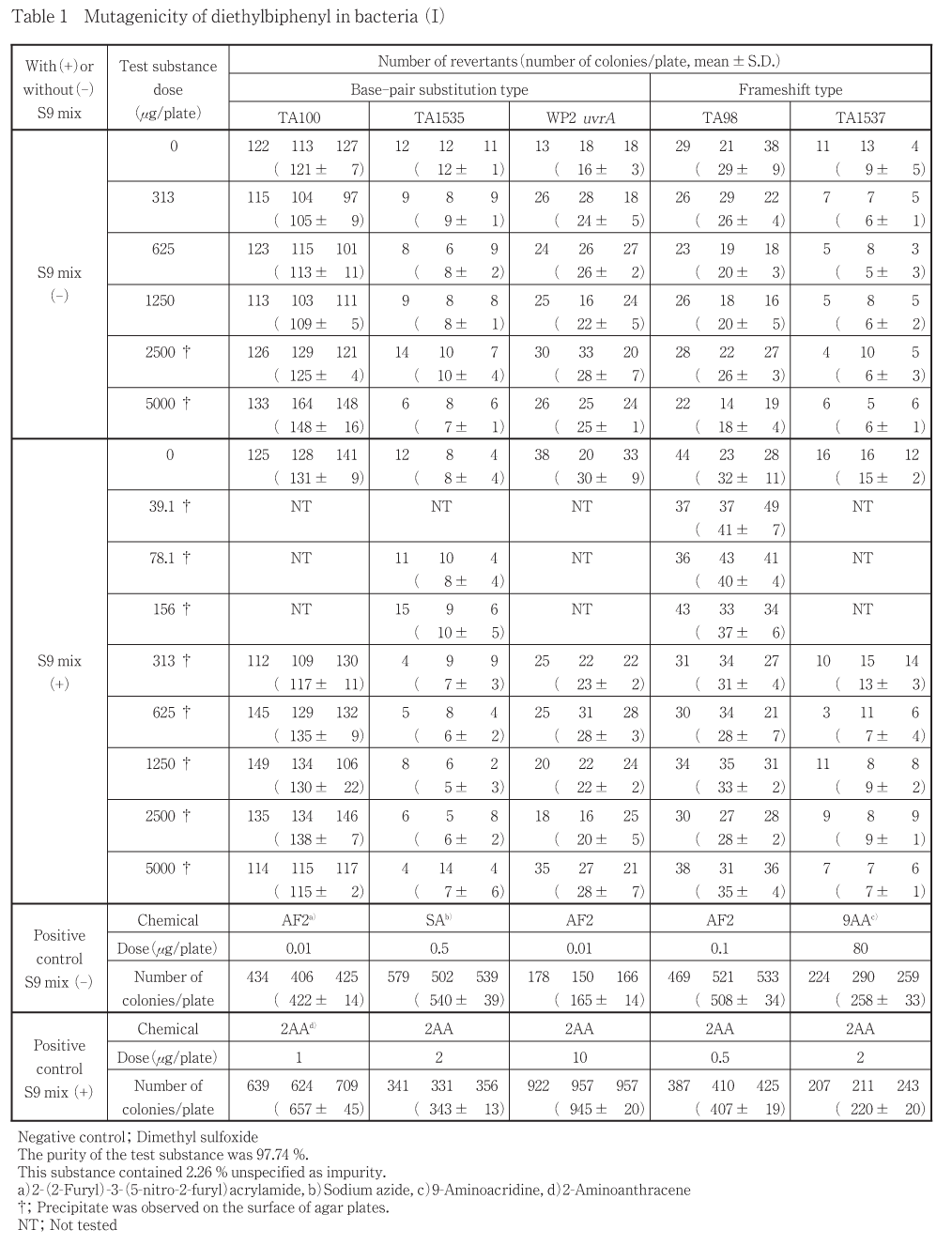
ジエチルビフェニルについて細菌を用いる復帰変異試験を実施した.
検定菌として,Salmonella typhimurium TA100,TA1535,TA98,TA1537 1)およびEscherichia coli WP2 uvrA 2)の5菌株を用いた.用量設定試験において,用いたいずれの検定菌においても生育阻害は認められなかった.なお,S9 mix添加条件において,TA1535では150 μg/plateの用量で,TA98においては50.0 μg/plateの用量で復帰変異コロニー数の増加傾向が認められたことから,本試験は,S9 mix添加条件において,TA1535では78.1〜5000 μg/plate,TA98では39.1〜5000 μg/plate,TA1535とTA98のS9 mix無添加条件およびそれ以外の検定菌では313〜5000 μg/plateの範囲で実施した.
その結果,用いた5種の検定菌のいずれの用量においても,陰性対照値の2倍以上となる復帰変異コロニー数の増加は認められなかった.
以上の結果からジエチルビフェニルは,用いた試験系において変異原性を有しないもの(陰性)と判定した.
ジエチルビフェニルは,淡黄色透明液体である.用いた被験物質は,ロット番号:7-YYY,純度:97.74 %,製造:新日鐵化学(東京)であり,新日鐵化学から供与された.被験物質は,使用時まで密閉,遮光し,冷蔵した.本ロットの被験物質について,実験期間中安定であることが被験物質提供者において確認された.
ジエチルビフェニルは,ジメチルスルホキシド(DMSO,ロット番号:PKJ4820,和光純薬工業)に溶解して最高用量の調製液を調製した後,同溶媒で所定の濃度に希釈して速やかに試験に用いた.調製時に,発熱,発泡および変色は認められなかった.
用いた陽性対照物質および調製法は以下のとおりである.
各検定菌に用いた陽性対照物質は,当研究所で十分な蓄積データが得られている物質および用量とし,それぞれTable中に示した.
| 2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリルアミド | (AF2,和光純薬工業) | |
| アジ化ナトリウム | (SA,和光純薬工業) | |
| 9-アミノアクリジン | (9AA,Sigma Chem.) | |
| 2-アミノアントラセン | (2AA,和光純薬工業) |
AF2,9AAおよび2AAはDMSOに,SAは日局注射用水に溶解したものを-20℃で凍結保存し,解凍後,速やかに試験に用いた.
試験には,Salmonella typhimurium TA100,TA1535,TA98,TA1537およびEscherichia
coli WP2 uvrAを用いた.
S. typhimuriumの4菌株は1997年8月7日に,E. coli WP2 uvrA株は1997年4月9日に日本バイオアッセイ研究センターの松島泰次郎博士から分与された.
検定菌は-80℃で凍結保存したものを用い,各菌株の特性確認は凍結保存菌の調製時に,アミノ酸要求性,UV感受性,膜変異(rfa),アンピシリン耐性因子pKM101(プラスミド)の有無および陰性対照と陽性対照の復帰変異コロニー数について調べ,特性が維持されていることを確認した.
試験に際して,ニュートリエントブロスNo. 2(Oxoid)を入れたL字型試験管に解凍した種菌を一定量接種し,37℃で10時間往復振とう培養したものを検定菌液とした.
分光光度計により660 nmの吸光度を測定し,検定菌液の増殖を確認した.
培地は,極東製薬工業製の最少グルコース寒天培地を用いた.なお,培地1 Lあたりの組成は下記のとおりである.
| 硫酸マグネシウム・七水和物 | 0.2 g | |
| クエン酸・一水和物 | 2 g | |
| リン酸水素二カリウム | 10 g | |
| リン酸一アンモニウム | 1.92 g | |
| 水酸化ナトリウム | 0.66 g | |
| グルコース | 20 g | |
| 大洋寒天(清水食品) | 15 g |
径90 mmのシャーレ1枚あたり30 mLを流して固めたものである.
下記の水溶液(A)および(B)または(C)を容量比10:1の割合で混合した.
| (A) バクトアガー(Difco) | 0.6 w/v% | |
| 塩化ナトリウム | 0.5 w/v% | |
| (B) Salmonella typhimurium用 | ||
| L-ヒスチジン | 0.5 mmol/L | |
| D-ビオチン | 0.5 mmol/L | |
| (C) Escherichia coli用 | ||
| L-トリプトファン | 0.5 mmol/L |
S9 mix 1 mLあたりの組成は下記のとおりである.
| S9* | 0.1 mL | |
| 塩化マグネシウム | 8 μmol | |
| 塩化カリウム | 33 μmol | |
| グルコース-6-リン酸 | 5 μmol | |
| NADH | 4 μmol | |
| NADPH | 4 μmol | |
| ナトリウム-リン酸緩衝液(pH 7.4) | 100 μmol |
*:7週齢のSprague-Dawley系雄ラットをフェノバルビタール(PB)および5,6-ベンゾフラボン(BF)の併用投与で酵素誘導して作製したS9(キッコーマン)を用いた.
プレインキュベーション法 3)により,S9 mix無添加条件およびS9 mix添加条件で試験を行った.
小試験管中に,被験物質調製液0.1 mL,S9 mix無添加条件では0.1 mol/Lナトリウム-リン酸緩衝液(pH 7.4)0.5 mL,S9 mix添加条件ではS9 mix 0.5 mL,検定菌液0.1 mLを混合し,37℃で20分間プレインキュベーションしたのち,約45℃に保温したトップアガー2 mLを加えて混和し,合成培地平板上に流して固めた.また,被験物質調製液の代わりに使用溶媒,または数種の陽性対照物質溶液を用いてそれぞれ陰性対照および陽性対照とした.用量設定試験においては,同時に実施した他試験と陰性および陽性対照の結果を共通とした.
培養は37℃で48時間行い,発生した復帰変異コロニー数をコロニーアナライザーまたは目視によって算定した.被験物質に由来する沈澱の有無は,肉眼により確認した.また,生育阻害の有無については,肉眼あるいは実体顕微鏡下で,寒天表面の菌叢の状態から判断した.用いた平板は用量設定試験においては,陰性および陽性対照では3枚ずつ,各用量については1枚ずつとした.また,本試験においては,両対照および各用量につき3枚ずつを用い,それぞれの平均値と標準偏差を求めた.陰性および陽性対照の復帰変異コロニー数の平均値を,それぞれ陰性対照値および陽性対照値とした.
用量設定試験は1回,本試験は同一用量について2回実施し,結果の再現性を確認した.
用いた5種の検定菌のうち,1種以上の検定菌のS9 mix無添加条件あるいはS9 mix添加条件において,被験物質を含有する平板上における復帰変異コロニー数の平均値が,陰性対照値の2倍以上に増加し,その増加に再現性および用量依存性が認められた場合に,当該被験物質は本試験系において変異原性を有するもの(陽性)と判定することとした.
50.0〜5000 μg/plateの範囲で公比を約3として,用量設定試験を実施した.その結果,用いたいずれの検定菌においても生育阻害は認められなかった.また,被験物質に由来する沈澱は,S9 mix無添加条件では1500 μg/plate以上の用量で,S9 mix添加条件ではすべての用量で認められた.なお,S9 mix添加条件において,TA1535では150 μg/plateの用量で,TA98においては50.0 μg/plateの用量で復帰変異コロニー数の増加傾向が認められた.
したがって,最高用量をすべての検定菌で5000 μg/plateとし,公比2で5,7(TA1535のS9 mix添加条件のみ)および8(TA98のS9 mix添加条件のみ)用量を設定して2回の本試験を実施した(Table 1, 2).その結果,用いたいずれの検定菌においても生育阻害は認められなかった.復帰変異コロニー数は,用いたいずれの検定菌においても,S9 mix添加の有無にかかわらず,陰性対照値の2倍以上となる増加は認められなかった.
以上の結果に基づき,ジエチルビフェニルは,用いた試験系において変異原性を有しないもの(陰性)と判定した.
なおジエチルビフェニルは,当研究所で実施したチャイニーズ・ハムスター培養細胞を用いる染色体異常試験でも陰性の結果が得られている4).また,関連物質であるBiphenylについては,復帰変異試験では陰性,染色体異常試験ではマウスS9を用いた代謝活性化法で陽性の結果が報告されている5, 6).4-Ethylbiphenylについては復帰変異試験および染色体異常試験ともに陰性の結果が報告されている7, 8).
| 1) | Maron DM, Ames BN:Revised methods for the Salmonella mutagenicity test. Mutation Res, 113:173-215(1983). |
| 2) | Green MHL:Mutagen testing using Trp+ reversion in Escherichia coli. In “Handbook of Mutagenicity Test Procedures”, Kilbey BJ, Legator M, Nichols W et al.(eds.), Elsevier, Amsterdam(1984)pp.161- 187. |
| 3) | Matsushima T, Sugimura T, Nagao M et al.: Factors modulating mutagenicity in microbial tests. In “Short-term Test Systems for Detecting Carcinogens”, Norpoth KH, Garner RC(eds.), Springer, Berlin(1980)pp.273-285. |
| 4) | 山影康次ら:ジエチルビフェニルのチャイニーズ・ハムスター培養細胞を用いる染色体異常試験.化学物質毒性試験報告,13:351-356(2006). |
| 5) | 労働安全衛生法有害性調査制度に基づく既存化学物質変異原性試験データ集,日本化学物質安全・情報センター,東京(1996)pp.229-230. |
| 6) | 祖父尼俊雄(監修):「染色体異常試験データ集」1998年版,エル・アイ・シー,東京(1999)p.77. |
| 7) | 宮川誠ら:4-エチルビフェニルの細菌を用いる復帰変異試験.化学物質毒性試験報告,7:625-628 (1999). |
| 8) | 太田絵津奈ら:4-エチルビフェニルのチャイニーズ・ハムスター培養細胞を用いる染色体異常試験.化学物質毒性試験報告,7:629-632(1999). |
| 連絡先 | |||
| 試験責任者: | 須井 哉 | ||
| 試験担当者: | 川上久美子,大山徳子,三枝克彦, 加藤初美 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257-8523 秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | |||
| Authors: | Hajime Sui (Study Director) Kumiko Kawakami, Noriko Ohyama, Katsuhiko Saegusa, Hatsumi Kato |
||
| Hatano Research Institute, Food and Drug Safety Center | |||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | |||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | ||