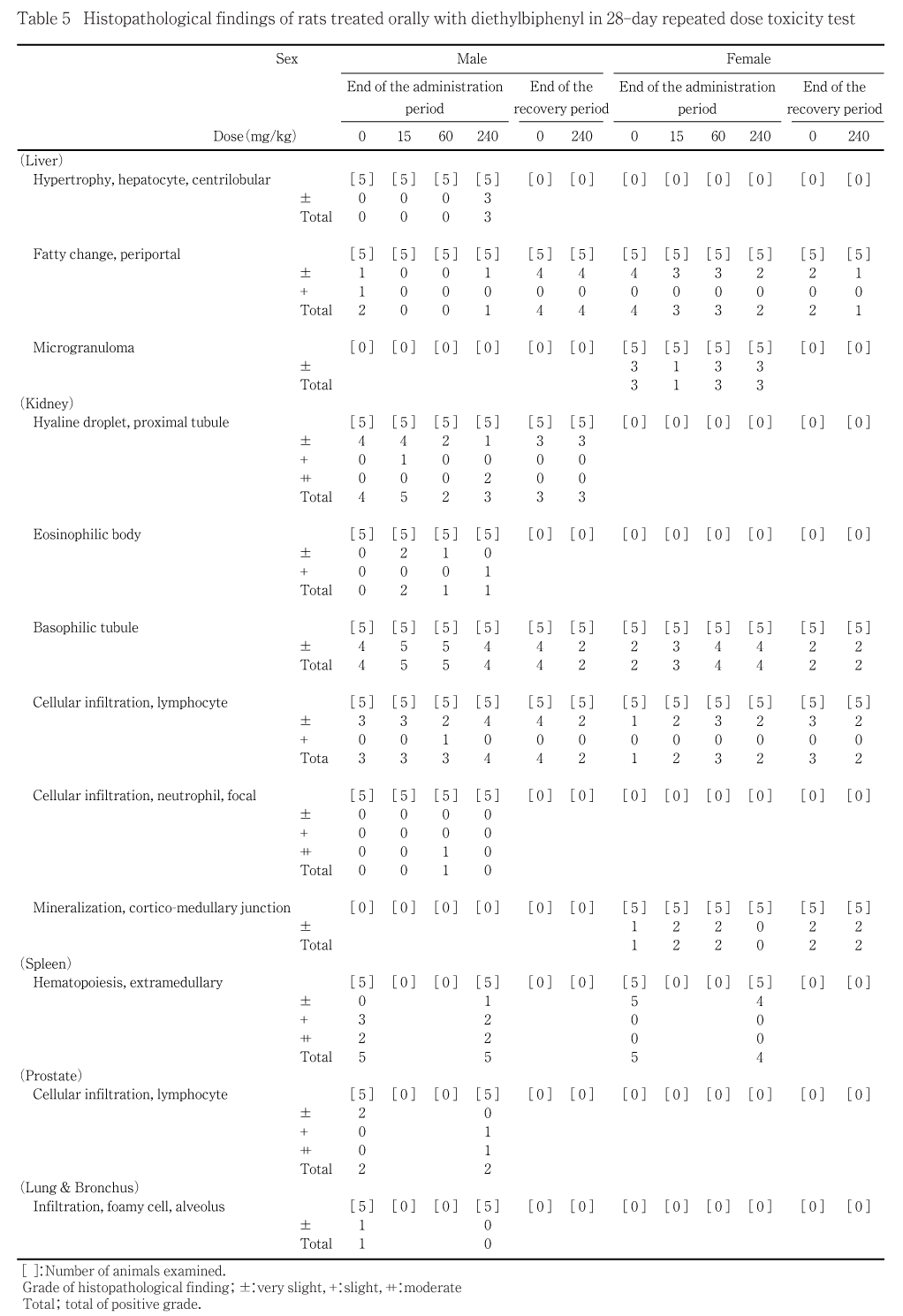
ジエチルビフェニルは合成系有機熱媒体の主要成分のひとつで,高濃縮性,難分解性を示す化学物質である.ジエチルビフェニルの28日間反復経口投与毒性試験(回復14日間)を雌雄のSprague-Dawley系ラットを用いて実施した.雌雄とも15,60および240 mg/kgの用量の被物質投与群ならびに媒体(コーン油)を投与する対照群の計4群を設定し,28日間の反復強制経口投与を行った.試験には雌雄とも各群5匹のほか,対照群および240 mg/kg群には回復試験として各5匹を加え,計60匹の動物を使用した.
一般状態観察では投与第9日以降,240 mg/kg群の雌雄に投与直後の一過性流涎が高頻度に観察された.詳細な症状観察および機能検査に特記すべき所見はなく,体重,摂餌量に被験物質投与の影響は認められなかった.投与期間終了時検査では,240 mg/kg群の血液および血液生化学検査でプロトロンビン時間,活性部分トロンボプラスチン時間の延長が雄に,総コレステロール濃度の増加が雌に認められた.器官重量では240 mg/kg群の肝臓で実重量の増加が雌に,相対重量の増加が雌雄に認められた.組織学的検査では,肝臓の小葉中心性の肝細胞肥大が雄の240 mg/kg群に観察された.また,回復試験終了時検査では投与期間終了時にみられた上記の変化は観察されず,被験物質投与の影響は14日間の休薬により回復することが示唆された.
以上の結果から,本試験条件下におけるジエチルビフェニルの無毒性量は雌雄とも60 mg/kg/dayであると考えられた.
被験物質として,新日鐵化学から提供されたジエチルビフェニル(ロット番号7-YYY,含量97.74 %)を使用した.受領した被験物質は,密閉容器に入れ冷所(冷蔵)で保管した.また,被験物質提供先である新日鐵化学において,動物試験前後に本被験物質の品質試験を実施し,試験期間中の被験物質の安定性を確認した.
投与検体は,被験物質を秤量し,メスシリンダーを用いて媒体であるコーン油(ナカライテスク)を加えて,4.8 w/v%溶液を調製した.この4.8 w/v%溶液を段階希釈して1.2および0.3 w/v%溶液を作製した.調製後の投与検体はガラス瓶に分取し,室温・遮光で保管した.また,0.3および4.8 w/v%の調製検体について室温・遮光条件下における8日間の安定性がHPLC法で確認されたため,投与検体の調製は投与前8日以内に行った.さらに,初回調製時の投与検体についてHPLC法で含量測定を実施した結果,各濃度の投与検体中には所定濃度の被験物質が含まれていることが確認された.
4週齢のSprague-Dawley(SD)系〔Crj:CD(SD)IGS,SPF〕の雌雄ラット(日本チャールス・リバー,厚木飼育センター)を購入し,検疫と飼育環境への馴化を兼ねて,入荷日を含め7日間予備飼育した.試験には雌雄各30匹を使用し,検疫終了時の体重を基に,体重別層化無作為抽出法により群分けした.投与開始時の週齢は5週齢であった.
動物は,許容温度21.0〜25.0℃,許容湿度40.0〜75.0 %,換気回数約15回/時間,照明12時間(7時〜19時点灯)に制御された飼育室内で,金属製金網床ケージに1匹ずつ収容し,固型飼料(CE-2,日本クレア)と水道水(秦野市水道局給水)を自由に摂取させて飼育した.
投与用量は,本試験に先立って実施した予備試験の結果を基に決定した.即ち,ジエチルビフェニルを62.5,250および1000 mg/kgの用量で,雌雄各群3匹のラットに7日間反復投与した結果,1000 mg/kg群で軽度な体重増加抑制が認められ,1000 mg/kg投与群の雄では血液学検査において血小板数が対照群に比較して有意に増加した.剖検所見では肝臓の大型化がジエチルビフェニル投与全群で観察され,低用量群でも被験物質投与の影響が僅かに認められた.以上の結果から,投与期間が28日間であることを考慮し,明らかな被験物質投与の影響が認められた250 mg/kg に近似した240 mg/kgを本試験の高用量とし,以下公比4で除して,中用量および低用量をそれぞれ60および15 mg/kgに設定した.各群の動物数は,雌雄とも対照群および高用量群を各10匹,低および中用量群を各5匹とし,対照群および高用量の雌雄各5匹は回復試験に用いた.
投与は1日1回,28日間,ラット用胃管を用いて強制的に経口投与した.投与容量は5 mL/kgとし,各投与時の最近時の体重を基に個体別に投与液量を算出した.なお,回復試験は14日間とした.
毎日(投与期間中は投与前および投与後各1回以上,回復試験期間中は1日1回),生死を含む一般状態を観察した.また,毎週1回の頻度で,毎回13時〜16時にスコアリング法を用いた詳細な症状観察を行った.まず,ケージ越しでの観察(姿勢・体位,自発運動,発声,振戦,痙攣)を行った後,動物をケージから取り出して外表を観察し(取り出し易さ,扱い易さ,心拍動,体温,被毛,皮膚色,可視粘膜,流涙,眼球突出,瞳孔径,流涎),作業台上での観察(体位・姿勢,探索行動,身づくろい,発声,挙尾反応,歩行,常同行動,奇妙な行動,振戦,痙攣,呼吸数,立毛,眼裂,排尿回数,排便回数,接触に対する反応,撤去反応,耳介反射)を行った.投与量および動物番号の情報はブラインドにして実施した.さらに,投与第4週および回復第2週の詳細な症状観察時に機能検査を行った.機能検査は聴覚刺激に対する反応(驚愕反応),視覚刺激に対する反応(視覚定位,瞳孔反射),固有感覚刺激に対する反応(正向反射)を観察した.
体重は,投与第1週は3回,それ以降は毎週2回の頻度で測定した.また,投与期間終了日(投与第28日),回復試験期間終了日(回復第14日)および剖検日にも体重を測定した.摂餌量は,毎週1回の頻度で1日あたりの摂餌量を測定した.
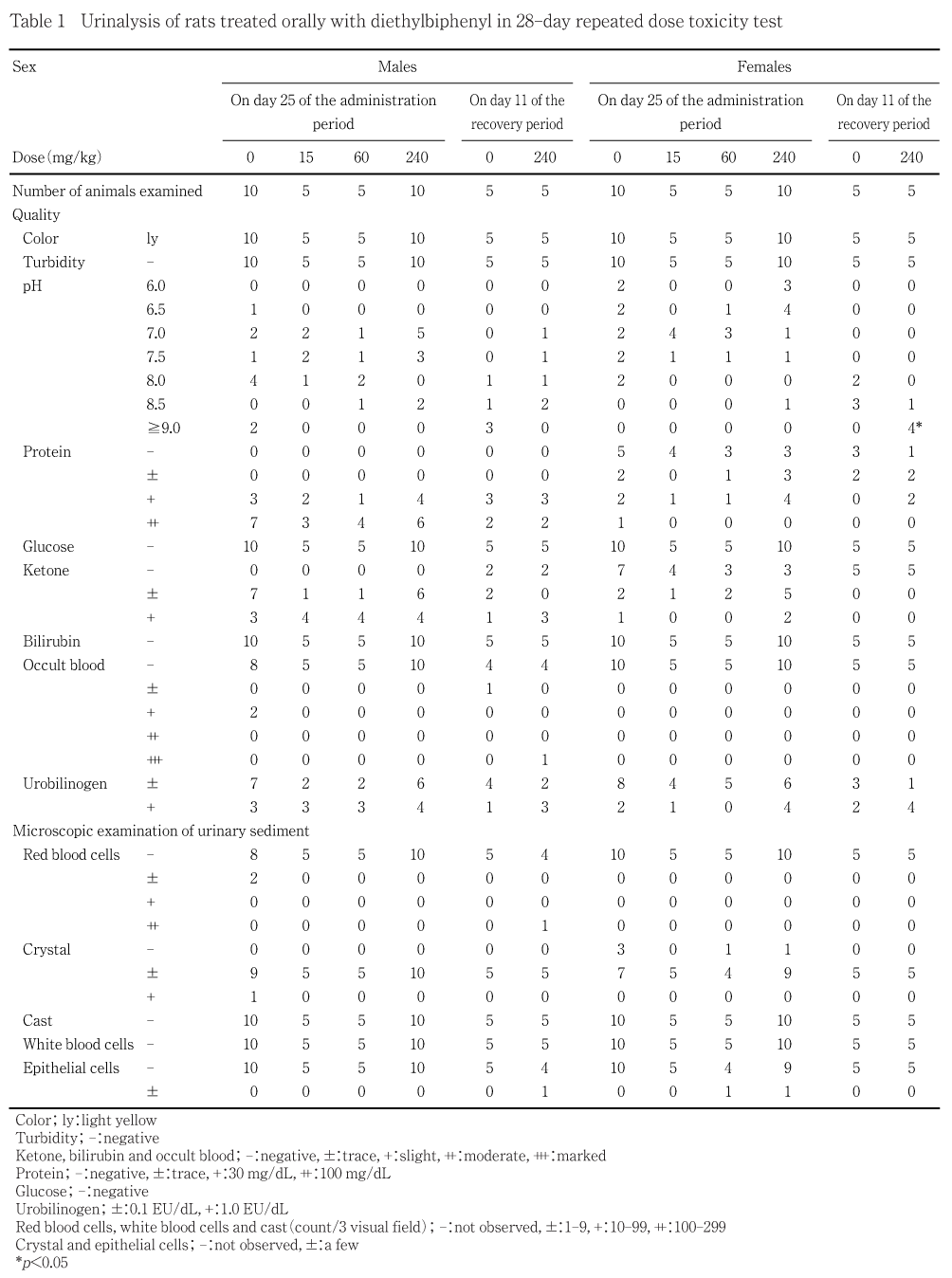
投与第4週(投与後)および回復第2週に動物を代謝ケージに収容し,採尿開始後4時間の時点で尿を採取し,視診により色調および濁度を,試験紙法(クリニテック200+,バイエル・三共)によりpH,潜血,蛋白,ブドウ糖,ケトン体,ウロビリノーゲンおよびビリルビンを,光学顕微鏡を用いて沈渣を検査した.
投与期間あるいは回復試験期間終了日から翌日の剖検日にかけて動物を,18〜21時間絶食させた.その後,ペントバルビタールナトリウム麻酔下で,腹部後大静脈からプロトロンビン時間および活性部分トロンボプラスチン時間の測定にはクエン酸ナトリウムを抗凝固剤として,その他の血液学検査用にはEDTA-2Kを抗凝固剤として採血し,血液生化学検査用にはヘパリンを抗凝固剤として採血した.採血は可能な限り対照群から低,中,高用量群の順に各群1匹ずつ,動物番号の若いほうから選抜して行った.
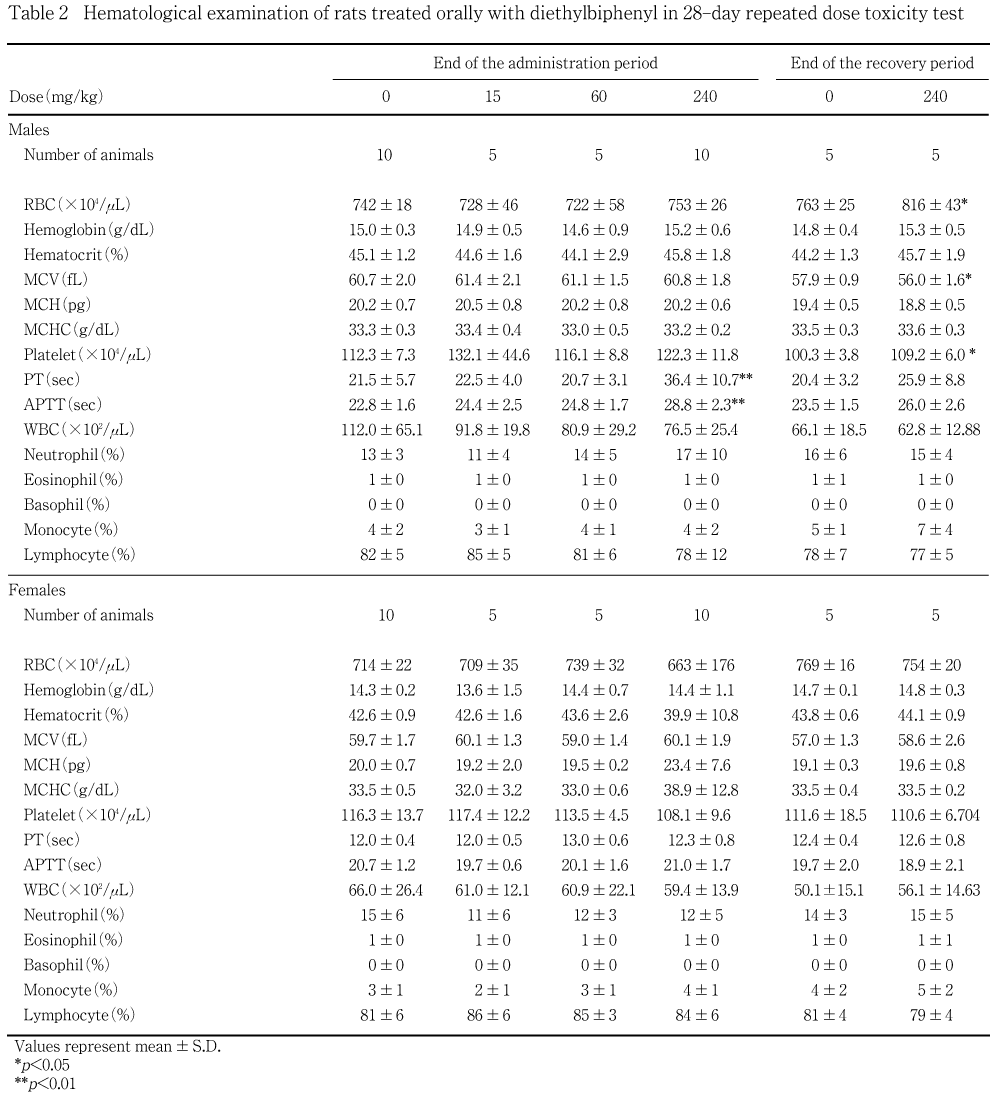
血液自動分析装置(CELL-DYN3500,ダイナボット)を用いて,電気抵抗法により赤血球数(RBC),平均赤血球容積(MCV)および血小板数,フローサイトメトリー・レーザー光散乱法/電気抵抗法により白血球数(WBC),フローサイトメトリー・レーザー光散乱法により,白血球分類,吸光度法により血色素量を測定し,これらを基にヘマトクリット値,平均赤血球血色素量(MCH)および平均赤血球血色素濃度(MCHC)を算出した.また,全自動血液凝固測定装置(CA-1000,東亜医用電子)を用いて,光散乱検出法によりプロトロンビン時間(PT)および活性部分トロンボプラスチン時間(APTT)を測定した.なお,網状赤血球比率は,採血時に標本を作製したが,赤血球数に雌雄とも変化が認められなかった事から観察は行わなかった.
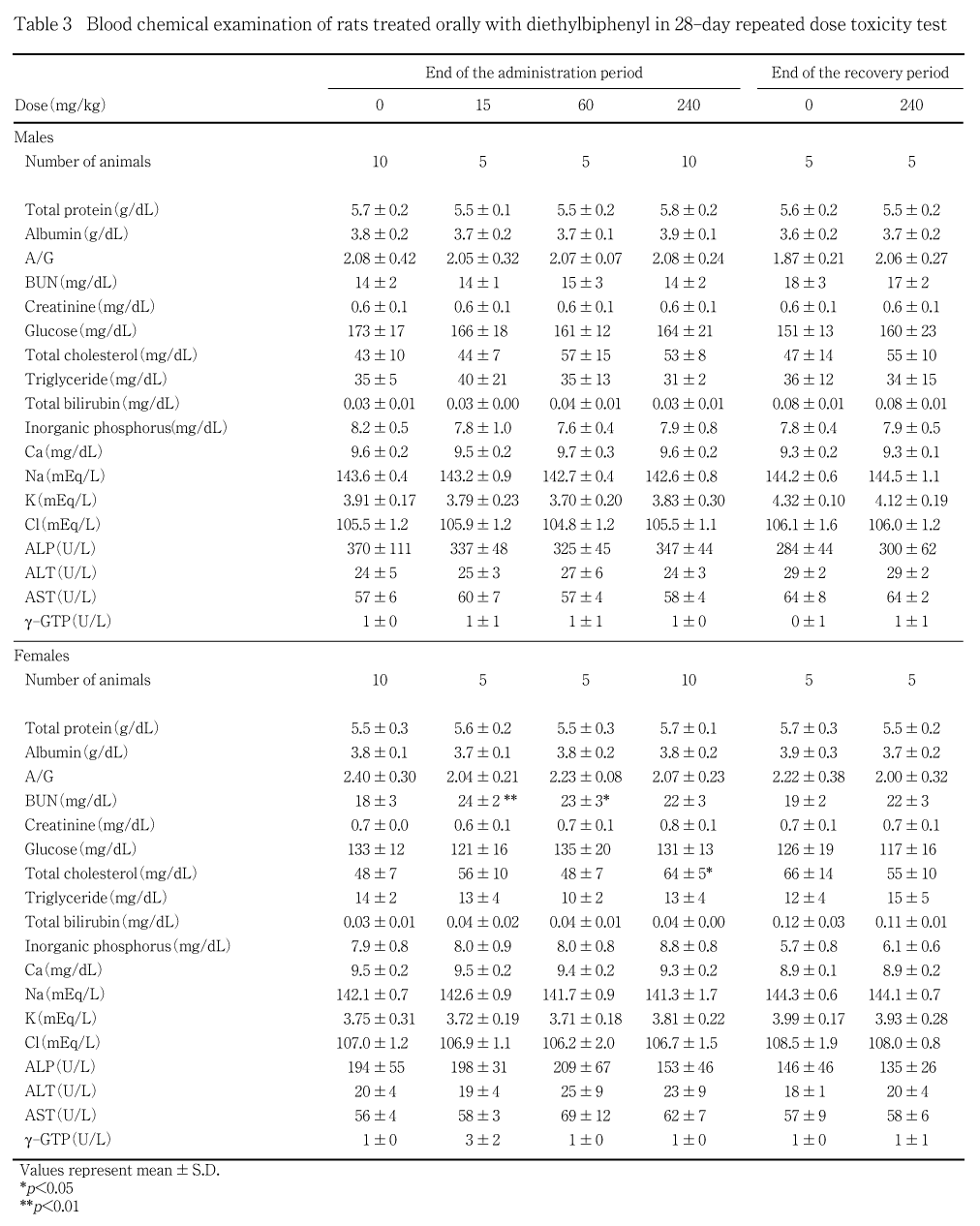
生化学自動分析装置(COBAS MIRA plus,ロシュ・ダイアグノスティックス)を用いて,ビウレット法により総蛋白濃度,BCG法によりアルブミン濃度,コレステロールオキシダーゼ・HDAOS法により総コレステロール濃度,GPO・HDAOS(グリセリン消去)法によりトリグリセライド濃度,ヘキソキナーゼ・G-6-PDH法によりグルコース濃度,ウレアーゼ・GlDH法により尿素窒素濃度(BUN),Jaff事@によりクレアチニン濃度,アゾビリルビン法により総ビリルビン濃度,GSCC法によりアルカリフォスファターゼ(ALP)活性,IFCC法によりアスパラギン酸アミノトランスフェラーゼ(AST)活性,アラニンアミノトランスフェラーゼ(ALT)活性およびg-グルタミルトランスペプチダーゼ(g-GTP)活性,OCPC法によりカルシウム濃度,モリブデン酸直接法により無機リン濃度を測定し,アルブミン/グロブリン(A/G)比を算出した.また,全自動電解質分析装置(EA05,エイアンドティー)を用いたイオン電極法によりナトリウムイオン濃度,カリウムイオン濃度および塩素イオン濃度を測定した.
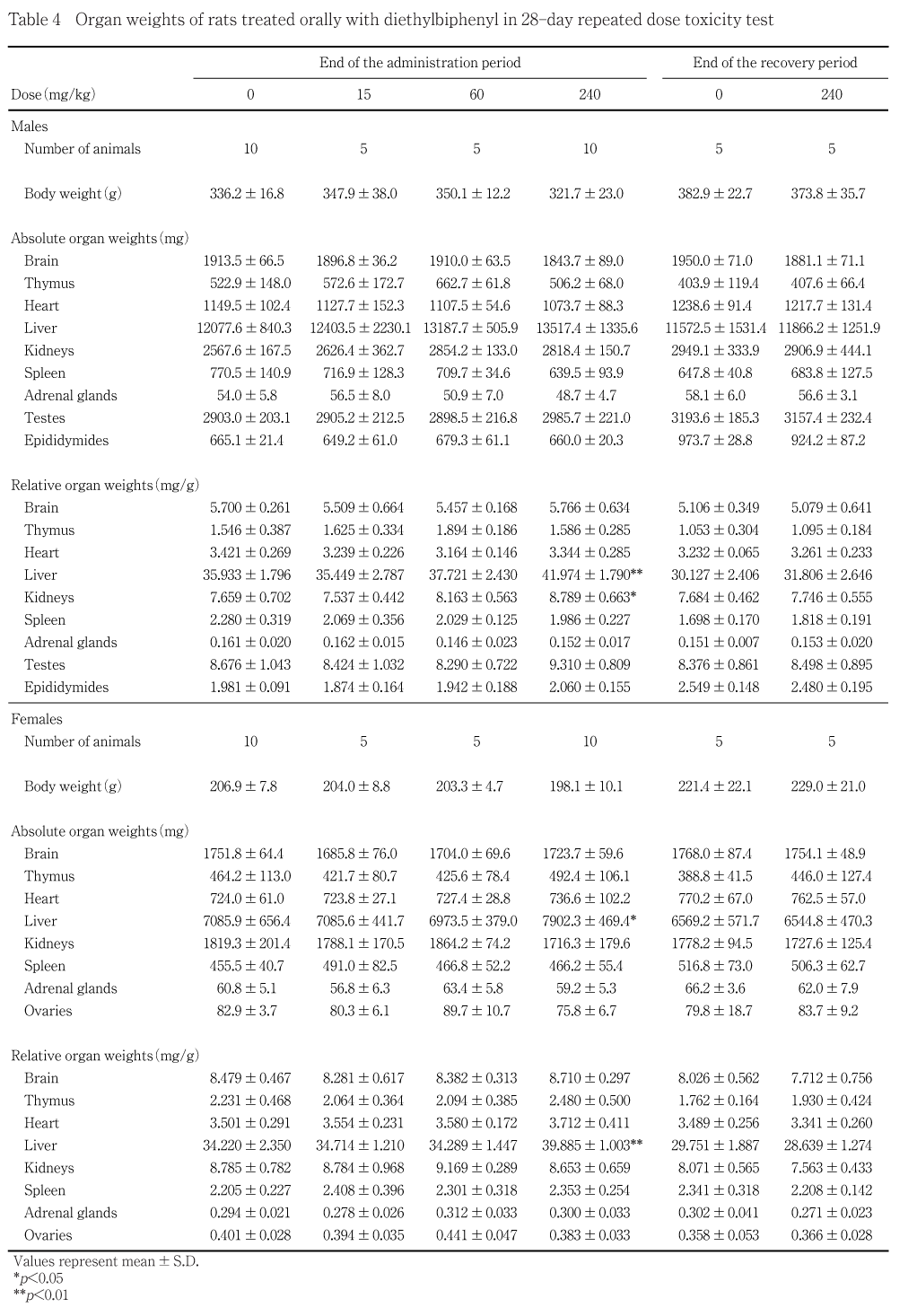
採血後,必要に応じて腋窩動脈を切断して放血屠殺し,器官および組織の肉眼的観察を実施した.また,各動物の肝臓,腎臓,副腎,精巣,精巣上体,卵巣,胸腺,脾臓,脳および心臓の重量(実重量)を測定したほか,各器官の重量を剖検日の体重で除して比体重値(相対重量)を算出した.肉眼的観察に引き続き,全例の肉眼的病変部,脳,脊髄,胃,小腸(十二指腸,空腸,回腸),大腸(結腸,直腸),肝臓,腎臓,副腎,脾臓,心臓,胸腺,甲状腺,気管,肺(気管支を含む),生殖腺(精巣,卵巣),副生殖器(精巣上体,前立腺,子宮,精嚢,腟),膀胱,リンパ節(腸間膜リンパ節,下顎リンパ節),坐骨神経(腓腹筋を含む),大腿骨および骨髄,大動脈,舌,食道,膵臓,顎下腺,舌下腺,下垂体,上皮小体および眼球を0.1Mリン酸緩衝10 %ホルマリン溶液に固定した.ただし,精巣および精巣上体はブアン液に固定した.また,投与期間終了時の対照群および高用量群の固定した器官および組織(ただし,十二指腸,空腸,直腸,精嚢,腟,大腿骨,大動脈,舌,食道および上皮小体を除く)パラフィン包埋して薄切し,ヘマトキシリン・エオジン染色標本を作製した後,光学顕微鏡を用いて組織学的に検査した.この検査の結果,肝臓,腎臓に被験物質投与に起因した可能性のある変化が認められたため,回復試験群を含む雌雄全例の肝臓および腎臓の組織学的検査を実施し,雄の対照および高用量群各2例の腎臓について抗a2uグロブリン抗体(パナファーム社提供)を用い, ABC法による免疫組織化学染色を実施した.
体重,摂餌量,血液学検査および血液生化学検査値ならびに器官重量の各測定値については,群ごとに平均値および標準偏差を求めた.検定対象が対照群を含めて4群の場合, Bartlettの方法により分散の一様性について検定を行い,分散が一様であった場合には一元配置型の分散分析を行い,群間に有意性が認められた場合は,Dunnett法により多重比較を行った.一方,分散が一様でなかった場合はKruskal-Wallisの順位検定を行い,群間に有意性が認められた場合には,Dunnett型の検定法で多重比較を行った.検定対象が対照群を含めて2群の場合,F検定を行い,等分散の場合はStudentのt検定,不等分散の場合にはAspin-Welchのt検定を行った.
尿の試験紙による検査成績,尿の色調および濁度については,投与第4週に得られた各検査値は,列の累積または分割表を用いるx^2検定を行い(pH,雄の尿蛋白については実施せず),有意性が認められた場合には,Dunnett型の検定法により多重比較を行った.回復第2週に得られた各検査値は,Wilcoxonの順位和検定を行った.
病理組織所見のグレード分けしたデータはMann- WhitneyのU検定により,また陽性グレードの合計値はFisherの直接確率の片側検定により,対照群と各被験物質投与群との間の有意差検定を行った.
なお,いずれの場合も有意水準は5 %とした.
死亡および切迫屠殺例はいずれの群にもみられなかった.
投与第9日から,流涎が高用量群の雌雄各8例で投与直後に観察されたが,翌日の投与時まで継続する例はなかった.回復試験期間中の一般状態には変化は認められなかった.
投与第2週に,ハンドリング時の一過性の流涎が高用量群の雄1例に認められた.その他,投与期間および回復試験期間ともにいずれの群にも特記すべき変化は認められず,神経毒性を示唆する所見も観察されなかった.また,投与第4週および回復第2週の機能検査でも,いずれの群においても異常は認められなかった.
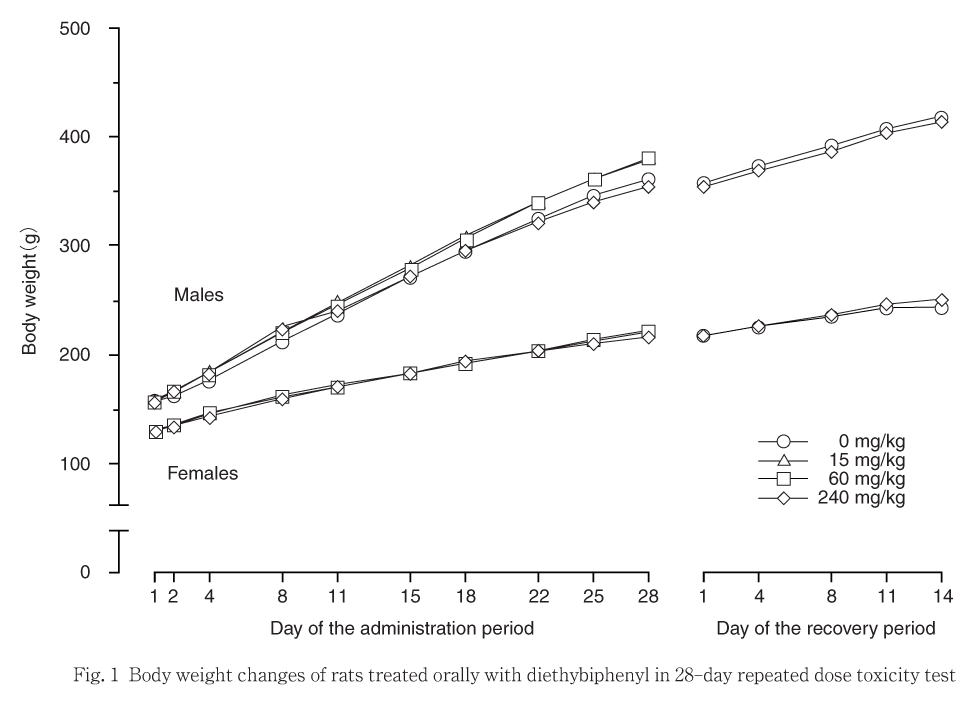
投与期間および回復試験期間を通して,体重は雌雄とも対照群と各被験物質投与群との間で有意差は認められず,概ね順調な増加傾向を示した.

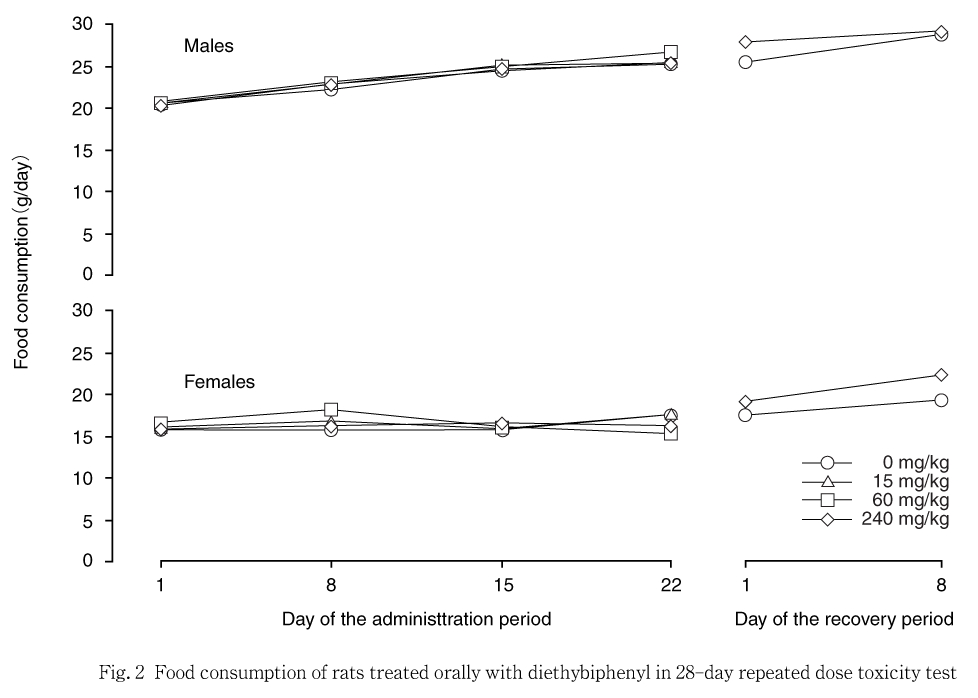
投与期間および回復試験期間を通して,摂餌量は雌雄とも対照群と各被験物質投与群の間に明らかな差は認められなかった.
投与第4週の検査では,対照群と被験物質投与群との間に明らかな差はみられなかった.回復試験第2週の検査では,対照群の雄1例に軽微な潜血が見られた.また,被験物質投与群の雄1例に重度の潜血,沈渣中の赤血球ならびに上皮細胞が観察された.
回復試験第2週の検査では雌の被験物質投与群で尿pHが対照群に比較して有意に高いアルカリ性(≧9)を示したが,雄の対照群においても3例で高いアルカリ性が観察されていること,血液生化学検査所見に異常がみられないことから,毒性学的意義は極めて少ないものと判断した.
投与期間終了時の検査では,高用量群の雄でプロトロンビン時間および活性部分トロンボプラスチン時間に有意な延長がみられた.
回復試験期間終了時の検査では,雄の被験物質投与群で赤血球数の有意な増加と平均赤血球容積の有意な減少,血小板数の有意な増加が観察されたが,片性のみに観察された変化であり,生理的変動範囲を著しく越えるものではないことから被験物質投与に関連する変化ではないと考えられる.
投与期間終了時の検査では,総コレステロール濃度の有意な増加が雌の高用量群に観察された.尿素窒素濃度の有意な増加が雌の低および中用量群に観察されたが,用量依存性がみられないこと,クレアチニン濃度,腎重量などに変化がみられなかったことから,被験物質投与に関連する変化である可能性はきわめて少ないものと考えられる.
回復試験期間終了時検査では,対照群と被験物質投与群の間で明らかな差は認められなかった.
投与期間終了時剖検例では,肝臓において実重量の有意な増加が高用量群の雌にみられ,相対重量の有意な増加が高用量群の雌雄に観察された.
その他,腎臓の相対重量の有意な増加が高用量群の雄で認められた.
回復試験期間終了時剖検例では,実重量および相対重量ともに対照群と被験物質投与群間で明らかな差が認められる器官はなかった.
雌雄の投与期間終了時および回復試験期間終了時剖検例ともに,変化は認められなかった.
投与期間終了時剖検例の肝臓では,軽微な小葉中心性肝細胞肥大が雄の高用量群3例に認められた.このほか,軽微な門脈周囲性の脂肪化が雄では対照群2例および高用量群1例に,雌では対照群を含めた各群の2〜4例に,軽微な微小肉芽腫が雌では対照群を含めた各群の1〜3例に観察されたが,対照群との間で変化の程度および発生頻度に差はみられなかった.腎臓では,雄で近位尿細管上皮細胞質内の硝子滴が対照群を含む各群に認められ,変化の程度は高用量群2例で中等度であったほかは軽微〜軽度の変化であった.好酸性小体が雄の各被験物質投与群で観察され,高用量群の1例では軽度,低および中用量群の3例は軽微な程度であった.a2u免疫組織染色を実施した対照および高用量群各2例の腎臓では,好酸性小体の辺縁部および硝子滴を含む多数の顆粒状物に免疫反応が観察された.さらに,中等度の好中球浸潤が雄の中用量群の1例に,軽微な程度を主とするリンパ球浸潤が雌雄各群に,好塩基性尿細管が雌雄各群に,皮髄境界部の軽微な鉱質沈着が雌の高用量群を除く各群に観察されたが,いずれも対照群との間で変化の程度および発生頻度に差はみられなかった.
脾臓では髄外造血が雄で軽微〜中等度,雌では軽微な程度で観察されたが雌雄とも対照群と被験物質投与群との間で発生頻度および変化の程度に差は見られなかった.
回復試験期間終了時剖検例の肝臓では,雌雄ともに軽微な門脈周囲性の脂肪化が観察され,腎臓では,好塩基性尿細管,リンパ球浸潤が雌雄に,近位尿細管の硝子滴が雄に,皮髄境界部の軽微な鉱質沈着が雌にみられたが,いずれも対照群および被験物質投与群間で変化の程度および発生頻度に差はみられなかった.
ジエチルビフェニルを15,60および240 mg/kg の用量で雌雄のSprague-Dawley系ラットに28日間にわたって強制経口投与し,その後14日間の回復試験期間を設けた.
一般状態観察では投与第9日以降投与終了日まで,240 mg/kg投与群の雌雄では投与直後の一過性流涎が高頻度に観察された.この症状は翌日の投与時には認められず,雌雄とも回復試験期間中には観察されなかったことから,被験物質の刺激性に起因する変化と判断される.
投与期間終了時剖検例の器官重量では,240 mg/kg投与群の雌では肝臓の実重量,同群の雌雄で肝臓の相対重量の増加が観察された.組織学検査で240 mg/kg投与群の雄で軽微な小葉中心性の肝細胞肥大が認められたことから,被験物質投与により肝臓における薬物代謝経路が活性化された可能性が考えられる.しかし,投与期間終了時の血液および血液生化学検査では240 mg/kg投与群の雄にプロトロンビン時間,活性部分トロンボプラスチン時間の有意な延長が,雌では総コレステロール濃度の有意な増加はみられたもののALT活性,AST活性などに変化がみられなかったことから1),240 mg/kg投与群での毒性変化は肝機能障害を生じるような重篤な変化ではないと考えられる.また,回復試験終了時の血液,血液生化学,病理学検査結果においては肝臓機能に関連した項目の変化は認められなかったことから,投与終了時に240 mg/kg投与群に観察された肝臓の変化は2週間の休薬で回復するものと考えられる.
一方,240 mg/kg群の雄では,腎臓の相対重量の有意な増加が観察され,組織学検査では中等度の近位尿細管上皮細胞質内の硝子滴が2例,軽度の好酸性小体が1例にみられた.硝子滴や好酸性小体は雄ラットの自然発生性変化としてよく観察される所見であるが2),D-リモネンやパラジクロルベンゼンなどの化学物質投与によりこの硝子滴の沈着が亢進することも知られている3).このため,雄については中間用量群の組織学検査を実施したが,対照群と各被験物質投与群間で硝子滴および好酸性小体の発生頻度および程度に統計学的有意差はなく,対照および240 mg/kg 群各2例で実施したa2uグロブリン免疫染色では全例に陽性反応が認められ,本試験で観察された硝子滴や好酸性小体も雄ラット特有の自然発生変化と考えられる.これらの結果から,雄の腎臓に観察された相対重量増加は被験物質投与に起因する可能性はきわめて少ないと判断される.
以上の結果から,ジエチルビフェニルの28日間反復投与によって引き起こされた毒性変化は,240 mg/kg投与群雄に観察されたプロトロンビンおよび活性部分トロンボプラスチン時間の延長,同群雌における総コレステロール濃度増加,雌雄に認められた肝臓の相対重量増加および雌の実重量増加,雄で観察された小葉中心性の肝細胞肥大であった.よって,無毒性量は雌雄とも60 mg/kg/dayと考えられる.
| 1) | Nagayabu T et al.:Background data for repeated- dose toxicity studies using Crj:CD(SD)IGS rats at the Hikari branch, Drug Safety Research Laboratories in Takeda Chemical Industries, Ltd. In “Biological Reference Data on CD(SD)IGS Rats- 1999”, Matsuzawa T, Inoue H(eds), CD(SD)IGS Study Group, Yokohama (1999)pp.74-88. |
| 2) | Noto T et al.:Spontaneous lesions in Crj:CD(SD) IGS rats versus in Jcl:SD rats used in toxicity studies -Histopathological findings. In “Biological Reference Data on CD(SD)IGS Rats-1999”, Matsuzawa T, Inoue H(eds), CD(SD)IGS Study Group, Yokohama(1999)pp.106-118. |
| 3) | 伊東信行(編著): 「最新毒性病理学」中山書店, 東京(1994)pp.193-209. |
| 連絡先 | |||
| 試験責任者: | 永田伴子 | ||
| 試験担当者: | 加藤博康,関 剛幸,古谷真美, 堀内伸二,稲田浩子,三枝克彦, 安生孝子 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | |||
| Authors: | Tomoko Nagata (Study Director) Hiroyasu Kato, Takayuki Seki, Mami Furuya, Shinji Horiuchi, Hiroko Inada, Katsuhiko Saegusa, Takako Anjo |
||
| Hatano Research Institute, Food and Drug Safety Center 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | |||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | ||