エテニルトリメトキシシランのラットを用いる経口投与による反復投与毒性・生殖発生毒性併合試験を行い,雌雄動物に対する毒性影響を検討するとともに,性腺機能,交尾行動,受胎および分娩などの生殖行動に及ぼす影響について検討した.投与量は,1000 mg/kgを高用量とし,以下250および62.5 mg/kgとした.各群の使用動物数は試験群を雌雄各12例とし,雄では各群ともそのうち半数を回復群とし,雌ではサテライト群として対照群,250および1000 mg/kg群に各6例の回復群を設けた.
死亡例は1000 mg/kg群で雄2例と雌1例に認められた.1000 mg/kg群の死亡例の雌雄で被毛の汚れ,自発運動の低下,赤色尿,体温下降,口の周囲の汚れ,肛門周囲の汚れ,下痢,緩徐呼吸および立毛がみられた.1000および250 mg/kg群の雌雄の生存例では,被毛の汚れおよび赤色尿がみられた.体重は,1000 mg/kg群の雄で投与期間に低値,雌で交配開始前に一過性の低値,妊娠21日および哺育0日に低値がみられた.摂餌量は,1000 mg/kg群の雄で低値および雌で交配開始前に低値がみられた.行動機能(FOB),感覚反応,握力および自発運動量では,投与に起因する変化はみられなかった.
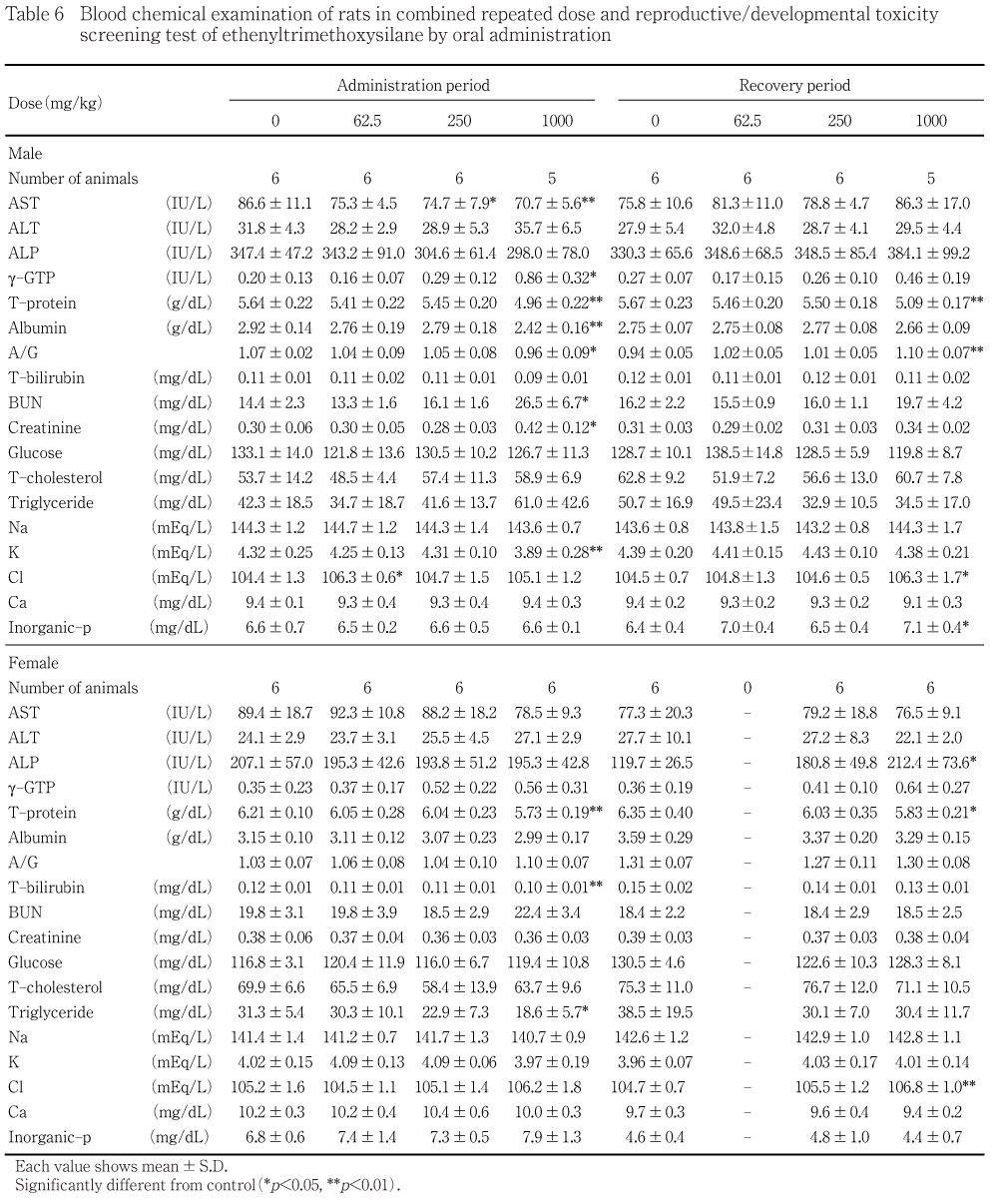
尿検査において,投与期間終了時に雌雄とも1000 mg/kg群で潜血陽性,上皮細胞,赤血球あるいは白血球がみられた.回復期間終了時には,雌雄とも投与に起因する変化は認められなかった.血液学検査において,投与期間終了時に雄では1000 mg/kg群で赤血球数,ヘモグロビン量およびヘマトクリット値,MCVおよびMCHの低値ならびにフィブリノーゲン濃度の高値,雌では250および1000 mg/kg群でヘマトクリット値の低値,1000 mg/kg群でヘモグロビン量の低値および活性化部分トロンボプラスチン時間の高値がみられた.回復期間終了時には,貧血傾向が1000 mg/kg群の雌雄および250 mg/kg群の雌で継続してみられた.血液生化学検査において,投与期間終了時に雄では1000 mg/kg群で総蛋白,アルブミン量,A/GおよびKの低値,g-GTP,尿素窒素およびクレアチニンの高値,雌では1000 mg/kg群で総蛋白およびトリグリセライドの低値ならびにg-GTPの高値傾向,250 mg/kg群でg-GTPの高値傾向がみられた.回復期間終了時には,1000 mg/kg群の雌雄で総蛋白の低値がみられた.
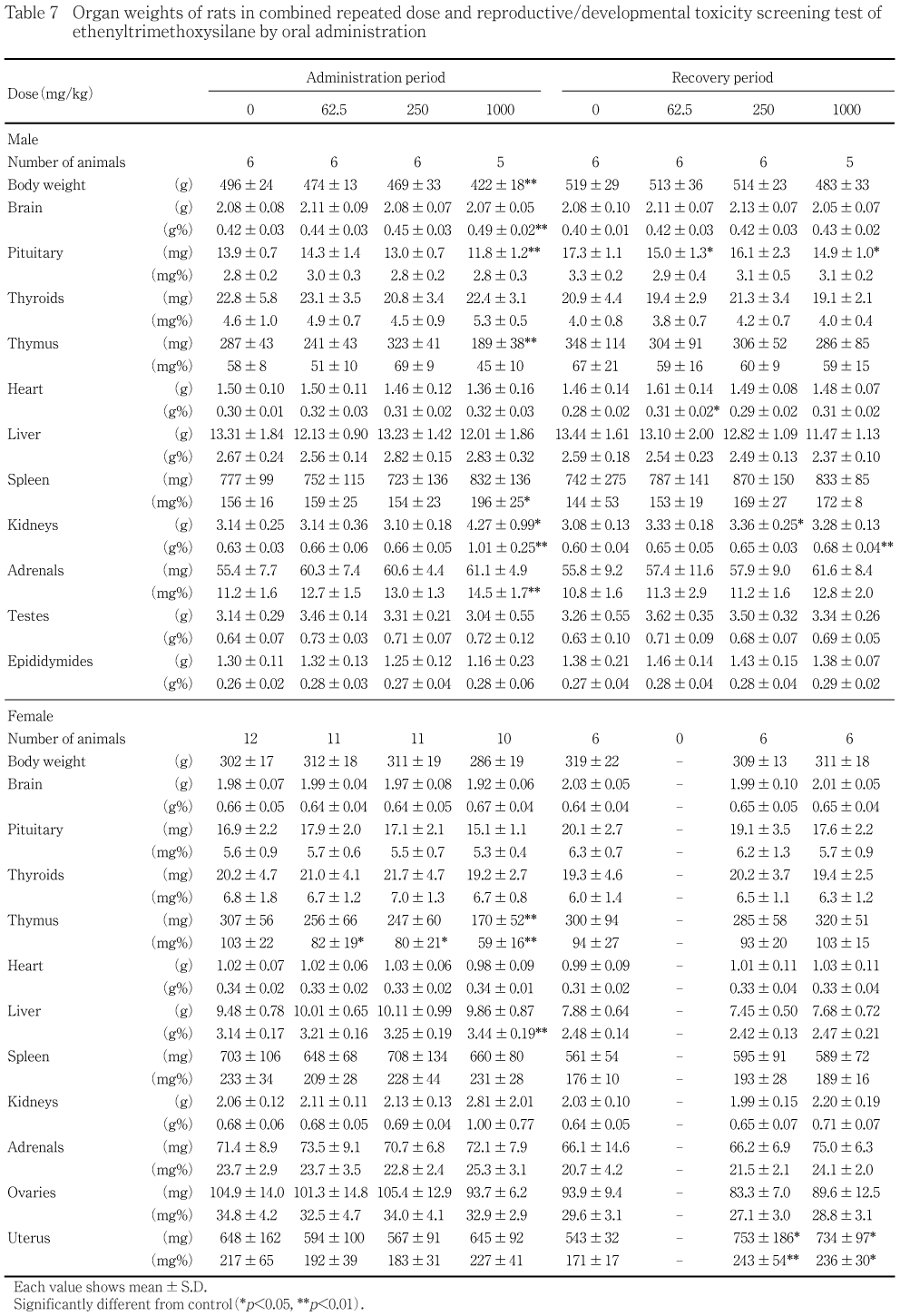
剖検において,投与期間終了時に1000 mg/kg群の雄で腎臓の腫大がみられた.器官重量において,投与期間終了時に雄では1000 mg/kg群で胸腺の絶対重量の低値,腎臓の絶対重量の高値ならびに脾臓,腎臓および副腎の相対重量の高値,雌では1000,250および62.5 mg/kg群で胸腺の相対重量の低値,1000 mg/kg群で胸腺の絶対重量の低値,肝臓の相対重量の高値がみられた.回復期間終了時には,1000 mg/kg群の雄で腎臓の相対重量の高値がみられた.雌では,投与に起因する変化は認められなかった.
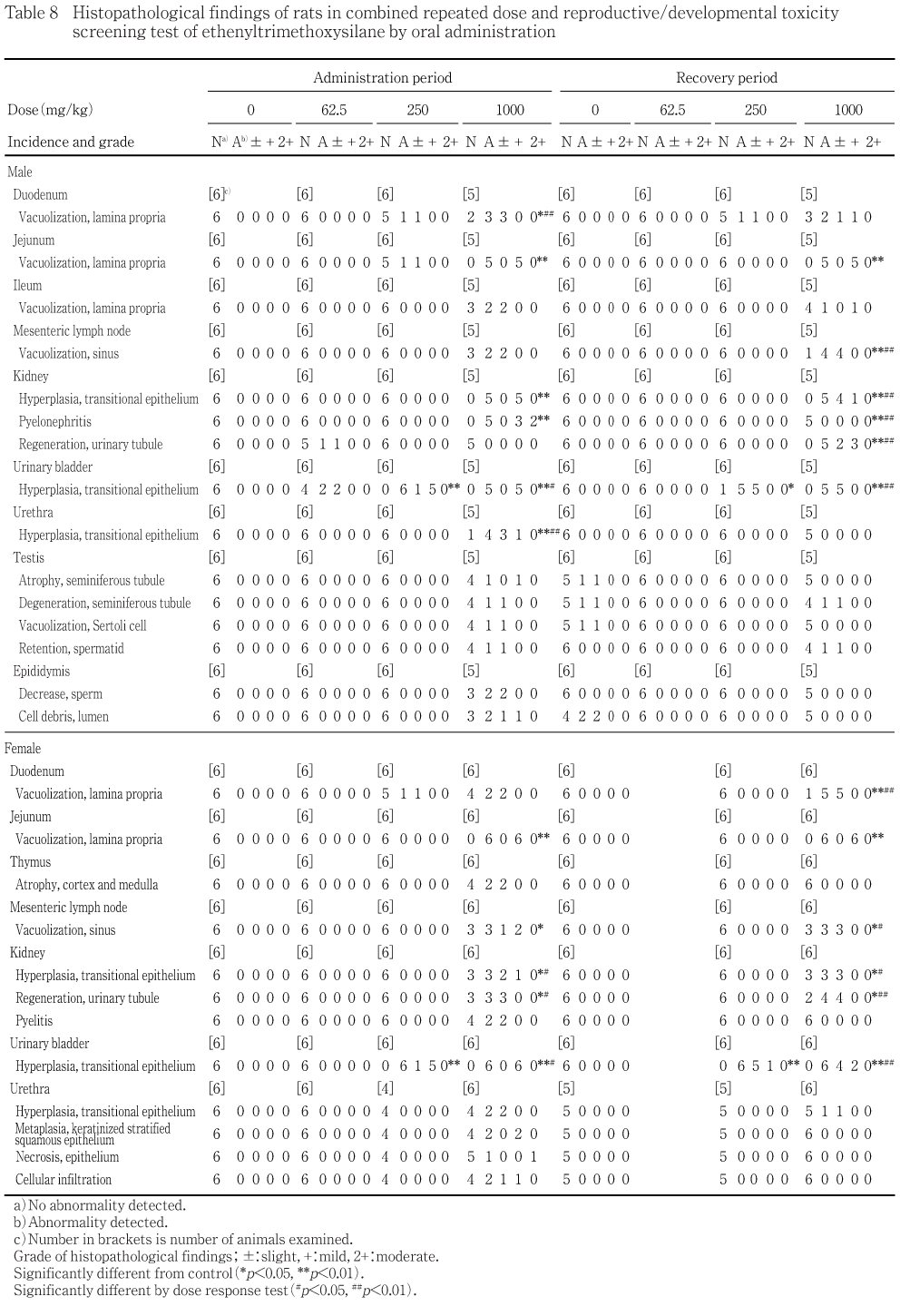
病理組織学検査では,投与期間終了時には雄では膀胱に移行上皮の過形成が1000,250および62.5 mg/kg群,十二指腸,空腸または回腸に粘膜固有層の空胞化が1000および250 mg/kg群,腸間膜リンパ節にリンパ洞の空胞化,腎臓に移行上皮の過形成および腎盂腎炎,尿道に移行上皮の過形成が1000 mg/kg群でみられた.雌では,十二指腸または空腸に粘膜固有層の空胞化ならびに膀胱に移行上皮の過形成が1000および250 mg/kg群,胸腺に皮質および髄質の萎縮,腸間膜リンパ節にリンパ洞の空胞化,腎臓に移行上皮の過形成,尿細管の再生および腎盂炎,尿道に移行上皮の過形成,角化重層扁平上皮化生,細胞浸潤および上皮の壊死が1000 mg/kg群でみられた.回復期間終了時には,雄では十二指腸,空腸または回腸に粘膜固有層の空胞化および膀胱に移行上皮の過形成が1000および250 mg/kg群,腸間膜リンパ節にリンパ洞の空胞化,腎臓に移行上皮の過形成および尿細管の再生が1000 mg/kg群,雌では膀胱に移行上皮の過形成が1000および250 mg/kg群,十二指腸および空腸に粘膜固有層の空胞化,腸間膜リンパ節にリンパ洞の空胞化,腎臓に移行上皮の過形成および尿細管の再生ならびに尿道に移行上皮の過形成が1000 mg/kg群でみられた.
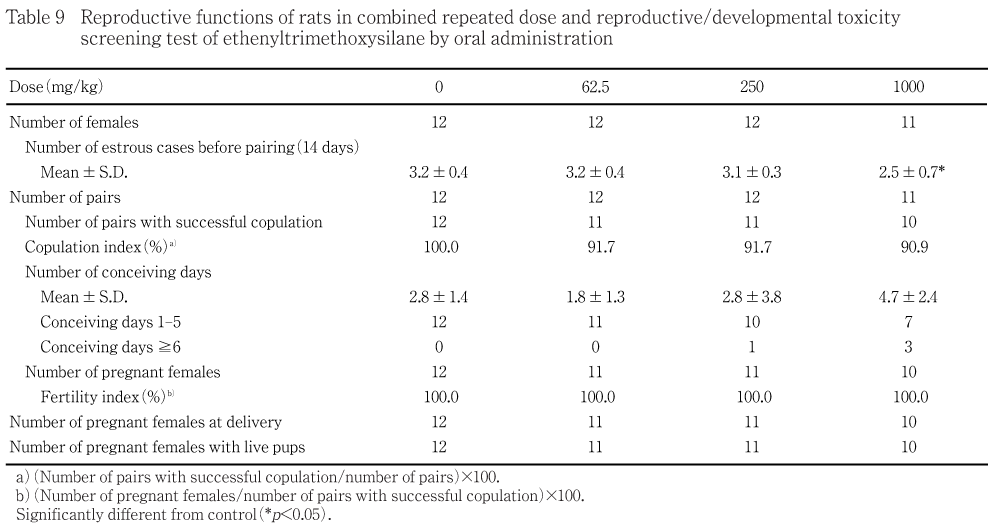
交配開始前の発情回数は,1000 mg/kg群で低値がみられた.交尾率,交尾所要日数,受胎雌数,受胎率,妊娠期間,出産率,分娩状態,哺育状態,妊娠黄体数,着床数および着床率には,投与に起因する変化はみられなかった.
児動物では,総出産児数,死産児数,新生児数,性比,分娩率,児の産出率,出生率,一般状態,4日の新生児数,新生児の4日の生存率,外表異常,体重および剖検には,投与に起因する変化はみられなかった.
以上のように,エテニルトリメトキシシランの無毒性量は,雄では62.5 mg/kg投与で膀胱に移行上皮の過形成が認められたことから62.5 mg/kg/day未満,雌では62.5 mg/kg投与で胸腺に病理組織学変化がみられないものの相対重量の低値が認められたことから,62.5 mg/kg/day未満と考えられる.また,生殖発生毒性学的な無毒性量は,雄では1000 mg/kg投与でいずれの項目にも影響が認められなかったことから1000 mg/kg/ day,雌では1000 mg/kg投与で性周期に影響が認められたことから250 mg/kg/dayと考えられる.児動物への無毒性量は,1000 mg/kg投与で生存性および体重などに影響が認められなかったことから1000 mg/kg/dayと考えられる.
エテニルトリメトキシシランは,無色透明の液体で微臭があり,水に難溶(加水分解性あり)である[Lot No. 308595,含量:100 %,沸点:123℃,蒸気圧:2.7 kPa以下/25℃,揮発性:なし,融点:0℃以下,比重又は嵩比重:0.97(25℃),信越化学工業(東京)].入手後は,冷蔵・遮光の条件下で保管した.投与期間終了後に被験物質を分析し,使用期間中安定であったことを確認した.
エテニルトリメトキシシランは,トウモロコシ油で溶解し,調製した.10,20および200 mg/mLの調製液は,調製後,冷蔵および遮光の条件下で7日間保管後,さらに室温および遮光の条件下で6時間保管しても安定性に問題のないことが確認されている.投与検体は,週1回以上の頻度で調製し,冷蔵・遮光条件下で保管後,7日以内に使用した.投与開始日および投与終了日に使用した投与検体中の被験物質濃度を測定した結果,被験物質含量に問題はなかった.
7週齢のCrj:CD(SD)IGS雌雄ラット(SPF)を日本チャールス・リバーから購入した.入手した動物は,5日間の検疫期間およびその後16日間(ただし,サテライト群雌は17日間)の馴化期間を設け,一般状態,体重推移あるいはFOB観察に異常がみられず,また性周期観察で異常が認められなかった動物(発情期が認められ,4日あるいは5日周期と考えられた動物)を群分けした.群分けは,コンピュータを用いて体重を層別に分けた後に無作為抽出法で各群の平均体重および分散がほぼ等しくなるように投与開始日に行った.
動物は,室温22〜24℃,湿度41〜71 %,明暗各12時間(照明:午前6時〜午後6時),換気回数12回/時に維持された飼育室で飼育した.検疫・馴化期間中および群分け後ともステンレス製ケージを用いて個別飼育した.母動物は,妊娠18日以降オートクレーブ処理した床敷(サンフレーク,日本チャールス・リバー)を入れたプラスチック製ケージで個別飼育し,自然分娩および哺育させ,哺育4日以降ステンレス製ケージを用いて個別飼育した.飼料は,固型飼料(CRF-1,オリエンタル酵母工業)を自由に摂取させた.剖検前日の午後4時から絶食させた.飲料水は,水道水を自由に摂取させた.
投与経路は,経口投与を選択した.投与に際しては,金属製経口胃ゾンデを取り付けたポリプロピレン製ディスポーザブル注射筒を用いて,強制経口投与した.投与液量は,投与日あるいは投与日に最も近い測定日の体重を基準とし,5 mL/kgで算出した.投与回数は1日1回とした.投与開始日の週齢は雌雄とも10週齢であり,体重範囲は雄が371〜423 g,雌が244〜271 g,サテライト群雌が250〜277 gであった.
各群の動物数は,試験群に雌雄各12例,サテライト群に雌各6例とした.ただし,雄は各群半数を回復群とした.
予備試験(投与段階:0,250,500および1000 mg/kg,各群雄5例)において,いずれの群にも死亡例は認められなかったが,250 mg/kg以上の群で投与後に赤色尿がみられ,摂餌量の低値,尿検査で潜血が認められた.そこで,当試験の投与量は,1000 mg/kgを高用量とし,以下公比4により250および62.5 mg/kgとした.また,対照として媒体(トウモロコシ油)のみを同容量投与する群を設けた.
投与期間は,雄では交配前14日間とその後28日間の合計42日間とし,試験群雌では交配前14日間,交配期間中,妊娠期間中および哺育6日までの合計44〜58日間とした.雄については,42日間の投与後に各群とも半数の動物について14日間の回復期間を設けた.また,サテライト群雌については,42日間の投与後に14日間の回復期間を設けた.なお,投与開始日を投与1日とし,最終投与の翌日を回復1日とした.
一般状態および死亡の有無は,投与期間中に投与前・後の1日2回,回復期間中に毎日1回観察した.死亡例は,発見後速やかに剖検した.
雄の体重は,投与期間中および回復期間中とも1週間に2回測定した.雌の体重は,投与期間中および回復期間中とも1週間に2回測定し,妊娠期間中は妊娠0,7,14および21日,哺育期間中は哺育0,4,6および7日に測定した.
雄の摂餌量は,交配開始前14日間および交配期間終了後から1週間に2回測定した.雌の摂餌量は,交配開始前14日間までは1週間に2回,妊娠期間中は妊娠2,9,16および20日,哺育期間中は哺育2日に測定した.
全例について,投与期間中に週1回下記の項目を観察した.観察は,投与後1時間に実施した.
(a)姿勢,かみつき行動,眼瞼閉鎖状態および痙攣はケージ内で観察した.
(b)ケージからの出し易さ,扱い易さ,筋の緊張,毛の状態,流涙,流涎および呼吸は手に持って観察した.
(c)立ち上がり回数,毛づくろい回数,歩行状態,眼瞼閉鎖状態,覚醒度,行動異常および正向反射はオープンフィールド内で観察した.
雄は,投与期間終了時剖検例について,投与41日の行動機能(FOB)観察後に瞳孔反射,接近反射,触覚反射,聴覚反射および痛覚反射を検査した.
雌は,各群とも動物番号の若い順に各6例について,哺育3日の行動機能(FOB)観察後に雄と同一項目を検査した.
雄は,投与期間終了時剖検例について,投与41日の感覚反応検査終了後にCPUゲージ(アイコーエンジニアリング)を用いて,前肢および後肢の握力を測定した.雌は,各群とも動物番号の若い順に各6例について,哺育3日の感覚反応検査終了後にCPUゲージを用いて,前肢および後肢の握力を測定した.
雄は,投与期間終了時剖検例について,投与40日にActivity Monitor(MED Associates)を使用し,歩行量および立ち上がり回数を投与後1時間まで測定した.雌は,各群とも動物番号の若い順に各6例について,哺育4日にActivity Monitorを使用し,歩行量および立ち上がり回数を投与後1時間まで測定した.
雄は,投与期間終了前に投与期間終了時の剖検用動物,回復期間終了前に回復期間終了時の剖検用動物について,採尿ケージを用いて絶食・給水下で新鮮尿を採取後,引き続いて給餌・給水下で24時間尿を採取した.雌は,各群とも動物番号の若い順に各6例について,哺育5日に採尿ケージを用いて絶食・給水下で新鮮尿を採取後,引き続いて給餌・給水下で24時間尿を採取した.サテライト群の雌は,回復期間終了前に採尿ケージを用いて絶食・給水下で新鮮尿を採取後,引き続いて給餌・給水下で24時間尿を採取した.採取した尿について,以下の検査を実施した.
新鮮尿:色調は,外観判定とした.pH,蛋白質,ブドウ糖,ケトン体,ビリルビン,潜血,ウロビリノーゲンは,尿検査試験紙(栄研化学)と尿自動分析装置(US- 2100,栄研化学)を用いて検査した.尿沈渣は,尿沈渣染色液(新Sternheimer法,国際試薬)で染色後に顕微鏡下で観察した.
24時間尿:尿量は,尿比重と重量から算出した.尿比重(S.G.)は,屈折率により屈折型尿比重計(ユリペット-IID,ニコン)を用いて測定した.
雄は,最終投与の翌日および回復期間終了後にペントバルビタールナトリウムの腹腔内投与による麻酔下で腹大動脈から血液を採取した.雌は,各群とも動物番号の若い順に各6例について,最終投与の翌日(哺育7日)にペントバルビタールナトリウムの腹腔内投与による麻酔下で腹大動脈から血液を採取した.サテライト群の雌は,回復期間終了後にペントバルビタールナトリウムの腹腔内投与による麻酔下で腹大動脈から血液を採取した.採取した血液について,以下の検査を実施した.
赤血球数,ヘモグロビン,ヘマトクリット,血小板数および白血球数は,EDTA-2K処理した血液について,多項目自動血球計数装置(Sysmex K-4500,シスメックス)を用いて測定した.さらに,平均赤血球容積(MCV),平均赤血球血色素量(MCH)および平均赤血球血色素濃度(MCHC)を算出した.
網状赤血球比率は,EDTA-2K処理した血液をBrecher法により超生体染色後,Giemsa染色標本を作製して顕微鏡下で赤血球1000個中の網状赤血球数を計数し,算出した.
白血球百分率は,EDTA-2K処理した血液のMay- Giemsa染色標本を作製して顕微鏡下で白血球100個を分類計数した.
プロトロンビン時間(PT),活性化部分トロンボプラスチン時間(APTT)およびフィブリノーゲンは,血液を3.2 %クエン酸ナトリウムで処理後,遠心分離[約4℃,3000 rpm(約1972×g),15分間]して得た血漿について,光散乱検出方式により全自動血液凝固測定装置(CA-530,シスメックス)を用いて測定した.
雌雄とも,血液学検査用の血液と同時期に腹大動脈から採取した血液を遠心分離[約4℃,3000 rpm(約1972×g),15分間]して得た血清について,以下の検査を実施した.
ASTはMDH-UV法,ALTはLDH-UV法,ALPはp-ニトロフェニルリン酸基質法,g-GTPはL-g-グルタミル-3-カルボキシ-4-ニトロアニリド基質法,総蛋白はBiuret法,総ビリルビンはジアゾ法,尿素窒素はウレアーゼ・GlDH法,クレアチニンはクレアチニナーゼ・F-DAOS法,ブドウ糖はヘキソキナーゼ・G-6-PDH法,総コレステロールはCOD・HDAOS法,トリグリセライドはGPO・HDAOS法,Caはo-CPC法,無機リンはPNP・XDH法,Na,KおよびClはイオン選択電極法により,いずれも生化学自動分析装置(AU 400,オリンパス)を用いて測定した.
アルブミンは総蛋白および蛋白分画値[電気泳動法,自動電気泳動装置(AES 310,オリンパス)]から,A/G(アルブミン/グロブリン)は蛋白分画値から算出した.
雌雄とも,採血後さらに放血致死させ,剖検した.脳(大脳,小脳,延髄),下垂体,甲状腺,胸腺,心臓,肝臓,脾臓,腎臓,副腎,精巣,精巣上体,卵巣および子宮は重量を測定した.各器官重量を最終体重で除して相対重量も算出した.下垂体および甲状腺は20 %中性緩衝ホルマリンで1晩固定後,測定した.これらの器官は,肺,気管,膵臓,唾液腺(舌下腺・顎下腺),食道,胃,十二指腸,空腸,回腸,盲腸,結腸,直腸,リンパ節(下顎・腸間膜),膀胱,精嚢,前立腺,腟,上皮小体,脊髄,坐骨神経,眼球,ハーダー腺,胸骨,大腿骨および乳腺とともに20 %中性緩衝ホルマリンで固定した.ただし,精巣および精巣上体はブアン液で2〜3時間固定後,90 %エチルアルコールに再固定し,眼球はグルタールアルデヒド・ホルマリンで1晩固定後,20 %中性緩衝ホルマリンに再固定した.母動物は,妊娠黄体数および着床数を算定した.
投与期間終了時剖検例の対照群および1000 mg/kg群の雌雄ならびに1000 mg/kg群の死亡例について,パラフィン包埋標本を作製後,HE染色組織標本を作製し,病理組織学検査を実施した.1000 mg/kg群の検査において対照群と比べて異常を示す動物数に差があると考えられた十二指腸,空腸,回腸,胸腺,腸間膜リンパ節,腎臓,膀胱,尿道,精巣および精巣上体については,250および62.5 mg/kg群についてもHE染色組織標本を作製し,病理組織学検査を実施した.また,回復期間終了時剖検例についても,十二指腸,空腸,回腸,胸腺,腸間膜リンパ節,腎臓,膀胱,尿道,精巣および精巣上体について同様に検査した.250 mg/kg以上の群で空腸を主とする小腸に粘膜固有層の空胞化が認められたため,対照群および1000 mg/kg群の各3例について空腸のオイルレッドO染色標本を作製し,病理組織学的検査を実施し,粘膜固有層の空胞化が脂肪蓄積によるものか否かを確認した.
雌の性周期は,投与開始日から交尾確認前日まで毎日1回観察した.
14日間投与した雄と雌を同一群内で1対1に組み合わせて同居交配した.交配期間は14日を限度として,交尾を確認するまでの連続同居交配とした.交尾確認は毎朝ほぼ一定時刻に行い,腟垢内に精子または腟栓を確認した雌を交尾成立動物として,その日を妊娠0日として起算した.
交尾雌は自然分娩させ,分娩状態の異常の有無,分娩終了の確認を妊娠21日から妊娠25日の午前10時まで毎日行った.午前10時に分娩が終了していた場合,その日を哺育0日とした.
母動物は,哺育状態を哺育0日から4日まで毎日観察した.
出産時に総出産児数と性,死産児数,新生児数および外表異常の有無を観察した.児動物は,一般状態および死亡の有無を毎日1回観察した.体重は,哺育0日(出生日)および4日に測定した.生存児は,哺育4日にジエチルエーテル麻酔下で腹大動脈から放血致死させた後に剖検した.
有意差検定は下記に示したように,対照群と各投与群の間で行い,危険率を5 %とした.
体重,摂餌量,握力,自発運動量,尿量,尿比重,血液学検査成績,血液生化学検査成績,器官の絶対重量および相対重量,発情回数,交尾所要日数,妊娠期間,妊娠黄体数,着床数,着床率,総出産児数,新生児数,死産児数,分娩率,児の産出率,出生率,4日の新生児数,新生児の4日の生存率,外表異常の出現率および性比は,各群で平均値および標準偏差を算出した.その後,Bartlett法による等分散性の検定を行い,等分散の場合にはDunnett法により行った.一方,等分散と認められなかった場合は,順位を利用したDunnett型の検定法により行った.
交尾率,受胎率および出産率は,χ^2検定により行った.
病理組織学検査において,1000 mg/kg群で毒性学的影響が示唆され,62.5および250 mg/kg群についても検査を実施した組織所見については,対照群との群間比較を上記の順位を利用したDunnett型の検定法を用いて行った.1000 mg/kg群において対照群との間に有意差が認められた場合は,Cochran・Armitageの傾向検定を用いて用量反応性の検定を行った.
1000 mg/kg群では,投与16日と投与17日に各1例が死亡した.対照群,62.5および250 mg/kg群では,死亡例および瀕死例は認められなかった.
投与期間中には,1000 mg/kg群では死亡2例のうち投与開始日から死亡前日までに一過性の流涎,被毛の汚れ,自発運動の低下,赤色尿および体温下降が2例,口の周囲の汚れ,肛門周囲の汚れ,下痢,緩徐呼吸および立毛が1例にみられた.同群の生存例では,投与直後に一過性の流涎が10例全例,被毛の汚れが10例全例および赤色尿が9例にみられた.250 mg/kg群では,投与直後に一過性の流涎が9例,被毛の汚れが12例全例および赤色尿が4例にみられた.62.5 mg/kg群では,一般状態の異常はみられなかった.
回復期間中には,いずれの群とも一般状態の異常はみられなかった.
1000 mg/kg群では,投与8日に1例が死亡した.対照群,62.5および250 mg/kg群では,死亡例および瀕死例は認められなかった.
交配開始前および交配期間中には,1000 mg/kg群では死亡例において投与開始日から死亡前日までに被毛の汚れ,自発運動の低下,赤色尿,体温下降,緩徐呼吸および立毛がみられた.同群の生存例では,投与直後に一過性の流涎が10例,被毛の汚れが11例全例および赤色尿が10例にみられた.250 mg/kg群では,投与直後に一過性の流涎が2例,被毛の汚れが9例および赤色尿が4例にみられた.62.5 mg/kg群では,一般状態の異常はみられなかった.
妊娠期間中には,1000 mg/kg群では投与直後に一過性の流涎が9例,被毛の汚れが9例および赤色尿が1例にみられた.250 mg/kg群では,投与直後に一過性の流涎が3例および被毛の汚れが9例にみられた.62.5 mg/kg群では,一般状態の異常はみられなかった.
哺育期間中には,1000 mg/kg群では投与直後に一過性の流涎が9例,被毛の汚れが3例および赤色尿が1例にみられた.250 mg/kg群では,投与直後に一過性の流涎が1例および被毛の汚れが5例にみられた.62.5 mg/kg群では,一般状態の異常はみられなかった.
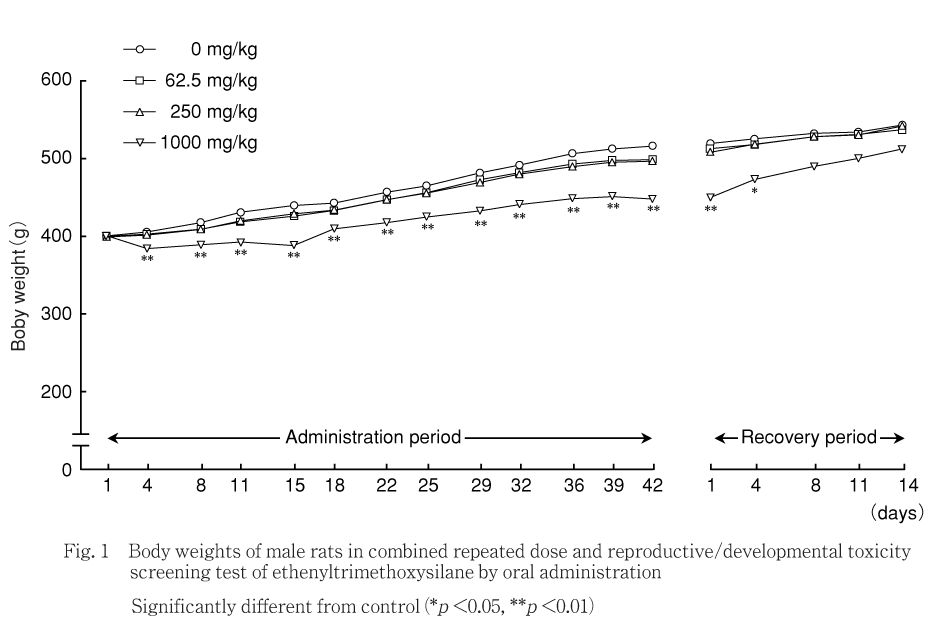
投与期間中には,1000 mg/kg群では対照群と比べて投与4〜42日に体重の有意な低値がみられた.250および62.5 mg/kg群では,対照群と比べて各測定日の体重に有意差はみられなかった.
回復期間中には,1000 mg/kg群では対照群と比べて回復1および4日に体重の有意な低値がみられた.250および62.5 mg/kg群では対照群と比べて各測定日の体重に有意差はみられなかった.

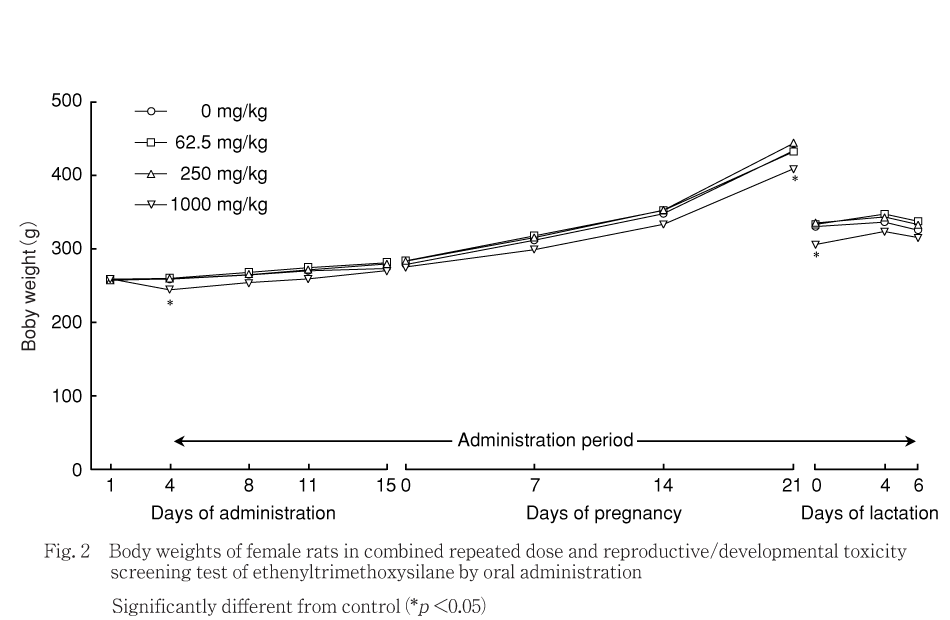
交配開始前および交配期間中には,1000 mg/kg群では対照群と比べて投与4日に体重の有意な低値がみられた.250および62.5 mg/kg群では,対照群と比べて各測定日の体重に有意差はみられなかった.
妊娠期間中には,1000 mg/kg群では対照群と比べて妊娠21日に体重の有意な低値がみられた.250および62.5 mg/kg群では,対照群と比べて各測定日の体重に有意差はみられなかった.
哺育期間中には,1000 mg/kg群では対照群と比べて哺育0日に体重の有意な低値がみられた.250および62.5 mg/kg群では,対照群と比べて各測定日の体重に有意差はみられなかった.
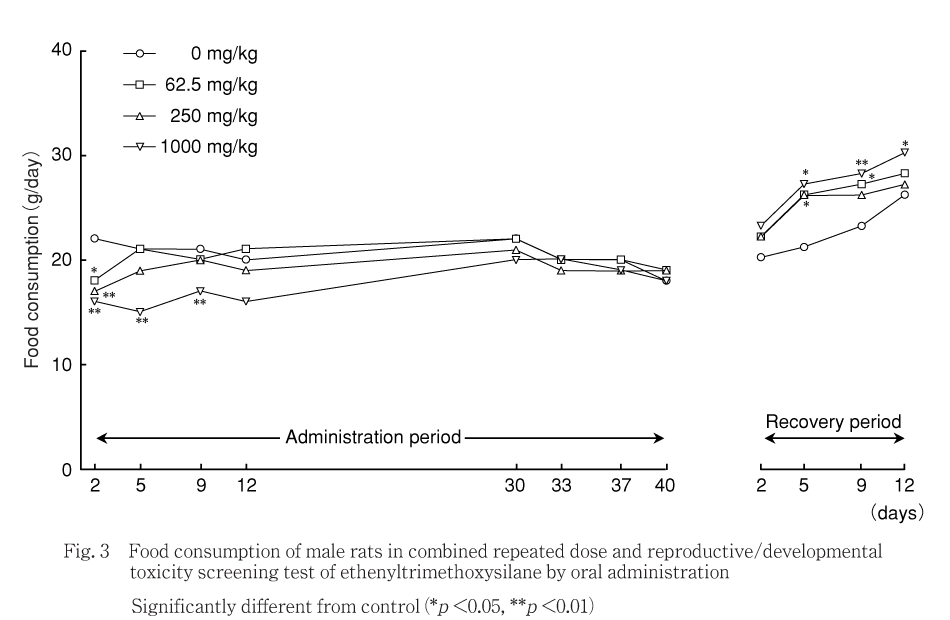
投与期間中には,1000 mg/kg群では対照群と比べて投与2,5および9日に摂餌量の有意な低値がみられた.250および62.5 mg/kg群では,対照群と比べて投与2日に摂餌量の有意な低値がみられた.
回復期間中には,1000 mg/kg群では対照群と比べて回復5,9および12日,250 mg/kg群では回復5日,62.5 mg/kg群では回復9日に摂餌量の有意な高値がみられたが,毒性学的意義はないと考えられる.
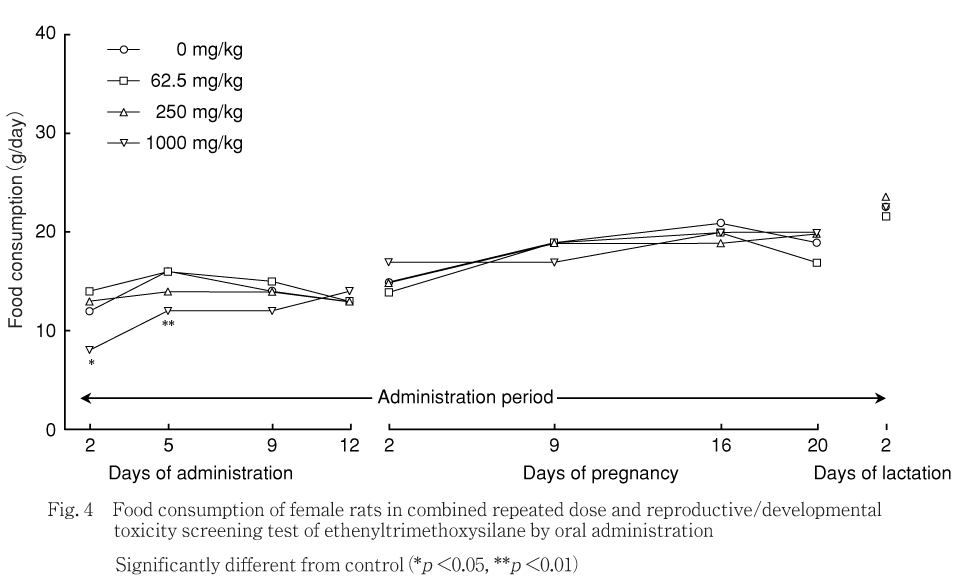
交配開始前には,1000 mg/kg群では対照群と比べて投与2および5日に摂餌量の有意な低値がみられた.250および62.5 mg/kg群では対照群と比べて各測定日の摂餌量に有意差はみられなかった.
妊娠期間中には,各投与群とも対照群と比べて各測定日の摂餌量に有意差はみられなかった.
哺育期間中には,各投与群とも対照群と比べて測定日の摂餌量に有意差はみられなかった.
各投与群とも,各測定日のいずれの項目にも投与による影響はみられなかった.
各投与群とも,各測定日のいずれの項目にも投与による影響はみられなかった.
各投与群とも,いずれの項目にも異常はみられなかった.
各投与群とも,いずれの項目にも異常はみられなかった.
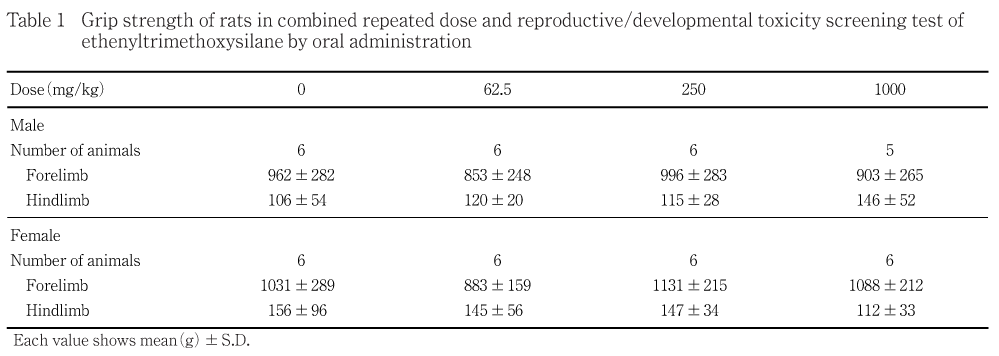
各投与群とも,対照群と比べて前肢および後肢の握力に有意差はみられなかった.
各投与群とも,対照群と比べて各測定項目に有意差はみられなかった.
各投与群とも,対照群と比べて各測定項目に有意差はみられなかった.
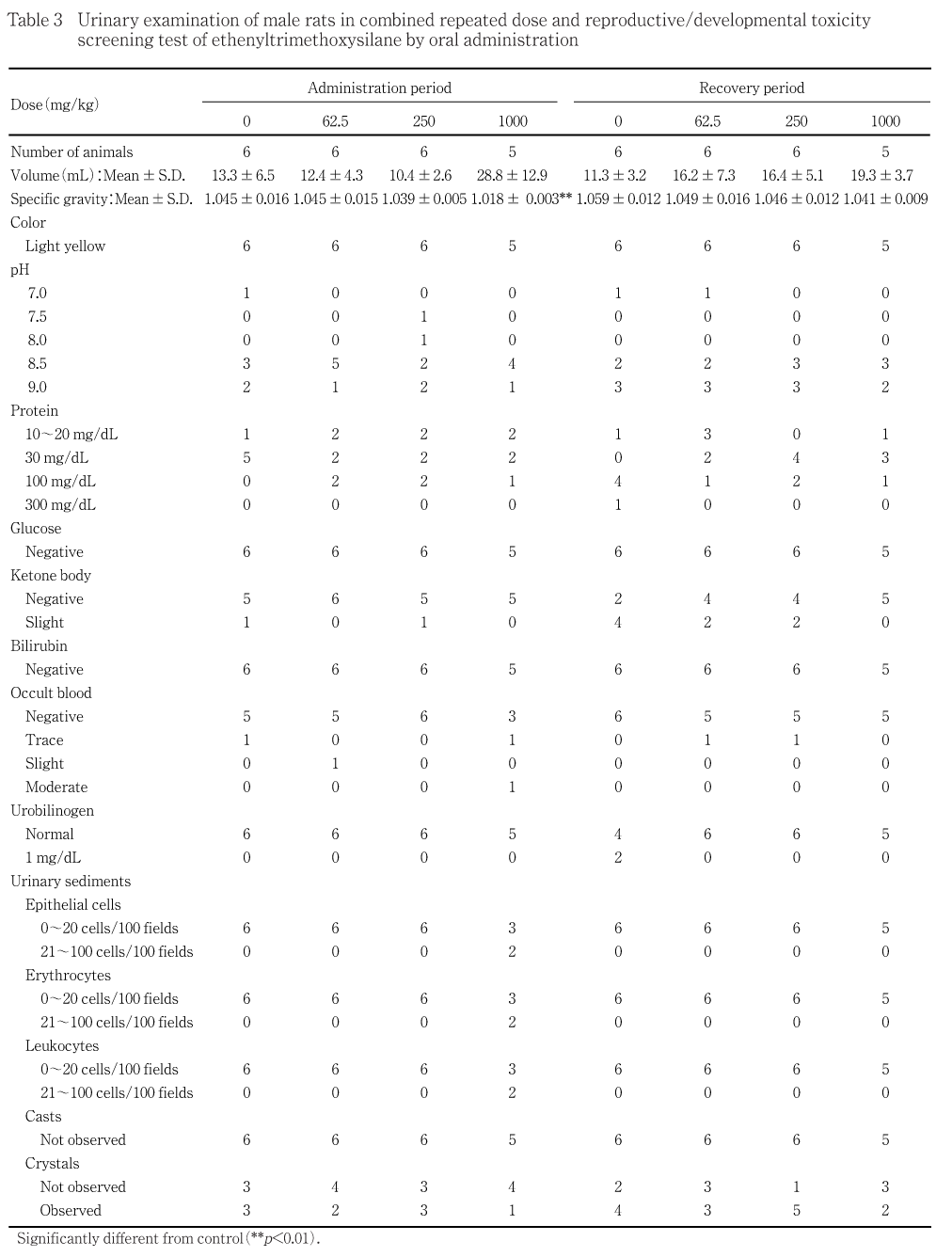
1000 mg/kg群では,対照群と比べて尿比重の有意な低値がみられた.250および62.5 mg/kg群では,対照群と比べて尿量および尿比重に有意差はみられなかった.
1000 mg/kg群では,潜血陽性ならびに沈渣で上皮細胞,赤血球および白血球がみられた.250および62.5 mg/kg群では,色調,pH,蛋白質,ブドウ糖,ケトン体,ビリルビン,潜血,ウロビリノーゲンおよび沈渣は対照群とほぼ同程度であった.
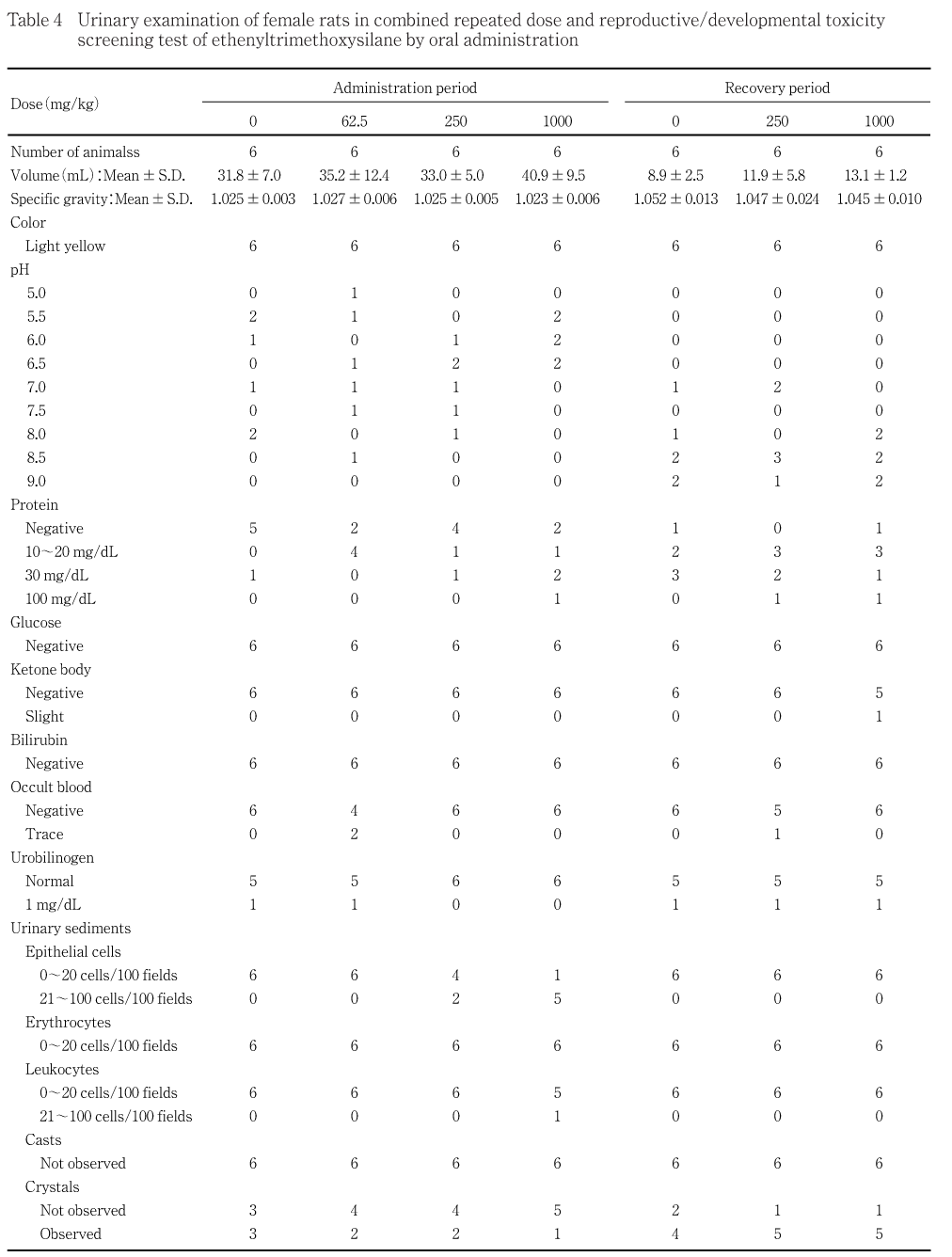
各投与群とも,対照群と比べて尿量および尿比重に有意差はみられなかった.
1000 mg/kg群では,沈渣で上皮細胞および白血球がみられた.250 mg/kg群では,沈渣で上皮細胞がみられた.62.5 mg/kg群では,色調,pH,蛋白質,ブドウ糖,ケトン体,ビリルビン,潜血,ウロビリノーゲンおよび沈渣は対照群とほぼ同程度であった.
各投与群とも,対照群と比べて尿量および尿比重に有意差はみられなかった.
各投与群とも,色調,pH,蛋白質,ブドウ糖,ケトン体,ビリルビン,潜血,ウロビリノーゲンおよび沈渣は対照群とほぼ同程度であった.
各投与群とも,対照群と比べて尿量および尿比重に有意差はみられなかった.
各投与群とも,色調,pH,蛋白質,ブドウ糖,ケトン体,ビリルビン,潜血,ウロビリノーゲンおよび沈渣は対照群とほぼ同程度であった.
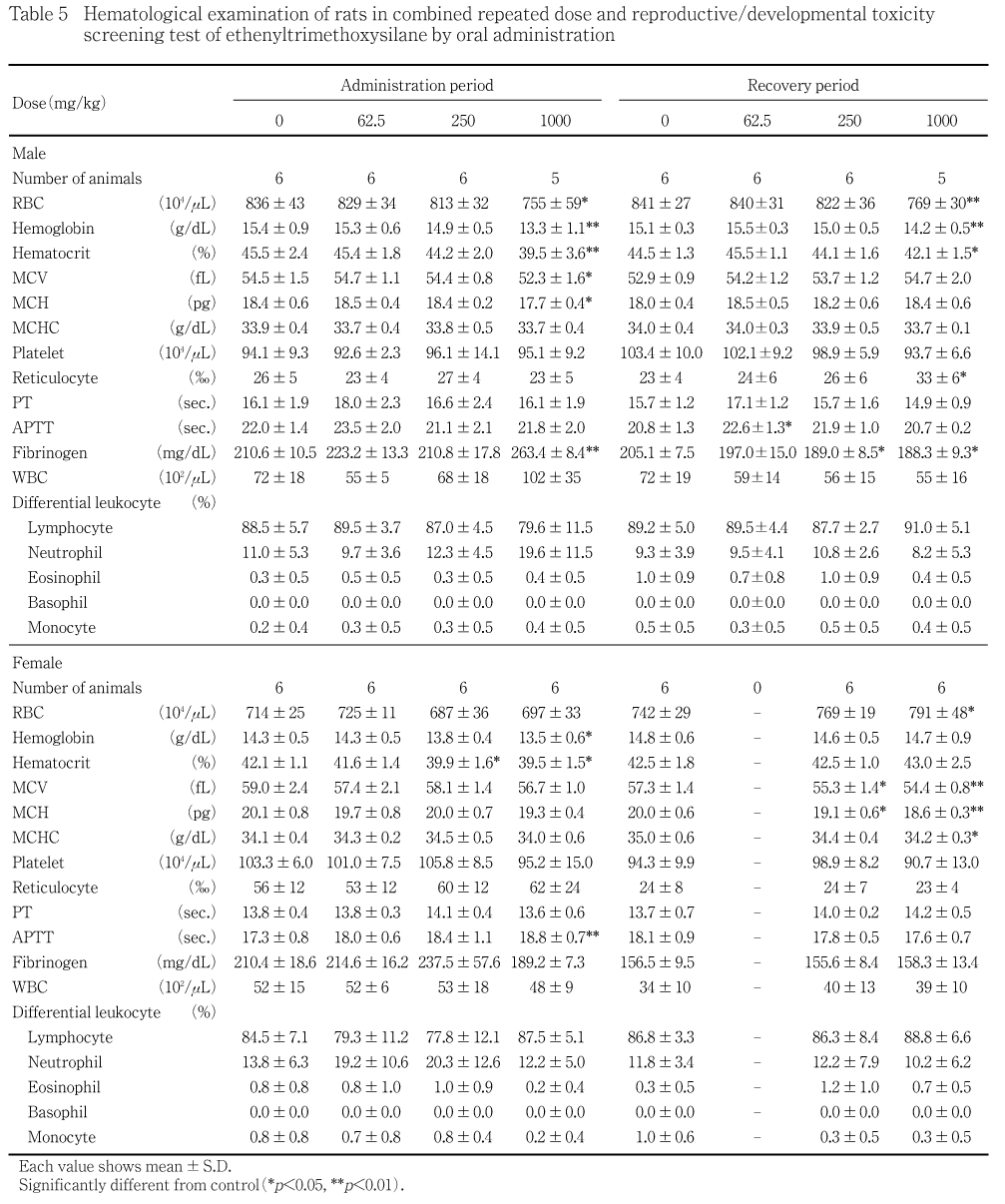
1000 mg/kg群では,対照群と比べて赤血球数,ヘモグロビン量およびヘマトクリット値,MCVおよびMCHの有意な低値ならびにフィブリノーゲン濃度の有意な高値がみられた.250および62.5 mg/kg群では,対照群と比べて各測定項目に有意差はみられなかった.
1000 mg/kg群では,対照群と比べてヘモグロビン量およびヘマトクリット値の有意な低値ならびに活性化部分トロンボプラスチン時間の有意な高値がみられた.250 mg/kg群では,対照群と比べてヘマトクリット値の有意な低値がみられた.62.5 mg/kg群では,対照群と比べて各測定項目に有意差はみられなかった.
1000 mg/kg群では,対照群と比べて赤血球数,ヘモグロビン量およびヘマトクリット値の有意な低値ならびに網状赤血球比率の有意な高値がみられた.その他,1000及び250 mg/kg群では対照群と比べてフィブリノーゲン濃度の有意な低値がみられたが,投与期間終了時にそれらの傾向は認められなかったことから,投与に基づくものではないと判断される.また,62.5 mg/kg群では,対照群と比べて活性化部分トロンボプラスチン時間の有意な高値がみられたが,投与量に依存した変化ではなかった.
1000 mg/kg群では,対照群と比べてMCV,MCHおよびMCHCの有意な低値ならびに赤血球数の有意な高値がみられた.250 mg/kg群では,対照群と比べてMCVおよびMCHの有意な低値がみられた.
1000 mg/kg群では,対照群と比べて総蛋白,アルブミン量,A/GおよびKの有意な低値,g-GTP,尿素窒素およびクレアチニンの有意な高値がみられた.その他,1000および250 mg/kg群では,対照群と比べてASTの有意な低値がみられたが,毒性学的意義はないと考えられる.また,62.5 mg/kg群では,対照群と比べてClの有意な高値がみられたが,投与量に依存した変化ではなかった.
1000 mg/kg群では,対照群と比べて総蛋白およびトリグリセライドの有意な低値がみられた.1000および250 mg/kg群では,対照群と比べて有意差はないもののg-GTPの高値傾向がみられた.その他,1000 mg/kg群では,対照群と比べて総ビリルビンの有意な低値がみられたが,毒性学的意義はないと考えられる.62.5 mg/kg群では,対照群と比べて各測定項目に有意差はみられなかった.
1000 mg/kg群では,対照群と比べて総蛋白の有意な低値およびA/Gの有意な高値がみられた.その他,1000 mg/kg群では,対照群と比べてClの有意な高値がみられたが,背景データの値に近いことから,投与に基づく変化ではないと判断される.また,同群では,対照群と比べて無機リンの有意な高値がみられたが,投与期間終了時にその傾向は認められなかったことから,投与に基づくものではないと判断される.250および62.5 mg/kg群では,対照群と比べて各測定項目に有意差はみられなかった.
1000 mg/kg群では,対照群と比べて総蛋白の有意な低値がみられた.その他,1000 mg/kg群では,対照群と比べてALPおよびClの有意な高値がみられたが,それらは背景データの値に近いことから,投与に基づく変化ではないと判断される.250 mg/kg群では,対照群と比べて各測定項目に有意差はみられなかった.
1000 mg/kg群の2死亡例で胸腺および脾臓の萎縮が全例,腎臓の腫大および腺胃粘膜の暗赤色化が各1例にみられた.
1000 mg/kg群の1死亡例で胸腺および脾臓の萎縮がみられた.
1000 mg/kg群では,腎臓の腫大が4例にみられた.250および62.5 mg/kg群並びに対照群では,異常はみられなかった.
哺育7日の剖検では,1000 mg/kg群では腎臓の腫大が1例にみられたが,偶発的変化と判断される.250および62.5 mg/kg群並びに対照群では,異常はみられなかった.
交尾不成立雌では,異常はみられなかった.
1000,250および62.5 mg/kg群では,異常はみられなかった.対照群では,脾臓の萎縮が1例にみられた.
いずれの群とも,異常はみられなかった.
剖検日の体重は,1000 mg/kg群では対照群と比べて有意な低値がみられた.250および62.5 mg/kg群では,対照群と比べて体重に有意差はみられなかった.
器官重量において,1000 mg/kg群では対照群と比べて胸腺の絶対重量の有意な低値,腎臓の絶対重量の有意な高値ならびに脾臓,腎臓および副腎の相対重量の有意な高値がみられた.その他,1000 mg/kg群では,下垂体の絶対重量の有意な低値がみられたが,その相対重量に有意差が認められないことから,投与による影響とは考えられない.また,同群では,脳の相対重量の有意な高値がみられたが,絶対重量に有意差が認められないことから,対照群との体重差に基づく変化と考えられる.250および62.5 mg/kg群では対照群と比べて各器官の絶対重量および相対重量に有意差はみられなかった.
剖検日の体重は,各投与群とも対照群と比べて有意差はみられなかった.
器官重量において,1000 mg/kg群では対照群と比べて胸腺の絶対重量および相対重量の有意な低値,肝臓の相対重量の有意な高値がみられた.250および62.5 mg/kg群では胸腺の相対重量の有意な低値がみられた.
剖検日の体重は,各投与群とも対照群と比べて有意差はみられなかった.
器官重量において,1000 mg/kg群では対照群と比べて腎臓の相対重量の有意な高値がみられた.その他,1000 mg/kg群では,下垂体の絶対重量の有意な低値がみられたが,その相対重量に有意差が認められないことから,投与による影響とは考えられない.250 mg/kg群では,対照群と比べて腎臓の絶対重量の有意な高値がみられたが,投与量に関連した変化ではないことから,投与による影響とは考えられない.62.5 mg/kg群では,対照群と比べて下垂体の絶対重量の有意な低値および心臓の相対重量の有意な高値がみられたが,投与量に関連した変化ではないことから,投与による影響とは考えられない.
剖検日の体重は,各投与群とも対照群と比べて有意差はみられなかった.
器官重量において,1000および250 mg/kg群では対照群と比べて子宮の絶対重量および相対重量の有意な高値がみられたが,1000および250 mg/kg群とも投与期間終了時にその傾向は認められなかったこと,背景データの値に近いことから,投与に基づくものではないと判断される.
[空腸] 粘膜固有層の空胞化が1例にみられ,その程度はごく軽度であった.
[腎臓] 移行上皮の過形成が1例にみられ,その程度はごく軽度であった.
[膀胱] 移行上皮の過形成が2例にみられ,その程度はごく軽度あるいは軽度であった.
[尿道] 移行上皮の過形成が2例にみられ,その程度はごく軽度であった.
[精巣] 精細管の萎縮が1例にみられ,その程度はごく軽度であった.
[精巣上体] 管腔内の細胞残渣が1例にみられ,その程度はごく軽度であった.
なお,各組織に死後変化が軽度あるいは中等度に認められ,その他の所見は確認できなかった.
[心臓] 細胞浸潤がみられ,その程度はごく軽度であった.
[腎臓] 移行上皮の過形成がみられ,その程度はごく軽度であった.
[膀胱] 移行上皮の過形成がみられ,その程度はごく軽度であった.
なお,各組織に死後変化が中等度に認められ,その他の所見は確認できなかった.
[十二指腸] 粘膜固有層の空胞化が1000 mg/kg群で3例および250 mg/kg群で1例にみられ,その程度はごく軽度であった.粘膜固有層の空胞化は,1000 mg/kg群で対照群と比べて有意差が認められ,かつ,用量反応性も確認された.
[空腸] 粘膜固有層の空胞化が1000 mg/kg群で5例および250 mg/kg群で1例にみられ,その程度は1000 mg/kg群で軽度,250 mg/kg群でごく軽度であった.粘膜固有層の空胞化は,1000 mg/kg群で対照群と比べて有意差が認められた.オイルレッドO染色による検査では,1000 mg/kg群で乳糜管内にオイルレッドOの弱陽性と粘膜固有層内にオイルレッドOの陽性が3例中各3例にみられた.
[回腸] 粘膜固有層の空胞化が1000 mg/kg群で2例にみられ,その程度はごく軽度であった.
[腸間膜リンパ節] リンパ洞の空胞化が1000 mg/kg群で2例にみられ,その程度はごく軽度であった.
[腎臓] 移行上皮の過形成および腎盂腎炎が1000 mg/kg群で各5例にみられ,それらの程度は移行上皮の過形成が軽度,腎盂腎炎が軽度あるいは中等度であった.移行上皮の過形成および腎盂腎炎は,1000 mg/kg群で対照群と比べて有意差が認められた.尿細管の再生が62.5 mg/kg群で1例にみられ,その程度はごく軽度であった.
[膀胱] 移行上皮の過形成が1000 mg/kg群で5例,250 mg/kg群で6例および62.5 mg/kg群で2例にみられ,その程度は1000 mg/kg群で軽度,250 mg/kg群でごく軽度あるいは軽度,62.5 mg/kg群でごく軽度であった.移行上皮の過形成は,1000および250 mg/kg群で対照群と比べて有意差が認められ,かつ,用量反応性も確認された.
[尿道] 移行上皮の過形成が1000 mg/kg群で4例にみられ,その程度はごく軽度あるいは軽度であった.移行上皮の過形成は,1000 mg/kg群で対照群と比べて有意差が認められ,かつ,用量反応性も確認された.
[精巣] 精細管の萎縮,精細管の変性,セルトリ細胞の空胞化および精子細胞の遺残が1000 mg/kg群で各1例にみられ,それらの程度は精細管の萎縮が軽度,精細管の変性,セルトリ細胞の空胞化および精子細胞の遺残がごく軽度であった.
[精巣上体] 精子の減少および管腔内の細胞残渣が1000 mg/kg群で各2例にみられ,それらの程度は精子の減少がごく軽度,管腔内の細胞残渣がごく軽度あるいは軽度であった.その他には,投与に関連した変化はみられなかった.
[十二指腸] 粘膜固有層の空胞化が1000 mg/kg群で2例および250 mg/kg群で1例にみられ,その程度はごく軽度であった.
[空腸] 粘膜固有層の空胞化が1000 mg/kg群で6例にみられ,その程度は軽度であった.粘膜固有層の空胞化は,1000 mg/kg群で対照群と比べて有意差が認められた.
[胸腺] 皮質および髄質の萎縮が1000 mg/kg群で2例にみられ,その程度はごく軽度であった.
[腸間膜リンパ節] リンパ洞の空胞化が1000 mg/kg群で3例にみられ,その程度はごく軽度あるいは軽度であった.リンパ洞の空胞化は,1000 mg/kg群で対照群と比べて有意差が認められた.
[腎臓] 移行上皮の過形成および尿細管の再生が1000 mg/kg群で各3例,腎盂炎が1000 mg/kg群で2例にみられ,それらの程度は移行上皮の過形成がごく軽度あるいは軽度,尿細管の再生および腎盂炎がごく軽度であった.移行上皮の過形成および尿細管の再生は,1000 mg/kg群で対照群と比べて有意差が認められ,かつ,用量反応性も確認された.
[膀胱] 移行上皮の過形成が1000 mg/kg群で6例および250 mg/kg群で6例にみられ,その程度は1000 mg/kg群で軽度,250 mg/kg群でごく軽度あるいは軽度であった.移行上皮の過形成は,1000および250 mg/kg群で対照群と比べて有意差が認められ,かつ,用量反応性も確認された.
[尿道] 移行上皮の過形成,角化重層扁平上皮化生および細胞浸潤が1000 mg/kg群で各2例,上皮の壊死が1000 mg/kg群で1例にみられ,それらの程度は移行上皮の過形成がごく軽度,角化重層扁平上皮化生が軽度,細胞浸潤がごく軽度あるいは軽度,上皮の壊死が中等度であった.
その他には,投与に関連した変化はみられなかった.
[十二指腸] 粘膜固有層の空胞化が1000 mg/kg群で2例および250 mg/kg群で1例にみられ,その程度は1000 mg/kg群でごく軽度あるいは軽度,250 mg/kg群でごく軽度であった.
[空腸] 粘膜固有層の空胞化が1000 mg/kg群で5例にみられ,その程度は軽度であった.粘膜固有層の空胞化は,1000 mg/kg群で対照群と比べて有意差が認められた.オイルレッドO染色による検査では,1000 mg/kg群で乳糜管内にオイルレッドOの陽性と粘膜固有層内にオイルレッドOの弱陽性あるいは陽性が3例中各3例にみられた.
[回腸] 粘膜固有層の空胞化が1000 mg/kg群で1例にみられ,その程度は軽度であった.
[腸間膜リンパ節] リンパ洞の空胞化が1000 mg/kg群で4例にみられ,その程度はごく軽度であった.リンパ洞の空胞化は,1000 mg/kg群で対照群と比べて有意差が認められ,かつ,用量反応性も確認された.
[腎臓] 移行上皮の過形成および尿細管の再生が1000 mg/kg群で各5例にみられ,それらの程度はごく軽度あるいは軽度であった.移行上皮の過形成および尿細管の再生は,1000 mg/kg群で対照群と比べて有意差が認められ,かつ,用量反応性も確認された.
[膀胱] 移行上皮の過形成が1000 mg/kg群で5例および250 mg/kg群で5例にみられ,その程度はごく軽度であった.移行上皮の過形成は,1000および250 mg/kg群で対照群と比べて有意差が認められ,かつ,用量反応性も確認された.
[精巣] 精子細胞の遺残および精細管の変性が1000 mg/kg群で各1例にみられ,それらの程度はごく軽度であった.対照群では,精細管の萎縮,精細管の変性およびセルトリ細胞の空胞化が各1例にみられ,それらの程度はごく軽度であった.
[精巣上体] 管腔内の細胞残渣が対照群で2例にみられ,その程度はごく軽度であった.
その他には,投与に関連した変化はみられなかった.
[十二指腸] 粘膜固有層の空胞化が1000 mg/kg群で5例にみられ,その程度はごく軽度であった.粘膜固有層の空胞化は,1000 mg/kg群で対照群と比べて有意差が認められ,かつ,用量反応性も確認された.
[空腸] 粘膜固有層の空胞化が1000 mg/kg群で6例にみられ,その程度は軽度であった.粘膜固有層の空胞化は,1000 mg/kg群で対照群と比べて有意差が認められた.
[腸間膜リンパ節] リンパ洞の空胞化が1000 mg/kg群で3例にみられ,その程度はごく軽度であった.リンパ洞の空胞化は,1000 mg/kg群で対照群と比べて有意差が認められ,かつ,用量反応性も確認された.
[腎臓] 移行上皮の過形成が1000 mg/kg群で3例にみられ,その程度はごく軽度であった.尿細管の再生が1000 mg/kg群で4例にみられ,その程度はごく軽度であった.移行上皮の過形成および尿細管の再生は,1000 mg/kg群で対照群と比べて有意差が認められ,かつ,用量反応性も確認された.
[膀胱] 移行上皮の過形成が1000 mg/kg群で6例および250 mg/kg群で6例にみられ,その程度は1000および250 mg/kg群ともごく軽度あるいは軽度であった.移行上皮の過形成は,1000および250 mg/kg群で対照群と比べて有意差が認められ,かつ,用量反応性も確認された.
[尿道] 移行上皮の過形成が1000 mg/kg群で1例にみられ,その程度はごく軽度であった.
その他には,投与に関連した変化はみられなかった.
交配開始前の投与期間の発情回数は,1000 mg/kg群では対照群と比べて有意な低値がみられた.250および62.5 mg/kg群では,対照群と比べて有意差はみられなかった.
交尾不成立は,1000,250および62.5 mg/kg群で各1組にみられた.交尾率は,各投与群とも対照群との間に有意差はみられなかった.交尾所要日数は,各投与群とも対照群との間に有意差はみられなかった.
不受胎雌は,いずれの群にも認められなかった.受胎率は,いずれの群とも100.0 %であった.
妊娠期間は,各投与群とも対照群と比べて有意差はみられなかった.各投与群とも,対照群と比べて妊娠黄体数,着床数および着床率に有意差はみられなかった.
出産率は,いずれの群とも100.0 %であった.
分娩状態および哺育状態において,いずれの群とも異常はみられなかった.
各投与群とも,対照群と比べて総出産児数,死産児数,新生児数,性比,分娩率,児の産出率および出生率に有意差はみられなかった.
各投与群とも,対照群と比べて4日の新生児数,新生児の4日の生存率に有意差はみられなかった.
新生児の外表異常としては,250 mg/kg群で無尾が2例にみられたが,対照群との間に有意差は認められず,自然発生例と考えられる.
児動物の一般状態において,いずれの群とも異常はみられなかった.
各投与群とも,対照群と比べて哺育0および4日の雌雄体重に有意差はみられなかった.
1000および62.5 mg/kg群並びに対照群では,異常はみられなかった.250 mg/kg群では,肺の萎縮が1例にみられたが,投与量に関連したものではないことから,投与による影響とは考えられない.
1000 mg/kg群では,腎盂拡張がみられたが,1例のみであり,偶発例と考えられる.250および62.5 mg/kg群並びに対照群では,異常はみられなかった.
エテニルトリメトキシシランのラットを用いる経口投与による反復投与毒性・生殖発生毒性併合試験を行い,雌雄動物に対する毒性影響を検討するとともに,性腺機能,交尾行動,受胎および分娩などの生殖行動に及ぼす影響について検討した.投与量は,1000 mg/kgを高用量とし,以下250および62.5 mg/kgとした.
反復投与による毒性については,死亡例が1000 mg/kg群で雄2例と雌1例に認められた.死亡例では,流涎,被毛の汚れ,自発運動の低下,赤色尿,体温下降,口の周囲の汚れ,肛門周囲の汚れ,下痢,緩徐呼吸および立毛がみられた.死亡例の病理組織学検査では,空腸に粘膜固有層の空胞化,腎臓,膀胱あるいは尿道に移行上皮の過形成がみられたが,いずれもごく軽度あるいは軽度な変化であり,重篤な変化ではなかった.その他の器官・組織は死後変化のため,精査できなかった.エテニルトリメトキシシランのラットを用いる単回経口投与毒性試験 1)では2000 mg/kg投与により,死亡例の発現と当試験と同様の一般状態の変化がみられていることから,エテニルトリメトキシシランによる全身状態の悪化により死に至ったと考えられる.
一般状態の変化としては,1000および250 mg/kg群の雌雄の生存例で被毛の汚れおよび赤色尿がみられた.なお,1000および250
mg/kg群の雌雄で流涎がみられたが,いずれも投与直後に一過性に認められたのみであり,痙攣などの神経症状あるいは唾液腺の形態学的変化は認められないことから,被験物質の刺激性に基づく変化と判断され,毒性症状とはみなさなかった.
体重は,1000 mg/kg群の雄で投与期間に低値,雌で交配開始前に一過性の低値,妊娠21日および哺育0日に低値がみられたが,回復期間には雌雄とも回復した.
摂餌量は,1000 mg/kg群の雄で低値および雌で交配開始前に低値がみられた.250および62.5 mg/kg群の雄で投与期間初期に低値がみられたが,一過性の変化であり,体重推移に異常が認められないことから,毒性学的意義はないと考えられる.
行動機能(FOB),感覚反応,握力および自発運動量では,投与に起因する変化はみられなかった.
尿検査において,雌雄とも1000 mg/kg群で潜血陽性,上皮細胞,赤血球あるいは白血球がみられた.投与期間中に雌雄とも1000および250 mg/kg群で被毛の汚れおよび赤色尿がみられたが,これらの変化は尿中に赤血球が混入したことによる変化と考えられる.また,血液生化学検査において,投与期間終了時に1000 mg/kg群の雄で総蛋白,アルブミン量,A/GおよびKの低値,尿素窒素およびクレアチニンの高値,雌で総蛋白の低値がみられた.総蛋白,アルブミン量,A/GおよびKの低値,尿素窒素およびクレアチニンの高値は,腎機能低下に伴うものと考えられる.投与期間終了時に1000 mg/kg群の雄で腎臓の腫大がみられ,腎臓の絶対重量および相対重量の高値がみられた.
泌尿器系の病理組織学検査において,投与期間終了時に雄では1000 mg/kg群で腎臓に移行上皮の過形成および腎盂腎炎,膀胱に移行上皮の過形成,尿道に移行上皮の過形成,250 mg/kg群で膀胱に移行上皮の過形成,62.5 mg/kg群で腎臓に尿細管の再生,膀胱に移行上皮の過形成,雌では1000 mg/kg群で腎臓に移行上皮の過形成,尿細管の再生および腎盂炎,膀胱に移行上皮の過形成,尿道に移行上皮の過形成,角化重層扁平上皮化生,細胞浸潤および上皮の壊死,250 mg/kg群で膀胱に移行上皮の過形成がみられた.移行上皮の過形成は,移行上皮の損傷部における再生像であると報告2)されている.また,terephthalic acid,dimethyl terephthalateあるいはdithiolanの投与によるラットで移行上皮の過形成が生じることが報告されている3).従って,エテニルトリメトキシシランあるいはその代謝産物により尿路上皮が障害され,上皮に過形成が生じたと考えられる.さらに,1000 mg/kg群では,尿路上皮の障害に伴う上行性感染により,腎盂腎炎あるいは腎盂炎を来し,腎機能が低下したと考えられる.投与期間終了時に1000 mg/kg群の雄で腎臓の絶対重量および相対重量の高値がみられており,腎盂腎炎との関連が示唆される.回復期間終了時には,1000 mg/kg群の雌雄で総蛋白の低値,1000 mg/kg群の雄で腎臓の相対重量の高値,1000および250 mg/kg群の雌雄で膀胱に移行上皮の過形成,1000 mg/kg群の雌雄で腎臓に移行上皮の過形成および尿細管の再生,1000 mg/kg群の雌ではさらに尿道に移行上皮の過形成がみられているものの,回復傾向にあると考えられる.
血液学検査において,投与期間終了時に雄では1000 mg/kg群で赤血球数,ヘモグロビン量およびヘマトクリット値,MCVおよびMCHの低値ならびにフィブリノーゲン濃度の高値,雌では1000 mg/kg群でヘモグロビン量およびヘマトクリット値の低値ならびに活性化部分トロンボプラスチン時間の高値,250 mg/kg群でヘマトクリット値の低値がみられた.回復期間終了時には,1000 mg/kg群の雌雄および250 mg/kg群の雌で貧血傾向が継続してみられた.1000 mg/kg群の雌雄および250 mg/kg群の雌で認められた貧血傾向は,尿中に赤血球が漏出したことによると考えられる.投与期間終了時に1000 mg/kg群の雄で脾臓の相対重量の高値がみられており,脾臓および骨髄に病理組織学変化はみられないものの,エテニルトリメトキシシランは造血機能に影響を及ぼす可能性がある.
血液生化学検査において,投与期間終了時に1000 mg/kg群の雌雄および250 mg/kg群の雌でg-GTPの高値あるいは高値傾向がみられた.g-GTPの高値あるいは高値傾向は,エテニルトリメトキシシランの肝臓への影響を示唆させるが,1000 mg/kg群の雌で肝臓の相対重量の高値がみられるものの,肝臓の病理組織学検査で変化は認められず,ごく軽微な変化と考えられる.
病理組織学検査では,投与期間終了時に雌雄とも1000および250 mg/kg群で空腸を主とする小腸に粘膜固有層の空胞化が認められた.1000 mg/kg群では,さらに腸間膜リンパ節にリンパ洞の空胞化がみられた.小腸の空胞化は,その発現部位が粘膜固有層であること,腸間膜リンパ節に同様の変化が認められたこと,さらにオイルレッドO染色の結果から,吸収されたエテニルトリメトキシシランがカイロミクロンとして吸収され,乳糜管内あるいは粘膜固有層内に貯留し,乳糜管が拡張し,さらに乳糜管とも連絡する腸管膜リンパ節のリンパ洞内にも貯留したと考えられる.血液生化学検査において,投与期間終了時に1000 mg/kg群の雄で総蛋白,アルブミン量およびA/Gの低値,1000 mg/kg群の雌で総蛋白およびトリグリセライドの低値がみられたが,これらの変化は前述した腎機能低下の他に小腸の粘膜固有層の空胞化に伴う消化・吸収機能の低下との関連が考えられる.なお,抗高血圧剤投与によりラットの小腸に乳糜管の拡張が生じる4)こと,パラフィン化合物投与によりラットの腸間膜リンパ節にリンパ洞の拡張が生じる5)ことが報告されている.回復期間終了時にも,1000 mg/kg群の雌雄および250 mg/kg雄で小腸に粘膜固有層の空胞化および腸間膜リンパ節にリンパ洞の空胞化がみられている.また,オイルレッドO染色では,投与期間終了時には粘膜固有層内の脂肪の染色性が強く,乳糜管内の脂肪の染色性が弱かった.一方,回復期間終了時には乳糜管内の脂肪の染色性が強くなったことから,粘膜固有層内の吸収過程のカイロミクロンが乳糜管内に順次移行したと考えられる.
投与期間終了時に雄では1000 mg/kg群で胸腺の絶対重量の低値および副腎の相対重量の高値,雌では1000 mg/kg群で胸腺の絶対重量および相対重量の低値,250および62.5 mg/kg群で胸腺の相対重量の低値がみられた.1000 mg/kg群の雌では,投与期間終了時に胸腺の皮質および髄質の萎縮がみられ,胸腺および副腎の重量変化は全身状態の悪化に基づく変化と考えられる.なお,全身状態の悪化は,泌尿器および小腸の障害により生じた変化と考えられる.
1000 mg/kg群の雄では,精巣および精巣上体の病理組織学検査で死亡例の1例,投与期間終了時の2例,回復期間終了時の1例の計4例に変化がみられた.しかし,対照群でも回復期間終了時に精巣および精巣上体に1000 mg/kg群と同様の変化が2例にみられている.また,Crj:CD(SD)IGSラットの当所の背景データにおいても,同様の変化は精巣で約10 %,精巣上体で約2 %が発現している6).従って,1000 mg/kg群の雄における精巣および精巣上体の変化は,偶発的変化と考えられる.
親動物の生殖発生毒性については,交配開始前の投与期間の発情回数は1000 mg/kg群で低値がみられたが,交尾率,交尾所要日数,受胎雌数,受胎率,妊娠期間,出産率,分娩状態,哺育状態,妊娠黄体数,着床数および着床率に投与に起因する変化はみられなかった.
児動物(F1)については,総出産児数,死産児数,哺育0日の新生児数,哺育0日の性比,分娩率,児の産出率,出生率,一般状態,哺育4日の生存児数,哺育4日の性比,哺育4日の生存率,外表,体重および剖検において,投与に起因する変化はみられなかった.
以上のように,エテニルトリメトキシシランの無毒性量は,雄では62.5 mg/kg投与で膀胱に移行上皮の過形成が認められたことから62.5 mg/kg/day未満,雌では62.5 mg/kg投与で胸腺に病理組織学変化がみられないものの相対重量の低値が認められたことから,62.5 mg/kg/day未満と考えられる.また,生殖発生毒性学的な無毒性量は,雄では1000 mg/kg投与でいずれの項目にも影響が認められなかったことから1000 mg/kg/ day,雌では1000 mg/kg投与で性周期に影響が認められたことから250 mg/kg/dayと考えられる.児動物への無毒性量は,1000 mg/kg投与で生存性および体重などに影響が認められなかったことから1000 mg/kg/dayと考えられる.
| 1) | 古橋忠和ら:エテニルトリメトキシシランのラットを用いる単回経口投与毒性試験.化学物質毒性試験報告,13:153-155(2006). |
| 2) | 日本毒性病理学会(編):膀胱/尿管/尿道.In「毒性病理組織学」東京(2000)pp.267-282. |
| 3) | 前川昭彦,林裕造(責任編集):泌尿器系.In「毒性病理学講座?テ農?病理学」地人書館,東京(1991)pp. 267-321. |
| 4) | Gopinath C, Prentice DE, Lewis DJ:The alimentary system and pancreas. In “Atlas of experimental toxicological pathology”, MTP Press(1987)pp.61-76. |
| 5) | Boorman GA, Eustis SL, Elwell MR, Montgomery Jr CA, MacKenzie WF:Spleen, lymph nodes, and thymus. In “Pathology of the fischer rat”, Academic Press(1990)pp.369-393. |
| 6) | Nagase T, Yoshijima K, Tomioka M, Ohe T, Ozawa M, Ito T, Kimura H, Okada M: Toxicological data on Crj:CD(SD)IGS and Crj:CD(SD)strain rats- Comparison of clinical pathology and histopathology, CD(SD)IGS(2000)pp.99-104. |
| 連絡先 | |||
| 試験責任者: | 古橋忠和 | ||
| 試験担当者: | 長瀬孝彦,内藤一嘉,藤村高志, 木村 均,伊藤 格,三輪洋司 | ||
| (株)日本バイオリサーチセンター 羽島研究所 | |||
| 〒501-6251 岐阜県羽島市福寿町間島6-104 | |||
| Tel 058-392-6222 | Fax 058-392-1284 | ||
| Correspondence | |||
| Authors: | Tadakazu Furuhashi(Study director) Takahiko Nagase, Kazuyoshi Naito, Takashi Fujimura, Hitoshi Kimura, Tadashi Ito, Yoji Miwa |
||
| Nihon Bioresearch Inc. | |||
| 6-104, Majima, Fukuju-cho, Hashima, Gifu, 501-6251, Japan | |||
| Tel +81-58-392-6222 | Fax +81-58-392-1284 | ||