
60 mg/kg群においても,雌雄で副腎の病理組織学的変化が,雄では摂餌量増加,コリンエステラーゼおよび血清総コレステロールの変化,肝臓の腫大が,雌では体重増加抑制,肝臓,腎臓および胸腺の病理組織学的変化が認められた.
以上の結果より,本試験条件下におけるリン酸ジフェニルクレジルの反復投与毒性に関する無影響量は雌雄ともl2 mg/kg,生殖発生毒性に関する無影響量は親動物に対して雄が60 mg/kg,雌が300 mg/kg,児動物に対しては300 mg/kgと考えられる.
検疫・馴化期間を含めた全飼育期間中,温度20〜25℃,湿度40〜70%R.H.,換気約12回/時,照明12時間(7:00〜l9:00)に自動調節された飼育室を使用した.動物は,実験動物用床敷(ベータチップ:日本チャールスリバー(株))を敷いたポリカーボネート製ケージに,1ケージ当り投与開始後は1匹,交配期問中は雌雄各1匹,哺育期間は1腹で収容し飼育した.
動物には,オートクレーブ滅菌した実験動物用固型飼料(CRF-1:オリエンタル酵母工業(株)および5 mmのフィルター濾過後紫外線照射した水道水を,それぞれ自由摂取させた.
投与期間は,雌雄とも交配前14日間.交配期間中,および雄は計画殺前日までの計45日間,雌は交尾成立後分娩を経て哺育3日までの計41〜45日間とした.被験物質は,オリーブ油に溶解させ,胃ゾンデを用いて毎日1回,午前中に強制経口役与した.投与液量は5 ml/kgとし,至近測定日の体重を基に算出した.なお,投与液の調製に際し純度換算は行わなかった.
 法),総ビリルビン(Jendrassik改良法),総蛋白(Biuret法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(O-CPC法),無機リン(UV法),ナトリウム,カリウム,クロライド(イオン選択電極法),コリンエステラーゼ(ヨウ化アセチルチオコリン-DTNB法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
法),総ビリルビン(Jendrassik改良法),総蛋白(Biuret法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(O-CPC法),無機リン(UV法),ナトリウム,カリウム,クロライド(イオン選択電極法),コリンエステラーゼ(ヨウ化アセチルチオコリン-DTNB法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
この他に,血球および脳のコリンエステラーゼを測定した.血球については,血液の一部をヘパリン(リチウム塩)処理後,3000 r.p.m.,10分間遠心分離し,得られた血球成分を生理食塩水で洗浄し測定に供した.脳については,採血後に腹大動脈切断により放血致死させた後直ちに摘出し,正中線より切断分離した右脳を秤量後,所定量の0.1%トライトンXを加え,超高速ホモジナイザー(ポリトロン:KINEMATIKA社)にて均質化し,2000 r.p.m.,10分間遠心分離し,得られた上清部分を測定に供した.いずれもヨウ化アセチルチオコリン-DTNB法により,血球については分光光度計(目立3200形:(株)日立製作所),脳については自動分析装置(日立736-10形:(株)日立製作所)を用いて測定した.
雌雄とも対照および300 mg/kg群の上記器官と非妊娠および非分娩雌の卵巣について,常法に従いヘマトキシリン・エオジン染色標本を作製し鏡検した.この結果,胃,肝臓,腎臓,副腎,精巣おょび胸腺で被験物質投与による変化が認められたため,12および60 mg/kg群のこれらの器官についても検査した.一部の動物の肝臓,腎臓および副腎については,オイルレッドO染色あるいはPAS染色を実施した.
哺育4日の解剖時に卵巣,子宮を摘出して黄体数および着床数を検査した.交尾確認後25日を経ても分娩しなかった雌は剖検し,着床の有無を確認するとともに,卵巣,子宮および膣を保存した.これらの検査結果から妊娠期問(妊娠0日から出産が確認された日までの期間),出産率[(生存児出産雌数/受胎雌数)×100],着床率[(着床数/黄体数)×100],分娩率[(総出産児数/着床数)×100]を算出した.
哺育0日に生存児数,死亡児数,性別および外表異常の有無を検査した後,一般状態,死亡の有無を毎日観察した.死亡動物は食殺等で検査に耐えないものを除き,ホルマリン・酢酸混合液により浸漬・固定し,実体顕微鏡下で内臓異常の有無を中心に剖検した.哺育0および4日の生存児数から,出生率[(出産確認時生存児数/総出産児数)×100],新生児生存率[(哺育4日生存児数/出産確認時生存児数)×100]を算出した.
(2) 体重
哺育0日および4日に1腹毎に雌雄単位でまとめて測定し,それぞれの平均値を算出した.また,哺育0日の体重を基に4日までの体重増加量を算出した.
(3) 形態学的検査
全ての生存児について哺育4日に口腔を含む外表異常の有無を検査した.その後各腹毎に,雌雄それぞれ約半数の生存児について,アリザリンレッドS骨格染色標本1)を作製し,対照,60および300 mg/kg群について骨格異常の有無を検査した.残りの生存児については,ホルマリン・酢酸混合液で固定後内臓標本とし,対照,60および300 mg/kg群について頭部をWilson氏法2),胸部および腹部を顕微解剖法3)により内臓異常の有無を検査した.
 法により平均値を比較した.分散が一様でない場合にはKruskal-Wallisの検定を行い,Dunnett型またはScheff
法により平均値を比較した.分散が一様でない場合にはKruskal-Wallisの検定を行い,Dunnett型またはScheff 型の順位和検定を行った.ただし,下記の*印の項目については,はじめにKruskal-Wallisの検定を行い,有意差が認められた場合に順位和検定を行った.計数データについてはFisherの直接確率法により検定した.ただし,尿の定性検査データについては,Armitageのx2検定を用いた.
型の順位和検定を行った.ただし,下記の*印の項目については,はじめにKruskal-Wallisの検定を行い,有意差が認められた場合に順位和検定を行った.計数データについてはFisherの直接確率法により検定した.ただし,尿の定性検査データについては,Armitageのx2検定を用いた.
有意水準は5%以下とした.新生児に関するデータについては,各母動物毎に算出した平均値を統計単位とした.以下に検定の対象となる項目を示す.


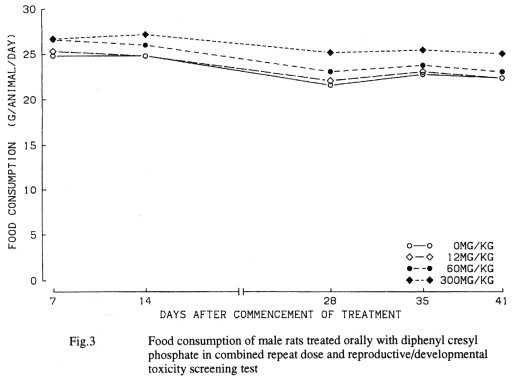
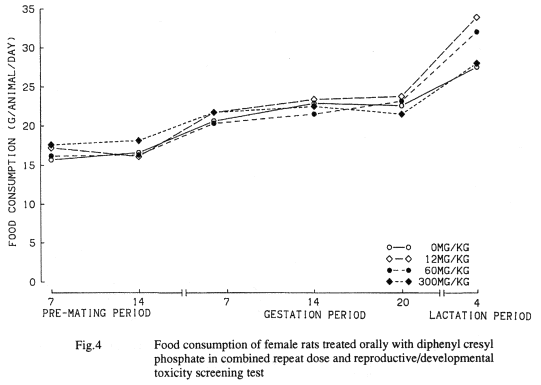

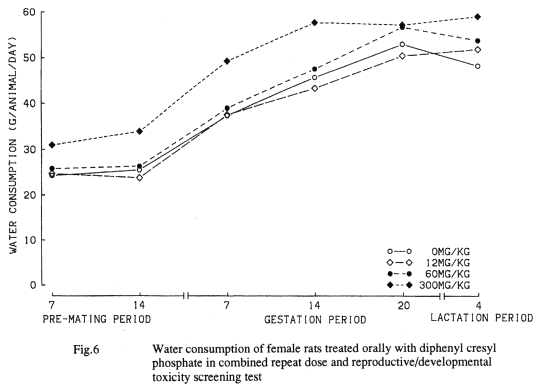
なお,白血球百分率で被験物質投与群の単球に低値がみられたが,生理的変動範囲内の値であり,かつ実数では有意差がなかったことから,対照群の値がやや高かったことによる偶発的な有意差と考えられる.
なお,300 mg/kg群のナトリウムが低値を示したが.生理的変動範囲内の値であったことから偶発的な変化と判断した.
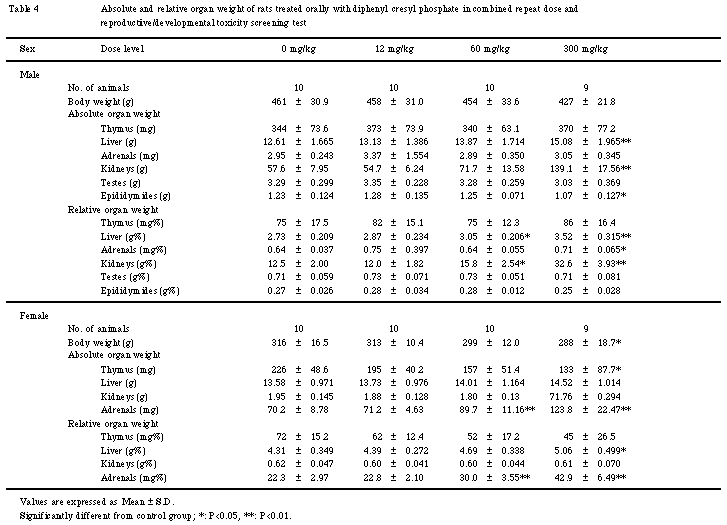
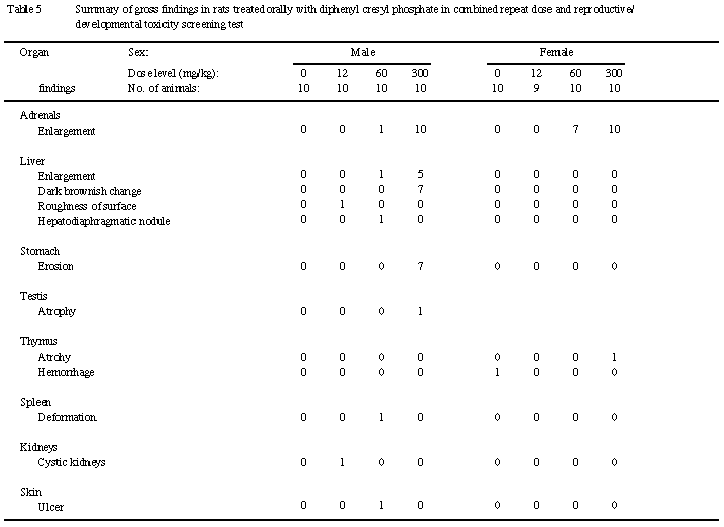
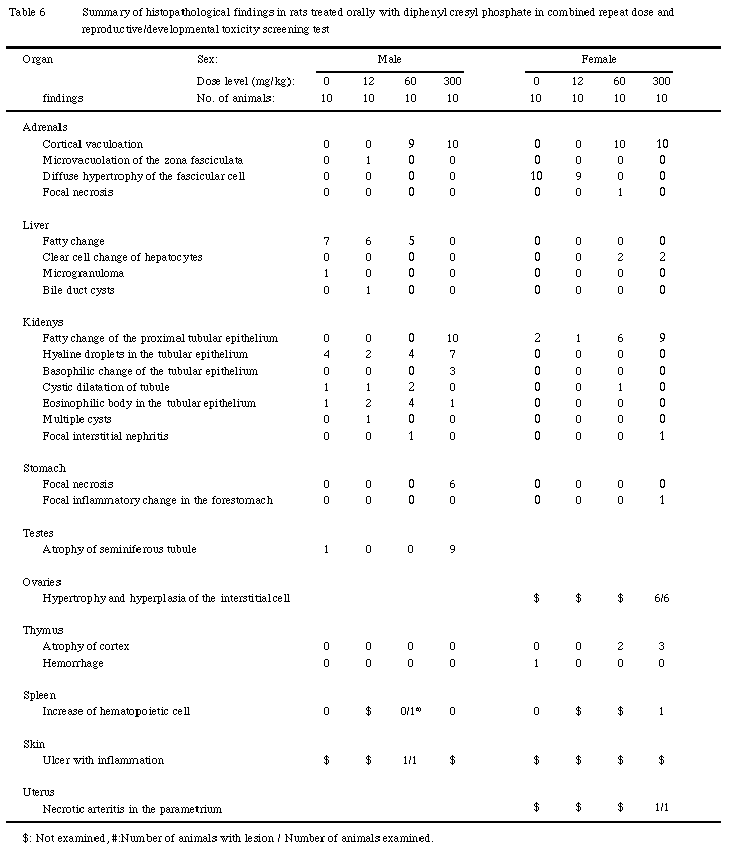
副腎では,皮質細胞の空胞化が60 mg/kg群の雄9例および雌の全例,300 mg/kg群の雌雄全例に認められた.60 mg/kg群では主として束状帯細胞の顕著な空胞化が,300 mg/kg群では皮質全層の細胞の空胞化が観察された.個々の細胞は腫大しており,その胞体内には微細あるいは粗大な空胞を充満し,核は辺縁部へ押しやられていた.この空胞はオイルレッドO染色により脂肪であるとが確認された.
肝臓では,肝細胞の脂肪化の減少とグリコーゲンの増加が認められた.肝細胞の脂肪化は対照,12および60 mg/kg群の雄でそれぞれ7,6および5例に認められたが,300 mg/kg群では認められなかった.対照群では小葉中間帯から辺縁部にかけて,微細な脂肪滴を充満している肝細胞あるいは粗大な脂肪滴を有する肝細胞を多数認めたが,300 mg/kg群においては脂肪滴を充満している肝細胞は認められなかった.肝細胞のグリコーゲン増加による明細胞化は60および300 mg/kg群の雌で各2例に認められた.これらの肝臓では小葉中間帯から辺縁部の肝細胞が腫大しており,透明に抜けた細胞質の中心部に核が位置していた.HE染色標本で透明に抜けた細胞質は,PAS染色によりグリコーゲンであることが確認された.
腎臓では,近位尿細管の脂肪化が300 mg/kg群の雄では全例に認められ,雌では対照,12,60および300 mg/kg群の2,1,6および9例と,60 mg/kg以上の役与群において発現数が増加していた.この変化は近位尿細管上皮基底膜側における微細な空胞として認められるものであり,ネフロン単位に出現していた.オイルレッドO染色を実施したところ,微細空胞は脂肪であることが確認された.また,尿細管上皮における硝子滴の出現が対照,12,60および300 mg/kg群の雄の4,2,4および7例に認められ,300 mg/kg群において発現数がやや増加していた.さらに,尿細管上皮の好塩基性変化が300 mg/kg群の雄3例に認められた.
胃では,腺胃粘膜における限局性の壊死が300 mg/kg群の雄6例に認められた.被蓋上皮およびその直下の粘膜固有層が壊死に陥っており,出血を伴う例もあった.
精巣では,精細管の萎縮が雄の対照群の1例および300 mg/kg群の9例に認められた.精上皮細胞の空胞化や精子細胞数の減少からなる萎縮初期の精細管や,ほとんどの精上皮細胞が変性・消失した萎縮後期の精細管等が両側精巣にび漫性にみられた.
卵巣では,組織学的検査を実施した非妊娠および非分娩雌,すなわち300 mg/kg群の6例全例に間質細胞の肥大および増生が認められた.肥大した間質細胞は微細空胞状を呈し,卵胞間で増殖していた.
胸腺では,萎縮が雌の60 mg/kg群の2例および300 mg/kg群3例に認められた.萎縮した胸腺の皮質では胸腺細胞が減少・消失しており,皮髄境界が不明瞭になっていた.


各群とも分娩した動物の哺育行動には異常は認められなかった.
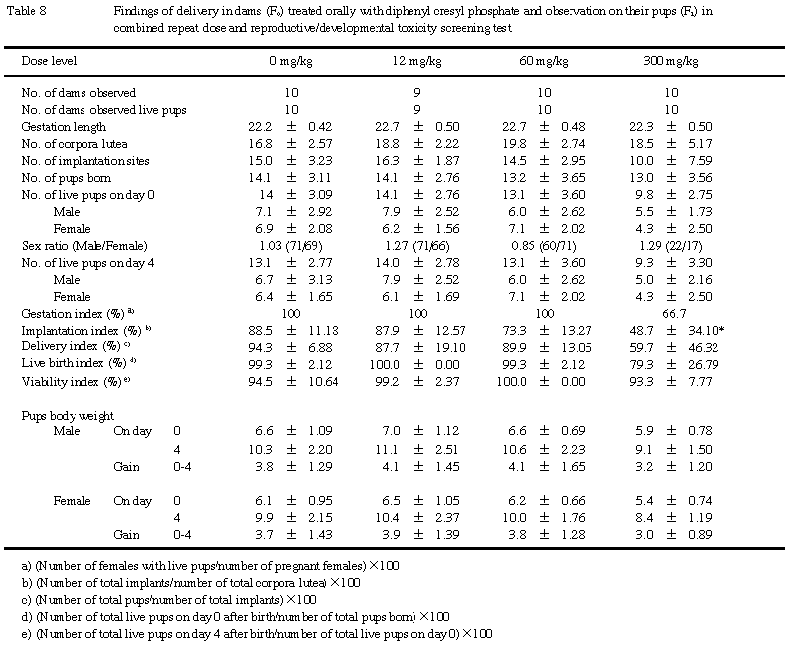
300 mg/kg群において.有意差は認められなかったが出産生存児数および出生率がやや低い値を示した.4腹中2腹の死産児数がやや多かったことが反映したものであったが,他の2腹では死産児は認められず,被験物質投与に起因したものかは明らかでなかった.出産児数,性比および新生児生存率に対照群との間に有意な差は認められなかった.
(2) 新生児の観察
いずれの群においても外表異常を示す新生児は認められず,生後の一般状態にも被験物質投与に起因する果常は認められなかった.
(3) 体重(Table 8)
雌雄とも哺育0日および4日の体重,ならびにその問の体重増加量に対照群と被験物質投与群との間に有意な差は認められなかった.
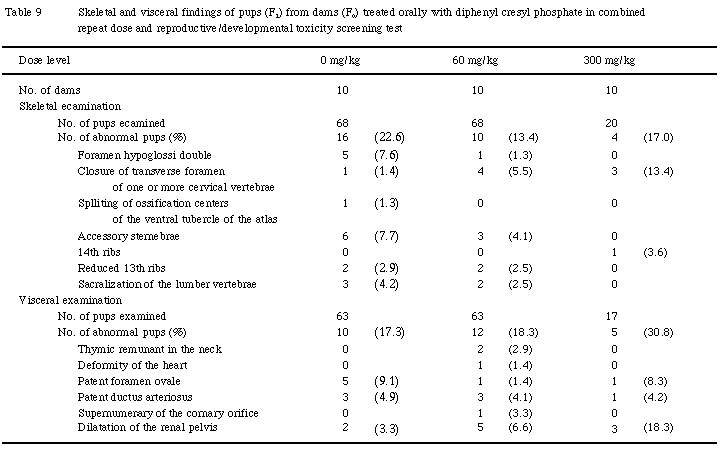
対照,60および300 mg/kg群ともに骨格奇形は認められなかった.骨格変異として過剰舌下神経孔,頸椎椎体横突孔閉鎖,第一頸推腹結節骨化核分離,過剰胸骨分節,14本肋骨(痕跡肋骨),第13肋骨短小および腰椎の仙椎化が観察されたが,いずれの発現率にも対照群との間に有意な差は認められなかった.
(2) 内臓検査
対照,60および300 mg/kg群で胸腺頸部残留,心臓変形,卵円孔開存,動脈管開存,過剰冠状動脈口および腎孟拡張が認められたが,いずれの発現率にも対照群との間に有意な差は認められなかった.
(3)死亡動物の内臓検査
検査可能であった動物は,対照群より順次,9,0,1および13例であった.
分娩日死亡動物では卵円孔開存が対照,60,300 mg/kg群のそれぞれ1,1および7例,動脈管開存が対照,60,300 mg/kg群のそれぞれ1,1および9例に認められた.これらは,出産前後に死亡したため卵円孔あるいは動脈管が完全に閉鎖しなかったものと考えられる.哺育1日以降の死亡動物では対照群の6例に動脈管開存が認められた.
投与後に観察された軽度の流挺については,トリクレジルフォスフェート(TCP)でも認められているが4),一部では投与直前から流挺し始める動物も観察されていること,および病理学的検査から胃粘膜のびらん・壊死など被験物質の刺激性を示唆する変化が認められていることから,局所刺激性に起因したものである可能性が考えられる.
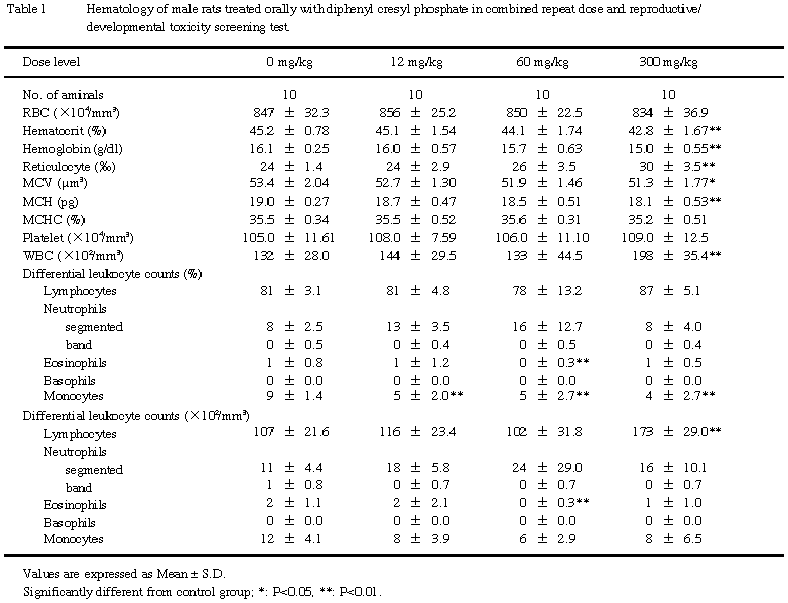
雄の血液学的検査で認められたヘマトクリット値,ヘモグロピン濃度の減少と網状赤血球数の増加などの貧血性変化および白血球数の増加については,TCPや他の有機リン化合物でも起こることが報告されている4-6).発現機序は明らかでないが,被験物質もこれらの有機リン化合物同様,血液性状に影響を及ぼすものと考えられる.
雄の血液生化学的検査では,種々の変化が60 mg/kg以上の群で認められた.すなわち,脳,血清,赤血球のコリンエステラーゼの低下は,有機リン化合物の主な作用であるコリンエステラーゼ活性阻害によるものと解釈される.アルブミンの減少およびA/G比の低下は,TCPでも同様に観察されている4).血清GPTおよびγ-GTPの上昇は,リン酸ジフェニルクレジルが肝臓の薬物代謝酵素誘導を起こすこと7),また,ある種の有機りン化合物は肝細胞の膜透過性の変化を起こすこと8,9)が示唆されていることから,被験物質の肝臓への影響を示す変化であると考えられる.トリグリセライドの減少および総コレステロールの増加も,他の有機リン化合物と類似した変化5,6,10,11)であり,被験物質もそれらと同様,脂肪酸のb酸化の活性化10),リポプロテインリパーゼ活性阻害12)あるいはレシチンコレステロールアシルトランスフェラーゼ活性阻害13)などにより脂質代謝へ影響を及ぼしている可能性が考えられる.
病理組織学的検査で認められた副腎皮質細胞の空胞化および卵巣間質細胞の肥大と増生は,TCPあるいは他の有機リン化合物によっても起こることが報告されており4,15,19),いずれもステロイドホルモン合成酵素の抑制14,18)やコレステロール代謝の阻害16,17)により生じる変化であり,被験物質投与による脂質代謝への影響と関連する変化と考えられる.また,肝臓で認められた脂肪化の減少も,血中トリグリセライドの減少と関連した変化であり,被験物質の脂質代謝への影響が反映したものと考えられる.一方,雌でみられたグリコーゲンの増加については,他の有機リン化合物と同様な肝グリコーゲンの合成九進10)によるものである可能性が考えられる.
精細管の萎縮については,同様の変化がTOCPにより引き起こされることが知られており20),また精巣上体管腔内の精子数に減少がみられていることから,この精巣の変化が受胎率低下の一因と考えられる.
腎臓で認められた尿細管上皮の脂肪滴の沈着は,腎臓に流れ込む脂質の量が多い時に発現する非特異的な変化であり21),尿細管上皮の硝子滴の出現は蛋白質の再吸収像である22).これらの変化は,対照群でも観察されているように,自然発生的にも発現するものであり,被験物質役与の影響により増強されたものと考えられる.
その他,胸腺の萎縮はストレス状態の動物でしばしば認められる変化であり23),雌では被験物質投与による影響に加えて,妊娠・分娩を経過することにより過剰なストレス状態にあったものと考えられる.また.尿量の増加および尿比重の低下は,電解質排泄量およびNa/K比に有意な変化がなかったこと,および腎臓には重篤な変化が認められなかったことから,飲水量の増加に伴った変化と考えられる.
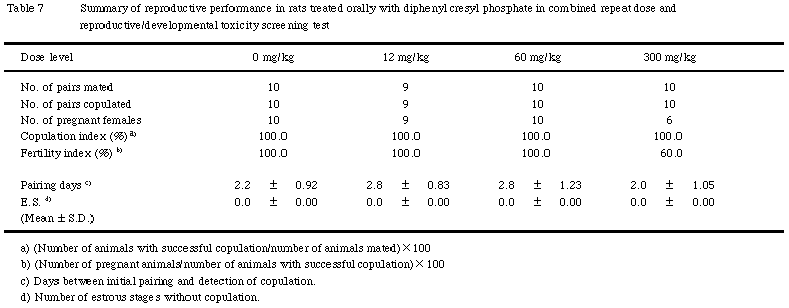
この受胎率および着床率の低下が雌雄いずれの要因によるものかは明らかでなかったことから,本試験とは別に補足試験を設け,被験物質を投与した動物と無処置動物を交配することにより,雌雄それぞれについて被験物質の影響を検討するとともに,雄については精子数,精子運動能および精子形態を検査した.その結果,被験物質を役与した雄では,交尾率への影響はなかったが,受胎率および着床率の低下が認められた.また,精巣上体尾部の精子数は顕著な減少を示すとともに,ほとんどの精子は頭部と尾部が分離し,生存する精子は認められなかった.一方,被験物質を投与した雌では交尾率,受胎率および着床率ともに影響は認められなかった.したがって,受胎率および着床率の低下は雄の精子形成障害に起因したものと考えられた.
本試験と同様な変化はTOCPでも認められており,精巣上体の精子密度の減少,精子頭部と尾部の分離,精子運動能低下を起こすといわれている20,24,25).一部の有機リン系殺虫剤およびアルキルフォスフェートも精巣毒性を示し,それらが精巣のライディッヒ細胞あるいはテストステロンにも影響を及ぼすのに対し,TOCPによる精巣障害は,LH,FSHあるいはテストステロンなどのホルモンに依存するものではないこと,および初期の標的はセルトリ細胞であることが示唆されている24,25).テストステロンはLHの支配下でライディッヒ細胞から分泌されるもので雄の交尾行動発現に重要なホルモンである.本試験においても受胎率の低下は認められたが,交尾率には影響がみられず,ライディッヒ細胞にも病理組織学的変化は認められなかった.これらのことから,被験物質もTOCPと類似の機序で精巣および精子形成に影響を及ぽしている可能性が考えられる.
出生児においては,300 mg/kg群の出生率がやや低い値を示したが,分娩動物数が4例と少なく,被験物質投与の影響であるか否かは明らかでなかった.出産児数,性比および新生児生存率には被験物質投与の影響は認められなかった.また,出生児の体重,外表,内臓および骨格検査でも被験物質投与に起因する変化は認められなかった.
以上のように,本試験では雌雄とも60 mg/kg以上の群で親動物に被験物質投与に起因した毒性変化が認められ,300 mg/kg群では雄の精子形成障害に起因する受胎率および着床率の低下が認められた.従って,本試験条件下における反復投与毒性に関する無影響量は雌雄とも12 mg/kg,生殖・発生毒性に関する無影響量は親動物に対して雄が60 mg/kg,雌が300 mg/kg,児動物に対しては300 mg/kgと考えられる.
| 1) | R. E. Staples and V. L. Schnell, Stein Techn. 39, 61 (1964). |
| 2) | J. G. Wilson, “Teratology principles and techniques,” ed. by J. G. Wilson and J. Warkany, The Univ. of Chicago press, Chicago and London, 1965, pp.262-277. |
| 3) | 西村耕一,Cong. Anom., 14, 23 (1974). |
| 4) | 斉藤千春ら,応用薬理,8, 107 (1974). |
| 5) | H. Oishi et al., Toxicol. Lett., 13, 29 (1982). |
| 6) | C. E. Healy et al., Fund. Appl. Toxicol., 16, 117 (1991). |
| 7) | S. Vainiotalo et al., Toxicology, 44, 31 (1987). |
| 8) | H. Hettwer and Ch. Gericke, Arch. Toxicol., 38, 251 (1977). |
| 9) | D. Gajewski and M. Katkiewicz, Acta Phyiol. Pol., 32, 507 (1981). |
| 10) | E. E. Enan et al., J. Environ. Sci. Health, B17, 549 (1982). |
| 11) | J. M. Poul, Toxicol. Lett., 16, 31 (1983). |
| 12) | A. Kozlowska et al., Arch. Toxicol., 62, 227 (1988). |
| 13) | M. Nakagawa and M. Uchida, Biochem. Pharmacol., 23, 1641 (1974). |
| 14) | R. R. Maronpot, Rnviron. Health. Perspect., 73, 125 (1987). |
| 15) | B. D. Carlton et al., Toxicology 46, 321 (1987). |
| 16) | P. Greaves, “Histopathology of preclinical toxicity studies: Adrenal gland,” Elsevier, Amsterdam, 1990, pp.696-721. |
| 17) | P. Greaves, “Histopathology of preclinical toxicity studies: Ovary,” Elsevier, Amsterdam, 1990, pp.649-669. |
| 18) | M. Civen et al., Biochem. Pharmacol., 26, 1901 (1977). |
| 19) | R. C. Pittman and D. Steinberg, Biochem. Biophys. Acta, 487, 431 (1977). |
| 20) | S. G. Somkuti et al., Toxicol. Appl. Pharmacol., 107, 35 (1991). |
| 21) | 小野江則,“新病理学総論:細胞障害と物質代謝障害,II脂質代謝障害”相沢幹,菊池浩吉編,南山堂,東京,1987,pp.59-71. |
| 22) | P. Greaves, “Histopathology of preclinical toxicity studies: Kidney,” Elsevier, Amsterdam, 1990, pp.497-554. |
| 23) | P. Greaves, “Histopathology of preclinical toxicity studies: Thymus,” Elsevier, Amsterdam, 1990, pp.111-115. |
| 24) | S. G. Somkuti et al., Toxicol. Appl. Pharmacol., 89, 49 (1987). |
| 25) | S. G. Somkuti et al., Toxicol. Appl. Pharmacol., 89, 64 (1987). |
| 連絡先 | |||
| 試験責任者: | 松浦郁夫 | ||
| 試験担当者: | 岩井真弓,星野信人,土谷稔,涌生ゆみ,豊田直人 | ||
| (株)三菱化学安全科学研究所 鹿島研究所 | |||
| 〒314-02 茨城県鹿島郡波崎町砂山14 | |||
| Tel 0479-46-2871 | Fax 0479-46-2874 | ||
| Correspondence | |||
| Authors: | Ikuo Matsuura(Study director) Mayumi Iwai, Nobuhito Hoshino, Minoru Tsuchitani, Yumi Wako, Naoto Toyota | ||
| Mitsubishi Chemical Safety Institute Ltd., Kashima Laboratory | |||
| 14 Sunayama, Hasaki-machi, Kashima-gun, Ibaraki, 314-02, Japan | |||
| Tel +81-479-46-2871 | Fax +81-479-46-2874 | ||