投与期間中に,1000 mg/kg投与群の雌2例が投与過誤により死亡した.
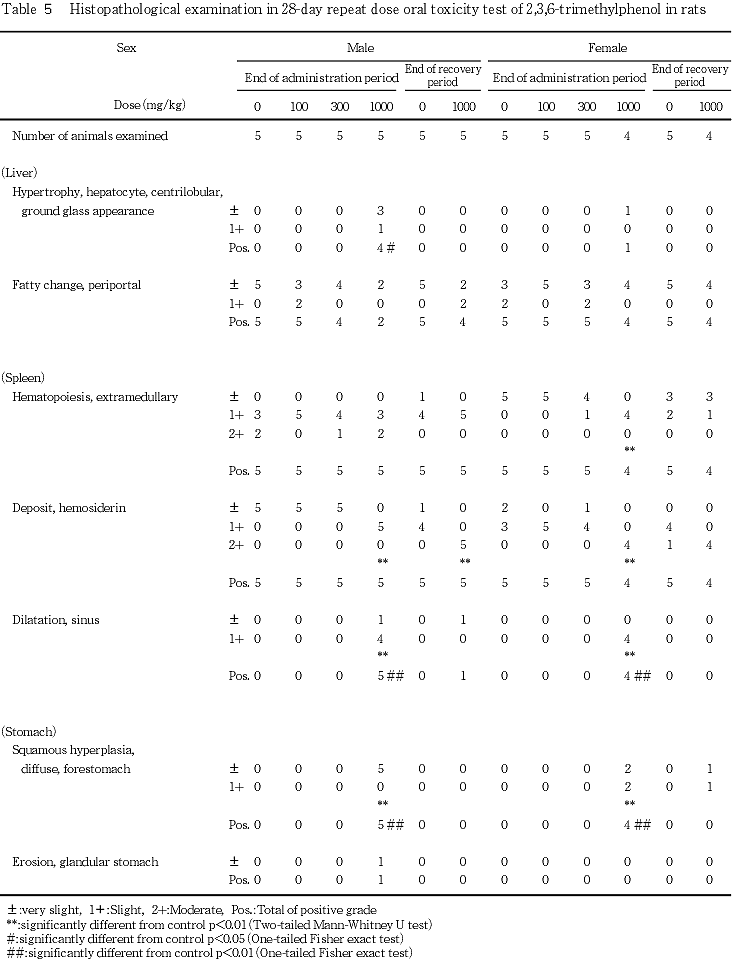
被験物質投与との関連を示唆する変化として,1000 mg/kg投与群では以下の所見が認められた.投与直後には,一過性変化の腹臥ないし歩行失調のほか,流涎が繰り返し散見された.これらの変化は,いずれも所見を認めた翌日の投与前までには消失し,流涎については,投与刺激による反射的反応であり,毒性変化ではないと判断した.投与期間中は,体重増加抑制および摂餌量の減少を示した.尿検査では,雄で尿量の有意な増加および尿比重の有意な減少ならびに黄色尿が認められ,雌で黄色尿のほか尿中の蛋白,ビリルビンおよびウロビリノーゲンの増加傾向が認められた.血液学検査では,雌で赤血球数,血色素量およびヘマトクリット値が有意に減少し,血液生化学検査では,雄で無機リン濃度が有意に増加,アルブミン濃度が有意に減少した.器官重量測定では,雄で副腎の絶対重量が有意に減少し,雌で脾臓の絶対重量および相対重量ならびに肝臓の相対重量が有意に増加した.病理学検査では,雌雄の肝臓でくもり硝子状変化を伴った小葉中心性の肝細胞肥大が散見され,その発現頻度は雄で有意に増加した.雌雄の脾臓では,静脈洞拡張およびヘモジデリン沈着が著しく,雌では髄外造血の亢進が認められた.また,前胃の扁平上皮にびまん性過形成が認められた.2週間の休薬により,これらの変化は概ね消失したが,回復期間終了時,雄で平均赤血球容積および平均赤血球血色素量が有意に減少し,雌の脾臓では投与期間終了時と同様に相対重量の有意な増加がみられた.病理組織学検査では,上記の肝臓および胃に認められた変化ならびに雌の髄外造血の亢進は,消失ないし軽減した.脾臓のヘモジデリン沈着は,雌雄とも対照群より著明であった.300 mg/kg投与群では,1000 mg/kg投与群に認められた上記の変化の内,雌雄で一過性の流涎,雌で体重増加抑制および摂餌量減少が認められたほか,雄では尿比重低下,血中無機リン濃度の増加および副腎の絶対重量減少が認められた.100 mg/kg投与群では,雌雄とも被験物質投与との関連を示唆する変化は認められなかった.
以上のことから,本試験条件下における2,3,6-トリメチルフェノールの無影響量は,雌雄とも100 mg/kg/day であると判断される.
群分けは,投与開始前日の体重に基づいて,体重別層化無作為抽出法により行った.動物数は,各性毎に,対照群および1000 mg/kg投与群は各10匹,100 mg/kgおよび300 mg/kg投与群は各5匹とし,そのうち,雌雄の対照群および雄の1000 mg/kg投与群の各5匹ならびに雌の1000 mg/kg投与群の4匹は,回復試験に用いた.
 (コールターエレクトロニクス(株))により赤血球数(電気抵抗法),白血球数(電気抵抗法),血色素量(吸光度法)平均赤血球容積(電気抵抗法)および血小板数(電気抵抗法)を測定し,これらを基にヘマトクリット値,平均赤血球血色素量および平均赤血球血色素濃度を算出した.血液の一部は塗抹標本とし,白血球分類(Wright-Giemsa染色)および網状赤血球比率(Brecher法)を求めた.また,クエン酸ナトリウムを抗凝固剤として採取した血液を用いてプロトロンビン時間および活性部分トロンボプラスチン時間(光散乱検出法,CA-1000,東亜医用電子(株))を測定した.
(コールターエレクトロニクス(株))により赤血球数(電気抵抗法),白血球数(電気抵抗法),血色素量(吸光度法)平均赤血球容積(電気抵抗法)および血小板数(電気抵抗法)を測定し,これらを基にヘマトクリット値,平均赤血球血色素量および平均赤血球血色素濃度を算出した.血液の一部は塗抹標本とし,白血球分類(Wright-Giemsa染色)および網状赤血球比率(Brecher法)を求めた.また,クエン酸ナトリウムを抗凝固剤として採取した血液を用いてプロトロンビン時間および活性部分トロンボプラスチン時間(光散乱検出法,CA-1000,東亜医用電子(株))を測定した.
 法),アルカリフォスファターゼ活性(GSCC法),GOT活性(IFCC法),GPT 活性(IFCC法),LDH活性(Wr
法),アルカリフォスファターゼ活性(GSCC法),GOT活性(IFCC法),GPT 活性(IFCC法),LDH活性(Wr blewski-La Due法),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),トリグリセライド濃度(GPO・DAOS法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(イオン電極法)を測定した.
blewski-La Due法),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),トリグリセライド濃度(GPO・DAOS法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(イオン電極法)を測定した.
一般状態の変化として,雌雄の1000 mg/kg投与群には,投与期間中に腹臥位または歩行失調を示す例が観察された.この変化は,いずれも投与後の観察において散見され,死亡例を除き変化を認めた翌日の投与前には消失する一過性のものであった.この変化は,しばしば繰り返し観察され,その例数は,雄では6例,雌では9例であった.
また,雌雄の300および1000 mg/kg投与群には,投与直後の一過性流涎が認められた.この変化は,雌雄とも1000 mg/kg投与群の方がより早期且つ高頻度に認められ,同群では,雌1例(投与第3日死亡)を除いて全例に観察された.また,投与直前の保定時から流涎を生じた例も散見された.
その他には,投与第3 週から投与期間終了時屠殺まで,対照群および300 mg/kgの雌各1例に,体表の脱毛が認められた.
回復期間中の観察では,全例において変化はみられなかった.


回復期間終了週の検査では,雌の1000 mg/kg投与群の尿中蛋白の増加は軽減され,その他も概ね消失した.
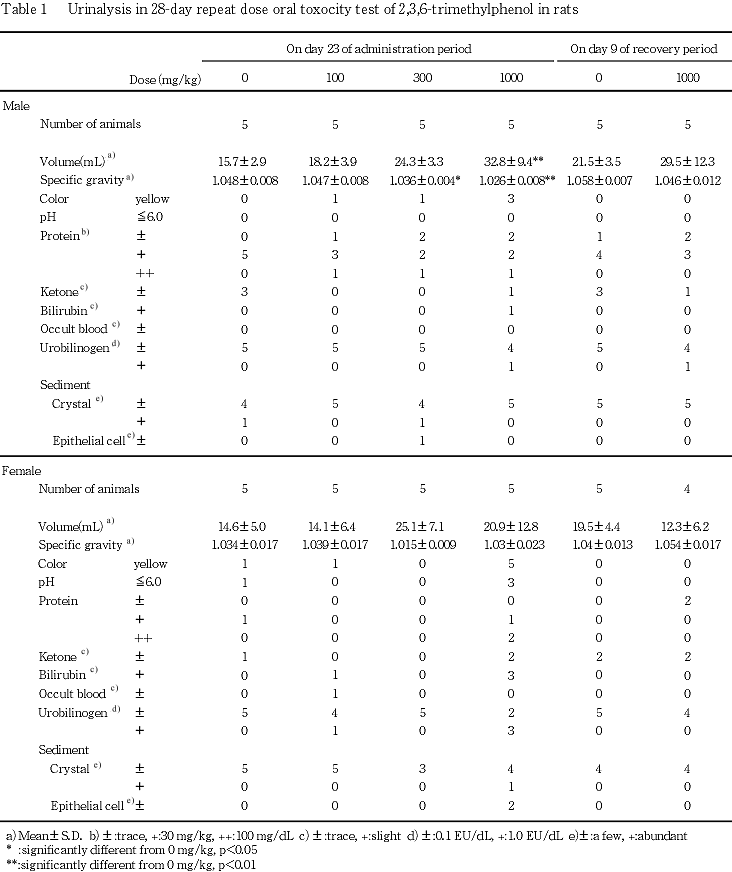
回復期間終了時の検査では,1000 mg/kg投与群の雄で,平均赤血球血色素量および平均赤血球容積の有意な減少が認められた.
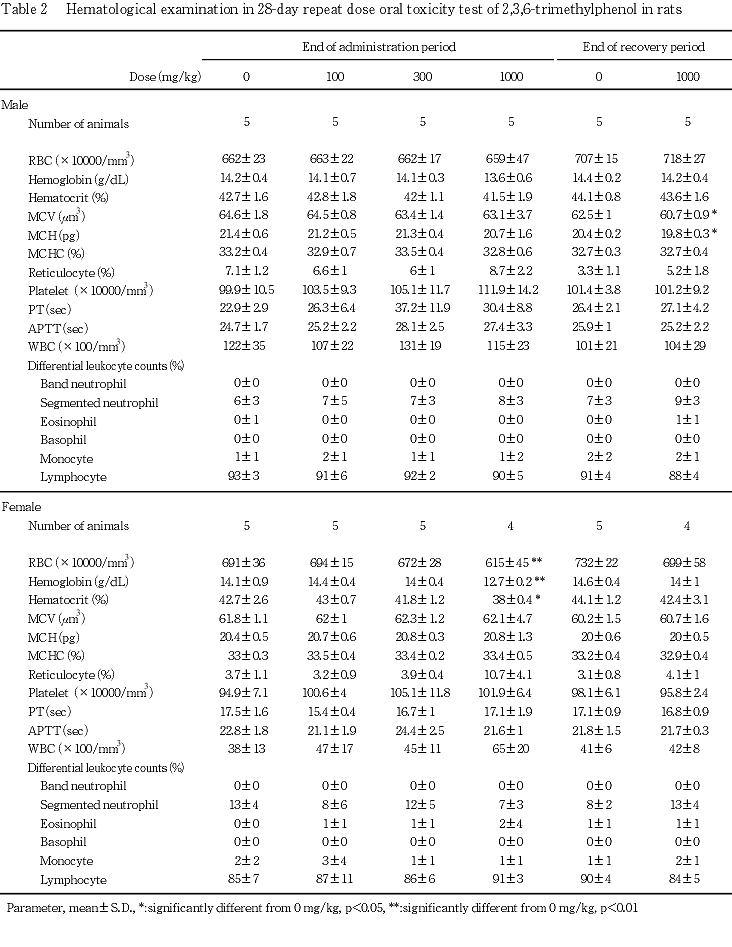
回復期間終了時の検査では,上記変化はいずれも消失した.また,投与期間終了時に変化を示さなかった項目において,有意差を生じた項目が散見された.
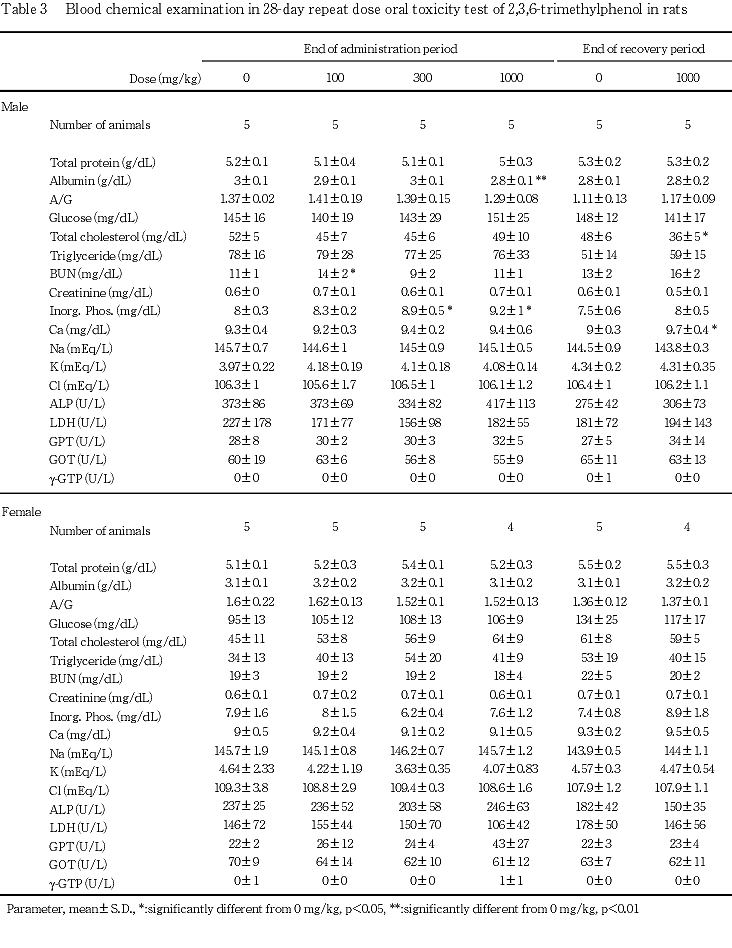
回復期間終了時屠殺例では,雌の1000 mg/kg投与群の脾臓の相対重量の有意な増加は認められたが,その他の変化は,概ね消失していた.また,その他にも統計学的に有意差を生じた項目が散見されたが,いずれも投与期間終了時に認められた変化ではなかった.
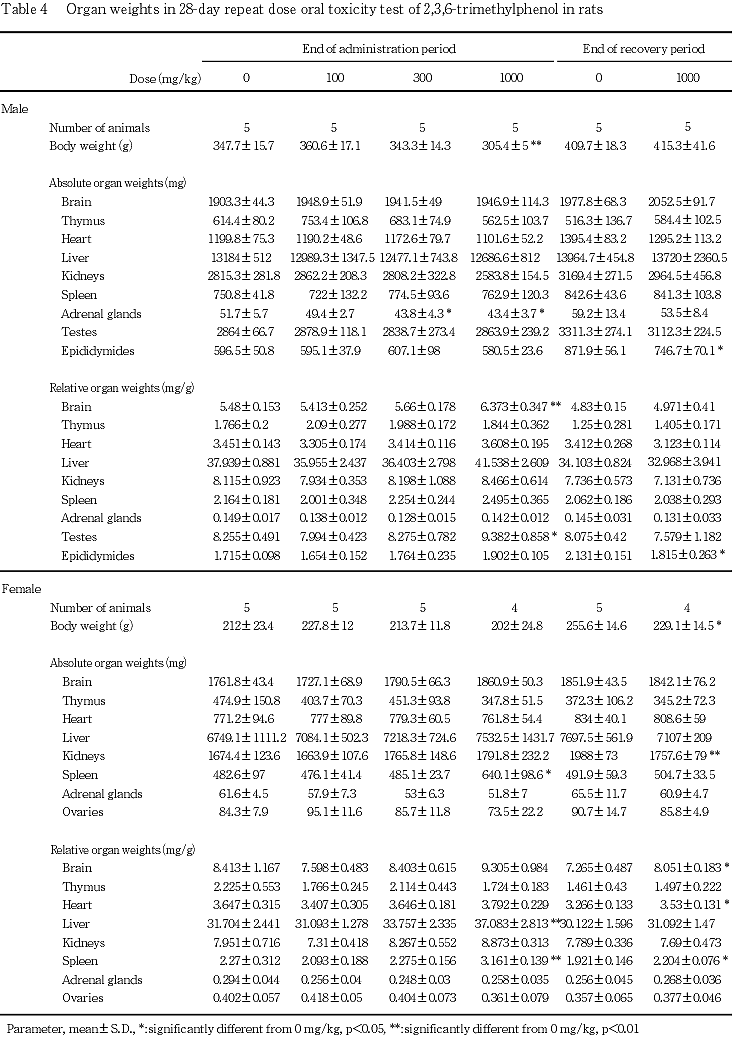
回復期間終了時屠殺例では,対照群および1000 mg/kg投与群の雄の肺に暗色点がみられた他に異常はなかった.
対照群の雄2例,雌1例に心筋変性がみられたが,1000 mg/kg投与群には異常は観察されなかった.
(肝臓)
1000 mg/kg投与群の雄4例,雌1例に小葉中心性肝細胞肥大がみられ,細胞質はややくもり硝子状を示した.1000 mg/kg投与群の雄では肝細胞肥大の発現頻度に有意な増加が認められた.その他,門脈周囲性の脂肪化がみられたが,対照群と被験物質投与群との間に発現頻度および程度の差はなく,100 mg/kg投与群の雌1 例に限局性の脂肪化がみられたが,他の群には認められなかった.
(脾臓)
1000 mg/kg投与群の雌雄では,対照群よりヘモジデリン沈着が増加し,静脈洞の拡張がみられた.統計学的には,同群の雌雄においてヘモジデリン沈着の程度および静脈洞拡張の発現頻度ならびに程度が,同群の雌において髄外造血の程度が各々対照群より有意に増加した.
(腎臓)
対照群および1000 mg/kg投与群の雌雄では,皮質に好塩基性尿細管がみられ,雄ではeosinophilic bodyがみられたが,両群間に発現頻度および程度の差はなかった.その他,対照群の雄1例に嚢胞がみられ,同群の雌1例の皮髄境界部に鉱質沈着が認められた.
(胃)
1000 mg/kg投与群の雌雄全例の前胃に扁平上皮のびまん性過形成がみられ,程度および発現頻度が有意差を示した.その他,同群の雄1例の腺胃にびらんがみられた.
(肉眼的病変部)
肺の暗色点では,いずれの例にも出血がみられたが,軽度ないしごく軽度な変化であった.肺の淡色領域では,泡沫細胞の集簇がみられた.胸腔内白色物質を有した例の肺では,胸膜に異物肉芽腫が認められた.また,皮膚の脱毛,貧毛,または痂皮部位には,潰瘍と痂皮および再生に伴うと思われる上皮細胞の過形成がみられた.
脳,脊髄,胸腺,膀胱,副腎,回腸,坐骨神経および大腿骨骨髄には,1000 mg/kg投与群の雌雄に異常は認められなかった.
投与期間終了時屠殺例にみられた肝細胞肥大は認められなかった.その他,門脈周囲性の脂肪化がみられたが,対照群と1000 mg/kg投与群との間に程度および頻度の差はなかった.
(脾臓)
1000 mg/kg投与群の雌雄ではヘモジデリン沈着が増強しており,雄ではその程度が有意な増加を示した.また,同群の雄1例に静脈洞の拡張がみられた.全例に髄外造血がみられたが,雌雄とも対照群との間に程度の差はなかった.
(胃)
1000 mg/kg投与群の雌1例の前胃に扁平上皮のびまん性過形成がみられた他には,異常はみられなかった.
(肺)
1000 mg/kg投与群の雄2例および対照群の雄1例に軽度の出血がみられた.
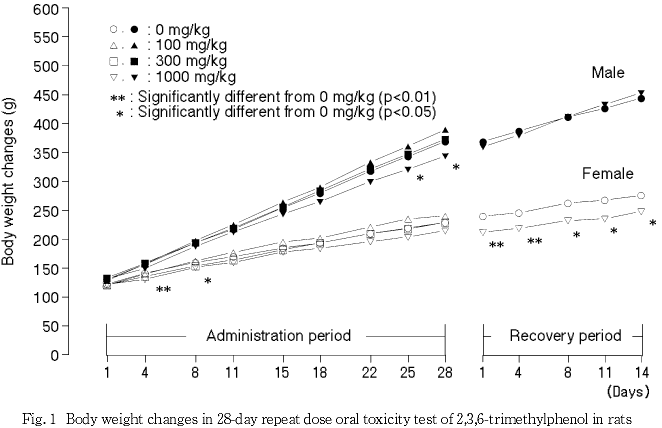
全身性の毒性として,1000 mg/kg投与群の雌雄では,投与期間中に体重増加抑制が認められた.同群では,投与初期に摂餌量が減少している.摂餌量の減少は,300 mg/kg投与群の雌でも認められ,その日の体重は,有意差はなかったものの低値を示しており,両変化の連動性が窺える.1000 mg/kg投与群の雌では,回復期間中は一貫して体重が有意な低値を示したが,加齢とともに増加しており,投与期間中の発育遅延により対照群との差を有したまま推移したと考えられる.
1000 mg/kg投与群の雌では,赤血球数,血色素量およびヘマトクリット値の減少,尿中ウロビリノーゲンの増加傾向,脾臓の重量増加および髄外造血亢進,静脈洞拡張およびヘモジデリン沈着などがあり,さらに,網状赤血球比率や多染性赤血球の増加傾向が認められたことから,溶血が示唆された.同群の雄では,貧血傾向および髄外造血の亢進は認められなかったものの,ヘモジデリン沈着の程度が増加傾向を示したことから,雌と同様に被験物質投与により溶血を生じた可能性が高い.
1000 mg/kg投与群の雌雄では,全例で前胃の扁平上皮のびまん性過形成がみられた.また,同群の雄1例では腺胃のびらんがみられ,雌1例(死亡例)の前胃には潰瘍の修復像と考えられる限局性の過形成が観察された.これらの変化が生じた機序は明らかではないが,被験物質の胃粘膜刺激性に由来すると推察される.
肝臓では,1000 mg/kg投与群の雄において,くもり硝子状を呈し肥大した肝細胞が小葉中心性に観察された.同群の雌では,この組織変化は軽度であったが,肝臓の相対重量の有意な増加が認められた.これらの変化は,被験物質投与により肝臓の薬物代謝酵素が誘導された可能性を示唆する.
上記の毒性変化は,2週間の回復期間を経て,概ね消失した.溶血を示唆した変化についても,雌雄とも脾臓のヘモジデリン沈着は認められたものの,赤血球数や髄外造血の程度に差はみられなかったことから,休薬によりこの変化の進行も停止するものと思われた.
投与直後の一過性の流涎は,用量依存的かつ高頻度に認められたが,毒性発現とはみなさなかった.この流涎は,強制経口投与された検体に対する忌避感(苦味や刺激等)から,反射的に生じたものである可能性が高い.投与直前の保定時から流涎を発した例については,反復投与により条件反射が成立したためであると考えられる.
以上のように,本試験では一過性の歩行失調,体重増加抑制,摂餌量の減少,前胃上皮のびまん性過形成が認められたほか,溶血および肝臓の薬物代謝酵素誘導を示唆する変化がみられた.100 mg/kg投与群の雌雄では,これらの所見はいずれも認められなかった.したがって,本試験条件下における2,3,6-トリメチルフェノールの無影響量は,雌雄とも100 mg/kg/dayであると判断される.
| 連絡先 | |||
| 試験責任者: | 大原直樹 | ||
| 試験担当者: | 関 誠,加藤博康,関 剛幸,笠間菊子,吉村慎介 | ||
| (財)食品薬品安全センター 秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Naoki Ohara(Study Director) Makoto Seki, Hiroyasu Katoh, Takayuki Seki, Kikuko Kasama, Shinsuke Yoshimura | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||