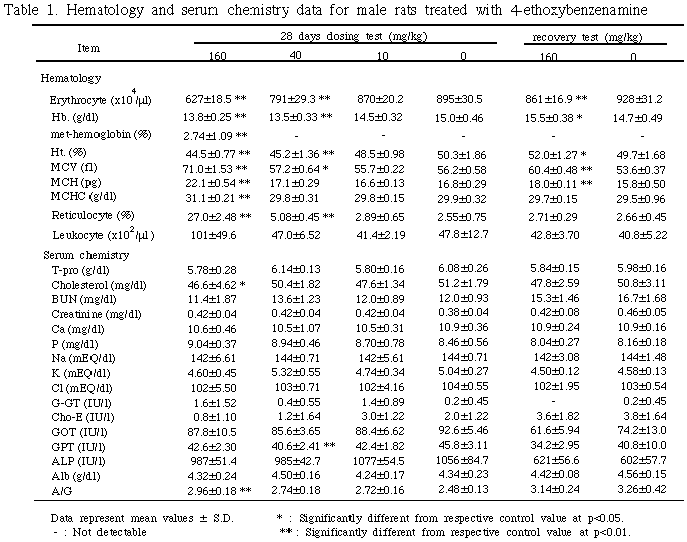
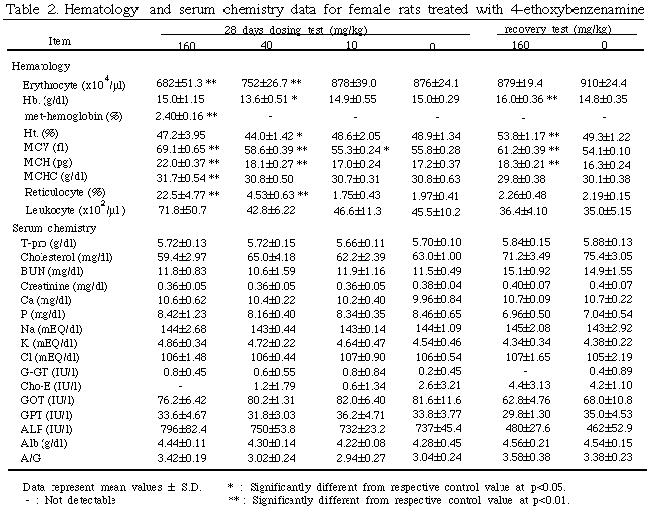
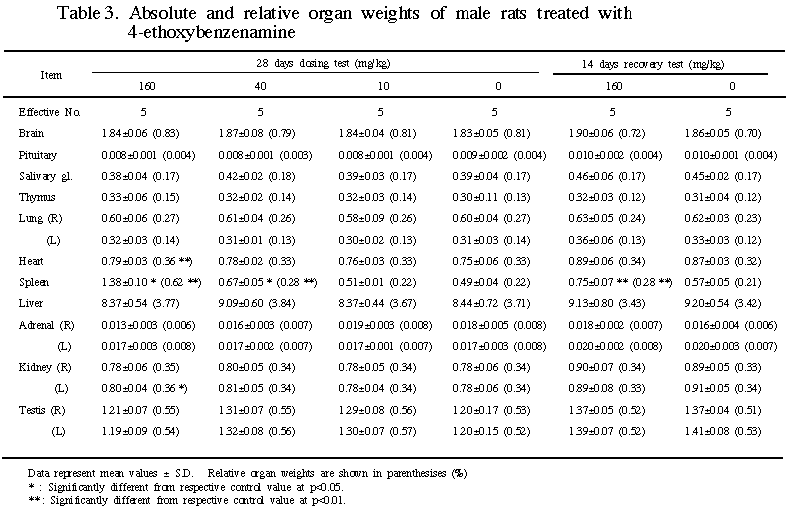
雌雄の160、40 mg/kg群において尿中ウロビリノーゲンの増加、赤血球数の減少と網状赤血球数の増加がみられ、また雌雄の160 mg/kg群においてメトヘモグロビン血症が認められた。脾臓重量の増加が雌雄160、40 mg/kg群でみられ、病理組織学的にはヘモジデリン沈着・髄外造血の亢進・うっ血が認められた。その他、骨髄の造血亢進、肝臓の軽度なヘモジデリン沈着と髄外造血の亢進が観察された。上記変化は14日間の休薬により回復した。
これらの所見を考慮し、4−エトキシベンゼナミンの無影響量は10 mg/kg/dayと判断された。
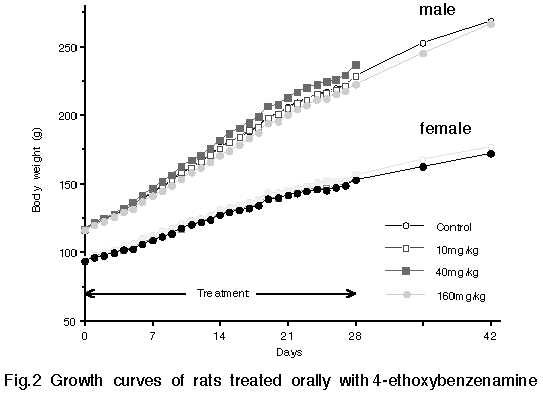
今回、我々は雌雄のF344ラット60匹を用い、化審法ガイドライン4)に準じて4−エトキシベンゼナミンの28日間の強制経口による反復投与試験を実施した。
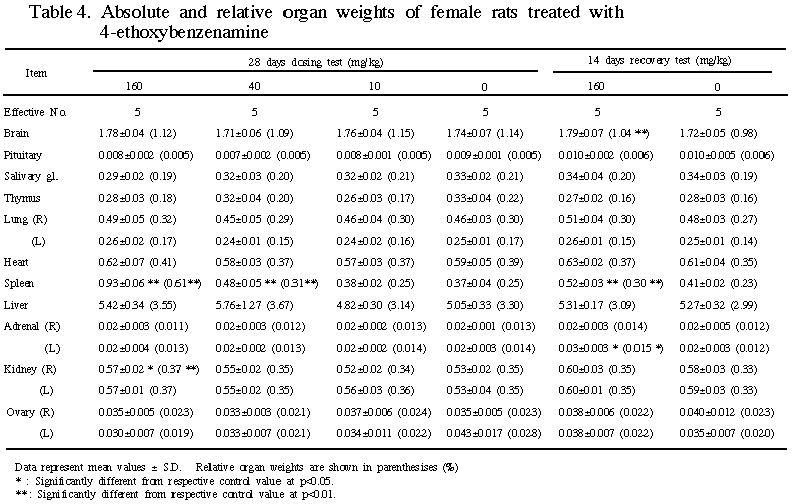
採血は、最終投与日または休薬14日目の夕刻から動物を一晩絶食させ、翌日にエーテル深麻酔下で、腹部大動脈より行なった。血液学的検査は赤血球数、白血球数、ヘモグロビン量(Hb.)、ヘマトクリット値(Ht.)、MCV、MCH、MCHCの各項目について実施し、さらにメトヘモグロビンの測定5)も行った。血清生化学的検査は総蛋白(T-Pro.)、総コレステロール、尿素窒素(BUN)、クレアチニン、カルシウム(Ca)、無機リン(P)、ナトリウム(Na)、カリウム(K)、クロール(Cl)、G-GT、コリンエステラーゼ(Cho-E)、GOT、GPT、LDH、ALP、アルブミン(Alb)、A/G比の各項目について実施した。採血した後に放血屠殺し剖検した。剖検時、肉眼的に観察した後に諸臓器を摘出・精査し、脳、下垂体、唾液腺、胸腺、心臓、肺、腎臓、副腎、脾臓、肝臓、精巣、卵巣については重量測定を行った。上記臓器に加え脊髄、胸骨、大腿骨、胃、腸、膵臓、膀胱、皮膚、乳腺、リンパ節、副鼻腔、気管支、食道、甲状腺、舌、精嚢腺、前立腺、子宮、腟を10%中性緩衝ホルマリン液で固定した。組織は通常の方法によりパラフィン包埋して薄切片を作製し、Hematoxylin-Eosin(HE)染色を施し、病理組織学的に検索を行った。なお、脾臓・肝臓・大腿骨骨髄についてはベルリンブルー染色も行い、病理組織学的に検索した。

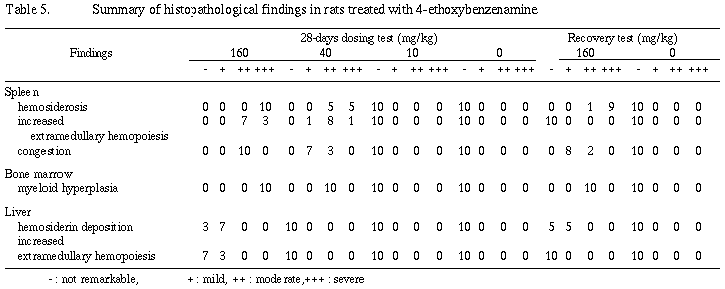
骨髄:雌雄の40 mg/kg以上の投与群において高度な赤芽球系の過形成(hyperplasia)が観察され、休薬により回復傾向を示した。雌雄の10 mg/kg群においては対照群と比較し明らかな病変は認められなかった。
肝臓:雌雄の160 mg/kg群において軽度な髄外造血の亢進およびKupffer細胞や肝細胞にヘモジデリンの沈着が観察されたが、これらは休薬により回復または回復傾向を示した。
その他の臓器において特記すべき所見はみられず、また、いずれの所見についても明かな性差は認められなかった。
4−エトキシベンゼナミンは医薬品フェナセチンの代謝物として知られている7, 8, 9)。フェナセチンは下熱鎮痛剤として用いられていたが、血液障害等の副作用がある、また、発がん性の危険性も報告されたことから現在ではあまり用いられていない薬物である。フェナセチン投与による血液障害(メトヘモグロビン血症)はおもにその代謝物であるp-phenetidine(N-hydroxy-p-phenetidine)によるものと報告されている7, 8, 9)。また、アニリン色素投与によるメトヘモグロビン血症も広く報告されている10)。本研究において4−エトキシベンゼナミン投与によりメトヘモグロビン血症が認められたことはこれらの報告と一致するものであった。
脾臓および肝臓におけるヘモジデリンの沈着は、これらの臓器におけるメトヘモグロビン赤血球の処理(崩壊)によるものと考えられた。一方、網状赤血球数の増加・骨髄の造血亢進・脾臓および肝臓における髄外造血の亢進は血球崩壊による赤血球数の減少(貧血)を補うための代償性反応として発現したものであり、4−エトキシベンゼナミンの造血系に対する直接的な障害作用によるものではないと考えられた。また、尿中ウロビリノーゲンの増加もヘモグロビン分解量の上昇に起因した反応と考えられた。本物質により惹起された変化はいずれも14日間の休薬により回復または回復傾向を示しており、これらの変化は可逆性と考えられた。
10 mg/kg群では雌雄とも、いずれの項目においても対照群と比較し有意な変化は認められず、本実験条件下における4−エトキシベンゼナミンの無影響量は10 mg/kg/dayと考えられた。
| 1) | “10889の化学商品,”化学工業日報社編, 化学工業日報社, 東京, 1989, pp.588 |
| 2) | N.M.Vasilenko, V.A.Volodchenko, A.A. Nakonechny, E.R. Sadokha, Pharmacol. toxicol., 3, 367 (1972). |
| 3) | D.V.Sweet ed.,“ Registry of toxic effects of chemical substances,”U.S. Department of Health and Human Services, USA, 1987, pp.3228 |
| 4) | 大森義仁, “ 化審法 毒性試験法の解説,”化学工業日報社, 東京, 1987, pp.23-42 |
| 5) | 中村延雄, 柴田昭, “ 血液学研究検査法,” 中外医学社 , 東京, 1980, pp.210 |
| 6) | 吉村 功, “ 毒性・薬効データの統計解析,” サイエンティスト社 , 東京, 1987, pp.26 |
| 7) | N.Nakayama, Y. Masuda, J.Pharmacobio-Dyn., 8, 868 (1985). |
| 8) | H.Egan, L.Fishbein, M. Castegnaro, I.K. O'neill, H. Bartsch, W. Davis, “ Environmental carcinogens - selected methods of analysis, 4,” International Agency for Reserch on Cancer., Lyon, 1981, pp.287-310 |
| 9) | S.P.Clissold, Drugs, 32, 46 (1986). |
| 10) | J.H.Harrison, D.J.Jollow, Mol.Pharmacol., 32, 423 (1987). |
| 連絡先: | |||
| 試験責任者 | 古川文夫 | ||
| 国立衛生試験所安全性生物試験研究センター | |||
| 病理部 | |||
| 〒158東京都世田谷区上用賀1-18-1 | |||
| Tel 03-3700-1141 | Fax 03-3700-2348 | ||
| Correspondence: | |||
| Furukawa, Fumio | |||
| Division of Pathology, | |||
| Biological Safety Research Center, | |||
| National Institute of Health Sciences, Japan | |||
| 1-18-1 Kamiyoga, Setagaya-ku, Tokyo, 158, Japan | |||
| Tel 81-3-3700-1141 | Fax 81-3-3700-2348 | ||