被験物質投与に起因した瀕死あるいは死亡はいずれの投与群にも認められなかった.
被験物質投与によると考えられる一般状態の変化としては,被験物質各投与群に流涎が,40 mg/kg以上の投与群に自発運動の減少,眼瞼下垂あるいは閉眼および鼻汁が,160 mg/kg投与群に流涙が,それぞれ投与後一過性に認められた.
体重増加および摂餌量には投与の影響は認められなかった.
剖検では,40 mg/kg以上の投与群に前胃粘膜の肥厚領域が観察され,病理組織学検査では前胃粘膜扁平上皮の軽度な過形成が観察された.しかし,下垂体,精巣,精巣上体,精嚢,凝固腺および前立腺については投与に起因した変化はいずれの投与群にも認められなかった.10 mg/kg投与群にはいずれの検査項目にも投与の影響は認められなかった.
被験物質投与によると考えられる一般状態の変化としては,自発運動の減少および流涎が,40 mg/kg投与群の投与初期,ならびに160 mg/kg投与群の全投与期間に,いずれも投与後一過性に観察された.また,40 mg/kg あるいは160 mg/kg投与群の投与初期には,鼻汁あるいは寄りかかりおよび腹臥位も投与後一過性に観察された.
体重増加については,明瞭な抑制は認められなかったが,摂餌量の抑制が,40 mg/kg以上の投与群の妊娠初期,および160 mg/kg投与群の哺育4日以降の時期に認められた.
剖検では,投与に関連した異常は観察されず,病理組織学検査においても,下垂体,胃,卵巣,子宮,頸部および腟のいずれにも,被験物質投与に起因した変化は認められなかった.
投与検体は,各濃度毎に秤量した被験物質を媒体とした0.5 w/v%カルボキシメチルセルロースナトリウム(CMC Na)水溶液(日局カルメロースナトリウム:丸石製薬(株),製造番号:6Z09,日局注射用水:光製薬(株),製造番号:9707SA)に懸濁することにより調製し,冷蔵保管して使用した.投与検体中に含まれる被験物質の含量および均一性は,秦野研究所において確認した.
動物は,基準温湿度各24 ± 1 ℃,および50-65 %,換気回数約15回/時間,照明12時間(7-19時点灯)に制御された飼育室で,金属製金網床ケージに個別に収容して飼育し,固型飼料(CE-2,日本クレア(株)および飲料水(水道水,秦野市水道局給水)を自由に摂取させた.妊娠14日(腟栓あるいは精子発見日=妊娠0日)以後の母動物は,プラスチック製ラット用繁殖ケージに収容し,床敷として紙パルプ製チップ(ALPHA-dri,加商(株)を適宜供給した.
各用量の投与検体は,各群の動物に対して剖検の前日まで毎日1回,調製検体をマグネティックスターラーで攪拌しながらラット用胃管を用いて経口投与した.すなわち,雄に対しては交配前10週間から最長3週間の交配期間を経て剖検前日に至るまでの連続98日間,また,雌に対しては交配前2週間,交尾までの交配期間,妊娠期間,哺育20日(分娩日=哺育0日)まで投与し,交尾後,分娩の認められなかった動物は,妊娠24日相当日まで同様に投与した.毎日の投与は,一定時刻の間(11-15時)に行い,各動物の投与液量(5 mL/kg)は,雄および交配前,交配期間中の雌では週1回測定される体重を基準とし,交尾後の雌では妊娠0,7,14,20日の体重を,分娩後の雌では哺育0,4,7,14日の体重を基準にそれぞれ算出した.
雌は全例について,交尾を確認するまでは週1回(投与1,8,15,22日),交尾確認後は,妊娠0,7,14,20日に,分娩後は哺育0,4,7,14,21日に測定した.これらのうち,投与22および29日については,交尾が確認されていない動物についてのみ測定したので評価の対象から除外した.
雌は全例について,交配前期間は投与2-3および9-10日,交尾確認後は,妊娠0-7,7-14,14-20日に,分娩後は哺育0-4,4-7,7-14,14-21日に測定した.
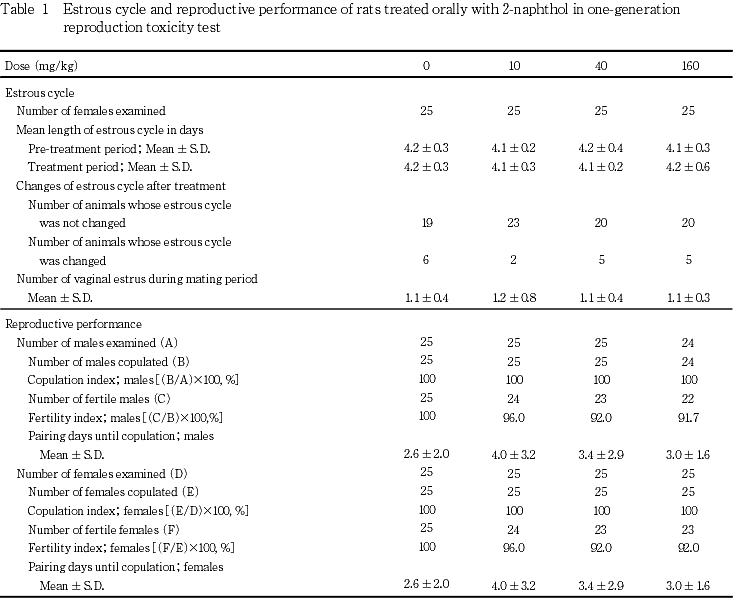
交配結果から,各群について交尾率[(交尾動物数/同居動物数)×100],受胎率[(受胎動物数/交尾動物数)×100],同居開始日から交尾確認日までの日数およびその間に回帰した発情期の回数を求めた.なお,交配前期間中の死亡により,交配開始時に160 mg/kg投与群において雄動物が1例不足したため,これと交配を予定していた雌動物については交配開始日を投与17日に延期して,同群内の既に交尾が確認されている雄動物と交配させた.
分娩の確認は,妊娠20日から妊娠25日までの9-11時に行い,腟からの出血あるいは受胎産物の娩出といった分娩徴候の有無を観察した.分娩の直接観察が可能な例については分娩状態を観察した.直接観察ができなかった例については,分娩完了後の一般状態から分娩困難の有無を判断して記録した.
分娩完了を確認した日を分娩日とし,それを哺育0日と規定して,分娩を確認した全例について,妊娠期間(妊娠0日-分娩日の日数)を算定し,出産率[(生児出産雌数/妊娠動物数)×100]を各群について求めた.また,哺育1日から毎日,哺育状態を観察した.
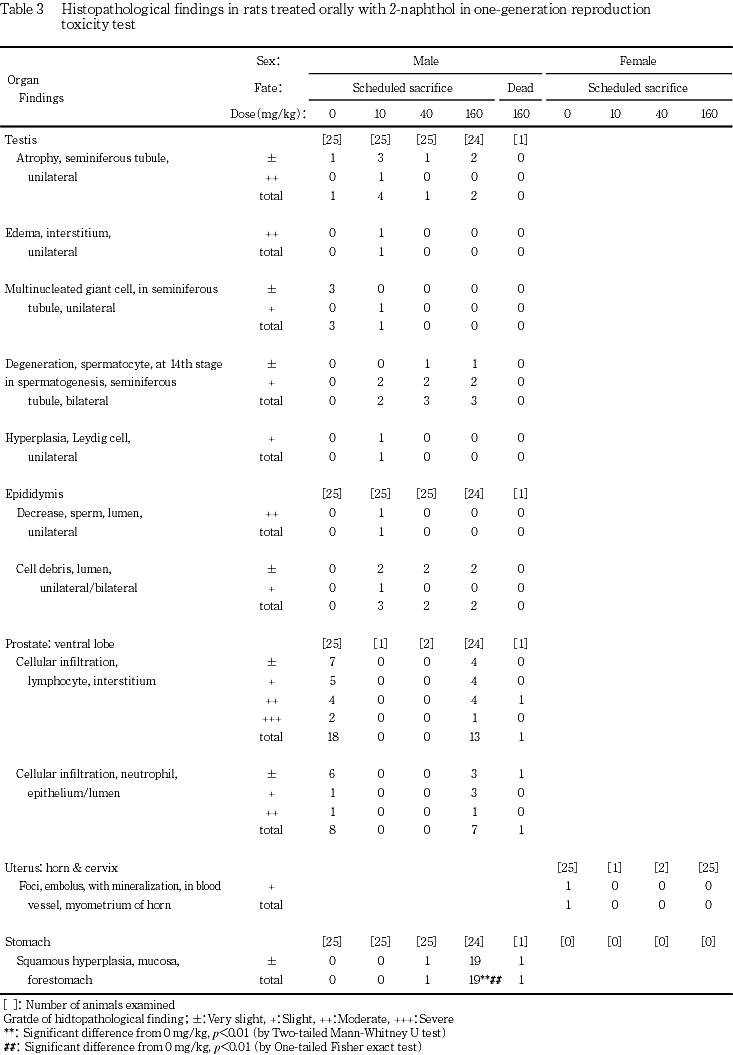
投与98日まで生存した動物は,その翌日に全例をペントバルビタールナトリウム麻酔下で放血・致死させて剖検した(定期解剖).剖検では,胸腹部主要器官の異常の有無を肉眼的に確認し,異常が観察された組織は,0.1 Mリン酸緩衝10 vol%ホルマリン溶液で固定して保存した.また,下垂体,胃,精巣,精巣上体,凝固腺,精嚢,前立腺,ならびに死亡例で異常の観察された肝臓を摘出し,異常の有無を肉眼的に確認した後,精巣および精巣上体はブアン液で固定し(長期保存は0.1 Mリン酸緩衝10 vol%ホルマリン溶液),その他は0.1 Mリン酸緩衝10 vol%ホルマリン溶液で固定して保存した.これらのうち,異常の認められた組織については常法に従ってパラフィン切片とし,ヘマトキシリン-エオジン染色を行って病理組織標本を作製して検査した.また,全例について下垂体,肝臓,胃,精巣,精巣上体,精嚢,前立腺腹葉および凝固腺の病理組織標本を作製し,肝臓については,肉眼的に異常の観察された動物について,その他の器官は対照群および高用量群の全例,ならびに中および低用量群において交尾した雌が妊娠しなかった例について検査した.さらに,高用量群の精巣および胃に,対照群では認められなかった変化が観察されたため,精巣,精巣上体および胃については中および低用量群の残りの例についても追加観察した.
同腹生児数の調整により生じた余剰児は,エーテルを吸入させて致死させた後,剖検し,10 vol%ホルマリン液に固定して保存した.
生存児は,全例を生後21日にエーテル吸入により致死させて剖検した.その際,異常が認められた器官は0.1 Mリン酸緩衝10 vol%ホルマリン溶液に固定して保存した.
生存例では,被験物質各投与群に流涎が認められた.10 mg/kg投与群では,流涎は投与初期の1例に1回だけ観察された.しかし,40 mg/kg以上の投与群では例数および頻度も増加し,160 mg/kg投与群ではほぼ全例に,投与全期間に亘って観察された.この他,投与後一過性に観察された変化としては,40 mg/kg以上の投与群に,自発運動の減少,眼瞼下垂あるいは閉眼,および鼻汁が,160 mg/kg投与群に流涙が,それぞれ認められた.160 mg/kg投与群では,糞便の小型化あるいは黒色軟便の排泄も1例ずつ一時的に認められた.被験物質の用量とは関連なく観察された変化としては,40 mg/kg投与群を除く各群に脱毛が,また,10 mg/kgおよび40 mg/kg投与群に痂皮形成が観察された.これらの所見の他に,40 mg/kg投与群の1例に上切歯の破損が一時的に認められ,他の1例に上顎の位置異常が投与91日から剖検に至るまで認められた.
雌では,いずれの投与群の動物にも死亡および瀕死屠殺例はなかった.投与に関連した所見としては,40 mg/kg以上の投与群に自発運動の減少および流涎が投与後一過性に観察された.これらの変化は,40 mg/kg投与群では投与初期のみに認められたが,160 mg/kg投与群では哺育期間も含む全期間に亘り観察され,その頻度も用量に依存して増加した.また,40 mg/kg投与群では鼻汁が,160 mg/kg投与群では,寄りかかりや腹臥位も,それぞれ投与初期に観察された.160 mg/kg投与群には認められなかったが,40 mg/kg投与群の投与初期に鼻汁が投与後一過性に観察された.これらの所見の他に,分娩後に観察された変化としては,40 mg/kg投与群の哺育6-7日に削痩が1例認められた.また,分娩日に全産児が死亡した160 mg/kg投与群の1例では,その日に異常呼吸音および外陰部の被毛汚染が認められ,その後,被毛汚染は腹部にまで及び,削痩も認められたが,回復した.被験物質の用量とは関連なく観察された所見としては,脱毛が全ての投与群に少数例ずつ認められ,会陰部の裂傷が,交配を開始した40 mg/kg投与群の1例に認められた.
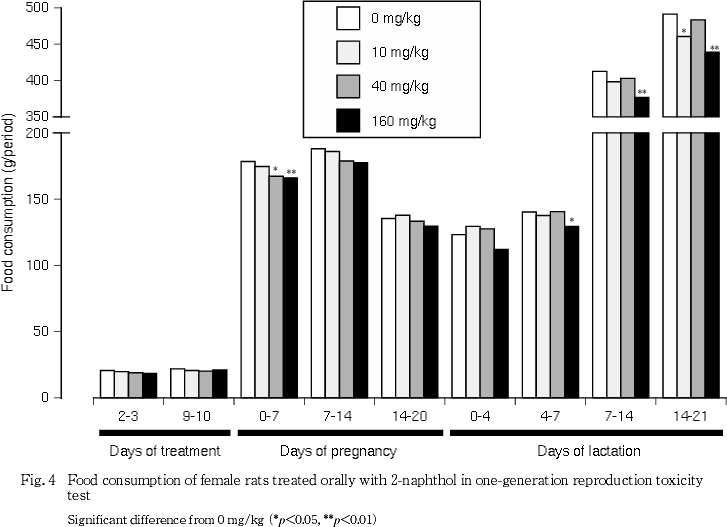
雌では,交配前および妊娠期の体重,ならびに交配前の期間の摂餌量については対照群と被験物質各投与群との間に有意差は認められなかった.分娩後の体重については,160 mg/kg投与群において,哺育4日までの増加抑制傾向が認められたが,対照群との間に有意差は認められなかった.一方,妊娠期以降の摂餌量については,40 mg/kg以上の投与群において,妊娠0-7日の値が,また,哺育期は160 mg/kg投与群において哺育4-21日の間における各期間の値が,それぞれ対照群と比較して有意(p<0.05, p<0.01)に低い値を示した.これらの他に,10 mg/kg投与群において哺育14-21日の値が対照群と比較して有意(p<0.05)に低い値を示した.

哺育状態については,生存産児の形態観察(後述)から,10 mg/kg投与群および160 mg/kg投与群の各1例は,生存児に対して外傷を与えたものと判断された.また,160 mg/kg投与群の1例は,生後1日に児を集めるといった哺育行動が認められなくなり,翌日全出生児が死亡した.その他の動物に異常は認められなかった.
定期解剖例では,40 mg/kgおよび160 mg/kg投与群の各1例に前胃粘膜の肥厚領域が観察され,160 mg/kg投与群の2例には肝臓に腫大が観察された.被験物質の用量とは関連なく観察された変化としては,対照群では,腎臓の片側性小型化および腎盂の片側性拡張が各1例に認められた.40 mg/kg投与群では,肝臓の淡色化を伴う分葉異常,腎臓の両側性小型化および淡色化,脾臓の淡色化を伴う腫大,副腎の腫大,ならびに脳,肺および大腿骨骨髄の淡色化が1例に認められ,肝臓の暗色化あるいは腎盂の片側性拡張が各1例に認められた.腎盂の片側性拡張は,160 mg/kg投与群にも1例観察された.生殖器官には被験物質の用量に依存した変化は認められず,10 mg/kg投与群では1例(妊孕性確認例)に精巣および精巣上体の片側性の小型化が観察された.40 mg/kg投与群では,精巣および精巣上体の両側性の小型化が2例に観察されたが,妊孕性が確認されなかったのは,これらのうちの1例のみであった.また,40 mg/kg投与群では,これらとは別の1例(妊孕性確認例)に精巣,精巣上体,前立腺および精嚢の淡色化,ならびに精巣上体の両側性小型化が観察されたが,160 mg/kg投与群の生殖器官に異常は認められなかった.
定期解剖例の各器官および組織に認められた所見を以下に示す.
(下垂体)
異常は観察されなかった.
(精巣および精巣上体)
妊孕性が確認されなかった例については,40 mg/kg および160 mg/kg投与群の各1例に,精子形成サイクルにおける第14期の段階にある精細管に限局して精母細胞の軽度な変性が観察され,40 mg/kg投与群の例には精巣上体の管腔内には細胞残屑が観察された.その他の例に異常は観察されなかった.
妊孕性が確認された例についても,第14期の段階にある精細管に限局した精細胞の変性が被験物質各投与群に少数例ずつ観察され,これらの例の多くに精巣上体の管腔内に細胞残屑が観察された.しかし,これらの所見については,対照群と被験物質各投与群との間に有意差は認められなかった.この他,片側性の精細管萎縮が対照群を含む各群に認められ,他の例と比較して多くの精細管に萎縮が認められた10 mg/kg投与群の1例の精巣には,間質に水腫およびライディッヒ細胞の過形成も認められ,精細管には多核巨細胞が認められた他,精巣上体にみられる精子は少なく,管腔内には細胞残屑が観察された.
(精嚢)
異常は観察されなかった.
(前立腺腹葉)
妊孕性が確認されなかった例については,160 mg/kg投与群の2例中1例の間質に軽度なリンパ球浸潤が観察されたが,その他の投与群の例に異常は認められなかった.
妊孕性が確認された例においても,対照群および160 mg/kg投与群の間質にリンパ球浸潤が観察され,浸潤の程度が強かった例では,上皮および管腔内への好中球浸潤も観察された.
(凝固腺)
異常は観察されなかった.
(胃)
40 mg/kg以上の投与群の前胃粘膜に扁平上皮の過形成が認められ,160 mg/kg投与群では,対照群と比較して頻度および程度ともに対照群との間に有意差(p<0.01)が認められた.
(剖検時異常器官)
対照群では,片側性小型化の観察された腎臓については,皮質には好塩基性の尿細管が認められ,皮質および髄質には円柱が認められた.また,腎盂の片側性拡張が観察された腎臓についてはeosinophilic bodyが認められた.
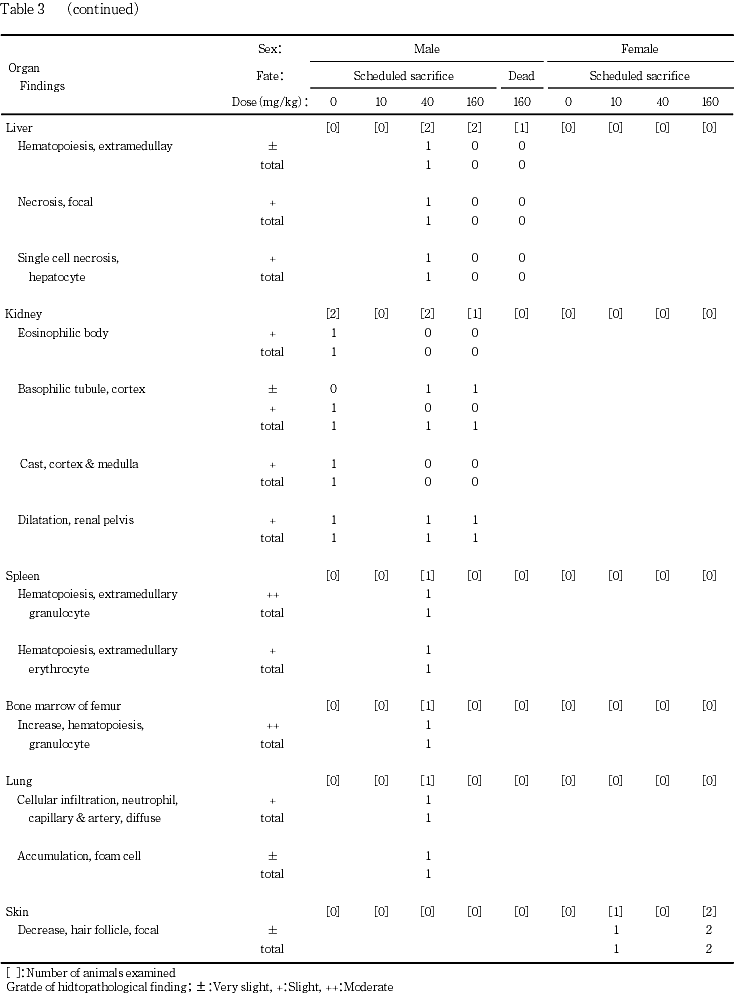
40 mg/kg投与群では,暗色化の認められた肝臓に異常は観察されなかった.肝臓の淡色化を伴う分葉異常,腎臓の両側性小型化および淡色化,脾臓の淡色化を伴う腫大,副腎の腫大,ならびに脳,肺および大腿骨骨髄の淡色化が認められた例では,肝臓に限局性壊死および肝細胞の単一細胞壊死および髄外造血が認められたが,脾臓には赤血球の髄外造血以外に,顆粒球産生の顕著な亢進が認められ,骨髄でも顆粒球産生の亢進が認められた.また,この例の肺には泡沫細胞の集簇,動脈および毛細血管の瀰漫性の好中球浸潤が認められ,腎皮質には好塩基性尿細管が観察されたが,脳および副腎に異常は認められなかった.腎盂の拡張が観察された例の腎臓にはその他の所見は認められなかった.
160 mg/kg投与群では,腫大が認められた例の肝臓に異常は観察されなかった.片側の腎盂に拡張が観察された例の腎臓については,皮質に好塩基性尿細管も観察された.
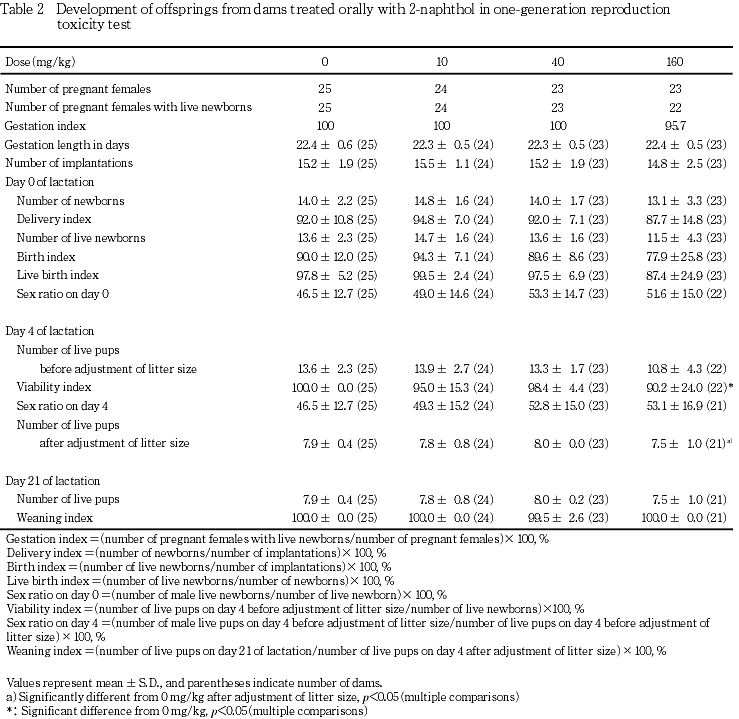
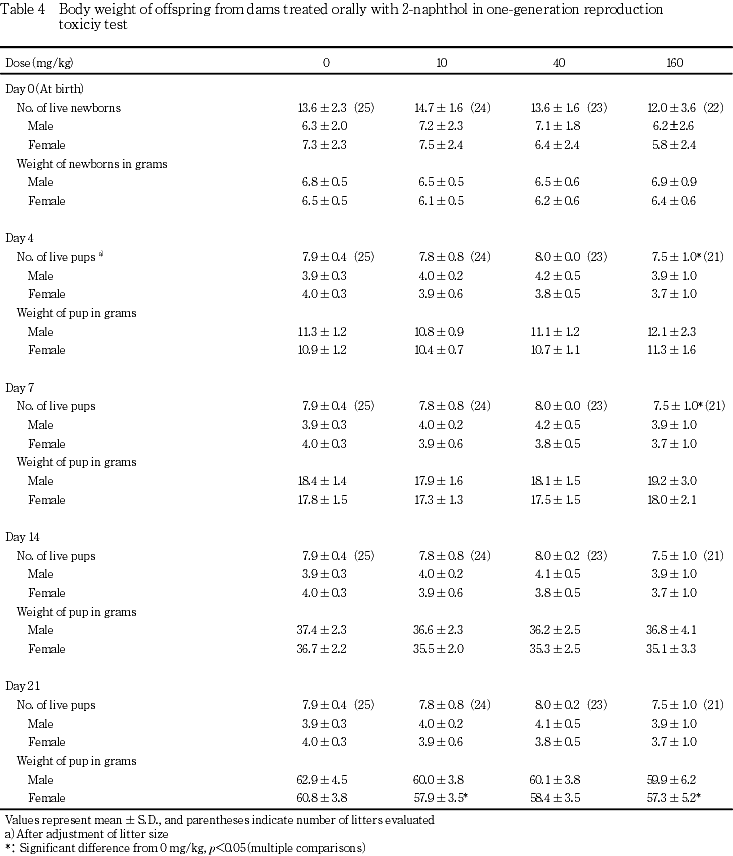
生存性については,出生日に発見された死亡児は,対照群および10 mg/kg投与群ではそれぞれ,4および2例全例が死産と判定された.また,40 mg/kg投与群では6例中3例,160 mg/kg投与群では27例中22例が死産と判定された.これら死産児の頻度については,対照群と被験物質各投与群との間で有意差は認められなかった.また,40 mg/kgまでの投与群については,産児数,分娩率,出生日ならびに生後4および21日における生存児数,生児出産率,出生率,新生児の4日の生存率のいずれも,対照群と同様の値を示した.しかし,160 mg/kg投与群については,出生日から生後4日までの間に死亡する産児が若干増加し,対照群との間に有意差は認められなかったが,出産生児数および生後4日の生児数が減少し,生児出産率および出生率が低値の傾向を示した.さらに,新生児の4日の生存率については対照群との間に有意差(p<0.05)が認められ,同腹生児数を調整してもリッターサイズは対照群と比較して有意(p<0.05)な低値を示した.しかし,各時期の性比および離乳率については対照群と被験物質各投与群との間で著差は認められなかった.
雌については,10 mg/kgおよび160 mg/kg投与群において,生後21日における体重が対照群と比較して有意(p<0.05)に低い値を示した.40 mg/kg投与群についてはいずれの時期も対照群との間に有意差は認められなかった.
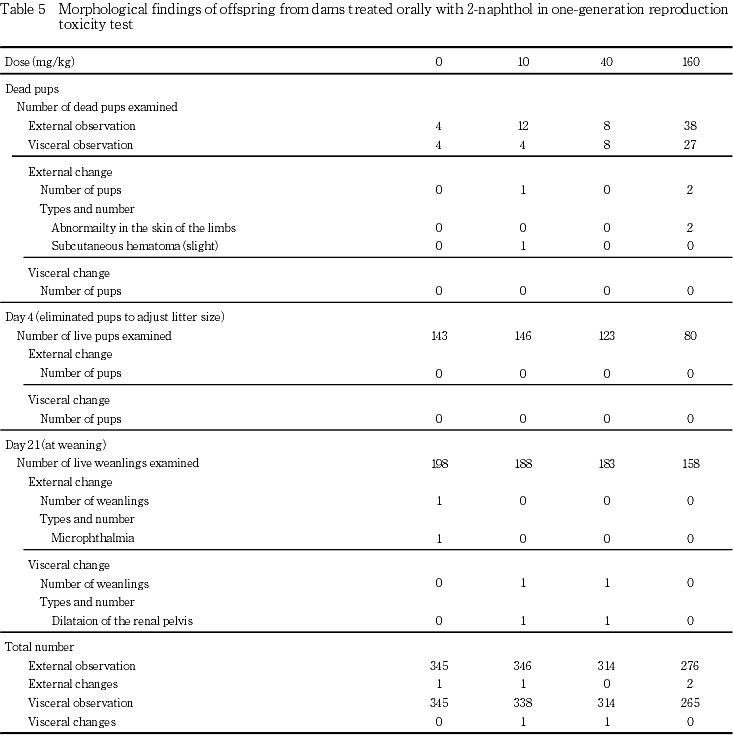
出生児の剖検では,対照群を含む各群の各1-2腹の出生児に奇形および変異を含む形態変化が観察された.外表の変化としては,対照群の1腹に小眼が,10 mg/kg 投与群の1腹に軽度な皮下血腫が,160 mg/kg投与群の1腹に皮膚が剥離して下垂しているのが観察された.これらのうち,奇形に分類されたのは,対照群の小眼のみであった.内臓の変化としては,内臓変異のひとつである腎盂の拡張が,10 mg/kgおよび40 mg/kg投与群の各1腹に観察された.剖検した出生児についてこれらの形態変化を認めた出生児の総数を求め,その頻度を比較した結果,外表に関しても内臓に関しても対照群と被験物質各投与群との間で有意差は認められなかった.
体重増加および摂餌量については,雄では投与の影響は認められなかった.しかし雌については,妊娠初期あるいは哺育期間中の摂餌量が40 mg/kg以上の投与群において低下し,さらに160 mg/kg投与群では,哺育初期の体重増加も若干抑制を受けた.雌では,10 mg/kg投与群の哺育14-21日の摂餌量にも対照群との間に有意差が認められたが,哺育期における40 mg/kg投与群の摂餌量には抑制は認められなかったことから,これについては偶発的変化であると判断された.
生殖器官の病理学検査では,被験物質各投与群の雄の精巣に,第14期の精子形成段階にある精細管に限局して精母細胞の変性が認められた.しかし,これは本試験に用いた系統で自然発生性に認められる変化であり,発生頻度も低かったことから,自然発生性である可能性が高い.雌の生殖器官については被験物質の用量に依存した変化は認められなかった.また,妊孕性の確認されなかった雌雄の生殖器官には,その原因と推測される所見は認められなかった.生殖器官以外の病理学検査では,予備試験において認められた胃辺縁部の粘膜肥厚と同一の所見である前胃粘膜の肥厚領域が,各1例ではあったが40 mg/kgおよび160 mg/kg投与群の雄動物に観察され,病理組織学検査においても40 mg/kg以上の投与群の雄に前胃粘膜扁平上皮の過形成が観察された.2-ナフトールには刺激性のあること10)から,雄では,40 mg/kg以上の投与量により胃粘膜が長期に亘り刺激されて,前胃粘膜扁平上皮に過形成が生じたものと考えられる.40 mg/kg投与群および160 mg/kg投与群の少数例に肝臓の腫大が観察されたが,関連した組織変化は観察されなかったことから,投与による影響ではないと判断された.その他の所見には被験物質の影響は認められなかった.雌については,いずれの組織にも投与の影響は認められなかった.
生殖能力に関しては性周期および交配成績に投与の影響は認められなかった.出産率,妊娠期間および着床数にも投与の影響は認められなかったが,分娩状態が不良であった例が40 mg/kgおよび160 mg/kg投与群に1例ずつ認められた.これらのうち,40 mg/kg投与群の例は,回復して哺育状態に異常は認められなかったが,160 mg/kg投与群では全産児が死亡していた.また,160 mg/kg投与群では,哺育4日までに新生児が死亡する例が多かった.160 mg/kg投与群では,分娩および哺育期間中にも投与後一過性の流涎が認められていること,哺育期間中に摂餌量の抑制が認められ,哺育初期には体重増加抑制の傾向も認められたことから,被験物質の投与が母動物の全身状態に影響を及ぼし,死亡する出生児がやや増加したものと推測される.これらのことから,2-ナフトールの生殖能力に対する無作用量は,雄では160 mg/kgであり,雌では40 mg/kgであると推定される.
生存性については,前述のように160 mg/kg投与群において死亡する動物がやや増加した.生存性を示す各種の指標のうち,特に,新生児期における死亡が増加する傾向を示した.出生時の体重は対照群と同等であったことから子宮内における発育抑制はなかったものと考えられる.また,新生児期の発育不良も認められなかった.形態に関しても,形態の変化は被験物質用量とは無関係に認められており,変化の認められた児の出現頻度にも対照群と各投与群との間で有意差は認められなかったことから,出生児の形態に影響を及ぼしていないものと考えられる.これらのことから,新生児期における死亡の若干の増加は,被験物質の出生児に対する直接的影響の可能性も考えられるが,母動物の哺育活動が生存にとって必須である新生児期に,投与によって母動物に自発運動の減少などの軽度な催眠作用が現れて母性行動が若干抑制されたことによる変化であると推測される.
10 mg/kgおよび160 mg/kg投与群において,生後21日における雌の出生児体重がやや低い値を示した.40 mg/kg投与群の体重については対照群との間に有意差が認められなかったことから,10 mg/kg投与群については,出生時の体重が若干低かったことなどによる偶発的変化であると判断された.一方,160 mg/kg投与群については,出生日における体重は対照群と同様であったこと,各腹ごとの出生児の生存性と生後21日における体重について,特に関連性が認められなかったことから,成長の抑制があったものと推測された.雄については,いずれの時期も対照群との間に有意差は認められなかった.しかし,雌と同様に生後21日の体重が若干低値を示していた.さらに,2-ナフトールと構造の類似した2-ヒドロキシ-3-ナフトエ酸の一世代生殖毒性試験11)においても,出生児の体重増加抑制が認められている.これらのことから,160 mg/kgの2-ナフトールは出生児の発育を若干抑制するものと考えられた.
| 1) | 吉村功,“毒性・薬効デ-タの統計解析(吉村功編),”サイエンティスト社,東京,1977. |
| 2) | 丹後俊郎,“医学への統計学(古川俊之監修),”朝倉書店,東京,1985. |
| 3) | 石居進,“生物統計学入門,”培風館,東京,1992. |
| 4) | 佐久間昭,“薬効評価-計画と解析,”東京大学出版会,東京,1977. |
| 5) | C. W. Dunnett, Biometrics, 20, 482(1964). |
| 6) | W. H. Kruskal, W. A. Wallis, J. Amer. Statist. Assoc., 47, 583(1952). |
| 7) | 2-Naphtol.(6304.), “The Merck Index, an Encyclopedia of Chemicals, Drugs, and Biologicals,” 11, eds. by S. Budavari, M. J. O' Neil, Merck & Co., Inc., Rahway 1989, p.1010. |
| 8) | Labor Hygiene and Occupational Pathology in the Estonian SSR, 8, 145(1972). |
| 9) | A. Risi, Naunyn-Schmiedeberg's Archiv fuer Experimentelle Pathologie und Pharmakol., 186, 195 (1937). |
| 10) | BIOFAX Industrial Bio-Test Laboratories, Inc., Data Sheets, 26-4(1973). |
| 11) | 代田眞理子,「2-ヒドロキシ-3-ナフトエ酸のラットを用いる経口投与一世代生殖毒性試験」試験報告書(食薬セ研第10-1636号)(未公刊). |
| 連絡先 | |||
| 試験責任者: | 代田眞理子 | ||
| 試験担当者: | 佐藤昌子,田子和美,関 誠 | ||
| (財)食品薬品安全センター 秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Mariko Shirota(Study director) Masako Sato, Kazumi Tago, Makoto Seki | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai, Hadano-shi, Kanagawa 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||