ケイ酸四ナトリウム塩 水和物のチャイニーズ・ハムスター肺由来細胞(CHL/IU細胞)を用いる染色体異常試験を実施した.
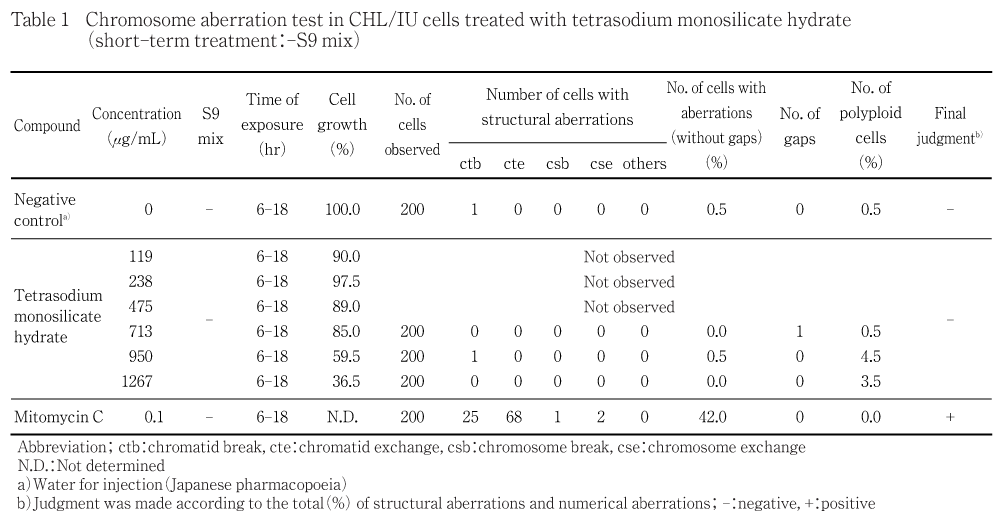
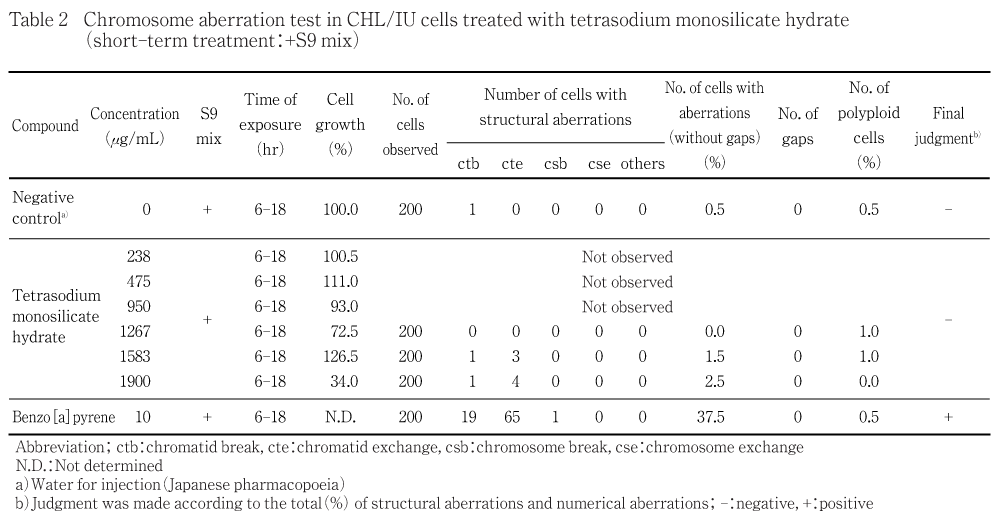
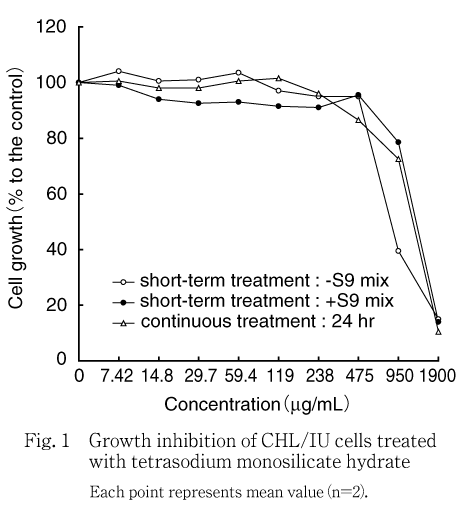
細胞増殖抑制試験の結果,50 %細胞増殖抑制濃度は短時間処理法のS9 mix非存在下が947 μg/mL,S9 mix存在下が1290 μg/mL,連続処理法(24時間処理)が1222 μg/mLであった.
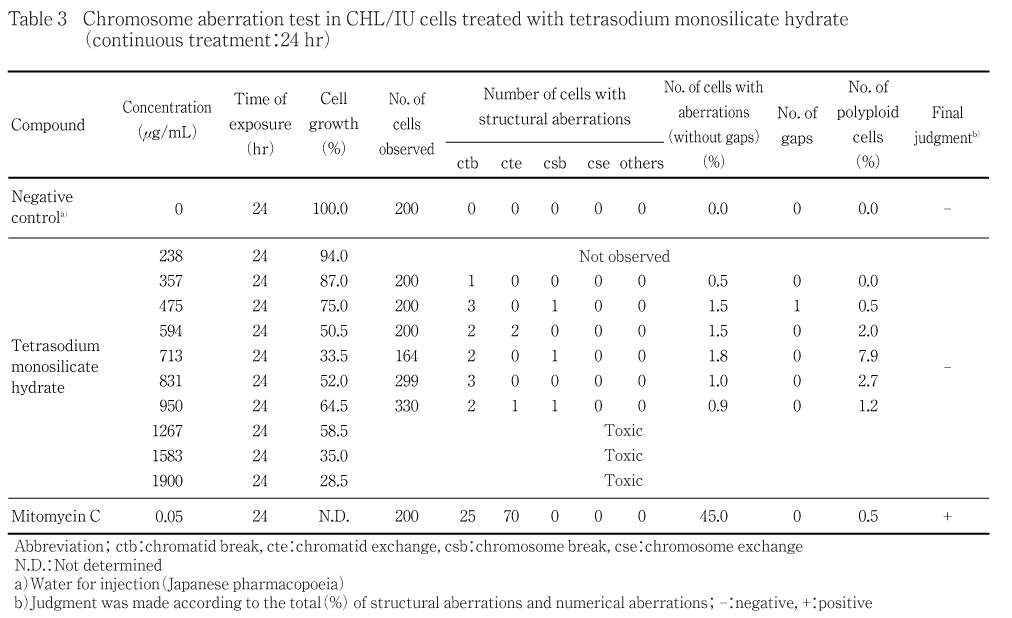
染色体異常試験は,各系列において1267 μg/mLあるいは1900 μg/mL(10 mM相当値)を最高用量とする6試験群で実施した.なお,連続処理法では細胞増殖抑制が軽度である用量においても分裂中期像が少なく,評価可能な3用量を得ることができなかったことから,用量間隔を狭めた再試験を2回(8および10試験群)実施した.
短時間処理法では,S9 mixの非存在下および存在下ともに被験物質処理群の染色体の構造異常ならびに倍数性異常の出現頻度は5 %未満であった.連続処理法では,被験物質処理群の染色体の構造異常の出現頻度は5 %未満であったが,倍数性異常の出現頻度は713 μg/mLの用量において7.9 %と軽度の増加がみられた.しかし,狭い用量間隔で設定した前後の用量では増加はみられず,用量との関連性もみられないことから結果は陰性と判断した.
以上の結果から,ケイ酸四ナトリウム塩 水和物は,本試験条件下において染色体異常を誘発しないと判断した.
ケイ酸四ナトリウム塩 水和物は白色固体で,水に溶解しアルカリ性(2 %溶液のpHは13前後)を示す.被験物質は,日本化学工業(東京)よりロット番号 30922(純度90.4 %)が提供され,冷暗所,密閉の条件で保存した.また,被験物質は実験期間中安定であったことが被験物質提供者において確認された.
被験物質は用時調製して試験に用いた.溶媒として日本薬局方注射用水(大塚製薬工場)を用い原液を調製し,さらに原液を溶媒で順次希釈して所定濃度の被験物質調製液を調製した.被験物質調製液は,全ての試験において培養液の10 vol%になるように加えた.なお,被験物質調製時に変色,発熱,発泡はみられなかった.
チャイニーズ・ハムスター肺由来のCHL/IU細胞を,大日本製薬から入手(1999年2月)した.細胞は凍結保存し,試験に際して解凍および継代を行い,継代数19を使用した.
非働化した牛胎児血清(GIBCO)を最終調製量の10 %になるように加えたイーグルMEM培地(日水製薬)を使用した.調製後の培養液は冷蔵で保存した.
2あるいは3×10^4 cells/5 mLのCHL/IU細胞を培養プレート(径6 cm,Becton Dickinson)に播き,5.0 %CO2,37.0℃に設定したCO2インキュベーターで培養した.
短時間処理法では,細胞播種3日後に被験物質調製液を混和した培養液と交換し,S9 mix非存在下および存在下で6時間処理し,処理終了後,さらに新鮮培地で18時間培養した.連続処理法では,細胞播種3日後に被験物質調製液を混和した培養液と交換し,24時間処理した.
S9 mix(キッコーマン)は,フェノバルビタールおよび5,6-ベンゾフラボンを投与したSprague-Dawley系ラット(雄,7週齢)の肝ホモジネートより調製されたものを購入し,製造後6カ月以内に使用した.添加量は培養液に対し5 vol%とした.
染色体異常試験に用いる被験物質の処理濃度を決定するため,被験物質の細胞増殖におよぼす影響を調べた.被験物質の細胞増殖抑制作用は,単層培養細胞密度測定装置(東洋測器)を用いて測定し,陰性対照群に対する割合を持って指標とした.
被験物質は,各系列ともに10 mM相当値の1900 μg/mLを最高濃度とし,以下公比2で低下させた計9用量を処理した.その結果,50 %細胞増殖抑制濃度は短時間処理法のS9 mix非存在下で947 μg/mL,S9 mix存在下で1290 μg/mL,連続処理法の24時間処理で1222 μg/mLであった(Fig. 1).なお,細胞増殖抑制が認められた用量の培養液の処理開始時のpHは全て12以上であった.

細胞増殖抑制試験の結果に基づき,各系列において1267 μg/mLあるいは1900 μg/mLを最高用量とする計6試験群を設定した.連続処理法の24時間処理では,細胞増殖率が50 %以上の用量においても分裂中期細胞が少なく評価可能な3用量を得ることができなかったことから,用量間隔を狭めた8試験群による再試験を設定し,さらに用量間隔を狭めた10試験群による2回目の再試験を設定した.染色体異常誘発性は2回目の再試験で得られた標本を用いて評価した.
陽性対照として,短時間処理法のS9 mix存在下ではベンゾ〔a〕ピレン(和光純薬工業)の10 μg/mL,S9 mix非存在下ではマイトマイシンC(協和発酵工業)の0.1 μg/ mL,連続処理法ではマイトマイシンCの0.05 μg/mLの濃度を用いた.
陽性対照群を除く各群には細胞増殖抑制計測用の2枚を加えた4枚のプレートを使用し,陽性対照群では2枚のプレートを使用した.
培養終了の約2時間前に,コルセミドを最終濃度が2 μg/mLとなるように培養液に加えた.染色体標本の作製は常法に従って行った.スライド標本は,各プレートより1枚(細胞毒性により得られた細胞数が少ない場合)あるいは2枚を作製し,2 vol%ギムザ溶液で20分間染色した.
標本観察の前に各用量の各プレートにつき1枚あるいは2枚(分裂中期像が少ない場合)の標本を選択してブラインド化した.
染色体の分析は,日本環境変異原学会・哺乳動物試験分科会(MMS)による分類法 1)に基づいて行い,ギャップ(gap),染色分体型切断(ctb),染色分体型交換(cte),染色体型切断(csb),染色体型交換(cse)およびその他の異常など構造異常の種類ならびに異常を持つ細胞の数を記録した.ギャップは構造異常には含めなかった.同時に倍数性異常の数も記録した.
各用量あたり200個(1プレートあたり100個)の分裂中期像について観察を行った.なお,1枚の分裂中期像が100個に満たない標本では,観察可能な数を観察した.
構造異常または倍数性異常のtotalの出現率(%)が10 %以上となり,その出現様式に用量依存性がみられる場合,あるいは5 %以上の出現率について再現性がみられる場合を陽性,それ以外を陰性とした.なお,統計学的手法による検定は実施しなかった.
短時間処理法の結果をTable 1および2に,連続処理法の結果をTable 3に示す.被験物質処理群における染色体の構造異常および倍数性異常の出現頻度は,短時間処理法ではS9 mix非存在下および存在下ともに5 %未満であった.連続処理法では,染色体の構造異常の出現頻度は5 %未満であったが,倍数性異常の出現頻度は713 μg/mLの用量で7.9 %と軽度の増加がみられた.しかし,公比が1.17あるいは1.20となる狭い用量間隔で設定した前後の用量では増加はみられず,用量との関連性もみられないことから結果は陰性と判断した.なお,各系列とも細胞増殖抑制が認められた用量の培養液の処理開始時のpHは全て12以上で,用量の増加に伴うpHの上昇と細胞増殖率の低下が認められた.
以上の結果から,ケイ酸四ナトリウム塩 水和物は,本試験条件下において染色体異常を誘発しないと判断した.
なお,当該被験物質は,当施設で実施した細菌を用いる復帰変異試験で陰性の結果が得られている.また,本被験物質と同じ無機ケイ酸塩であるケイ酸カルシウムは,ヒトリンパ球を用いた染色体異常試験 2)および姉妹染色分体交換試験 2)で陽性の結果が,ケイ酸マグネシウム3)およびケイ酸アルミニウムナトリウム3, 4)は,細菌を用いた復帰変異試験で陰性の結果が報告されている.
| 1) | 日本環境変異原学会・哺乳動物試験分科会(編):「化学物質による染色体異常アトラス」朝倉書店,東京(1988)pp. 16-37. |
| 2) | Aslam M et al.:Cytotoxic and genotoxic effects of calcium silicate on human lymphocytes in vitro. Mutation Res, 300:45-48(1993). |
| 3) | Prival MJ et al.: Bacterial mutagenicity testing of 49 food ingredients gives very few positive results. Mutation Res, 260:321-329(1991). |
| 4) | Zeiger E et al.: Salmonella mutagenicity tests: III. Results from the testing of 255 chemicals. Environ Mol Mutagen, 9:1-110(1987). |
| 連絡先 | |||
| 試験責任者: | 河村公太郎 | ||
| 試験担当者: | 二平佳苗,小森絵美,榊原隆史 | ||
| (株)化合物安全性研究所 | |||
| 〒004-0839 札幌市清田区真栄363番24 | |||
| Tel 011-885-5031 | Fax 011-885-5313 | ||
| Correspondence | |||
| Authors: | Khotaro Kawamura (Study Director) Kanae Nihei, Emi Komori, Takashi Sakakibara |
||
| Safety Research Institute for Chemical Compounds | |||
| 363-24 Shin-ei Kiyota-ku, Sapporo-shi, 004-0839, Japan | |||
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | ||