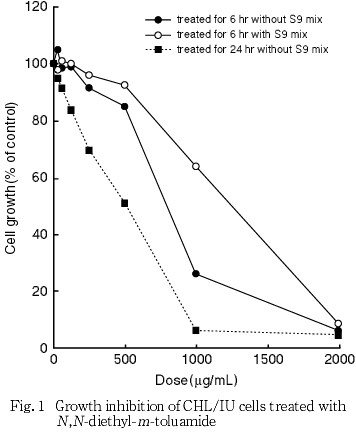
染色体異常試験に用いる用量を決定するため,短時間処理法および連続処理法ともに 31.25〜2000 μg/mLの範囲で細胞増殖抑制試験を行った結果,短時間処理法S9 mix非存在下では1000 μg/mL 以上,S9 mix存在下では2000 μg/mL,また,連続処理法では1000 μg/mL 以上で50 %を上回る細胞増殖抑制が認められた.したがって,染色体異常試験における用量は,短時間処理法の場合はS9 mix非存在下では,125,250,500,750および1000 μg/mL,S9 mix存在下では,250,500,1000,1500および2000 μg/mL,連続処理法の場合は62.5,125,250,500,750および1000 μg/mL とした.
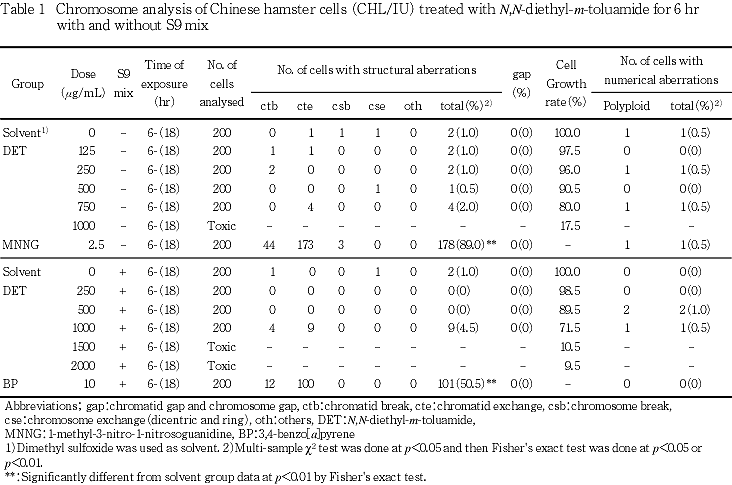
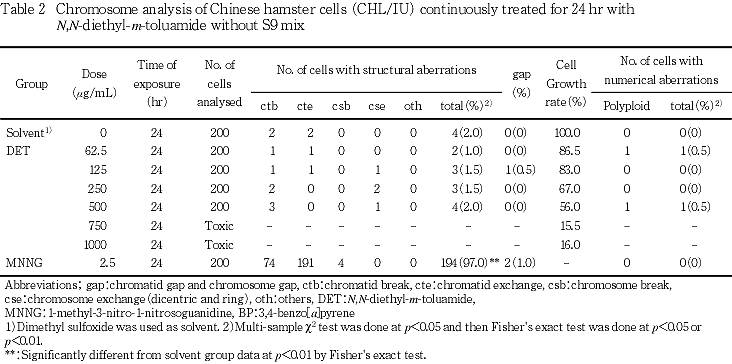
試験の結果,短時間処理法S9 mix 非存在および存在下並びに連続処理法のいずれの場合においても,染色体異常を有する細胞の増加は認められなかった.
以上の成績から,N,N-ジエチル-m-トルアミドのCHL/IU細胞に対する染色体異常誘発性は陰性と判定した.
短時間処理法では,培養開始3日後に被験物質を加えS9 mix非存在および存在下で6時間処理し,処理終了後,新鮮培養液でさらに18時間培養した.連続処理法では,培養開始3日後に被験物質を加え24時間処理した.
実験終了後,残余被験物質を分析した結果,安定性に問題はなかった.
 ,MI-60,オリンパス光学工業)を用いて測定し,溶媒対照群の細胞増殖率を100 %とした時の各用量群の細胞増殖率を求めた.
,MI-60,オリンパス光学工業)を用いて測定し,溶媒対照群の細胞増殖率を100 %とした時の各用量群の細胞増殖率を求めた.
その結果(Fig. 1),短時間処理法の場合,S9 mix非存在下では1000 μg/mL以上,S9 mix存在下では2000 μg/mLで50 %を上回る細胞増殖抑制が認められ,50 %細胞増殖抑制用量はそれぞれ500〜1000 μg/mLおよび1000〜2000 μg/mLの用量域にあると判断した.連続24時間処理では1000 μg/mL以上で50 %を上回る細胞増殖抑制が認められ,500 μg/mL でほぼ50 %細胞増殖抑制が認められた.

陽性対照として,短時間処理法S9 mix存在下では3,4-benzo[a]pyrene(B[a]P, Sigma Chemical)を10 μg/mL,短時間処理法S9 mix非存在下および連続処理法では1-methyl-3-nitro-1-nitrosoguanidine(MNNG,Aldrich Chemical)を2.5 μg/mLの用量で用いた.陽性対照物質の溶媒には,いずれもDMSO使用した.
染色体異常試験では,1用量あたり4枚のディッシュを用いた.このうち2枚で染色体標本を作製し,残りの2枚について単層培養細胞密度計により細胞増殖率を測定した.陽性対照群については細胞増殖率の測定は行わなかった.
染色体構造異常細胞および倍数性細胞の出現頻度について,多試料χ2検定を行い有意差(有意水準5 %以下)が認められた場合は,フィッシャーの直接確率法を用いて溶媒対照群と各用量群との間の有意差検定(有意水準は多重性を考慮して,5 %または1 %を処理群の数で割ったものを用いた)を行った.
その結果,溶媒対照群と比較して,被験物質による染色体異常細胞の出現頻度が2用量以上で有意に増加し,かつ用量依存性あるいは再現性が認められた場合,陽性と判定した.
連続処理法による結果をTable 2に示す.被験物質を加えて24時間処理したいずれの用量群においても,染色体の構造異常および培数性細胞の誘発作用は認められなかった.
なお,短時間処理法S9 mix非存在下の1000 μg/mL,S9 mix存在下の1500 μg/mL以上,連続処理法の750μg/mL以上の用量においては,細胞毒性のため,観察可能な分裂中期像は認められなかった.
したがって,N,N-ジエチル-m-トルアミドの CHL/IU 細胞に対する染色体異常誘発性は陰性と判定した.本試験結果は,CHL/IU 細胞において,染色体異常を有する細胞の出現頻度が5 %未満を陰性とする石館らの判定基準2)からみても,明らかに陰性と判断されるものであった.
N,N-ジエチル-m-トルアミドの変異原性については,S. typhimuriumを用いた復帰突然変異試験で陰性3)と報告されている.発ガン性については,マウス,ラットおよびイヌを用いたがん原性試験でいずれも陰性4)と報告されている.
| 1) | 日本環境変異原学会・哺乳動物試験分科会(編):「化学物質による染色体異常アトラス」朝倉書店,東京(1988)pp.16-37. |
| 2) | 石館 基(監修):「改定増補 染色体異常試験データ集」エル・アイ・シー,東京(1987)p.19. |
| 3) | Zeiger E, Anderson B, Howorth S, Lawlor T, Mortelmans K: Salmonella Mutagenicity Tests, V. Results from the testing of 311 chemicals. Environmental and Molecular Mutagenesis, 19:2-141(1992). |
| 4) | Schoenig GP, Osimitz TG, Gabriel KL, Hartragel R, Gill MW, Goldenthal EL:Evaluation of the chronic toxicity and oncogenicity of N, N-diethyl-m-toluamide(DEET), Toxicological Science, 47:99-109(1999). |
| 連絡先 | |||
| 試験責任者: | 野田 篤 | ||
| 試験担当者: | 野田 篤,昆 尚美 | ||
| (財)畜産生物科学安全研究所 | |||
| 〒229-1132 神奈川県相模原市橋本台3-7-11 | |||
| Tel 042-762-2775 | Fax 042-762-7979 | ||
| Correspondence | ||||
| Authors: | Atsushi Noda(Study director) Naomi Kon | |||
| Research Institute for Animal Science in Biochemistry and Toxicology | ||||
| 3-7-11 Hashimotodai, Sagamihara-shi, kanagawa, 229-1132 Japan | ||||
| Tel +81-42-762-2775 | Fax +81-42-762-7979 | |||