 投与期間終了後解剖動物の8,40および200 mg/kg群ならびに回復期間終了後解剖動物の全群の雌雄の肝臓.
投与期間終了後解剖動物の8,40および200 mg/kg群ならびに回復期間終了後解剖動物の全群の雌雄の肝臓. 投与期間および回復期間終了後解剖動物全群の雌雄の胃および鼻腔.
投与期間および回復期間終了後解剖動物全群の雌雄の胃および鼻腔. 投与期間終了後解剖動物全群の雄の下垂体.
投与期間終了後解剖動物全群の雄の下垂体.
対照群,200および1000 mg/kg群については14日間回復群を設けた.
投与期間中に雌の1000 mg/kg群の1例が自発運動の低下,緩徐呼吸および腹部膨満を示したため,瀕死期殺した.剖検の結果,消化管の膨満,胃境界縁の壁の肥厚,腺胃壁のびらん等が認められた.
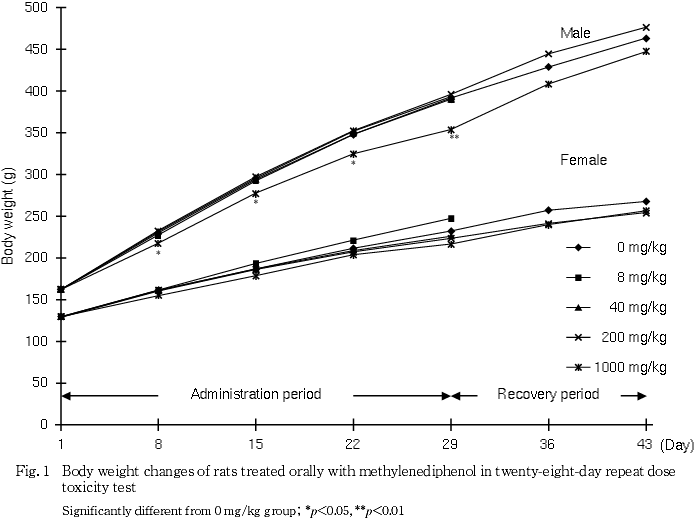
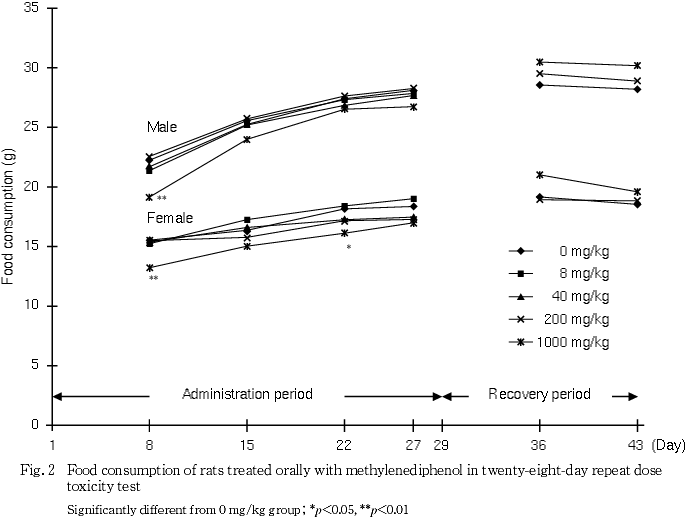
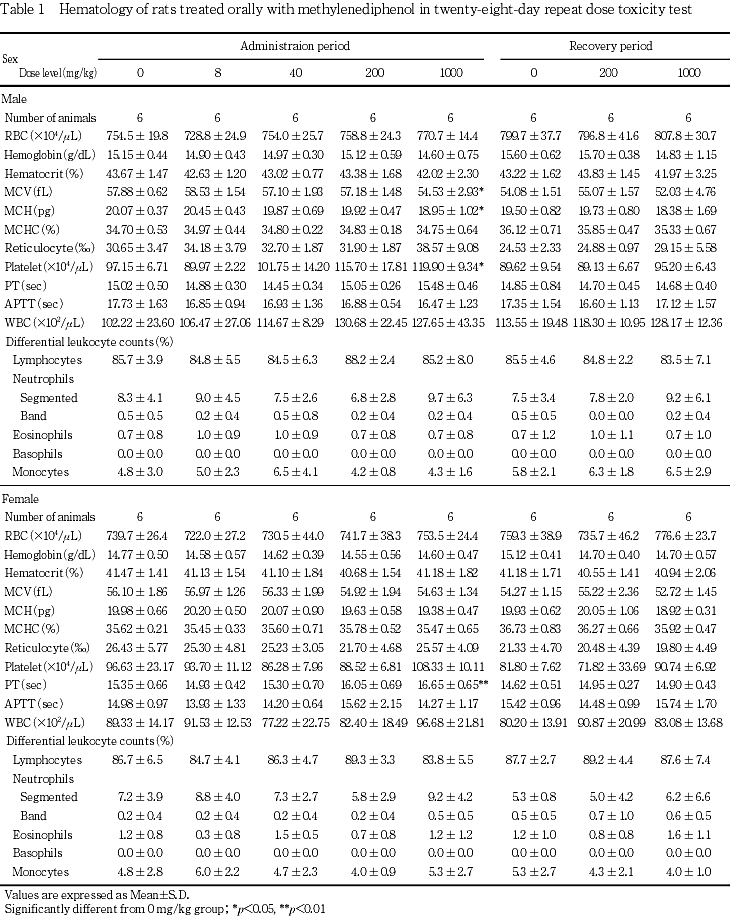
有意な体重の低値が雄の1000 mg/kg群で,有意な摂餌量の低値が雌雄の1000 mg/kg群で,それぞれ投与期間中に認められた.
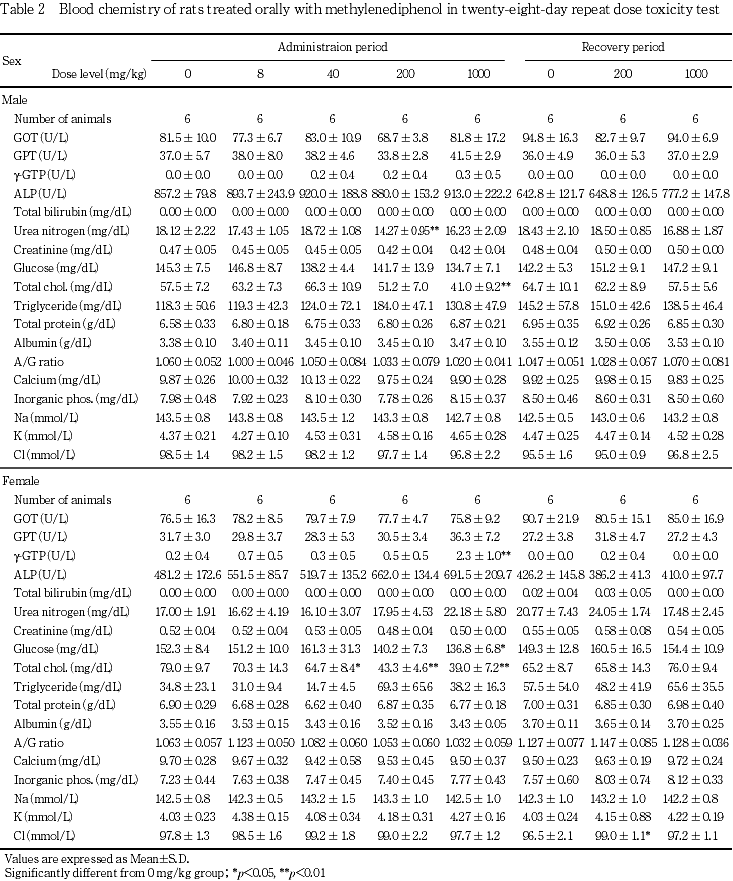
血液生化学検査において,投与期間終了時に雌雄の1000 mg/kg群で総コレステロールの低値と,雌の1000 mg/kg群でグルコースの低値およびgGTの高値,雌の200および40 mg/kg群で総コレステロールの低値が認められた.これらの変化は,回復期間中にはみられなかった.
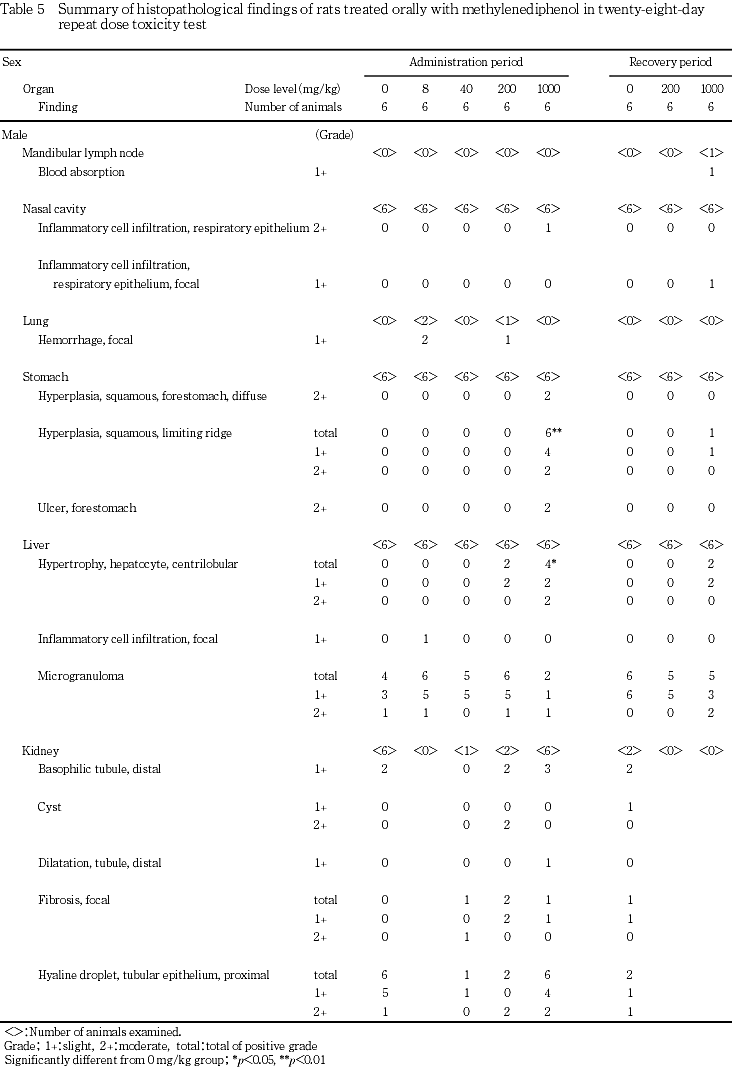
病理学検査で被験物質投与によると思われる変化が胃および肝臓で認められた.
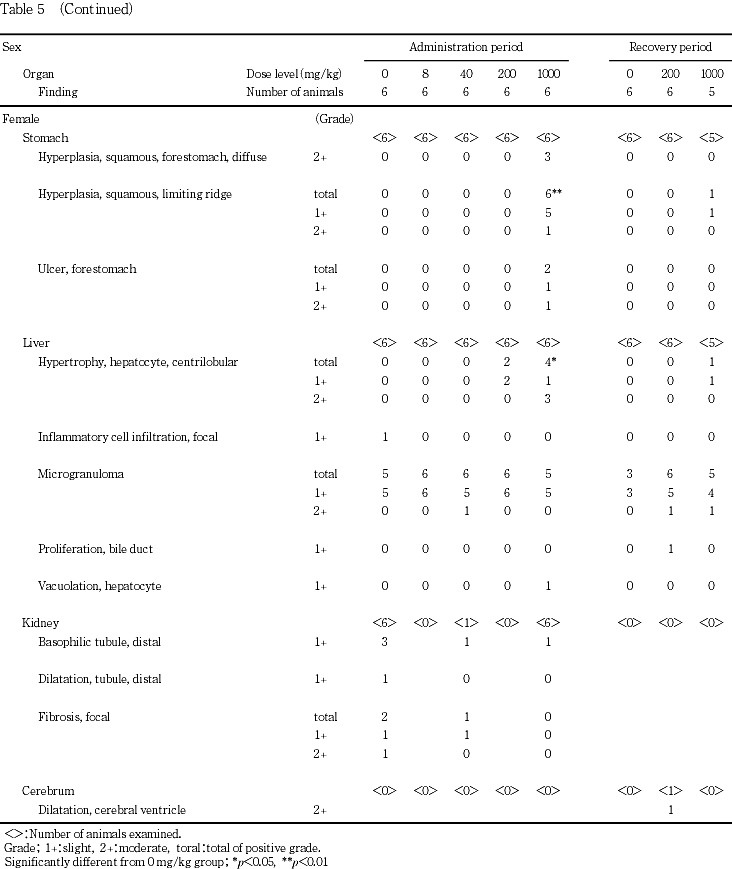
胃では1000 mg/kg群の雌雄で,剖検時に腺胃壁の赤色化,前胃壁の肥厚,境界縁の壁の肥厚が認められた.200 mg/kg群の雌雄では,境界縁の壁の肥厚が認められた.病理組織学検査では前胃の過形成,境界縁の壁の過形成,前胃の潰瘍が1000 mg/kg群の雌雄で認められた.これらの変化は被験物質投与液の消化管粘膜に対する刺激性を示唆するものと考えられた.
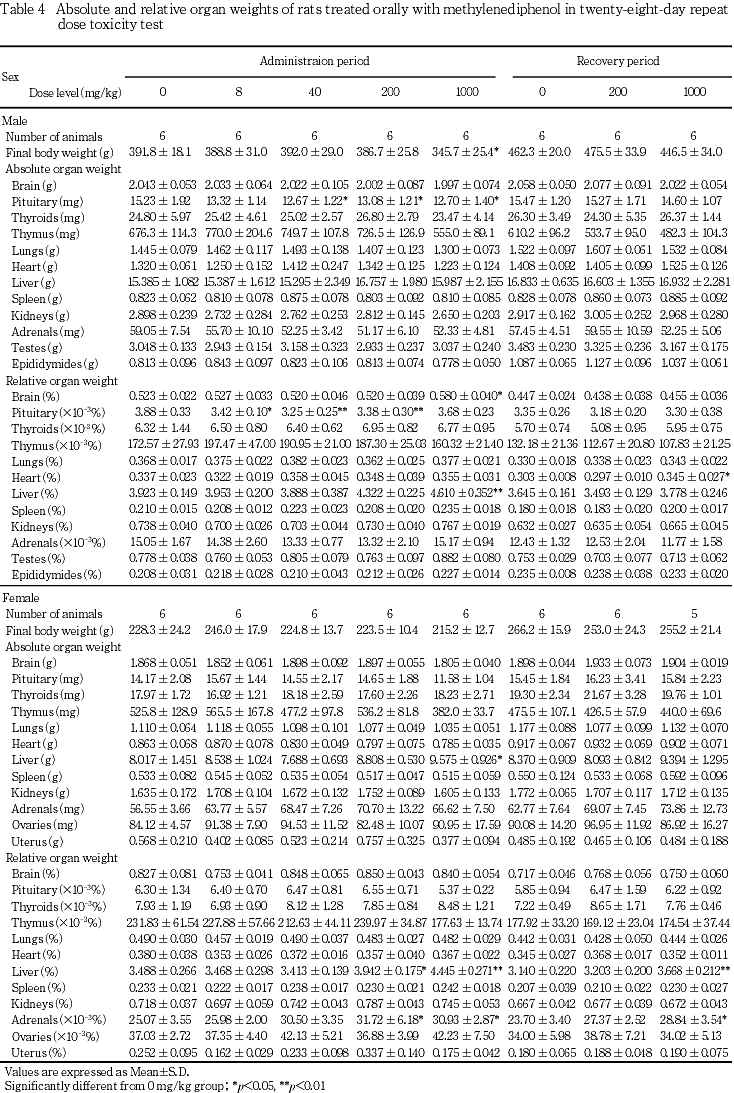
肝臓では病理組織学検査で小葉中心性の肝細胞肥大が雌雄の200および1000 mg/kg群で認められた.器官重量測定でも雌雄の1000 mg/kg群で肝臓重量の高値(絶対重量または相対重量),雌の200 mg/kg群で肝臓重量の高値(相対重量)が認められており,被験物質投与に起因した薬物代謝酵素の誘導が示唆された.
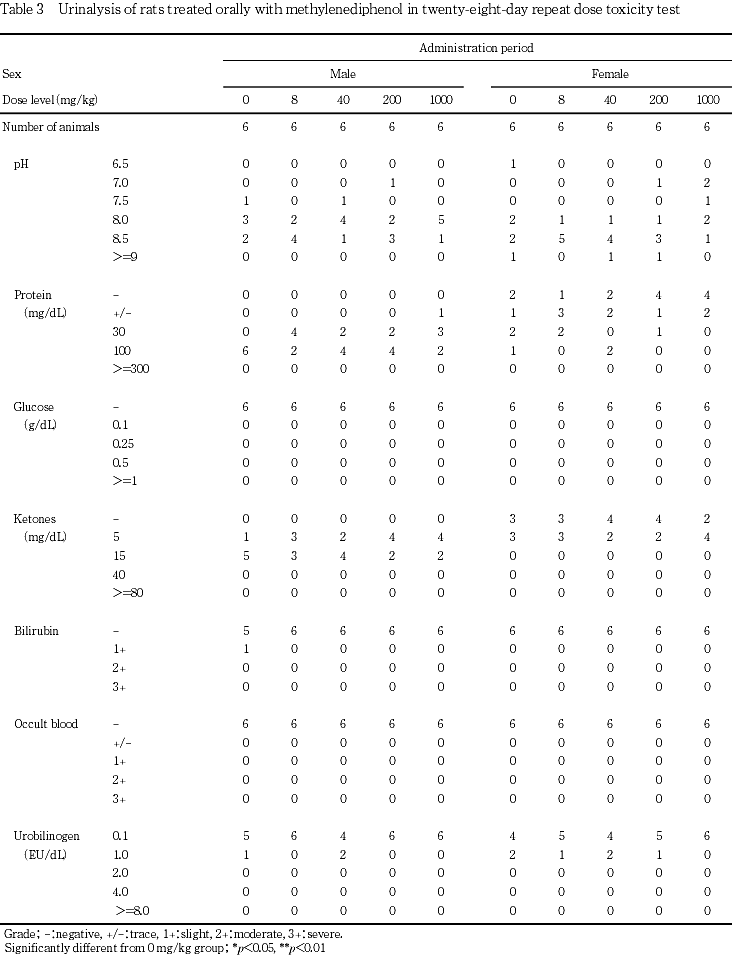
血液学検査,尿検査の結果,被験物質投与に起因すると考えられる変化はみられなかった.
以上,雄は200 mg/kg群で,雌は40 mg/kg群で被験物質投与に起因すると考えられる変化が認められた.従って,本試験条件下における無影響量(NOEL)は,雄は40 mg/kg/day,雌は8 mg/kg/dayと判断した.
被験物質原体は冷蔵暗所に保存し,試験に供した.被験物質は試験期間中安定であったことを確認した.
検疫・馴化期間を含めた全飼育期間中,温度22 ± 2 ℃(許容範囲19〜25 ℃),相対湿度55 ± 15 %(許容範囲35〜75 %),換気約12回/時(オールフレッシュエアー供給),照明12時間/日(7:00-19:00)に自動調節した飼育室を使用した.当該期間中の温湿度の実測値はそれぞれ22〜24 ℃,51〜79 %であった.
動物を滅菌済みの実験動物用床敷(ベータチップ,日本チャールス・リバー(株))を敷いたポリカーボネート製ケージに1ケージあたり同性2匹(投与期間中)収容し飼育した.
動物には,実験動物用固型飼料(MF:オリエンタル酵母工業(株))および5 μmのフィルター濾過後,紫外線照射した水道水を,それぞれ自由に摂取させた.
本試験に先立ち,被験物質を100,500,1000および2000 mg/kgの各用量でSD系ラットに単回投与した結果,2000 mg/kg群で一般状態の異常が認められ,0,100,500および1000 mg/kgの各用量で14日間反復経口投与した結果,1000または500 mg/kg群の雌雄で,被験物質投与によると思われる変化が認められた.従って,本試験では最高用量を1000 mg/kgとし,以下公比5で200,40および8 mg/kgの計4用量群を設定した.投与液量は10 mL/kgとし,至近測定日の体重を基に算出した.さらに溶媒(0.1 % Tween 80添加0.5 % CMC-Na水溶液)のみを投与する対照群を設けた.
投与液は被験物質を溶媒(0.1 % Tween 80[東京化成工業(株)]添加0.5 % CMC-Na[関東化学(株)]水溶液)に懸濁調製し,冷蔵・暗所に保存した.投与液中の被験物質濃度,均一性及び8日間の安定性については,当研究所にて分析確認した.
 法),グルコース(GlcK-G6PDH法),総コレステロール(CES-CO-POD法),トリグリセライド(LPL-GK-G3PO-POD法),総蛋白(Biuret法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(OCPC法),無機リン(PNP-XOD-POD法),ナトリウム,カリウム,クロール(イオン選択電極法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
法),グルコース(GlcK-G6PDH法),総コレステロール(CES-CO-POD法),トリグリセライド(LPL-GK-G3PO-POD法),総蛋白(Biuret法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(OCPC法),無機リン(PNP-XOD-POD法),ナトリウム,カリウム,クロール(イオン選択電極法)を自動分析装置(日立736-10形:(株)日立製作所)により測定した.
また,全例の上記器官に加え,脊髄,眼球およびハーダー腺,リンパ節(下顎・腸間膜),気管,胃,十二指腸,空腸,回腸,盲腸,結腸,直腸,膵臓,膀胱,精嚢,前立腺腹葉,大腿骨および骨髄,大腿筋および坐骨神経,鼻腔,その他肉眼的異常部位を採取し,10 %中性リン酸緩衝ホルマリン液で固定し,保存した.ただし,精巣と精巣上体はブアン液で,眼球とハーダー腺はダビドソン液で固定した.
投与期間終了時に採取した対照群と1000 mg/kg群の雌雄全例の器官・組織(胸腺,心臓,肝臓,脾臓,腎臓,副腎,精巣,精巣上体,精嚢,卵巣)ならびに対照群を含む全動物の肉眼的異常部位より,常法に従ってヘマトキシリン・エオジン(H.E)染色標本を作製し,鏡検した.
さらに各種検査の結果,以下のように病理組織学検査を追加した. 投与期間終了後解剖動物の8,40および200 mg/kg群ならびに回復期間終了後解剖動物の全群の雌雄の肝臓.
投与期間終了後解剖動物の8,40および200 mg/kg群ならびに回復期間終了後解剖動物の全群の雌雄の肝臓. 投与期間および回復期間終了後解剖動物全群の雌雄の胃および鼻腔.
投与期間および回復期間終了後解剖動物全群の雌雄の胃および鼻腔. 投与期間終了後解剖動物全群の雄の下垂体.
投与期間終了後解剖動物全群の雄の下垂体.
投与後流涎が雌雄とも200および1000 mg/kg群の全例で,腹臥位が雌の1000 mg/kg群の2例で認められた.投与前流涎が雌の200 mg/kg群で1例および1000 mg/kg群で1例に認められた.投与前流涎は,各用量で12例中1例のみに認められ,他の個体では認められなかったこと,症状の発現状況が一時的なことから,被験物質投与とは関連のない,特定の個体のみの条件反射的な症状と判断した.これらの症状はいずれも投与期間終了とともに消失した.
回復期間終了時に,心臓相対重量の高値が1000 mg/kgの雄で,肝臓と副腎の相対重量の高値が1000 mg/kgの雌で認められた.
これらの変化のうち,回復期間終了時に認められた,心臓相対重量の高値は,投与期間終了時に変化はみられないことから,被験物質投与と関連のない変化と判断した.また,投与期間終了時に認められた脳相対重量の高値は,同群で体重の有意な低値が認められていること,絶対重量に変化は認められなかったことから,体重の低値に伴う二次的変化と判断した.
回復期間終了後解剖動物において,境界縁の壁の肥厚が200 mg/kg群の雌雄各1例,1000 mg/kg群の雄2例,雌4例で認められ,腺胃壁の赤色化が200 mg/kg群の雄の1例と1000 mg/kg群の雌の2例に認められた.
投与期間中に瀕死状態に陥ったため,安楽死させた1000 mg/kg群の雌1例では,全身の削痩,胃および腸管全域の膨満(ガス貯留),境界縁の壁の肥厚,腺胃壁のびらん,肝臓,脾臓,胸腺の小型化,副腎の赤色斑が認められた.
その他,投与期間および回復期間終了後解剖動物で種々の変化が認められたが,いずれも本系統ラットに自然発生性に認められる変化であり,その発現状況に一定の傾向が認められないことから,被験物質投与とは関連のない変化と判断した.
投与期間終了後解剖動物において,1000 mg/kg群の雌雄全例で胃の境界縁の過形成が認められ,そのうち雄2例,雌1例では程度の増強が認められた.また,1000 mg/kg群の雄2例,雌3例では前胃粘膜の過形成,同群の雌雄各2例では前胃の潰瘍が認められた.肝臓では小葉中心性の肝細胞肥大が200 mg/kg群の雌雄各2例,1000 mg/kg群の雌雄各4例に認められ,そのうち1000 mg/kg群の雄2例,雌3例で程度が増強していた.雄の下垂体重量に変化が認められたため,病理組織検査を実施したが,いずれの個体にも変化は認められず,器官重量の変化は偶発的なものと判断した.また,1000 mg/kg群の雄1例で,鼻腔内の出血を伴った炎症性細胞浸潤が認められた.
回復期間終了後解剖動物において,1000 mg/kg群の雌雄各1例で,胃境界縁の軽度の過形成が認められた.また,1000 mg/kg群の雄2例,雌1例で小葉中心性の肝細胞肥大が認められた.
投与期間中に瀕死期殺した1000 mg/kg群の雌1例では胃の境界縁の過形成,前胃粘膜の過形成および前胃の潰瘍,腺胃粘膜の出血,および副腎のうっ血,肝細胞,白脾髄,胸腺,卵巣,小腸粘膜の萎縮が認められた.なお,剖検所見で消化管のガス膨満が認められ,鼻腔閉鎖が疑われたため,鼻腔の組織学的検査を行ったが,変化は認められなかった.
投与期間および回復期間終了後解剖動物で,剖検時に腺胃の赤色化が認められたが,病理組織検査では対応する変化は認められなかった.また,剖検時に胃境界縁の壁の肥厚が認められた,投与期間終了後解剖動物の40 mg/kg群の雄1例,200 mg/kg群の雌雄各3例,および回復期間終了後解剖動物の200 mg/kg群の雌雄各1例,1000 mg/kg群の雄1例,雌3例では,病理組織検査では対応する変化は認められなかった.
その他に種々の変化が認められたが,いずれも本系統のラットに自然発生性に認められる変化であり,その発現状況に一定の傾向が認められないことから,被験物質投与とは関連のない変化と判断した.
病理組織検査結果を統計解析した結果,投与期間終了後解剖動物の1000 mg/kg群の雌雄で認められた胃の境界縁の過形成がいずれもp<0.01で有意,小葉中心性の肝細胞肥大がいずれもp<0.05で有意であった.
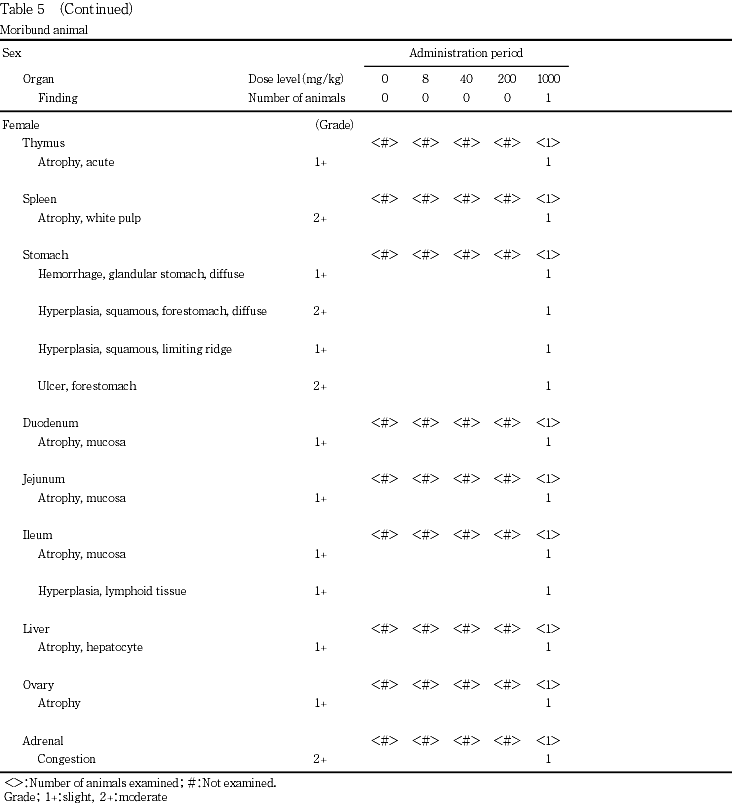
投与期間中に1000 mg/kg群の雌1例で一般状態の悪化(自発運動の減少,腹臥位,緩徐呼吸,腹部膨満)が認められたため,瀕死期解剖した.剖検所見で消化管全体の膨満(ガス貯留)や各種の衰弱性変化が認められた.本物質の単回投与試験3)では2000 mg/kg群の死亡動物で肉眼的および病理組織学的に鼻道内および鼻粘膜に病変が認められており,今回の一般状態および剖検所見も類似していたが,鼻腔に組織学的変化は認められず,原因は不明であった.
流涎が雄の200 mg/kg群で第3日から1000 mg/kg群で第2日から,雌では200 mg/kg群で第2日から,1000 mg/kg群で第1日から認められた.発現状況はほとんどの個体が投与後のみに発現する一時的なもので,断続的な発現を示す個体が多かった.この流涎は,被験物質の刺激性に起因する変化であり,毒性学的意義はないと判断し,NOELの推定根拠からは除外した.投与期間中に一過性のラッセル音,自発運動の低下,腹臥位を示した個体が雌の1000 mg/kg群で少数例みられたが,剖検ではそれらに関連する変化は認められなかった.
体重の低値が雄の1000 mg/kg群で第8日から第29日まで認められた.同群では第8日に摂餌量の低値が認められていることから,被験物質投与の影響が考えられた.雌では第8日と第22日に摂餌量の低値が認められたが,体重には有意差は認められなかった.
投与期間終了後解剖動物の1000 mg/kg群の雄で総コレステロールの低値が,雌では40,200および1000 mg/kg群で総コレステロールの低値が,1000 mg/kg群でグルコースの低値がそれぞれ認められた.これら一連の変化から,被験物質投与によって動物が低栄養状態に陥ったことが示唆された.
肝臓の器官重量測定では,投与期間終了時の雄の1000 mg/kg群で相対重量の高値,雌の200 mg/kg群で相対重量の高値,雌の1000 mg/kg群で絶対重量および相対重量の高値が認められた.これらの肝臓の病理組織学検査では小葉中心性の肝細胞の肥大が認められており,薬物代謝酵素の誘導による生体の適応反応と思われた4, 5).また本変化に関連すると考えられるgGTの高値が雌の1000 mg/kg群で認められた.肝細胞の肥大は,回復期間終了時には発現例数の減少および程度の軽減が認められ,回復性を示した.
肝臓で誘導された薬物代謝酵素は,特に雄ラットで視床下部−下垂体−甲状腺の内分泌機構に影響すると理解されている6).投与期間終了時に,雄の下垂体絶対重量および相対重量の低値が認められたため病理組織検査を実施したが,変化は認められなかったこと,絶対重量および相対重量は,いずれも生理的変動範囲内の変化であったこと,甲状腺の器官重量は正常であったことから,下垂体重量の変化は被験物質投与とは関連のないものと判断した.
胃で被験物質の粘膜に対する刺激性を示唆する変化が認められた.病理解剖検査で雌雄の1000 mg/kg群で腺胃壁の赤色化,前胃壁の肥厚,境界縁の壁の肥厚が認められた.これらの変化のうち,境界縁の壁の肥厚は雄の40 mg/kg群の1例,200 mg/kg群の3例,雌の200 mg/kg群の3例にも認められたが,対応する病理組織学的変化が認められなかったため,これらの個体における所見は被験物質投与とは関連がないと判断した.本剖検所見に対応する病理組織学的変化は雌雄の1000 mg/kg群のみに認められた.投与期間終了時の1000 mg/kg群で,前胃粘膜の過形成が雄2例,雌3例で,境界縁の過形成が雌雄全例で,前胃の潰瘍が雄2例,雌2例で認められた.雄2例および雌1例では境界縁の過形成の程度の増強が認められた.回復期間終了時には境界縁の過形成が1000 mg/kg群の雌雄各1例で軽度に認められたのみで,他の所見は認められず,頻度および程度も軽減していたことから,これら胃の変化には明らかな回復性が認められた.
投与期間終了時に認められた副腎相対重量の高値(200および1000 mg/kg群の雌)は,血液生化学検査で観察された総コレステロール値の低値に関連した変化と考えられた.
尿検査では,被験物質投与に起因すると考えられる変化はみられなかった.
以上,被験物質投与に起因すると考えられる変化として,雄には投与期間終了時の200 mg/kg群で肝臓における小葉中心性の肝細胞肥大が,雌には投与期間終了時の40 mg/kg群で総コレステロール値の低値が認められた.従って,本試験条件下における無影響量(NOEL)は,雄は40 mg/kg/day,雌は8 mg/kg/dayと判断した.
| 1) | “有機化合物辞典,”講談社,東京,1985, pp.741-742. |
| 2) | “新化学インデックス,”化学工業日報社,東京,1993, p.499. |
| 3) | “メチレンジフェノールのラットを用いる経口投与による単回投与毒性試験,”三菱化学安全科学研究所(未公刊) |
| 4) | C. Gopinath, D. E. Prentice and D. J. Lewis, “The liver, Atras of experimental toxicological pathology,” eds. by C. Gopinath, D. E. Prentice and D. J. Lewis, MTP Press Limited, Lancaster, 1987, pp. 43-60. |
| 5) | P. Greaves, “Chapter  , Digestive System, Liver, Histopathology of preclinical toxicity studies,” Elsevier, Amsterdam, 1990, pp. 393-440. , Digestive System, Liver, Histopathology of preclinical toxicity studies,” Elsevier, Amsterdam, 1990, pp. 393-440.
|
| 6) | C. C. Capen, R. A. DeLellis and J. T. Yarrington, “Endocrine System, Thyroid Follicular Cells, Handbook of Toxicologic Pathology,” eds. by W. M. Hascheck and C. G. Rousseaux, Academic Press, San Diego, 1991, pp.711-736. |
| 連絡先 | |||
| 試験責任者: | 須藤雅人 | ||
| 試験担当者: | 伊藤重美,泉孔美子,友成由紀,豊田直人,水嶋亜弥子,鈴木美江,増田久美子 | ||
| (株)三菱化学安全科学研究所鹿島研究所 | |||
| 〒314-0255 茨城県鹿島郡波崎町砂山14 | |||
| Tel 0479-46-2871 | Fax 0479-46-2874 | ||
| Correspondence | ||||
| Authors: | Masato Sudo(Study director) Shigemi Itoh, Kumiko Izumi, Yuki Tomonari, Naoto Toyota, Ayako Mizushima, Yoshie Suzuki, Kumiko Masuda | |||
| Mitsubishi Chemical Safety Institute Ltd., Kashima Laboratory | ||||
| 14 Sunayama, Hasaki-machi, Kashima-gun, Ibaraki, 314-0255 Japan | ||||
| Tel +81-479-46-2871 | Fax +81-479-46-2874 | |||