ピグメントグリーンNo. 7のラットを用いる28日間反復経口投与毒性試験
Twenty-eight-day Repeat Dose Oral Toxicity Test of Pigment green No. 7 in Rats
要約
ピグメントグリーンNo. 7についてSD系のラットを用い,0,100,300および1000 mg/kgの用量で28日間反復経口投与毒性試験を実施した.なお,対照群および1000 mg/kg群にはそれぞれ雌雄各5匹の14日間回復群を設けた.
一般状態の観察では,雌雄とも異常は認められず,死亡例もなかった.また,体重,摂餌量,血液学検査,血液生化学検査,尿検査および病理学検査では,雌雄とも被験物質投与に起因する変化は認められなかった.
以上の結果,ピグメントグリーンNo. 7の毒性は雌雄いずれの投与群にも認められなかったことから無影響量は雌雄とも1000 mg/kgと判断された.
方法
1. 被験物質
ピグメントグリーンNo. 7[大日本インキ化学工業(株)(茨城)提供,Lot No. SB04479,純度99.1 %]は緑色の粉末で,水,熱,光に対して安定な化合物である.被験物質は,使用時まで室温の条件下で保管された.なお,本ロットは投与期間中安定であることが確認された.
2. 供試動物
供試したSprague-Dawley系ラット[Crj:CD(SD)IGS, SPF]は日本チャールス・リバー(株)から4週齢で購入した.動物を検収後,試験環境に9日間馴化させた後,5週齢で投与を開始した.動物はあらかじめ体重によって層別化し,無作為抽出法により各試験群を構成するように群分けした.投与開始時の体重は雄で138〜156 g,雌で110〜120 gであった.
3. 飼育条件
動物は,温度22.3〜23.2 ℃,湿度53〜71 %,換気回数毎時20回,照明12時間(午前7時点灯,午後7時消灯)のバリアシステム飼育室で飼育した.水洗式飼育機を使用し,金属製前面・床網目飼育ケージに動物を1匹ずつ収容した.オリエンタル酵母工業(株)製造の放射線滅菌改良NIH公開ラット・マウス飼料および水道水を自由に摂取させた.飼育ケージは隔週1回,給餌器は週1回取り換えた.
4. 試験群の構成
試験群は1群雌雄各5匹をからなる0,100,300および1000 mg/kgの4群ならびに0および1000 mg/kgの回復群を設け,計60匹を使用した.
[用量設定理由]
用量設定のための2週間反復投与試験を0,100,300および1000 mg/kgの4用量で実施した結果,1000 mg/kg群では雌で肥満の傾向を示す動物が認められたが,明らかな毒性徴候ではなかった.したがって,28日間反復投与毒性試験の高用量も予備試験同様1000 mg/kgとし,以下公比約3で除して中用量を300 mg/kg,低用量を100 mg/kgと設定した.
5. 投与方法
被験物質はコーン油(ナカライテスク(株))に懸濁させ,胃ゾンデを用いて胃内に強制経口投与した.投与容量は体重100 g当たり0.5 mLとした.対照群には媒体のみ投与した.なお,投与期間は28日間とし,0および1000 mg/kg群についてはさらに投与期間終了後に14日間の回復期間を設けた.
6. 投与液の調製
被験物質は,各用量ごとに所定量を精秤し,コーン油に懸濁した.投与液の調製は1週間に1回実施し,1日分毎に小分けして投与時まで室温保管した.なお,被験物質の特性上,分析器機を用いての測定が不可能であるため,コーンオイル中の安定性確認および投与液中の被験物質濃度分析は実施しなかった.
7. 観察,測定および検査
1) 一般状態の観察
全動物を投与期間中は毎日3回(投与前,投与後1および5時間)観察し,中毒症状の有無,行動異常,死期の迫った動物および死亡動物の有無等を記録した.
2) 体重
投与開始から回復期間終了時まで,毎週1回測定した.
3) 摂餌量
毎週1回飼料の残量を測定し,飼料摂取量(g/week)を算出した.
4) 血液学検査
投与期間終了時および回復期間終了時の計2回実施した.採血するに当たり,動物は約16時間絶食させた後,動物をエーテルで麻酔後開腹し,腹部大動脈から採血した.採取した血液の一部にEDTA-2Kを添加し,ヘマトクリット値(HCT:RBC, MCVより算出),ヘモグロビン量(HGB:シアンメトヘモグロビン法),赤血球数(RBC:暗視野板法),平均赤血球容積(MCV:暗視野板法),平均赤血球血色素量(MCH:HGB, RBCより算出),平均赤血球血色素濃度(MCHC:HGB, HCTより算出),血小板数(PLT:暗視野板法),白血球数(WBC:フローサイトメトリー法)および白血球百分率を血液自動分析装置THMS H・1E(米国マイルス社)を用いて測定した.さらに,3.13 %クエン酸ナトリウム水溶液添加血液の血漿を用いて,プロトロンビン時間(PT:Quick1段法),活性化部分トロンボプラスチン時間(APTT:クロット法)およびフィブリノーゲン量(Fibrinogen:トロンビン時間法)を血液凝固自動測定装置KC-40(独国Amelung社)を用いて測定した.
5) 血液生化学検査
血液学検査に引き続き採取した血液を静置後,遠心分離して得られた血清を用いて,総蛋白(T. protein:Biuret法),アルブミン(Albumin:BCG法),A/G比(A/G:計算値),血糖(Glucose:HK-G-6-PDH法),中性脂肪(Triglyceride:GK-GPO遊離グリセロール消去法),総コレステロール(T. cholesterol:コレステロールオキシダーゼESET法),尿素窒素(BUN:ウレアーゼGLDH法),クレアチニン(Creatinine:酵素法),総ビリルビン(T. bilirubin:バナジン酸酸化法),アスパラギン酸アミノトランスフェラーゼ(AST:酵素-UV法,JSCC),アラニンアミノトランスフェラーゼ(ALT:酵素-UV法),アルカリホスファターゼ(ALP:P-ニトロフェニルリン酸基質法),γ-グルタミルトランスペプチダーゼ(γ-GTP:L-γ-グルタミル-3-カルボキシ-4NA基質法,JSCC),カルシウム(Calcium:MXB法),無機リン(I. phosphorus:PNP-XDH法)を多項目生化学自動分析装置(日立7170,(株)日立製作所)で,ナトリウム(イオン選択電極法),カリウム(イオン選択電極法)および塩素(イオン選択電極法)を電解質測定装置(EA06R,(株)エイアンドティー)で測定した.
6) 尿検査
投与期間終了週および回復期間終了週の計2回実施した.採尿器を用いて約3時間および約24時間の尿を採取し,3時間尿を用いてpH,潜血,ケトン体,糖,蛋白,ビリルビンおよびウロビリノーゲンについて,試験紙(N-マルティスティックスSG,バイエル・三共(株))および尿分析装置(CLINITEK500,バイエル社)で測定した.また,24時間尿を用いて,尿量および色調を検査後,尿比重計UR-S((株)アタゴ)で尿比重を測定するとともに,尿を遠心分離後Sternheimer変法により沈渣を染色し,鏡検した.
7) 病理学検査
投与期間終了時および回復期間終了時に動物をエーテル麻酔し,放血安楽死させ病理解剖を実施した.また,脳,肝臓,腎臓,副腎,胸腺,心臓,脾臓,精巣,精巣上体および卵巣について重量を測定し,器官重量/体重比を算出した.上記重量測定器官と脊髄,下垂体,眼球,唾液腺(顎下腺,舌下腺),甲状腺,上皮小体,肺(注入固定,気管支を含む),気管,膵臓,胃,小腸(パイエル氏板を含む),大腸,精嚢,前立腺,子宮,腟,膀胱,末梢神経(坐骨神経),リンパ節(下顎リンパ節,腸間膜リンパ節),骨髄(大腿骨),大動脈,皮膚,乳腺,その他肉眼観察で変化が認められた器官および組織は十分な量の10 %中性緩衝ホルマリン液で固定した.但し,精巣および精巣上体はブアン液で前固定した後,10 %中性緩衝ホルマリン液で固定した.
病理組織学検査は固定した器官・組織のうち,投与期間終了時に解剖した全動物の肺(気管支含む)および肝臓ならびに対照群および高用量群の胸腺,心臓,脾臓,腎臓,副腎,胃,小腸,大腸,精巣,精巣上体,子宮,卵巣および骨髄(大腿骨)について実施した.常法に従ってパラフィン包埋,薄切後,ヘマトキシリン・エオジンで染色し,鏡検した.
8. 統計解析
体重,摂餌量,血液学検査値,血液生化学検査値,尿検査値(尿量および尿比重のみ),器官重量および器官重量/体重比について,対照群と各投与群間の有意差を検定した.最初にBartlettの等分散検定を実施した.等分散の場合はDunnettの多重比較検定1, 2)で対照群と各投与群間の有意差を検定した.Bartlettの等分散検定で不等分散の場合はSteelの検定3)で対照群と各投与群間の有意差を検定した.上記定量値の有意水準は5および1 %の片側検定で実施した.また,生存率および病理学検査結果の検定はFisherの確率計算法を用いた.なお,投与期間終了時の対照群の雄1例における同個体の腎臓に異常があり統計解析結果に影響を及ぼす可能性が血液学,血液生化学,尿および病理学検査の各結果から示唆されたため,白血球数,好中球比率,リンパ球比率,フィブリノーゲン量,尿素窒素,クレアチニン,総蛋白,アルブミン,A/G,尿量,尿比重,心臓重量,腎臓重量,脾臓重量,心臓相対重量,腎臓相対重量および脾臓相対重量を統計対象から除外した.
結果
1. 死亡率
投与期間中および回復期間中,雌雄とも対照群を含む全ての試験群で死亡例は認められなかった.
2. 一般状態の観察
投与期間および回復期間を通じ,雌雄いずれの群にも異常を示す動物は観察されなかった.
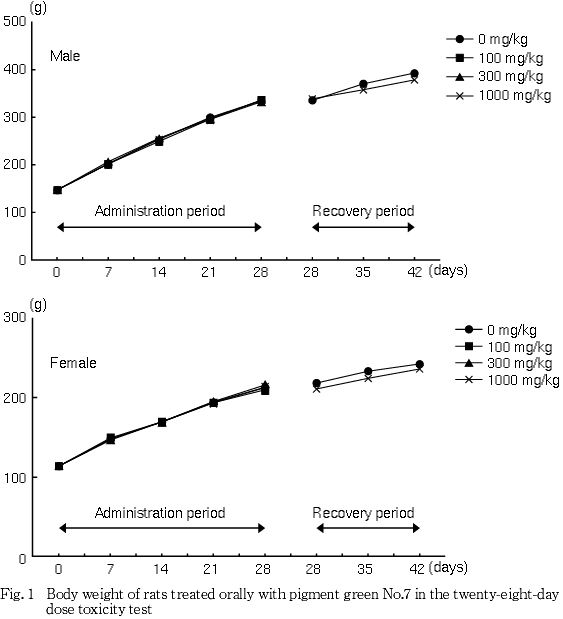
3. 体重(Fig. 1)
雄では,投与期間を通じ,対照群と被験物質投与群とで差は認められなかった.回復期間において1000 mg/kg群で回復2週間の体重増加量が低値を示したが,回復1および2週に差が認められない程度の僅かな変化であること,投与期間には認められない変化であることから,偶発的な変化と判断された.
雌では,投与期間および回復期間を通じ,対照群と被験物質投与群とで差は認められなかった.
4. 摂餌量
雄では,投与期間および回復期間を通じ,対照群と被験物質投与群とで差は認められなかった.
雌では,投与期間を通じ,対照群と被験物質投与群とで差は認められなかった.回復期間において1000 mg/kg群で回復1週の摂餌量および回復2週間の総摂餌量が低値を示したが,回復2週に差が認められないこと,投与期間には認められない変化であることから,偶発的な変化と判断された.
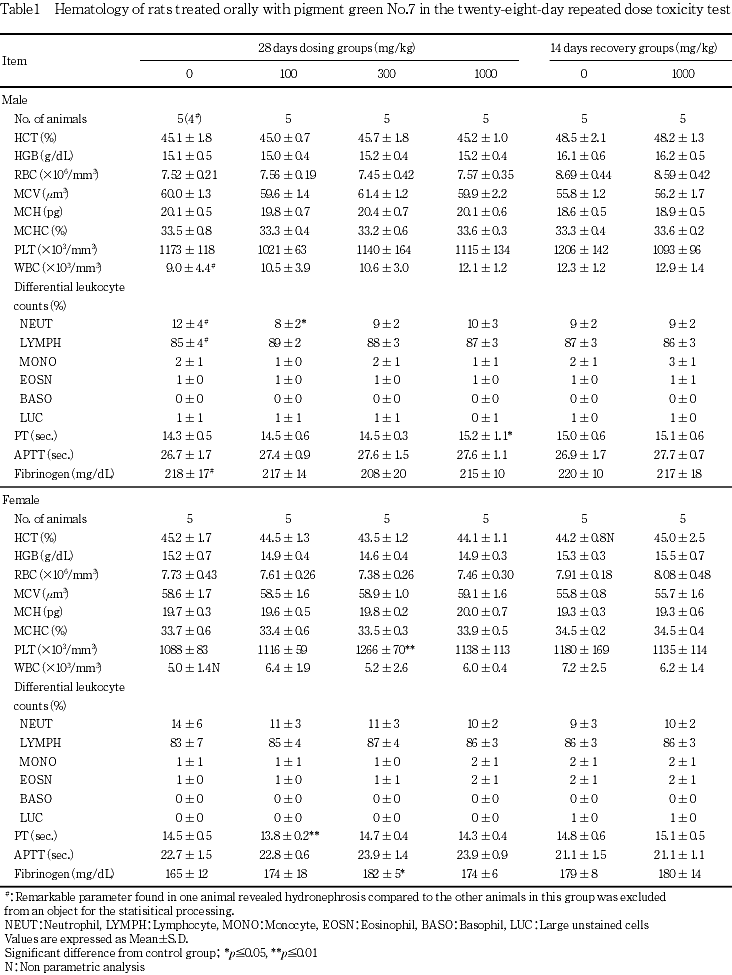
5. 血液学検査(Table 1)
[投与期間終了時の検査結果]
雄では,100 mg/kg群で好中球比率が低値を示したが,いずれも用量に対応する変化ではなかった.また,1000 mg/kg群でプロトロンビン時間が延長を示した.
雌では,300 mg/kg群で血小板数が高値傾向を,フィブリノーゲン量が高値を示したが,いずれも用量に対応する変化ではなかった.また,100 mg/kg群でプロトロンビン時間が短縮を示したが,毒性学的意義のない変化であった.
[回復期間終了時の検査結果]
雌雄とも,対照群と1000 mg/kg群とでいずれの検査項目にも差は認められなかった.
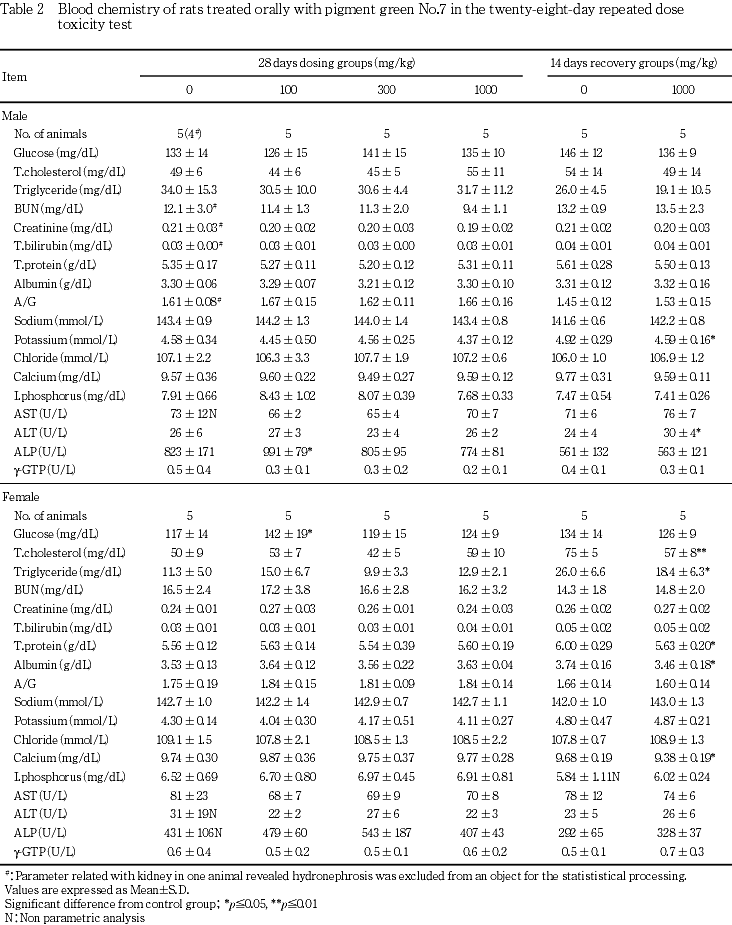
6. 血液生化学検査(Table 2)
[投与期間終了時の検査結果]
雄では100 mg/kg群でアルカリホスファターゼが高値を示し,雌では100 mg/kg群で血糖が高値を示したが,いずれも用量に対応する変化ではなかった.
[回復期間終了時の検査結果]
雄では1000 mg/kg群でカリウムが低値を示し,ALTが高値を示したが,これらはいずれも投与期間終了時には認められなかった変化であることから,被験物質投与との関連は示唆されなかった.雌では1000 mg/kg群で総コレステロール,中性脂肪,総蛋白,アルブミンおよびカルシウムが低値を示したが,これらはいずれも投与期間終了時には認められなかった変化であることから,被験物質投与との関連は示唆されなかった.
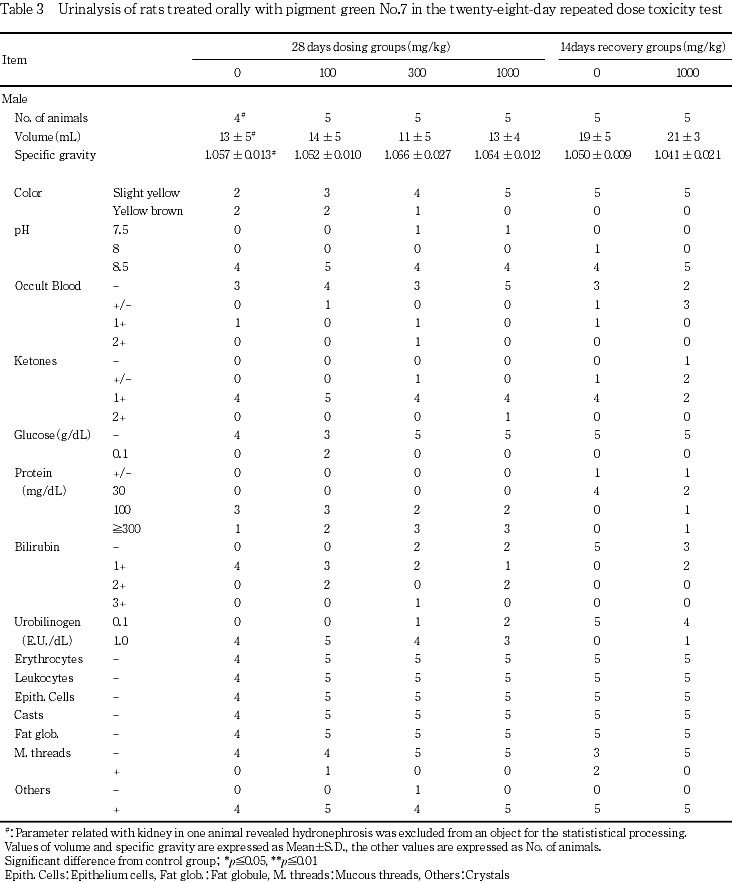
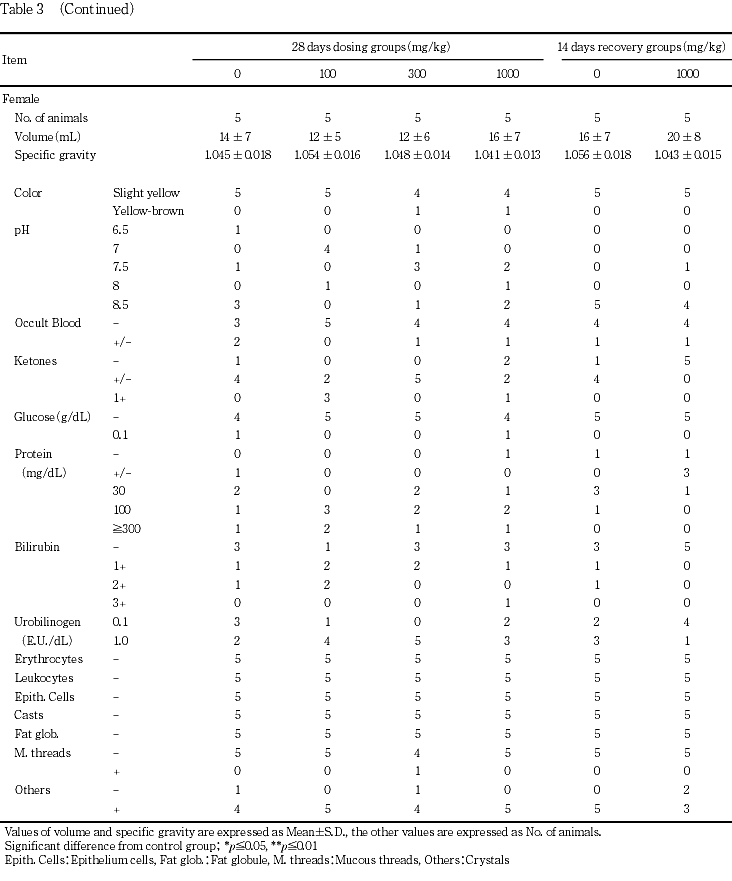
7. 尿検査(Table 3)
[投与期間終了時の検査結果]
雌雄とも,対照群と被験物質投与群とでいずれの検査項目にも差は認められなかった.
[回復期間終了時の検査結果]
雌雄とも,対照群と1000 mg/kg群とでいずれの検査項目にも差は認められなかった.
8. 器官重量(Table 4)
[投与期間終了時の検査結果]
雄では,対照群と被験物質投与群とでいずれの器官重量にも差は認められなかった.雌では,100 mg/kg群で胸腺重量が高値を示したが,用量に対応する変化ではなかった.
[回復期間終了時の検査結果]
雄では1000 mg/kg群で脳重量が低値を示し,雌では肝臓および腎臓重量が低値を示したが,これらはいずれも投与期間終了時には認められなかった変化であることから,被験物質投与との関連は示唆されなかった.
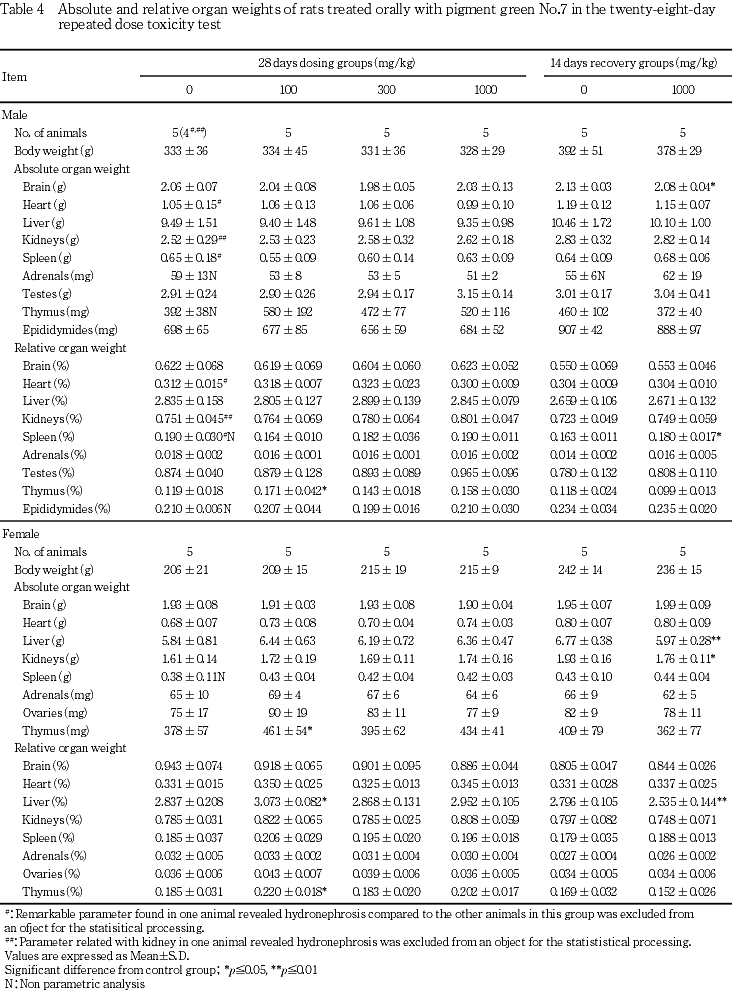
9. 器官重量/体重比(相対重量)(Table 4)
[投与期間終了時の検査結果]
雄では100 mg/kg群で胸腺相対重量が高値を示し,雌では100 mg/kg群で肝臓および胸腺相対重量が高値を示したが,これらはいずれも用量に対応しない変化であった.
[回復期間終了時の検査結果]
雄では1000 mg/kg群で脾臓相対重量が高値を示し,雌では1000 mg/kg群で肝臓相対重量が低値を示したが,これらはいずれも投与期間終了時には認められなかった変化であることから,被験物質投与との関連は示唆されなかった.
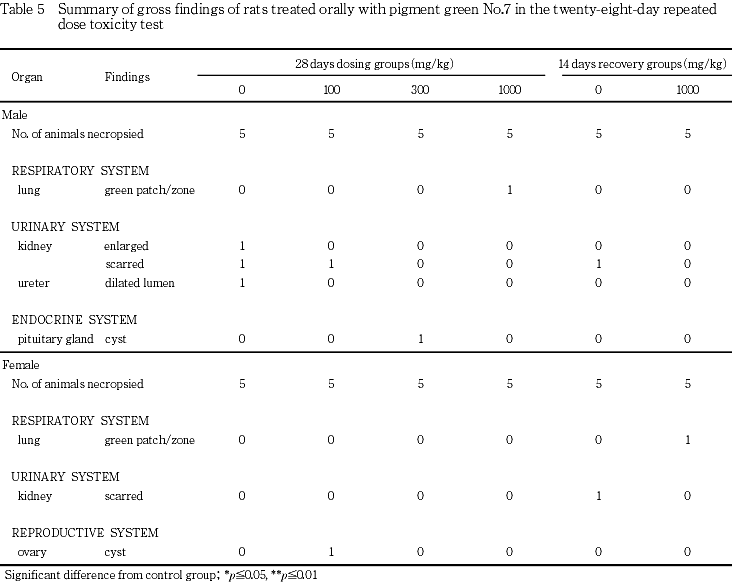
10. 病理学検査(剖検所見:Table 5,組織所見:Table 6)
1) 剖検所見
[投与期間終了時計画解剖動物]
剖検で対照群に比較して被験物質投与群に多く発生した所見は認められなかったが,肺の緑色斑点/区域が1000 mg/kg群の雄1例に認められた.その他,雄で下垂体の嚢胞,腎臓の瘢痕化,腎臓の肥大および尿管の内腔拡張が,雌で卵巣の嚢胞が認められた.
[回復期間終了時計画解剖動物]
剖検で対照群に比較して被験物質投与群に多く発生した病変は認められなかったが,肺の緑色斑点/区域が1000 mg/kg群の雌1例に認められた.その他,雌雄ともに腎臓の瘢痕化が観察された.
2) 剖検所見
対照群と比較して被験物質投与群で多く発生した所見は観察されなかった.雄の対照群では,水腎症が1例観察され,これに伴った尿細管の好塩基化,拡張,壊死および炎症ならびに移行上皮の増生などの変化が観察された.なお,剖検所見で肺の緑色斑点/区域が認められた1000 mg/kg群の動物では肺胞内に緑色の色素を貪食したマクロファージが多数認められた.肺のマクロファージ集簇はこの1例のほかは,雄の1000 mg/kg群で1例および雌の100 mg/kg群で1例に認められたが,色素の貪食はなく限局性のものであった.また,肝臓の髄外造血が雄の100,300および1000 mg/kg群で各1例ずつ,雌の300および1000 mg/kg群でそれぞれ1および3例に認められたが,雌では対照群にも1例に観察された.その他,雌雄ともに腎臓の尿細管好塩基化,肝臓の脂肪化,周辺性脂肪化および小肉芽腫ならびに胃の腺腔拡張が観察されたが,これらはいずれも僅かか,単発性の発生であった.

考察
一般状態の観察では,雌雄とも異常は認められず,死亡例もなかった.
体重および摂餌量測定の結果,雌雄とも被験物質投与の影響は認められなかった.
血液学検査の結果,雄の1000 mg/kg群で認められたプロトロンビン時間の延長は,対照群と比較して僅かな変化であり,肝細胞の障害を示唆する病変も認められなかったことから毒性学的意義はないと判断された.雌では被験物質投与の影響は認められなかった.
血液生化学および尿検査の結果,雌雄とも被験物質投与の影響は認められなかった.
器官重量測定の結果,雌雄とも,実重量および相対重量のいずれにも被験物質投与の影響は認められなかった.
病理学検査の結果,投与期間終了時において被験物質投与による影響が示唆される変化は,剖検所見ならびに組織所見ともに観察されなかった.雄の1000 mg/kg群では1例に肺の緑色斑点/区域が認められたが,組織学的には緑色の色素を貪食したマクロファージが多数認められたことから緑色を呈する被験物質が誤嚥などにより肺胞内に侵入したものと考えられ,毒性学的な意義はないと判断された.他の2例に認められた肺のマクロファージ集簇については,色素の貪食もなく,限局性であったことから,生理的なものと考えられ,毒性学的な意義はないと判断された.複数の動物に認められた肝臓の髄外造血は,用量に対応しない変化であり,被験物質投与による影響ではないと判断された.対照群の雄1例に認められた水腎症は,血流障害,代謝障害,炎症等を合併していた可能性が大であることから,腎機能に関連すると考えられる項目ならびに同群の他の4例と比較して際だつ値を示した項目を統計対象から除外したことは適切であると判断された.
以上の結果,ピグメントグリーンNo. 7の毒性は雌雄いずれの投与群にも認められなかったことから無影響量は雌雄とも1000 mg/kgと判断された.
文献
| 1) | 佐野正樹,岡山佳弘,医薬安全性研究会会報,32,21(1990). |
| 2) | M. Yoshida,J. Jap. Soc. Comp. Stat. 1, 111(1988).
|
| 3) | 倍味繁,稲葉太一,医薬安全性研究会会報,40, 33(1994). |
| 連絡先 |
| 試験責任者: | 大庭耕輔 |
| 試験担当者: | 各務 進,向井大輔,宮島留美子,大橋信之 |
| (財)食品農医薬品安全性評価センター |
| 〒437-1213 静岡県磐田郡福田町塩新田字荒浜582-2 |
| Tel 0538-58-1266 | Fax 0538-58-1393 | |
| Correspondence |
| Authors: | Kousuke Oba(Study director)
Susumu Kakamu, Daisuke Mukai, Rumiko Miyajima, Nobuyuki Oohashi |
| Biosafety Research Center, Foods, Drugs and Pesticides(An-pyo Center) |
| 582-2 Arahama, Shioshinden, Fukude-cho, Iwata-gun, Shizuoka, 437-1213, Japan |
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | |








