 〕に溶解し,さらに,この20 %溶液を6および2 %(w/v)の濃度に段階希釈した後,プラスチック容器に分注し,投与時まで冷暗所で保管した.調製された検体は調製後8日以内に使用した.なお,調製検体の安定性試験および含量試験を実施した結果,0.2および20 %(w/v)日本薬局方注射用水溶液の被験物質は,冷暗所で10日間は安定であり,また,初回に調製した投与検体中の被験物質の平均含量は,所定濃度の103〜105 %であることが確認された.
〕に溶解し,さらに,この20 %溶液を6および2 %(w/v)の濃度に段階希釈した後,プラスチック容器に分注し,投与時まで冷暗所で保管した.調製された検体は調製後8日以内に使用した.なお,調製検体の安定性試験および含量試験を実施した結果,0.2および20 %(w/v)日本薬局方注射用水溶液の被験物質は,冷暗所で10日間は安定であり,また,初回に調製した投与検体中の被験物質の平均含量は,所定濃度の103〜105 %であることが確認された.投与期間中および回復試験期間中に,いずれの投与群においても死亡例は認められなかった.
一般状態の変化として,1000 mg/kg投与群の雄で7例,雌で全例の投与直後に一過性の流涎がみられたが,翌日の投与前症状観察までには回復した.資料調査(データベース:Material Safety Data Sheets-OHS/1996Q1およびRTECS-1996/Q3)により,この流涎は被験物質の刺激性によるものと判断した.
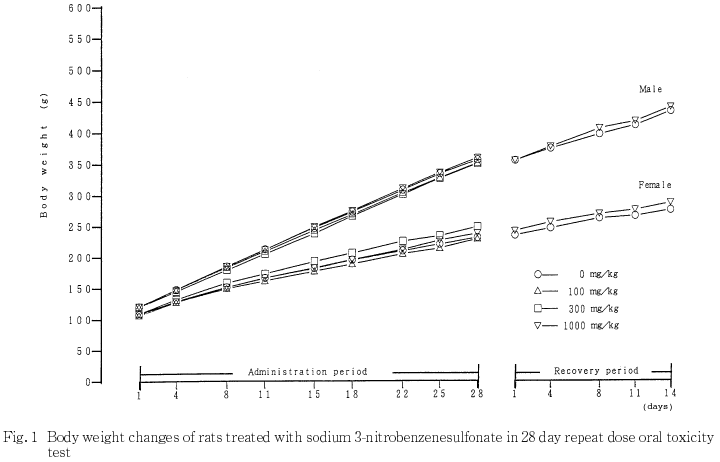
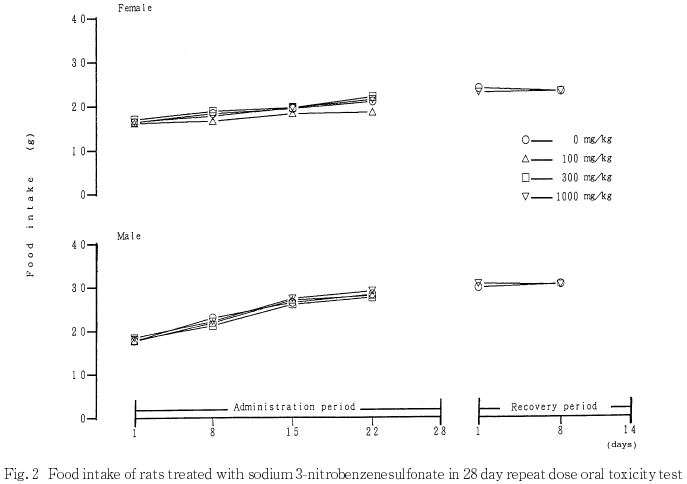
体重および摂餌量については,溶媒対照群と被験物質投与群との間に有意差は認められなかった.また,尿検査,血液学検査,血液生化学検査および病理学検査においても被験物質投与に起因すると考えられる変化は認められなかった.
以上の結果から,3-ニトロベンゼンスルホン酸ナトリウムの1000 mg/kg投与群で,被験物質投与による影響は,流涎のみであった.したがって,3-ニトロベンゼンスルホン酸ナトリウムの28日間反復経口投与毒性試験(回復14日間)における無影響量は,雌雄とも300 mg/kgであると判断した.
 より提供された3-ニトロベンゼンスルホン酸ナトリウム〔ロット番号:K0116,性状:白色粉末,純度:98.8 wt%〕を用い,入手後,室温にて保管した.
より提供された3-ニトロベンゼンスルホン酸ナトリウム〔ロット番号:K0116,性状:白色粉末,純度:98.8 wt%〕を用い,入手後,室温にて保管した.
被験物質を20 %(w/v)の濃度になるよう日本薬局方注射用水〔製造番号:9510AH,光製薬 〕に溶解し,さらに,この20 %溶液を6および2 %(w/v)の濃度に段階希釈した後,プラスチック容器に分注し,投与時まで冷暗所で保管した.調製された検体は調製後8日以内に使用した.なお,調製検体の安定性試験および含量試験を実施した結果,0.2および20 %(w/v)日本薬局方注射用水溶液の被験物質は,冷暗所で10日間は安定であり,また,初回に調製した投与検体中の被験物質の平均含量は,所定濃度の103〜105 %であることが確認された.
〕に溶解し,さらに,この20 %溶液を6および2 %(w/v)の濃度に段階希釈した後,プラスチック容器に分注し,投与時まで冷暗所で保管した.調製された検体は調製後8日以内に使用した.なお,調製検体の安定性試験および含量試験を実施した結果,0.2および20 %(w/v)日本薬局方注射用水溶液の被験物質は,冷暗所で10日間は安定であり,また,初回に調製した投与検体中の被験物質の平均含量は,所定濃度の103〜105 %であることが確認された.
 〕を6日間にわたり予備飼育した後,一般状態に異常の認められなかった雌雄各30匹を試験に供した.動物は,全飼育期間を通じて,温度24.0〜24.7℃,湿度50〜65 %,換気回数約15回/時間,照明時間12時間(7〜19時点灯)に制御された飼育室内で,金属製金網床ケージに1匹ずつ収容し,固型飼料(CE-2,日本クレア
〕を6日間にわたり予備飼育した後,一般状態に異常の認められなかった雌雄各30匹を試験に供した.動物は,全飼育期間を通じて,温度24.0〜24.7℃,湿度50〜65 %,換気回数約15回/時間,照明時間12時間(7〜19時点灯)に制御された飼育室内で,金属製金網床ケージに1匹ずつ収容し,固型飼料(CE-2,日本クレア )および水道水(秦野市水道局給水)を自由に摂取させて飼育した.
)および水道水(秦野市水道局給水)を自由に摂取させて飼育した.
群分けは,検疫期間中に異常のない動物の中から,投与開始前日の体重に基づいて,体重別層化無作為抽出法により行った.動物数は,溶媒対照群および1000 mg/kg投与群では, 雌雄各群10匹とし,100および300 mg/kg投与群では, 各5匹の動物を用いた. また, 溶媒対照群および1000 mg/kg投与群では, 各群5匹を投与期間終了後, 14日間の回復試験に用いた.
投与は,1日1回,28日間,毎日9時〜12時の間に,ラット用胃管を用いて強制的に行い,投与液量は,雌雄とも5 mL/kgとして,各投与時に最も近い時点で測定された体重に基づいて個別に算出した.
 ,コールターエレクトロニクス)により赤血球数(電気抵抗法),白血球数(電気抵抗法),血色素量(吸光度法),平均赤血球容積(電気抵抗法),および血小板数(電気抵抗法)を測定し,これらを基に平均赤血球血色素量,平均赤血球血色素濃度およびヘマトクリット値を算出した.血液の一部は塗抹標本とし,白血球分類(Wright-giemsa染色),網状赤血球比率(Brecher法)およびハインツ小体比率(メチルバイオレット染色による超生体染色)を求めた.なお,プロトロンビン時間および活性部分トロンボプラスチン時間の測定は,クエン酸ナトリウムを抗凝固剤として採取した血液を用いて,光散乱検出法(CA-3000, 東亜医用電子
,コールターエレクトロニクス)により赤血球数(電気抵抗法),白血球数(電気抵抗法),血色素量(吸光度法),平均赤血球容積(電気抵抗法),および血小板数(電気抵抗法)を測定し,これらを基に平均赤血球血色素量,平均赤血球血色素濃度およびヘマトクリット値を算出した.血液の一部は塗抹標本とし,白血球分類(Wright-giemsa染色),網状赤血球比率(Brecher法)およびハインツ小体比率(メチルバイオレット染色による超生体染色)を求めた.なお,プロトロンビン時間および活性部分トロンボプラスチン時間の測定は,クエン酸ナトリウムを抗凝固剤として採取した血液を用いて,光散乱検出法(CA-3000, 東亜医用電子 )により実施した.また, 解剖時に摘出された大腿骨髄の塗抹標本を作成して,Wright-Giemsa染色を施し,骨髄像を光学顕微鏡で検査した.
)により実施した.また, 解剖時に摘出された大腿骨髄の塗抹標本を作成して,Wright-Giemsa染色を施し,骨髄像を光学顕微鏡で検査した.
 法),アルカリフォスファターゼ活性(パラニトロフェニルリン酸基質法),GOT活性(SSCC法),GPT活性(SSCC法),LDH活性(Wr
法),アルカリフォスファターゼ活性(パラニトロフェニルリン酸基質法),GOT活性(SSCC法),GPT活性(SSCC法),LDH活性(Wr blewski-La Due法),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),トリグリセライド濃度(GPO・DAOS法), γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法), A/G比(総蛋白濃度およびアルブミン濃度より算出)を測定した.なお,メトヘモグロビンの測定は,投与期間終了剖検時の溶媒対照群および高用量群のみ,可視紫外分光光度計(UVIDEC-610C型,日本分光
blewski-La Due法),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),トリグリセライド濃度(GPO・DAOS法), γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法), A/G比(総蛋白濃度およびアルブミン濃度より算出)を測定した.なお,メトヘモグロビンの測定は,投与期間終了剖検時の溶媒対照群および高用量群のみ,可視紫外分光光度計(UVIDEC-610C型,日本分光 )により,松原らの方法1)で測定した.また,全自動電解質分析装置(EA05, A&T)により,ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(イオン電極法)を測定した.
)により,松原らの方法1)で測定した.また,全自動電解質分析装置(EA05, A&T)により,ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(イオン電極法)を測定した.
1000 mg/kg投与群の回復期間終了時剖検動物の雄1例では投与期間終了週に行った尿検査において,強い潜血反応が認められたため,この動物の腎臓および膀胱の病理組織学検査を実施した.
 法方法で多重比較を行った.一方,分散が一様でない場合はKruskal-Wallisの順位検定を行い,有意(有意水準:5 %)ならばDunnettあるいはScheff
法方法で多重比較を行った.一方,分散が一様でない場合はKruskal-Wallisの順位検定を行い,有意(有意水準:5 %)ならばDunnettあるいはScheff 法方法で多重比較を行った.また試験群が溶媒対照を含め2群となる場合には,溶媒対照群と被験物質投与群の各平均値の差の検定は,等分散であればStudentのt検定,不等分散であればAspin-Welchのt検定を行った.さらに,病理組織所見については,グレード分けしたデータはMann-WhitneyのU検定により,また,陽性グレードの合計値は,Fisherの直接確率の片側検定により,溶媒対照群と各被験物質投与群との間の有意差検定を行った(有意水準:5 %).
法方法で多重比較を行った.また試験群が溶媒対照を含め2群となる場合には,溶媒対照群と被験物質投与群の各平均値の差の検定は,等分散であればStudentのt検定,不等分散であればAspin-Welchのt検定を行った.さらに,病理組織所見については,グレード分けしたデータはMann-WhitneyのU検定により,また,陽性グレードの合計値は,Fisherの直接確率の片側検定により,溶媒対照群と各被験物質投与群との間の有意差検定を行った(有意水準:5 %).
回復試験期間中には,投与期間中に痂皮や脱毛が認められた動物と同じ例で,痂皮または脱毛が,溶媒対照群の雄1例,1000 mg/kg投与群の雄2例にみられたが,いずれも,この系統のラットでは頻繁にみられ,被験物質に起因した変化ではないと判断した.
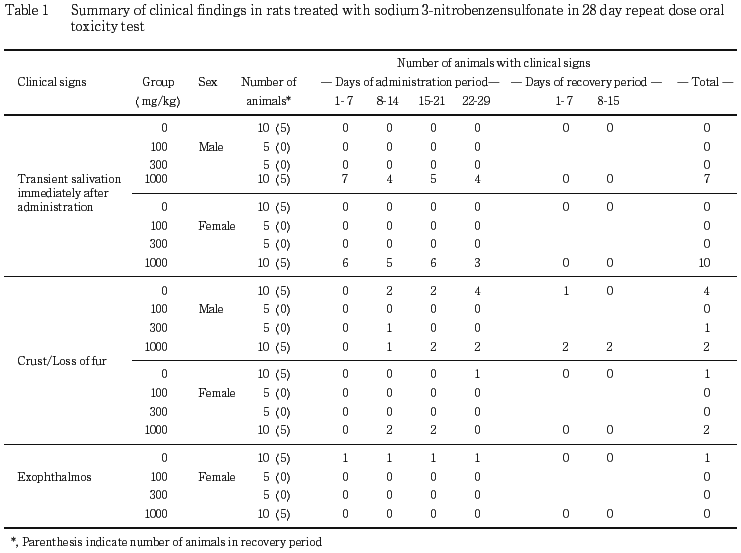
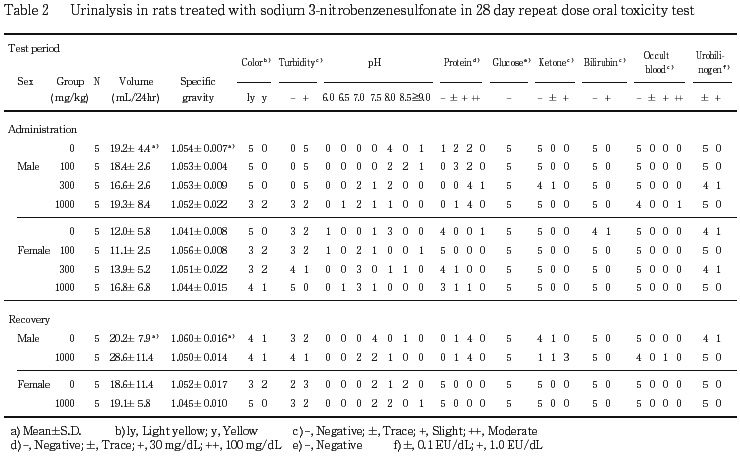
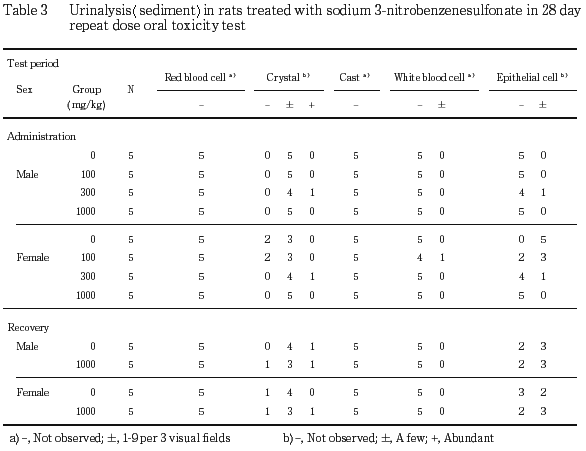
その他,蛋白,ビリルビン,ケトン体およびウロビリノーゲンが陽性または疑陽性となる例があり,尿沈渣中に上皮細胞,白血球または結晶が観察される例もあったが,いずれも,その出現頻度あるいは程度に用量依存性は認められなかった.なお,その他の検査項目については,溶媒対照群と被験物質投与群との間に差は認められなかった.
回復試験期間終了週の検査では,1000 mg/kg投与群の雄1例で潜血が陽性を示した.また,溶媒対照群の雄1例,1000 mg/kg投与群の雄4例でケトン体が陽性または疑陽性を示した.その他の検査項目については,溶媒対照群と被験物質投与群との間に差は認められなかった.
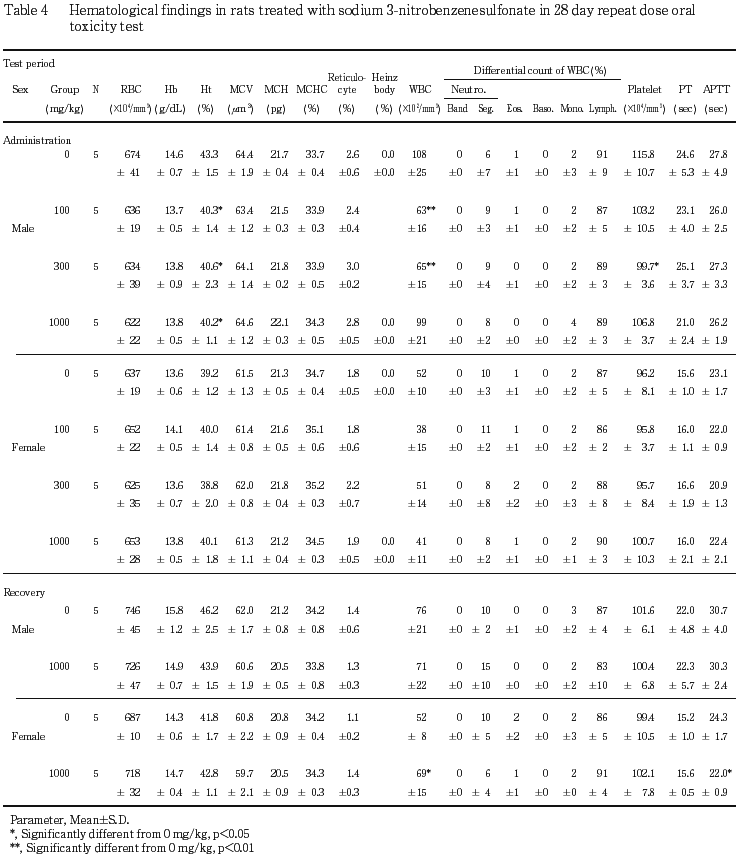
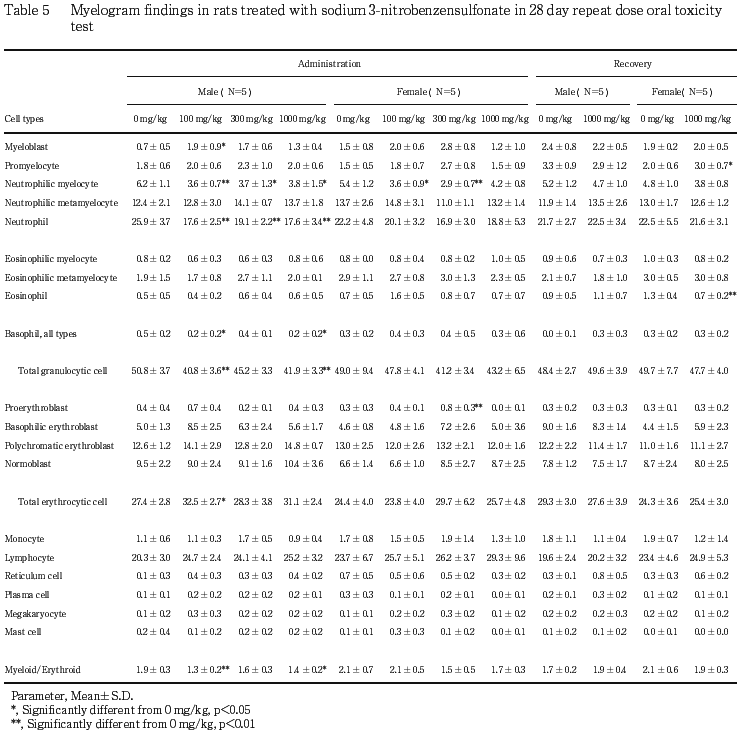
投与期間終了時の骨髄像検査では,100 mg/kg投与群の雄で骨髄芽球および赤芽球系細胞の有意な増加ならびに,好中性骨髄球,好中球,好塩基球,顆粒球系細胞およびM/E比の有意な減少が,100 mg/kg投与群の雌で好中性骨髄球の有意な減少が,300 mg/kg投与群の雄で好中性骨髄球および好中球の有意な減少が,300 mg/kg投与群の雌で好中性骨髄球の有意な減少ならびに,前赤芽球の有意な増加が,1000 mg/kg投与群の雄で好中性骨髄球,好中球,好塩基球,顆粒系細胞およびM/E比の有意な減少がみられた.
回復試験期間終了時の骨髄像検査では,1000 mg/kg投与群の雌で前骨髄芽球の有意な増加および好酸球の有意な減少がみられた.
投与期間終了時の血液学検査では,ハインツ小体の変化はみられなかったため,回復試験期間終了時の検査は行わなかった.その他の検査項目については,溶媒対照群と被験物質投与群との間に差は認められなかった.
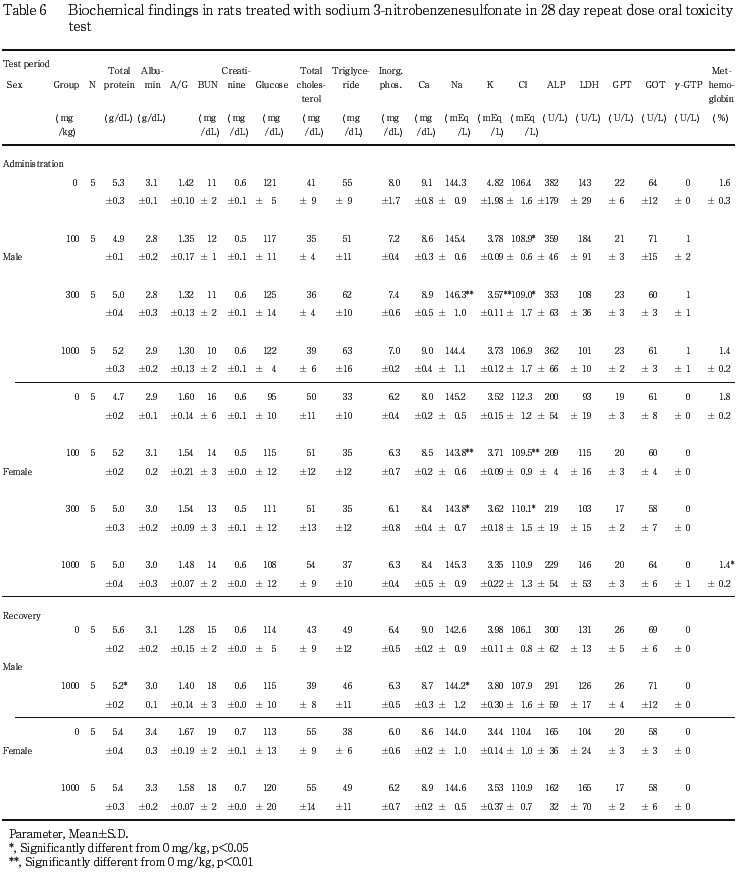
回復試験期間終了時の検査では,1000 mg/kg投与群の雄で総蛋白濃度の有意な低下およびナトリウム濃度の上昇がみられた.
その他の検査項目では,溶媒対照群と被験物質投与群の間に有意差は認められなかった.
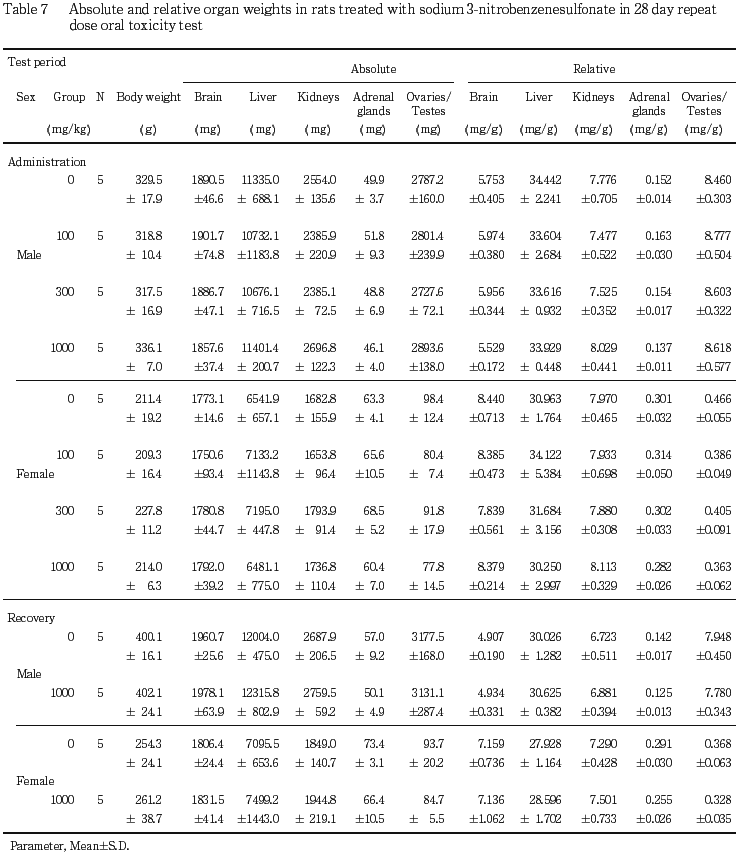
回復試験期間終了時の剖検では,肺の褐色点が1000 mg/kg投与群の雄1例で,胸壁との癒着が溶媒対照群の雌1例で,腎臓では尿細管像の明瞭化が1000 mg/kg投与群の雄1例で,嚢胞が溶媒対照群の雄1例で,肝臓の小葉像明瞭化が1000 mg/kg投与群の雌1例で,皮膚の脱毛が1000 mg/kg投与群の雄1例で,痂皮が1000 mg/kg投与群の雄2例で,副腎の白色点散在が1000 mg/kg投与群の雌1例で,子宮腔の拡張が溶媒対照群の雌2例で観察されたが,いずれの所見も同系統のラットに散見されることから,被験物質投与に起因すると考えられる明らかな変化ではないと判断した.
投与期間終了時剖検例において肉眼的に異常がみられた動物のうち,下顎リンパ節の腫大がみられた溶媒対照群の雄1例では病理組織学検査の結果,下顎リンパ節における形質細胞の過形成が認められ,肉眼的に肺の暗赤色または褐色点が認められた動物のうち溶媒対照群の雌1例ならびに300および1000 mg/kg投与群の雄それぞれ1例では肺の出血が,肺と胸壁の癒着がみられた300 mg/kg投与群の雌では胸膜の線維化および炎症が認められた.腎盂の拡張がみられた100 mg/kg投与群の雄1例および1000 mg/kg投与群の雄1例(前述)では,いずれも組織学的にも腎盂の拡張が確認され,好塩基性尿細管も認められたがその他に異常はなかった.また肉眼的に腎臓に陥凹部がみられた100 mg/kg投与群の雄1例,腎臓の腫大がみられた1000 mg/kg投与群の雄1例の腎臓には,いずれも皮質の好塩基性尿細管が認められたがその他に異常はなかった.また,肝臓に淡色領域がみられた1000 mg/kg投与群の雌雄各1例では,門脈周囲性脂肪化が認められたのみであった.眼球の赤色点がみられた溶媒対照群の雄1例では角膜血管新生が認められ,皮膚では肉眼的に痂皮がみられた溶媒対照群の雌1例,雄2例で,潰瘍ならびに痂皮および炎症が認められた.
回復試験期間終了時剖検例のうち肉眼的に異常がみられた動物では,肺の褐色点が認められた1000 mg/kg投与群の雄1例では肺の出血が,肺と胸壁の癒着がみられた溶媒対照群の雌1例では胸膜の線維化が認められた.腎臓の尿細管像の明瞭化がみられた1000 mg/kg投与群の雄1例ではeosinophilic bodyが認められた.腎臓の嚢胞がみられた溶媒対照群の雄1例では,組織学的にも腎臓の嚢胞が確認されたほか,皮質の好塩基性尿細管とeosinophilic bodyが認められた.肝臓で小葉像が明瞭にみられた1000 mg/kg投与群の雌1例では門脈周囲性脂肪化が,副腎で白色点の散在がみられた1000 mg/kg投与群の雌1例では限局性の球状帯の脂肪滴の増加がみられた.子宮腔の拡張がみられた溶媒対照群の雌1例では病理組織学検査において子宮腔の拡張であることが確認された.また,肉眼的に痂皮がみられた1000 mg/kg投与群の雄2例では,いずれも潰瘍ならびに炎症が認められた.
尿検査では,投与期間終了週の検査で,1000 mg/kg投与群の雄1例で,強い潜血反応陽性が認められた.同例の腎臓皮質には好塩基性尿細管がみられたが,変化の程度はごく軽微であり,病理組織学検査を行ったほとんどの雄にも認められる所見であることから,被験物質による影響ではないと判断した.この他,本例の膀胱には異常がみられなかったため,この潜血の原因を明確にすることはできなかった.また,回復試験期間終了週の検査では,1000 mg/kg投与群の雄4例で,ケトン体が陽性または疑陽性を示したが,投与期間終了週の検査では認められず,偶発的なものと判断した.
被験物質の構造類似化合物であるニトロベンゼンは,貧血,およびメトヘモグロビン血症を起こすことが知られているため2),メトヘモグロビンの測定およびハインツ小体の観察を実施したが,1000 mg/kg投与群の雌においてメトヘモグロビン濃度の低下が認められたのみであった.この変化は,その方向性から毒性学的意義は少ないものと判断した.その他,血液学検査および血液生化学検査では,いくつかの項目で有意差が認められた.さらに,雄のヘマトクリット値の低値は被験物質投与群の全てに溶媒対照群と比較して有意差が認められたが,他の血液学検査項目には影響が認められないことから毒性学的意義は少ないと判断した.また,骨髄像検査のM/E比で, 顆粒球系細胞の減少を疑わせる変化がみられ,被験物質投与群において溶媒対照群と比較し,有意な変化が認められたが,病理組織学的には骨髄あるいは脾臓に造血障害を示唆する変化は認められないことから,被験物質は本試験条件下では,血液あるいは造血組織に影響を及ぼさないと判断した.
以上の結果から,本試験条件下における3-ニトロベンゼンスルホン酸ナトリウムの無影響量は雌雄とも300 mg/kgであると判断した.
| 1) | 松原高賢,"臨床検査マニアル,"北村元任他編,文光堂,東京,1988, pp. 321-324. |
| 2) | 下武男, 小野寺博志, 松島裕子ら,衛生試験所報告,112 , 71(1994). |
| 連絡先 | |||
| 試験責任者: | 大原直樹 | ||
| 試験担当者: | 原田知子,今野和則,加藤博康,小島幸一, 稲田浩子,安生孝子,畔上二郎,関 剛幸, 吉村愼介,三枝克彦 | ||
| (財)食品薬品安全センター 秦野研究所 | |||
| 〒257-8523 秦野市落合 729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Naoki Ohara(Study Director) Tomoko Harada, Kazunori Konno, Hiroyasu Katoh, Kohichi Kojima, Hiroko Inada, Takako Anjo, Jiro Azegami, Takayuki Seki, Sinsuke Yoshimura, Katsuhiko Saegusa | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | FAX +81-463-82-9627 | |||