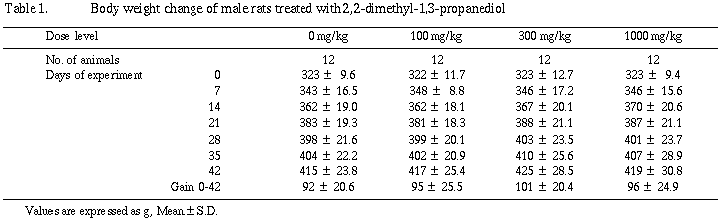
体重および摂餌量は雌雄ともに群間で差はなく被験物質投与の影響は認められなかった。
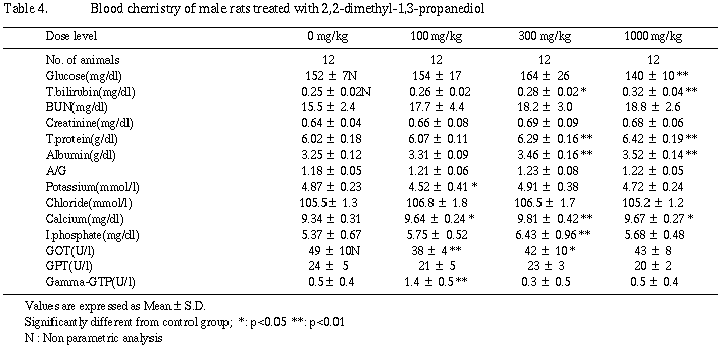
雄の血液学的検査では、被験物質投与の影響と考えられる変化はなかった。また、血液化学的検査では、300および1,000 mg/kg群でアルブミンの増加に伴う総蛋白の増加と総ビリルビンの増加が認められ、さらに1,000 mg/kg群では血糖値の減少が認められた。
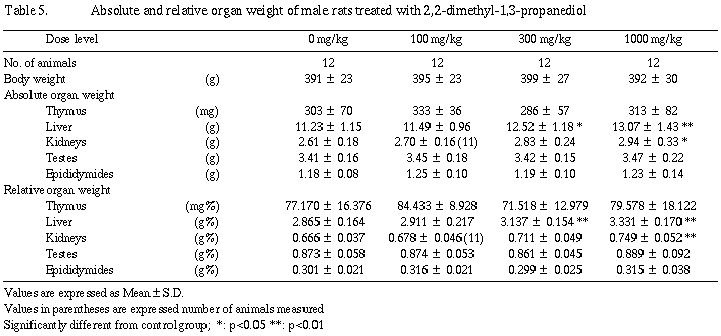
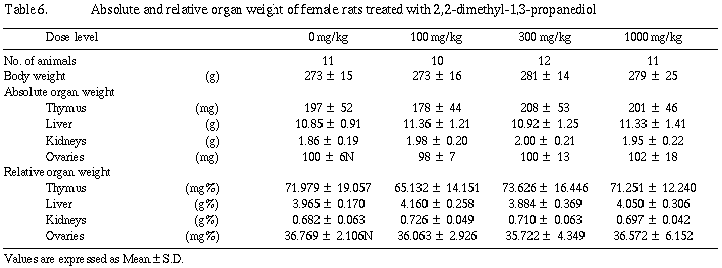
器官重量は雄の300および1,000 mg/kg群で肝臓重量が増加した。さらに1,000 mg/kg群では腎臓重量が増加し、300 mg/kg群でも統計学的有意差はないものの増加傾向が認められた。
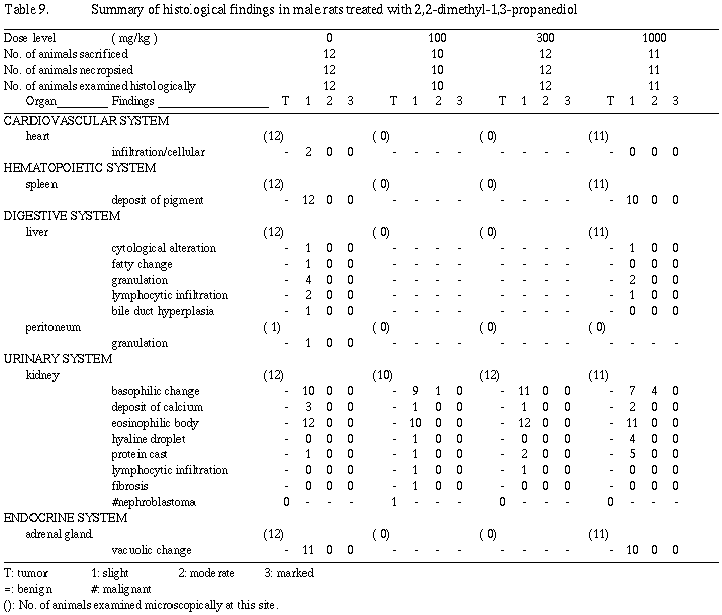
雄の剖検所見では、1,000 mg/kg群の12例中2例に肝臓の肥大が観察された。病理組織学検査では、肝臓の肥大を裏付ける明確な形態的変化は認められなかった。腎臓の所見として、雄の1,000 mg/kg群で蛋白円柱や硝子滴変性が増加し、尿細管上皮の中程度好塩基性化が11例中4例に観察された。
分娩時観察では、対照群の1例を除き妊娠動物の全例が正常に分娩し哺育期間を通じ被験物質投与の影響は認められなかった。また、新生児の外表検査でも被験物質投与によると考えられる異常はなく、体重も哺育4日まで順調に増加した。死産児および哺育4日までの死亡児ならびに哺育4日の剖検では、被験物質投与によると考えられる異常所見は観察されなかった。
以上の結果から、2, 2−ジメチル−1, 3−プロパンジオールの反復投与毒性は、雄の300 mg/kg/day以上の投与で認められ、雌では1,000 mg/kg/day投与によっても認められなかった。したがって、最大無影響量は、雄では100 mg/kg/day、雌では1,000 mg/kg/dayと判断した。また、雌雄の生殖に及ぼす影響および児動物の発生・発育に及ぼす影響は1,000 mg/kg/day投与によっても認められず、最大無影響量はともに1,000 mg/kg/dayと判断した。
本被験物質は局方注射用蒸留水[ロット番号9106AS, 9108CS, 9108VS(光製薬)]に溶解し、20(w/v)%溶液を調製した。これを原液とし、注射用蒸留水で順次希釈し各群の投与溶液を調製した。調製後は、使用時まで冷蔵庫に保存した。調製液中の被験物質は0.2, 20(w/v)%溶液の場合、冷暗条件下ですくなくとも7日間安定であることが確認されているため、調製は1週間に1回実施し、調製後7日以内に使用した。
投与液の濃度分析は、各群の調製液について調製開始時に調製したバッチから無作為にサンプルを抽出し実施した。その結果、97.0〜103%の範囲で適切に調製されており問題はなかった。
動物は、温度22〜24℃、湿度50〜60%、換気回数20回/時間、照度150〜300lux、照明時間12時間(午前7時点灯、午後7時消灯)に設定された飼育室(W8×D8×H2.5 m、160m^3)で飼育した。株式会社東京技研サービス(東京都府中市)の自動水洗式飼育機(W486×D79×H160 cm)を使用し、アルミ製前面・床ステンレス網目飼育ケージ(W15.8×D23.8×H16.0 cm、飼育ケ−ジ・スペ−ス6,017 cm^3)に動物を1匹ずつ収容し飼育した。但し、交配期間中の雄は、アルミ製前面・床ステンレス網目飼育ケージ(W36.8×D25.0×H16.0 cm、飼育ケ−ジ・スペ−ス14,720 cm^3)に収容し飼育した。母動物は、妊娠18日以降哺育4日までアルミ製前面・床ステンレス網目飼育ケージ(W36.8×D25.0×H16.0 cm)に哺育トレーおよび巣作り材料(アルファードライ)を入れて飼育した。
飼料は、オリエンタル酵母工業株式会社(東京都中央区)製造のNMF固型飼料(放射線滅菌飼料)を使用した。飲水は、水道水を自由に摂取させた。
供給した飼料、水および巣作り材料には試験に支障を来す可能性の考えられる夾雑物の混在はなかった。
群分け後の動物の識別は個体別に耳に入れ墨をするとともにケージごとに動物標識番号(Animal ID-No.)をつけた。
以上の結果から、本試験の最高用量は予備試験と同じ1,000 mg/kgを設定し、以下公比約3にて除し、300および100 mg/kgを設定した。
投与経路は、OECDガイドライン「反復投与毒性・生殖発生毒性併合試験」で指示されている投与経路に準じて強制経口投与を選択した。投与容量は、体重100 g当り0.5 mlとし、個体別に測定した最新体重に基づいて算出を行った。胃ゾンデを用いて毎日1回(7日/週)強制経口投与した。対照群には局方注射用蒸留水のみを投与した。
雄の投与期間は、交配前14日間と交配期間14日間および交配終了後の17日間の連続45日間とした。雌の投与期間は、交配前14日間と交配期間中(交尾成立まで最長14日間)ならびに交尾成立雌の妊娠期間を通じて分娩後の哺育3日まで(40〜46日間)とした。なお、交尾不成立の雌は交配期間終了後の解剖前日まで45日間投与した。
性周期観察は交尾成立日まで行い、発情期から次の発情期までの間の日数を性周期日数とし平均性周期を算出した。
交配結果から、各群について交尾率[(交尾動物数/同居動物数)×100]を算出した。
新生児は哺育1日に出産児数(生存児+死亡児)を調べ、性別を判定するとともに、外形異常の有無を調べた。また、哺育1および4日に雌雄別の同腹児重量を測定し、雌雄別1匹当りの平均重量を算出した。
哺育4日に新生児全例を屠殺し、主要器官の肉眼観察を行った。哺育期間中の死亡児も同様に主要器官の肉眼観察を行った。また、新生児の4日生存率[(哺育4日生児数/出産生児数)×100]を算出した。
a) 血液学的検査
血液学検査には初血を用いた。THMS H6000(米国テクニコン社)を用いて下記の項目を測定した(EDTA-3K添加血液)。
| 白血球数 | (WBC) | 暗視野板法 |
| 赤血球数 | (RBC) | 暗視野板法 |
| ヘモグロビン量 | (HGB) | シアンメトヘモグロビン法 |
| ヘマトクリット値 | (HCT) | 全赤血球の容積より補正 |
| 平均赤血球容積 | (MCV) | RBC, HCTより算出 |
| 平均赤血球血色素量 | (MCH) | HGB, RBCより算出 |
| 平均赤血球血色素濃度 | (MCHC) | HGB, HCTより算出 |
| 血小板数 | (PLT) | 暗視野板法 |
| 白血球百分率 | フローサイトケミストリー法 |
網状赤血球数(RC)についてはキャピロット(テルモ株式会社、東京都渋谷区)で染色後、血液塗抹標本を作製し鏡検した。
b) 血液化学的検査
クリーンシール(株式会社ヤトロン、東京都千代田区)に血液を採取し、30分間放置後3,000 r.p.m. 7分間遠心分離して得た血清を検査に用いた。生化学自動分析装置CentrifiChem ENCORE II(ベーカー社、米国)およびEKTACHEM 700N(コダック社、米国)を用いて下記の項目を測定した。
| 総蛋白(TP) | ビューレット法 |
| アルブミン(Alb) | B.C.G.法 |
| A/G | 計算値 |
| 血糖(Glu) | ヘキソキナーゼ法 |
| 尿素窒素(BUN) | ウレアーゼ改良法 |
| クレアチニン(Crea) | Jaffe 法 |
| 総ビリルビン(T-Bili) | ジアゾ色素法 |
| グルタミン酸オキザロ | |
| 酢酸トランスアミナーゼ(GOT) | Karmen改良法 |
| グルタミン酸ピルビン | |
| 酸トランスアミナーゼ(GPT) | Wroblewski and LaDue改良法 |
| γーグルタミルトランス | |
| ペプチダーゼ(γ-GTP) | 酵素法 |
| カルシウム(Ca) | アリザリン法 |
| 無機リン(IP) | モリブデンブルー法 |
| カリウム(K) | 電極法 |
| 塩素(Cl) | 電極法 |
a) 雄動物
45日間投与後、約16時間の絶食させ、エーテル麻酔下で放血安楽死させた。主要器官の肉眼的観察を行い、肝臓、腎臓、胸腺、精巣上体および精巣重量を測定し、器官重量・体重比を算出した。また、全動物の重量測定器官に加えて脳、心臓、脾臓、副腎、精嚢、前立腺、下垂体および肉眼所見で変化が認められた器官・組織として腹腔内の塊を10%中性緩衝ホルマリン液に固定した。なお、精巣および精巣上体はブアン氏液に固定した。
b) 自然分娩した雌
哺育4日にエーテル麻酔後放血安楽死させ、主要器官の肉眼的観察を行った後、肝臓、腎臓、胸腺および卵巣重量を測定し、器官重量・体重比を算出した。また、全動物の重量測定器官に加えて脳、心臓、脾臓、副腎、下垂体および肉眼所見で変化が認められた器官・組織として肺を10%中性緩衝ホルマリン液に固定した。また、剖検時に黄体数および着床痕数を調べた。
c) 交尾不成立の雌
45日間投与後、エーテル麻酔後放血安楽死させ、主要器官の肉眼的観察を行った後、皮膚、乳腺、リンパ節、唾液腺、胸骨、大腿骨(骨髄を含む)、胸腺、気管、肺および気管支、心臓、甲状腺および上皮小体、舌、食道、胃および十二指腸、小腸、大腸、肝臓、膵臓、脾臓、腎臓、副腎、膀胱、卵巣、子宮、腟、眼球、ハーダー腺、脳、下垂体および脊髄を10%中性緩衝ホルマリン液に固定した。
d) 自然分娩の認められない雌
妊娠25日にエーテル麻酔後放血安楽死させ、主要器官の肉眼的観察を行った後、皮膚、乳腺、リンパ節、唾液腺、胸骨、大腿骨(骨髄を含む)、胸腺、気管、肺および気管支、心臓、甲状腺および上皮小体、舌、食道、胃および十二指腸、小腸、大腸、肝臓、膵臓、脾臓、腎臓、副腎、膀胱、卵巣、子宮、腟、眼球、ハーダー腺、脳、下垂体および脊髄を10%中性緩衝ホルマリン液に固定した。着床痕が認められない動物は不妊と判定した。
 の多重比較検定で対照群と各投薬群間の有意差を検定した。Bartlettの等分散検定で不等分散の場合はKruskal-Wallisの順位検定を実施した。有意で各群の標本数が同数の場合はDunnettの順位検定、各群の標本数が異なる場合はScheff
の多重比較検定で対照群と各投薬群間の有意差を検定した。Bartlettの等分散検定で不等分散の場合はKruskal-Wallisの順位検定を実施した。有意で各群の標本数が同数の場合はDunnettの順位検定、各群の標本数が異なる場合はScheff の順位検定で対照群と各投薬群間の有意差を検定した。出産率、交尾率、受胎率についてはχ^2検定を行った。病理組織学検査で群間に程度差が認められた場合は累積カイ二乗検定を行った。なお、哺育期間中の新生児に関する成績は1母体当りの平均を1標本とした。有意水準は*:P< 0.05および**:P< 0.01とした。
の順位検定で対照群と各投薬群間の有意差を検定した。出産率、交尾率、受胎率についてはχ^2検定を行った。病理組織学検査で群間に程度差が認められた場合は累積カイ二乗検定を行った。なお、哺育期間中の新生児に関する成績は1母体当りの平均を1標本とした。有意水準は*:P< 0.05および**:P< 0.01とした。
一般状態の観察では、雌雄とも被験物質投与による変化は認められなかった。自然発生性の所見として雄の100 mg/kg群で腹腔内の腫瘤および泌尿生殖器の出血が投与7週に1例、眼分泌物が投与4週に、また切歯異常(上顎切歯折れ)が投与3週に同一個体の1例に観察された。雌では、眼分泌物が対照群で妊娠8日に1例および100 mg/kg群で妊娠13日から哺育1日にかけて1例に観察された。

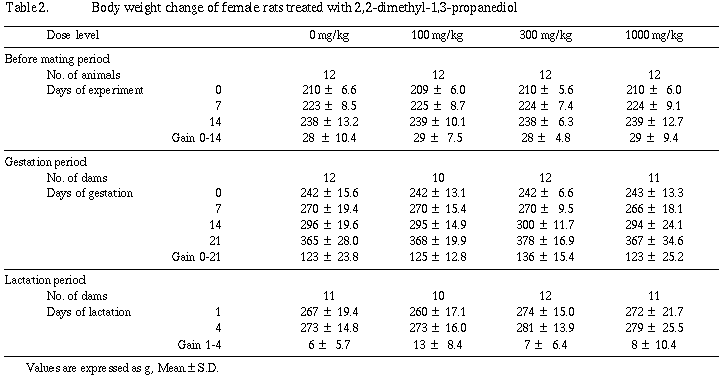

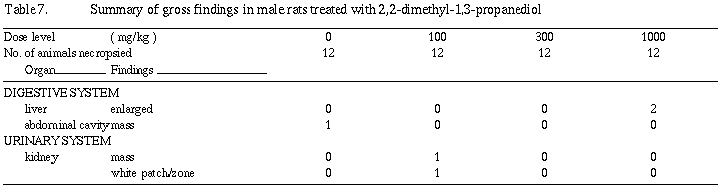

交尾の成立しなかった雌は100 mg/kg群に1例認められたが、異常所見は観察されなかった。妊娠の成立しなかった雌は100および1,000 mg/kg群の各1例に認められたが、被験物質投与の影響と考えられる異常所見は観察されなかった。
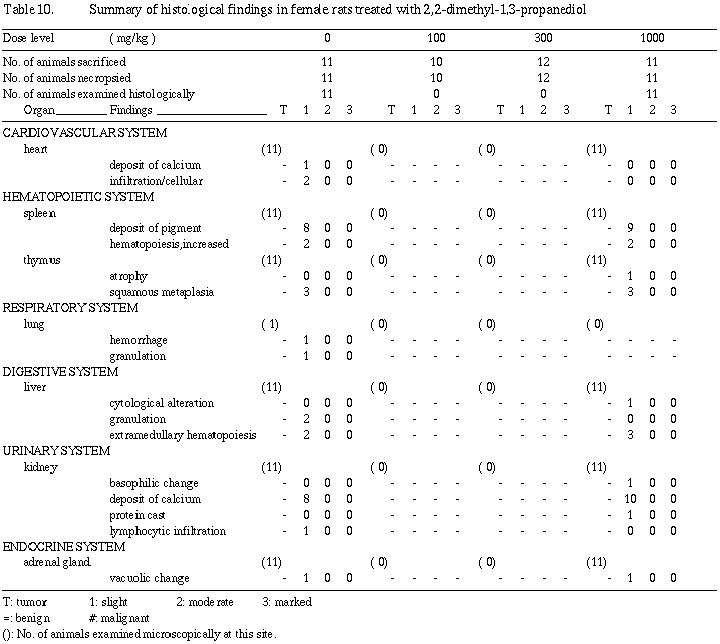
哺育4日の母動物の剖検では、被験物質投与による影響が示唆される所見は観察されなかった。自然発生性の病変と考えられる所見として、肺の有色斑/区域が対照群および100 mg/kg群にそれぞれ1例、肝臓の結節が100 mg/kg群に1例および卵巣の嚢胞が300 mg/kg群に1例観察された。
交尾の成立しなかった動物は100 mg/kg群で雌雄各1例認められた。これらの動物では、脾臓の色素沈着、腎臓の尿細管上皮好塩基性化・石灰沈着が雌雄に、心臓の石灰沈着、肝臓の小肉芽巣、腎臓の好酸性小体・蛋白円柱、副腎の空胞化が雄に観察された。
妊娠を成立させなかった雄および妊娠の成立しなかった雌は、100および1,000 mg/kg群で雌雄各1例認められた。これらの動物では、脾臓の色素沈着、肝臓の小肉芽巣が雌雄に、心臓の細胞浸潤、胸腺の扁平上皮化生、腎臓の尿細管上皮好塩基性化・好酸性小体・リンパ球浸潤、副腎の空胞化が雄に、腎臓の石灰沈着が雌にそれぞれ認められた。
分娩が認められなかった雌は対照群の1例に認められた。この動物では、脾臓の色素沈着、腎臓の石灰沈着・リンパ球浸潤が観察された。
性周期観察では、100 mg/kg群の1例に偽妊娠と考えられる性周期の停止(連続した発情休止期像)が11日間連続して認められたが交尾はその後成立した。その他、1,000 mg/kg群の平均性周期は対照群の4.0日に比べて4.3日と長く、統計学的有意差が認められた。

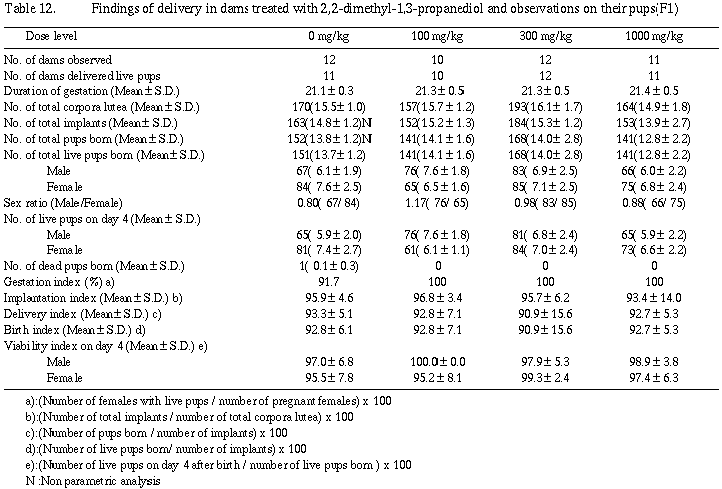
哺育1および4日の体重は雌雄ともに群間差がなく統計学的有意差は認められなかった。
死産児および哺育4日までの死亡児の剖検では、主要器官の異常は認められなかった。哺育4日の剖検では、肝臓の奇形結節(過形成)が300 mg/kg群の1例に観察されたのみでその他異常は観察されなかった。
体重および摂餌量は雌雄ともに群間で差はなく被験物質投与の影響は認められなかった。
雄の血液学的検査では、いずれの検査項目においても被験物質投与の影響と考えられる変化はなかった。血液化学的検査では、300および1,000 mg/kg群でアルブミンの増加に伴う総蛋白の増加および総ビリルビンの増加が認められ、さらに1,000 mg/kg群で血糖値の減少が認められた。これら、1,000 mg/kg群で認められたアルブミン、総蛋白および総ビリルビンの増加は、肝臓に対する影響を示唆するものであり、被験物質投与の影響と考えられた。
器官重量は雌においては被験物質投与の影響が認められなかったが、雄では300および1,000 mg/kg群で肝臓の実重量および相対重量が増加し、さらに1,000 mg/kg群で腎臓の実重量および相対重量が増加した。また、300 mg/kg群では統計学的有意差は認められないものの腎臓の実重量および相対重量が増加傾向を示した。肝臓重量の増加に関連する剖検所見として、雄の1,000 mg/kg群で12例中2例に肝臓の肥大が観察され、被験物質投与の影響と考えられた。組織学検査では、肝臓の肥大を裏付ける明確な形態的変化は認められず、光顕所見には現われない程度の機能的増大による肥大と考えられる。その他、腎臓の蛋白円柱と硝子滴変性が病変の程度としては軽度ではあるが雄の1,000 mg/kg群で発生数の増加または増加傾向を示した。また、同群の腎尿細管上皮の中等度好塩基性化は11例中4例に観察された。これら腎臓の変化は、被験物質投与による特異的な変化ではなく、対照群にも観察されるような自然発生的な病変が雄では被験物質投与により増強されたものと考えられた。分娩不能動物、交尾不成立動物および妊娠不成立動物の組織学検査では、それぞれの原因に関連すると考えられる異常所見は認められなかった。
以上のことから、2, 2−ジメチル−1, 3−プロパンジオールは、300 mg/kg/day以上の投与で雄の場合、肝臓および腎臓重量の増加または増加傾向、また、1,000 mg/kg/day投与でアルブミンの増加に伴う総蛋白の増加および総ビリルビンの増加、血糖値の減少、腎臓の蛋白円柱、硝子滴変性数の増加または増加傾向、尿細管上皮の好塩基性化の程度の増強および肝臓の肥大を誘起した。雌では1,000 mg/kg/day投与によっても認められなかった。したがって、反復投与毒性の最大無影響量は、雄では100 mg/kg/day、雌では1,000mg/kg/dayと判断された。
分娩時観察では、対照群の1例を除き、妊娠動物の全例が正常に分娩し、哺育期間を通じ被験物質投与の影響は認められなかった。また、新生児の外表検査でも被験物質投与によると考えられる異常はなく、体重も哺育4日まで群間に差はなく順調に増加した。
死産児および哺育4日までの死亡児ならびに哺育4日の剖検では、被験物質投与によると考えられる異常所見は認められなかった。
以上のことから、2, 2−ジメチル−1, 3−プロパンジオールの雌雄の生殖に及ぼす影響および児動物の発生に及ぼす影響は、1,000 mg/kg/day投与によっても認められず、最大無影響量はともに1,000mg/kg/dayと判断された。
| 1) | Govt. Reports Announcements & Index, NTIS/PB 89-215776 (1982). |
| 2) | C. G. Shayne and S.W.Carrol, "Statics and Experimental Design For Toxicologists," Telford Press, 1986. |
| 3) | 佐久間昭 "薬効評価 I−計画と解析−," 東京大学出版会, 1977. |
| 4) | 石居進, "生物統計学入門," 培風館, 1975. |
| 連絡先: | |||
| 試験責任者 | 萩田孝一 | ||
| (財)食品農医薬品安全性評価センター | |||
| 〒437-12 静岡県磐田郡福田町塩新田字荒浜 582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence: | |||
| Hagita, Koichi | |||
| Biosafety Research Center, Foods, Drugs and Pesticides (An-pyo Center), Japan | |||
| 582-2 Shioshinden Arahama, Fukude-cho, Iwata-gun, Shizuoka, 437-12, Japan | |||
| Tel 81-538-58-1266 | Fax 81-538-58-1393 | ||