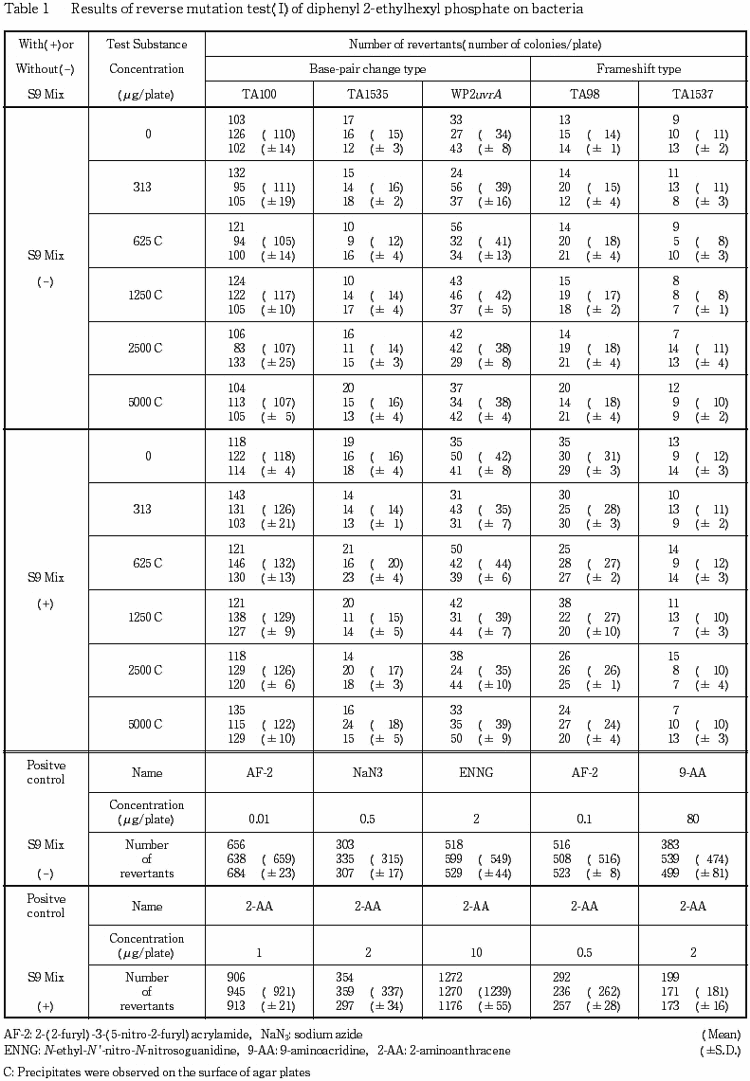
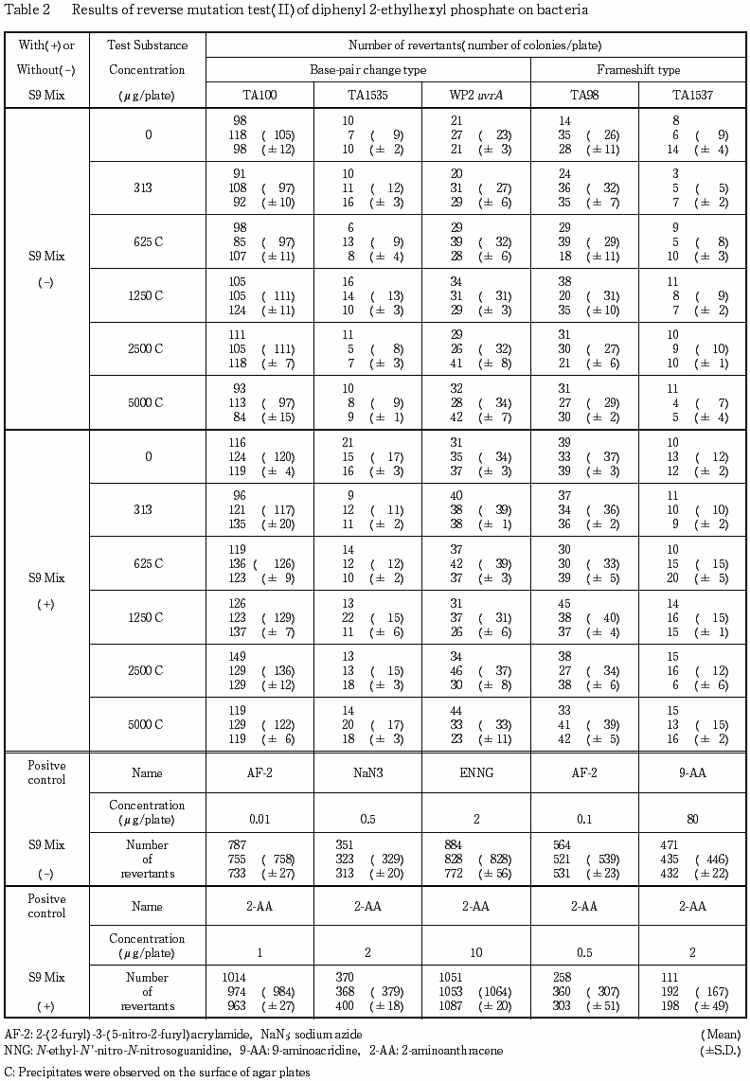
検定菌として,Salmonella typhimurium(TA100,TA1535,TA98,TA1537)およびEscherichia coli(WP2 uvrA)を用い,プレインキュベーション法により実施した.予備試験の結果をもとに,本試験ではS9 mix非共存下および共存下の各菌株について5000〜313μg/プレート(公比2)の5濃度を設定した.
2回の本試験の結果とも,S9 mixの有無によらず,いずれの菌株においても陰性対照値の2倍以上を示す復帰変異コロニー数の増加は認められなかった.
以上の結果より,本試験条件下ではリン酸(2-エチルヘキシル)ジフェニルエステルは,変異原性を有さない(陰性)と判定された.
試験に際して,各凍結菌株を融解後,その20μlをニュートリエントブロス(Oxoid Nutrient Broth No.2,Unipath社)25 gを1 lの精製水に溶解して作成した液体完全培地10 mlに接種し,37℃で8時間振盪培養した.培養終了後の菌懸濁液は菌濃度を測定した後,試験に使用した.
リン酸(2-エチルヘキシル)ジフェニルエステルはジメチルスルホキシド(DMSO,ロット番号:708S1611,関東化学(株))を用いて最高濃度(50 mg/ml)の溶液を調製した後,同溶媒で公比2で希釈したものを用いた.
| AF-2: | 2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリルアミド | (純度:98.8%,和光純薬工業(株)) |
| NaN3: | アジ化ナトリウム | (純度:96.5%,和光純薬工業(株)) |
| ENNG: | N-エチル-N '-ニトロ-N-ニトロソグアニジン | (純度:99.0%,Sigma Chemical Co.) |
| 9-AA: | 9-アミノアクリジン | (純度:99%,Sigma Chemical Co.) |
| 2-AA: | 2-アミノアントラセン | (純度:98.0%,和光純薬工業(株)) |
| 硫酸マグネシウム七水塩 | 0.2 g |
| クエン酸一水塩 | 2 g |
| リン酸水素二カリウム無水塩 | 10 g |
| リン酸-アンモニウム | 1.92 g |
| 水酸化ナトリウム | 0.66 g |
| ブドウ糖 | 20 g |
| 寒天(OXOID Agar No.1) | 15 g |
| S9* | 0.1 ml |
| 塩化マグネシウム六水塩 | 8μmol |
| 塩化カリウム | 33μmol |
| D-グルコース6-リン酸 | 5μmol |
| β-NADPH | 4μmol |
| β-NADH | 4μmol |
| ナトリウム-リン酸緩衝液(pH 7.4) | 100μmol |
| 滅菌精製水 | 残量 |
| *: | 購入したS9(キッコーマン(株))を使用した.このS9は,7週齢の雄性SD系ラットにフェノバルビタールと5,6-ベンゾフラボンを併用投与して作製した肝ホモジネートの9000 × g 遠心上清分画である. |
試験管に被験物質溶液0.1 mlを分注し,0.1 Mナトリウム-リン酸緩衝液(pH 7.4)0.5 mlと菌懸濁液0.1 mlを加え,37℃で20分間振盪した.S9 mixを共存させる場合には,0.1 Mナトリウム-リン酸緩衝液の代わりに S9 mixを0.5 ml加えた.プレインキュベーション後,トップアガー2 mlを上記の試験管に加えて混和し,最少グルコース寒天平板培地に重層した.重層したトップアガーが凝固した後,37℃で48時間培養した.実体顕微鏡を用いて菌叢の生育状態を観察し,被験物質による抗菌性の有無を調べた後,プレート上の復帰変異コロニー数を自動コロニーカウンターで計測した.予備試験は各濃度あたり1 枚のプレートを使用した.本試験は各濃度あたり3枚のプレートを使用し,再現性を確認するため2回実施した.また,被験物質溶液の代わりに陰性対照物質(溶媒)および各菌株毎の陽性対照物質を用いて,被験物質群と同様の操作を行う対照群を設けた.
S9 mix非共存下および共存下の625μg/プレート以上で沈殿物が認められた.
以上の結果から,リン酸(2-エチルヘキシル)ジフェニルエステルの変異原性は陰性と結論した.

| 1) | D.M. Maron and B.N. Ames, Mutation Research,113, 173-215(1983). |
| 2) | M.H.L. Green and W.J. Muriel, Mutation Research,38, 3-32(1976). |
| 連絡先 | |||
| 試験責任者: | 水野 文夫 | ||
| 試験担当者: | 榎本 佳明,石毛 裕子 | ||
| (株)三菱化学安全科学研究所 鹿島研究所 | |||
| 314-02 茨城県鹿島郡波崎町砂山14 | |||
| Tel 0479-46-2871 | Fax 0479-46-2874 | ||
| Correspondence | ||||
| Authors: | Fumio Mizuno(Study director) Yoshiaki Enomoto,Yuko Ishige | |||
| Mitsubishi Chemical Safety Institute Ltd.,Kashima Laboratory | ||||
| 14 Sunayama,Hasaki-machi,Kashima-gun,Ibaraki,314-02 Japan | ||||
| Tel +81-479-46-2871 | Fax +81-479-46-2874 | |||