4-エチルフェノールのラットを用いる28日間反復経口投与毒性試験
Twenty-eight-day Repeat Dose Oral Toxicity Test of 4-Ethylphenol in Rats
要約
4-エチルフェノールは,反応性高分子(ポリパラビニルフェノール)原料,酸化防止剤,医薬品・農薬・染料などの原料として使用されている1).4-エチルフェノールを0(オリブ油),100,300および1000 mg/kgの投与量で,1群当たり雌雄各7あるいは14匹のCrj:CD(SD)IGSラットに28日間反復経口投与してその毒性を検討した.さらに,0および1000 mg/kg群の雌雄各7匹を用いて投与終了の翌日から14日間観察を継続して投与期間終了時にみられた毒性の回復性についても併せて検討した.
100 mg/kg群では,いずれの検査項目にも変化はみられなかった.
300 mg/kg群では,投与期間終了時に雄の肝臓の絶対重量および相対重量に高値がみられた.病理組織学検査では,雄で前胃に扁平上皮過形成が認められた.
1000 mg/kg群の一般状態は,投与期間を通して投与後約1時間までの間によろめき歩行または流涎が雌雄とも観察された.回復期間中には異常は観察されなかった.体重は,雄で投与7日から28日に,雌で投与14日から28日に低値がみられた.回復期間中は,雌雄とも体重は対照群より低値であったが,体重増加率は対照群を上回り,回復傾向がみられた.摂餌量は,雌雄とも投与期間中低値がみられた.投与4週の尿検査では,雌の尿量に高値がみられた.投与期間終了時の血液生化学検査では,雄でGPTの高値,雌で総コレステロールの高値がみられた.器官重量は,雄で肝臓および腎臓の相対重量,雌で肝臓の相対重量に高値がみられた.剖検では,雌雄とも前胃の粘膜肥厚が高頻度でみられ,病理組織学検査では,雌雄とも前胃に扁平上皮過形成が認められた.これらの変化は,回復期間終了時にはみられなかった.
以上のことから,本試験条件下における無影響量(NOEL)は,雄で100 mg/kg/day,雌で300 mg/kg/dayであると結論される.
方法
1. 被験物質および投与液の調製
4-エチルフェノール(純度:98.3 %,Lot No. 81029A,丸善石油化学(株),東京)は,白色結晶で,融点が44.8 ℃,沸点が219 ℃,水に不溶,アセトン,DMSOおよびエーテルに可溶である.入手後の被験物質は遮光気密容器に入れ,冷所で保存した.残余被験物質を製造業者が分析し,投与期間中の被験物質の安定性を確認した.投与液の調製は,投与量ごとに被験物質を精秤し,所定の濃度となるように溶媒である日本薬局方オリブ油(ヤクハン製薬(株)を加えて溶解することによって行った.調製液は,室温で3時間,冷暗所保存条件下で8日間安定であることが確認されていることから,調製後直ちに遮光気密容器に入れて冷蔵庫内(2〜8 ℃)に保存し,調製後7日以内に使用した.投与に用いる初回および最終調製時の各濃度の調製液について被験物質の濃度を分析した結果,含有率は設定値の98.5〜102 %であり,調製液は規定の濃度を含有することを確認した.
2. 試験動物および飼育条件
日本チャールス・リバー(株)よりSprague-Dawley系ラット(Crj:CD(SD)IGS)の雌雄を4週齢で購入して雄は6日間,雌は7日間の検疫・馴化を行った後,健康な動物を雌雄各42匹選択して5週齢で試験に供した.投与開始日の体重範囲は雄が150〜168 g,雌が122〜147 gであった.動物は,温度21〜24 ℃,湿度37〜61 %,換気回数10〜15回/時間および照明時間12時間(8:00から20:00まで点灯)に制御されたバリアシステムの飼育室で,ブラケット式金属製金網床ケージに群分け前は5匹以内,群分け後は個別で飼育した.飼料はγ線照射固型飼料(CRF-1,オリエンタル酵母工業(株)を金属製給餌器を用いて,飲料水は札幌市水道水を自動給水装置を用いてそれぞれ自由に摂取させた.
3. 投与量および投与方法
投与量設定試験では,0,250,500,1000および2000 mg/kg/dayの投与量で1群雌雄各5匹のSD系ラットに14日間経口投与した.その結果,2000 mg/kg群では投与3日までに雌雄とも全例死亡した.1000 mg/kg群では,雌1例の死亡,雌雄の体重および摂餌量の低値,前胃粘膜の肥厚,肝臓の相対重量の高値がみられた.血液生化学検査では,1000 mg/kg群の雄でGPTと総コレステロールの高値がみられた.500 mg/kg群の雄ではGPTの高値がみられた.250 mg/kg群には被験物質の投与によると思われる変化は認められなかった.以上のことから,28日間反復経口投与毒性試験の本試験では,雌雄のラットに確実に毒性が認められると予測される1000 mg/kgを最高用量とし,以下公比約3で除して300および100 mg/kgの3用量群とし,これに溶媒(オリブ油)のみを同様に投与する対照群を含めた計4群を設定した.1群の動物数は雌雄とも7または14匹とし,投与前々日の体重に基づいて層化無作為抽出法により群分けを行った.
投与に際しては,ラット用胃ゾンデを用いて1日1回,28日間の計28回,強制的に胃内に投与した.投与容量を5 mL/kgとし,各動物の投与液量は投与日に最も近い測定日の体重に基づいて算出した.
4. 検査項目
1) 一般状態観察
投与期間および回復期間中,全例について1日1回以上の頻度で観察した.
2) 体重および摂餌量測定
体重は全例について,投与1日(投与前),投与2,7,14,21および28日(投与終了日),回復1,7および14日ならびに剖検日に測定し,投与1日から28日,回復1日から14日の体重増加量および体重増加率を算出した.また,摂餌量は剖検日を除いて体重と同じ日に測定した.
3) 尿検査
投与4週および回復2週に全例を代謝ケージに収容して非絶食下で採尿を行い,同時に採尿中の飲水量(重量)も測定した.約3時間の蓄尿についてpH,蛋白,糖,ケトン体,ウロビリノーゲン,ビリルビン,潜血反応(以上,マルティスティックス,バイエル・三共)および色調(肉眼観察)ならびに沈渣(鏡検)を検査し,21時間蓄尿について尿量(容量)および比重(屈折計法,アタゴ)を測定した.
4) 血液学検査
全例について剖検時に16〜20時間絶食させた後,エーテル麻酔下で腹部大動脈より採血し,EDTA・2Kで処理した血液を用いて赤血球数,ヘマトクリット値,血小板数,白血球数(以上,電気抵抗法),ヘモグロビン量(シアンメトヘモグロビン法)(以上,自動血球計数装置F-820,シスメックス),平均赤血球容積(赤血球数,ヘマトクリット値より算出),平均赤血球ヘモグロビン量(赤血球数,ヘモグロビン量より算出),平均赤血球ヘモグロビン濃度(ヘマトクリット値,ヘモグロビン量より算出),網赤血球数(Brecher法)および白血球百分比(May-Gr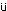 nwald-Giemsa染色)を測定した.また,3.8 %クエン酸ナトリウムで処理した後,3000回転/分で10分間遠心分離して得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血液凝固自動測定装置アメルングKC-10A,バクスター)を測定した.
nwald-Giemsa染色)を測定した.また,3.8 %クエン酸ナトリウムで処理した後,3000回転/分で10分間遠心分離して得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血液凝固自動測定装置アメルングKC-10A,バクスター)を測定した.
5) 血液生化学検査
血液学検査と同様に,全例について腹部大動脈より採血し,ヘパリン処理した後,3000回転/分で10分間遠心分離して得られた血漿を用いてGOT(IFCC法),乳酸脱水素酵素(Wr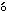 blewski & La Due法)およびグルコース(ヘキソキナーゼ法)を測定し,無処理血液を3000回転/分で10分間遠心分離して得られた血清を用いてGPT(IFCC法),アルカリホスファターゼ(Bessey-Lowry法),γ-GTP(包接L-γ-グルタミル-ρ-ニトロアニリド基質法),総コレステロール(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff
blewski & La Due法)およびグルコース(ヘキソキナーゼ法)を測定し,無処理血液を3000回転/分で10分間遠心分離して得られた血清を用いてGPT(IFCC法),アルカリホスファターゼ(Bessey-Lowry法),γ-GTP(包接L-γ-グルタミル-ρ-ニトロアニリド基質法),総コレステロール(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff 法),カルシウム(OCPC法),無機リン(Fiske-SubbaRow法),総蛋白(ビウレット法)(以上,自動分析装置7150形,日立製作所),ナトリウム,カリウム(以上,炎光光度法,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),蛋白分画およびA/G比(以上,セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
法),カルシウム(OCPC法),無機リン(Fiske-SubbaRow法),総蛋白(ビウレット法)(以上,自動分析装置7150形,日立製作所),ナトリウム,カリウム(以上,炎光光度法,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),蛋白分画およびA/G比(以上,セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
6) 剖検および器官重量測定
投与28日および回復14日の翌日に全例について,体外表を観察し,エーテル麻酔下で採血後放血致死させ剖検した.また,脳,肺,心臓,肝臓,腎臓,脾臓,副腎,下垂体,胸腺,甲状腺(上皮小体含む),精巣,精巣上体および卵巣の重量を測定するとともに,絶対重量を剖検日の体重で除し100を乗じて相対重量を算出した.
7) 病理組織学検査
全例について脳(大脳および小脳),下垂体,胸腺,甲状腺,上皮小体,副腎,脾臓,心臓,胸部大動脈,舌,食道,胃(前胃および腺胃),肝臓,膵臓,十二指腸,空腸,回腸(パイエル板含む),盲腸,結腸,直腸,喉頭,気管,肺(気管支含む),腎臓,膀胱,前立腺,精嚢(凝固腺含む),卵巣,子宮(角部および頸部),膣,乳腺(原則として右腹部,雌のみ),皮膚(腹部),胸骨(骨髄含む),大腿骨(骨髄含む),脊髄(頸部),骨格筋(大腿部),腸間膜リンパ節,下顎リンパ節,顎下腺,舌下腺,耳下腺および坐骨神経を10 %中性緩衝ホルマリン液で,眼球およびハーダー腺をデビッドソン液で固定・保存し,精巣および精巣上体をブアン液で固定後70 %エタノールで保存した.これらの器官・組織を常法に従ってパラフィン包埋後,薄切してヘマトキシリン・エオジン染色標本を作製し,対照群および高用量群の全例を鏡検した.さらに前胃,喉頭,食道および腺胃は,その他の用量群の雌雄の動物全例,ならびに腎臓は雄全例を鏡検した.
5. 統計解析
体重,体重増加量,体重増加率,摂餌量,尿検査の定量的項目,血液学検査,血液生化学検査,器官の絶対重量および相対重量の結果についてBartlettの検定法を行い,等分散性を解析した.等分散の場合は一元配置分散分析法で解析し,不等分散の場合はKruskal-Wallisの検定法で解析した.一元配置分散分析の結果,有意差がみられた場合は,Dunnettの検定法で解析した.Kruskal-Wallis法の解析の結果,有意差がみられた場合は,Mann-WhitneyのU-検定法で解析した.
尿比重および尿検査の定性的項目の結果については,Kruskal-Wallisの検定法で解析し,有意差がみられた場合は,Mann-WhitneyのU-検定法を用いて解析した.
これら対照群と被験物質投与群との間の検定においては,いずれも有意水準を5 %とした.
結果
1. 一般状態
1000 mg/kg群では,流涎が投与6日以降投与終了日までの期間中,雄で9例,雌で6例に投与直後から30分の間に観察された.また,よろめき歩行が雄で投与1,3,10,17日に,雌で投与3,14,16日に各1例観察され,これらのうち,投与1日の雄1例および投与3日の雌1例には横臥も観察された.これらの症状は,投与後数分から発現し,発現後約1時間で消失した.その他に,外尿道口周囲の被毛の汚れが雄で投与15日に1例観察され,雌では投与期間を通して散見された.回復期間にはいずれの動物にも変化は認められなかった.
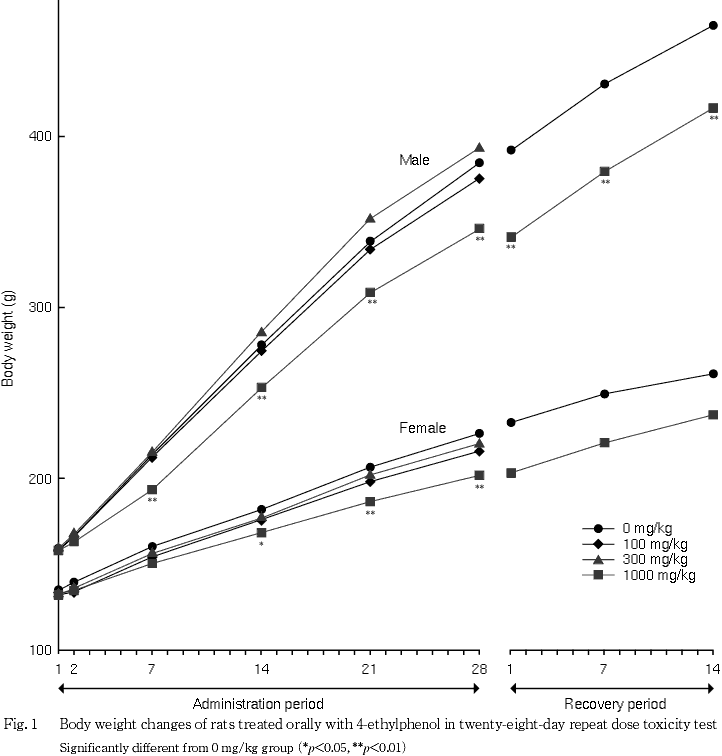
2. 体重(Fig. 1)
投与期間中,100および300 mg/kg群では雌雄とも対照群と比較して有意な差は認められなかった.1000 mg/kg群では,雄で投与7日から28日まで,雌で投与14日から28日までの各測定日の体重に対照群と比較して有意な低値が認められた.投与期間中の体重増加量および体重増加率も雌雄とも有意な低値であった.
1000 mg/kg群の回復期間の体重は,期間を通して雄は有意な低値、雌は低値傾向を示した.しかし,雌雄とも体重増加量は対照群を上回り,体重増加率は有意な高値であった.
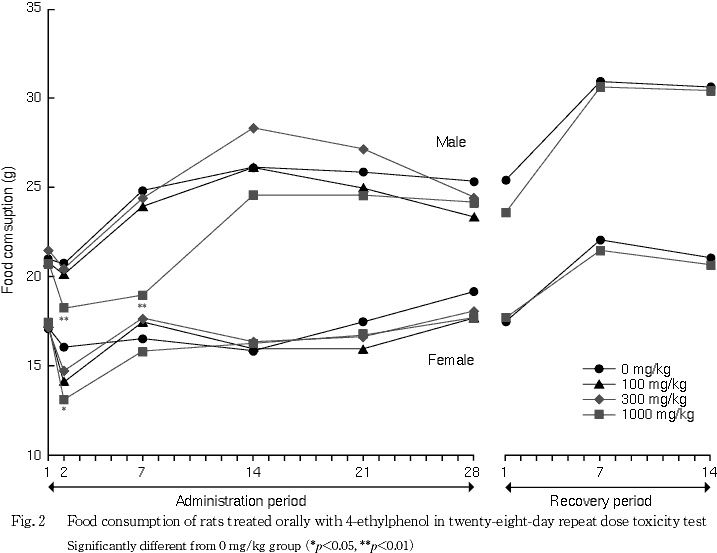
3. 摂餌量(Fig. 2)
投与期間中,100および300 mg/kg群では雌雄とも対照群と比較して有意な差は認められなかった.1000 mg/kg群の摂餌量は,雄で投与2日および7日に,雌で投与2日に対照群と比較して有意な低値が認められた.
1000 mg/kg群の回復期間の摂餌量には,雌雄とも対照群と比較して有意な差は認められなかった.
4. 尿検査および飲水量
投与4週の検査では,1000 mg/kg群の雌で尿量が有意な高値であったこと以外,雌雄ともいずれの投与群においても,対照群と比較して有意な差は認められなかった.
回復2週の検査では,いずれの検査項目にも変化は認められなかった.
5. 血液学検査(Table 1, 2)
投与期間終了時の検査では,300 mg/kg群において,雄の平均赤血球容積および雌の桿状核好中球の比率が対照群と比較して有意な高値であったが,1000 mg/kg群におけるそれらの値は対照群とほぼ同じであったことから偶発的な変動と考えられた.その他の検査項目では,いずれの投与群においても対照群と比較して有意な差は認められなかった.
回復期間終了時には,1000 mg/kg群の雌で赤血球数の有意な低値および平均赤血球ヘモグロビン量の有意な高値がみられたが,いずれも偶発的な変化と考えられた.
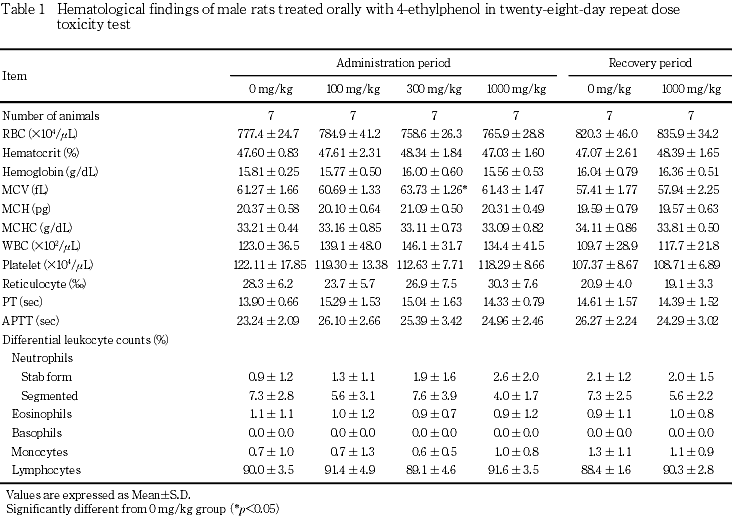
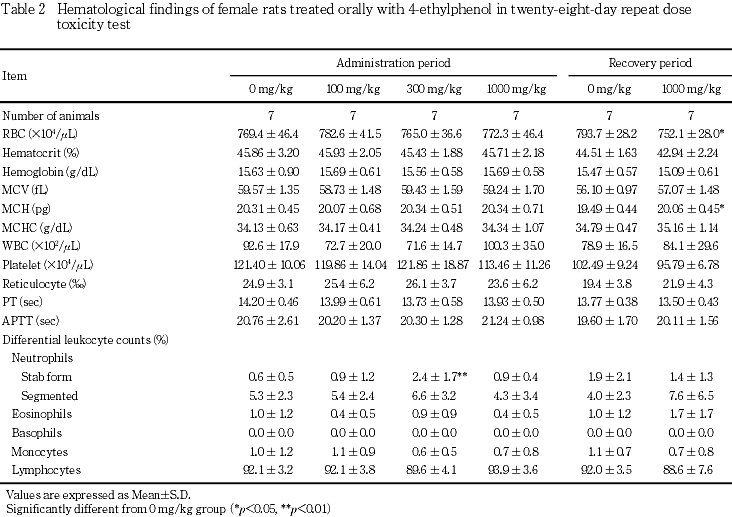
6. 血液生化学検査(Table 3, 4)
投与期間終了時の検査では,100 mg/kg群の雄でアルブミン分画およびA/G比の低値,雌でナトリウムの高値,300 mg/kg群の雄でグルコースの高値がみられたが,これらはいずれも1000 mg/kg群では認められない変化であった.1000 mg/kg群では,雄でGPTが対照群と比較して有意な高値を示した.その他にgグロブリン分画およびナトリウムの有意な低値がみられたが,関連項目に明らかな変化のないことから,4-エチルフェノール投与と関連のない変化と考えられた.雌では,γ-GTP,総コレステロールおよびトリグリセリドに有意な高値がみられた.これらのうちγ-GTPの高値は対照群の変動範囲が狭いことによるもの,トリグリセリドの高値は特に高値を示した個体が1例みられたことによる変動であり,4-エチルフェノール投与と関連のない変化と考えられた.
回復期間終了時には,1000 mg/kg群で,雄の総ビリルビンおよび無機リンならびに雌のアルカリホスファターゼに有意な高値がみられたが,いずれも軽度な変化であり,偶発的な変動と考えられた.
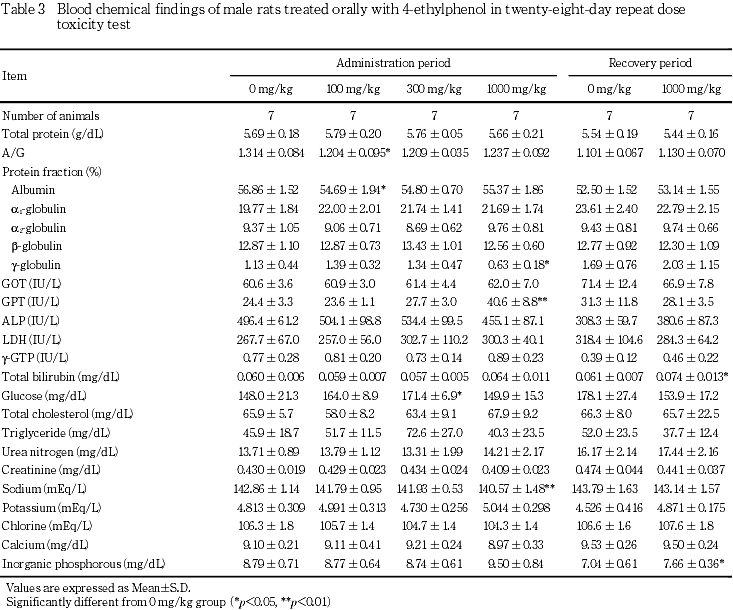
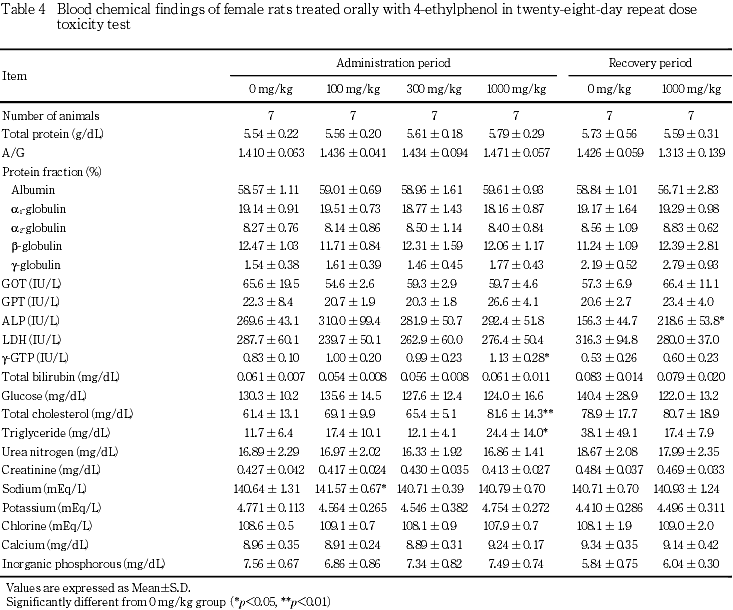
7. 剖検
投与期間終了時には,100および300 mg/kg群では,雌雄とも異常は認められなかった.1000 mg/kg群では,前胃粘膜の肥厚が雄で5例,雌で6例にみられた.さらに同群の雌1例の腺胃粘膜に暗赤色斑がみられた.
回復期間終了時には,1000 mg/kg群の雌雄とも異常は認められなかった.
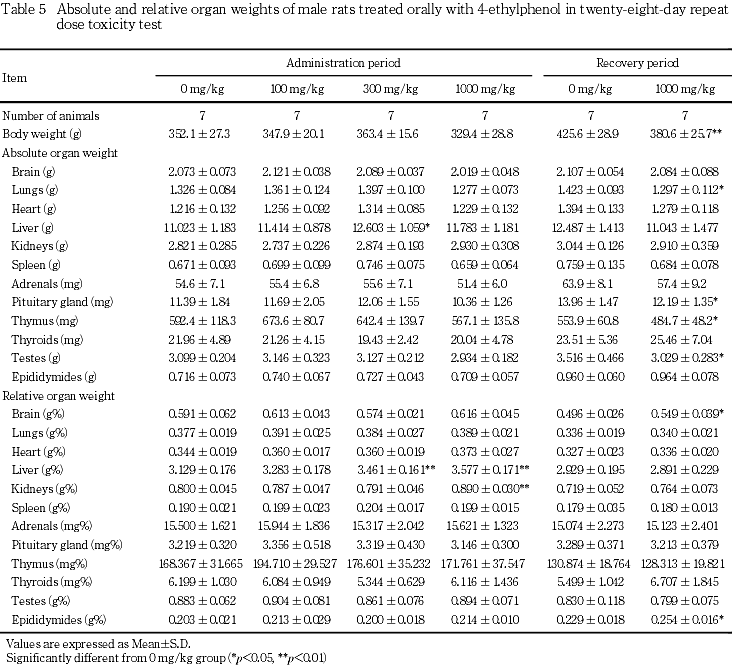
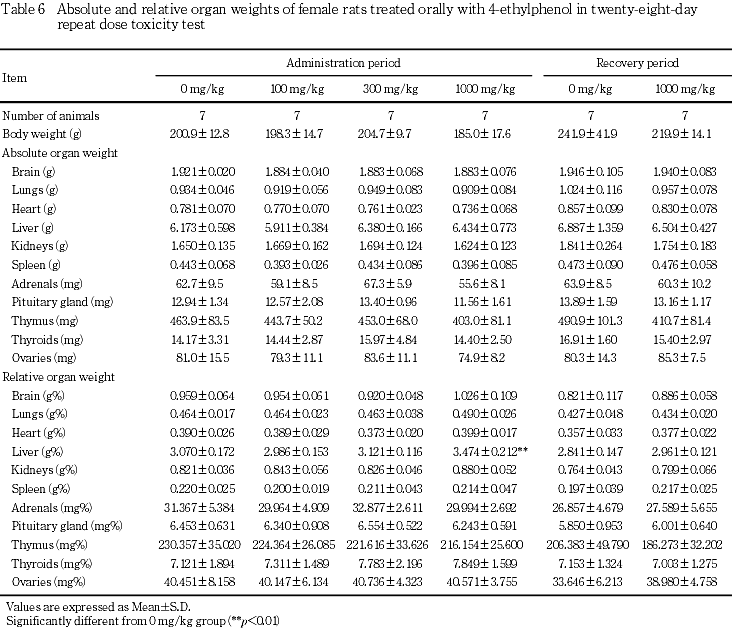
8. 器官重量(Table 5, 6)
投与期間終了時には,雄では,300 mg/kg群において肝臓の絶対重量および相対重量に対照群と比較して有意な高値が認められた.1000 mg/kg群では,肝臓の絶対重量に高値傾向がみられ,相対重量は有意な高値であった.また,腎臓の相対重量に有意な高値がみられた.雌では,1000 mg/kg群で肝臓の絶対重量に高値傾向がみられ,相対重量が有意な高値であった.
回復期間終了時には,1000 mg/kg群の雄では,剖検日の体重が有意な低値を示し,肺,下垂体,胸腺および精巣の絶対重量に有意な低値がみられたが,相対重量には有意差はなかった.脳および精巣上体の相対重量は有意な高値であった.雌では,いずれの器官の重量にも対照群との間に有意な差はみられなかった.
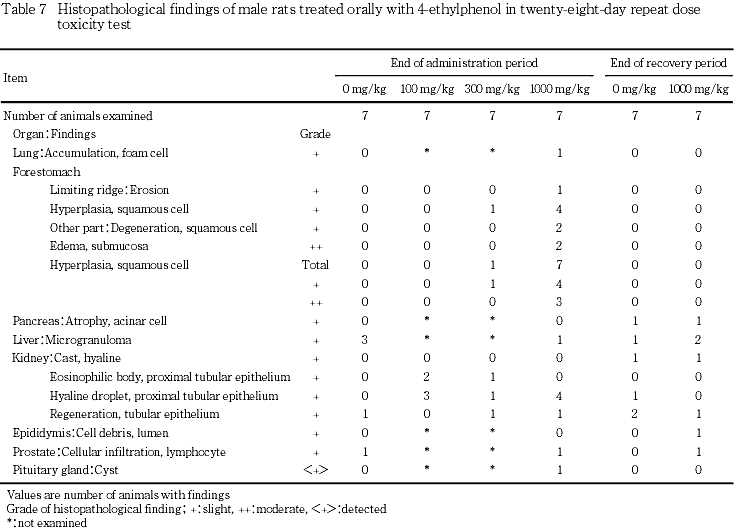
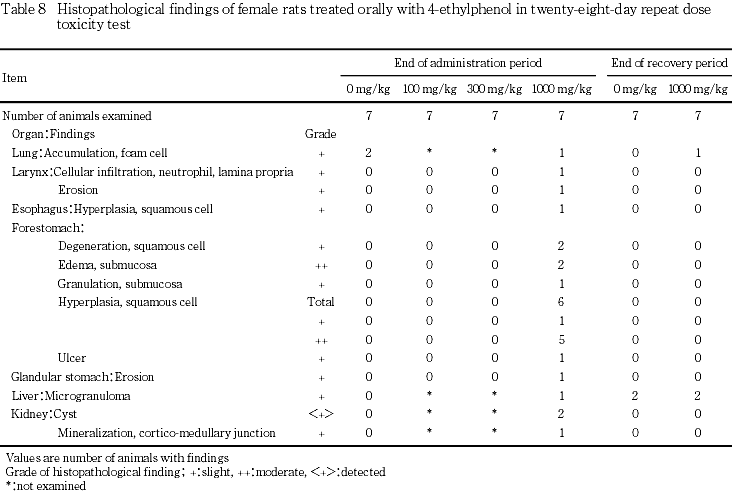
9. 病理組織学検査(Table 7, 8)
投与期間終了時の検査では,1000 mg/kg群の雌雄において消化管に変化が認められ,雄で,前胃境界縁におけるびらんが1例と扁平上皮過形成が4例,前胃のその他の部位の扁平上皮の変性と粘膜下織の水腫が各2例,扁平上皮過形成が7例全例(軽度;4例,中等度;3例)にみられた.雌では,喉頭の粘膜固有層における好中球浸潤,喉頭のびらん,食道の扁平上皮過形成が各1例,前胃の扁平上皮の変性と粘膜下織の水腫が各2例,粘膜下織における肉芽形成が1例,扁平上皮過形成が6例(軽度;1例,中等度;5例),潰瘍が1例にみられた.300 mg/kg群では,雄で前胃境界縁における扁平上皮過形成,前胃のその他の部位の扁平上皮過形成(軽度)が各1例みられた.さらに,雄では近位尿細管上皮の硝子滴が,100,300および1000 mg/kg群でそれぞれ,3例,1例および4例みられた.これらの変化は,回復期間終了時には認められなかった.
考察
1000 mg/kg群では,一般状態の変化として雌雄ともよろめき歩行または流涎が投与直後から1時間の間に認められた.これらの症状は回復期間中にはみられなかった.体重は雌雄とも投与期間中増加が抑制され,低値がみられた.回復期間には雌雄とも体重は対照群より低値であったが,回復期間終了時の体重増加率は対照群を上回っており,回復傾向がみられた.摂餌量には投与期間中にのみ雌雄で低値がみられた.
投与4週の尿検査で認められた雌の尿量の高値については,同時期に当試験施設で実施された3-メチルフェノールおよび3-アミノフェノールの28日間反復経口投与毒性試験2, 3)の高用量群の雄または雌において同様の変化が認められていることから,フェノール類に共通の変化であり,4-エチルフェノール投与に起因するものと考えられた.回復2週の検査では同じ変化はみられなかった.
投与期間終了時の血液生化学検査で雄のGPTおよび雌の総コレステロールの高値がみられた.雄のGPTの高値は,用量設定試験でも認められているが,GOT,アルカリホスファターゼ,γ-GTP,総ビリルビン等の肝機能検査に変化がないことから,肝障害に基づく変化ではないと考えられた.総コレステロールの高値は,用量設定試験では雄に,本試験では雌に認められ,4-エチルフェノールが脂質代謝系に対して影響を及ぼす可能性が考えられた.回復期間終了時には,投与期間終了時に変化のみられた項目にはいずれも異常はなく,回復性が認められた.
剖検では,前胃の粘膜肥厚が雌雄とも高頻度で発現し,病理組織学検査においても前胃に扁平上皮過形成が雄では全例に,雌では7例中6例にみられ,その他にびらん,扁平上皮の変性と粘膜下織の水腫,粘膜下織における肉芽形成または潰瘍等の変化がみられた.その他の消化管の病理組織学検査では雌で腺胃粘膜のびらん,喉頭の粘膜固有層における好中球浸潤,喉頭のびらん,食道の扁平上皮過形成が各1例認められた.これらの変化はいずれも,4-エチルフェノールが皮膚・粘膜に刺激性を持つ1)ことによるものと考えられた.回復期間終了時には,これらの変化は認められなかった.
器官重量は,投与期間終了時に雌雄の肝臓の重量および相対重量に高値傾向または高値がみられた.雄では,さらに腎臓の相対重量に有意な高値がみられた.しかし,雌雄の肝臓および雄の腎臓には4-エチルフェノール投与に起因すると考えられる病理組織学的異常は認められなかった.回復期間終了時に雄で肺,下垂体,胸腺および精巣の絶対重量の低値,脳および精巣上体の相対重量の高値がみられたが,体重の低値に伴った変化と考えられた.
その他の1000 mg/kg群における病理組織学的所見のうち,投与期間終了時に雄において腎臓の近位尿細管上皮の硝子滴の発現率が対照群の0 %に対して57.1 %と高かったが,変化の程度が軽度であること,自然発生で認められることが知られている4, 5)こと,ならびに当試験施設の過去5年間9試験での背景データにおける発現率(0〜71.4 %)の範囲内であることから,毒性学的意義は低いと考えられた.100および300 mg/kg群では,腎臓の近位尿細管上皮の硝子滴の発現の増加は認められなかった.
300 mg/kg群では,雄において投与期間終了時に,肝臓の絶対重量と相対重量に有意な高値がみられ,前胃に病理組織学的に扁平上皮過形成が認められた.これらはいずれも1000 mg/kg群でみられている変化であることから,4-エチルフェノール投与に起因するものと考えられた.
100 mg/kg群では,いずれの検査項目にも変化はみられなかった.
以上のことから,本試験条件下における無影響量(NOEL)は,雄で100 mg/kg/day,雌で300 mg/kg/dayであると結論される.
文献
| 1) | “13398の化学商品,”化学工業日報社,東京,1998, p. 613. |
| 2) | 藤井咲子,化学物質毒性試験報告,8, 460(2001). |
| 3) | 須永昌男,化学物質毒性試験報告,8, 486(2001). |
| 4) | 田中寿子,“実験動物の病理組織,”榎本真,林裕造,田中寿子 編,ソフトサイエンス社,東京,1981, pp. 380-398. |
| 5) | 高橋道人 監訳,“毒性病理学の基礎-実験動物の病理,”ソフトサイエンス社,東京,1992, pp. 155-170.
|
| 連絡先 |
| 試験責任者: | 藤井咲子 |
| 試験担当者: | 堀川裕尚,咲間正志,平田真理子,古川正敏,山本美代子 |
| (株)化合物安全性研究所 |
| 〒004-0839 札幌市清田区真栄363番24 |
| Tel 011-885-5031 | Fax 011-885-5313 | |
| Correspondence |
| Authors: | Sakiko Fujii(Study director)
Hironao Horikawa, Masashi Sakuma, Mariko Hirata, Masatoshi Furukawa, Miyoko Yamamoto |
| Safety Research Institute for Chemical Compounds Co., Ltd. |
| 363-24 Shin-ei, Kiyota-ku, Sapporo, Hokkaido, 004-0839, Japan |
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | |

 nwald-Giemsa染色)を測定した.また,3.8 %クエン酸ナトリウムで処理した後,3000回転/分で10分間遠心分離して得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血液凝固自動測定装置アメルングKC-10A,バクスター)を測定した.
nwald-Giemsa染色)を測定した.また,3.8 %クエン酸ナトリウムで処理した後,3000回転/分で10分間遠心分離して得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,血液凝固自動測定装置アメルングKC-10A,バクスター)を測定した.
 blewski & La Due法)およびグルコース(ヘキソキナーゼ法)を測定し,無処理血液を3000回転/分で10分間遠心分離して得られた血清を用いてGPT(IFCC法),アルカリホスファターゼ(Bessey-Lowry法),γ-GTP(包接L-γ-グルタミル-ρ-ニトロアニリド基質法),総コレステロール(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff
blewski & La Due法)およびグルコース(ヘキソキナーゼ法)を測定し,無処理血液を3000回転/分で10分間遠心分離して得られた血清を用いてGPT(IFCC法),アルカリホスファターゼ(Bessey-Lowry法),γ-GTP(包接L-γ-グルタミル-ρ-ニトロアニリド基質法),総コレステロール(酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(Jaff 法),カルシウム(OCPC法),無機リン(Fiske-SubbaRow法),総蛋白(ビウレット法)(以上,自動分析装置7150形,日立製作所),ナトリウム,カリウム(以上,炎光光度法,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),蛋白分画およびA/G比(以上,セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.
法),カルシウム(OCPC法),無機リン(Fiske-SubbaRow法),総蛋白(ビウレット法)(以上,自動分析装置7150形,日立製作所),ナトリウム,カリウム(以上,炎光光度法,自動炎光光度計480型,コーニング),クロール(電量滴定法,クロライドカウンターCL-6M,平沼産業),蛋白分画およびA/G比(以上,セルロースアセテート膜電気泳動法,全自動電気泳動装置CTE-150,常光)を測定した.









