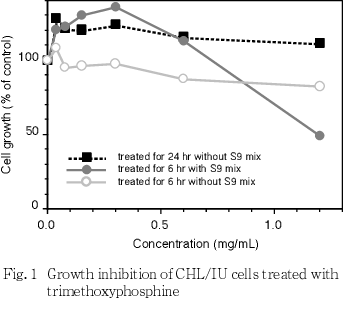
連続処理(24時間)および短時間処理(6時間)のS9 mix非存在下では,1.2 mg/mL(10 mM)の濃度においても50 %を越える細胞増殖抑制は認められなかった.短時間処理のS9 mix存在下における50 %細胞増殖抑制濃度は,1.2 mg/mL(10 mM)であった.このことから,すべての試験において1.2 mg/mL(10 mM)の濃度を最高処理濃度とし,連続処理およびS9 mix非存在下での短時間処理では,公比2で3濃度,S9 mix存在下での短時間処理では,公比2で4濃度設定した.連続処理では,24時間および48時間処理後,短時間処理ではS9 mix非存在下および存在下で6時間処理し,新鮮培地で更に18時間培養後,標本を作製し,検鏡することにより染色体異常誘発性を検討した.染色体分析が可能な最高濃度は,すべての系列で1.2 mg/mL(10 mM)の濃度であったことから,これらの濃度を高濃度群として 3濃度群を観察対象とした.
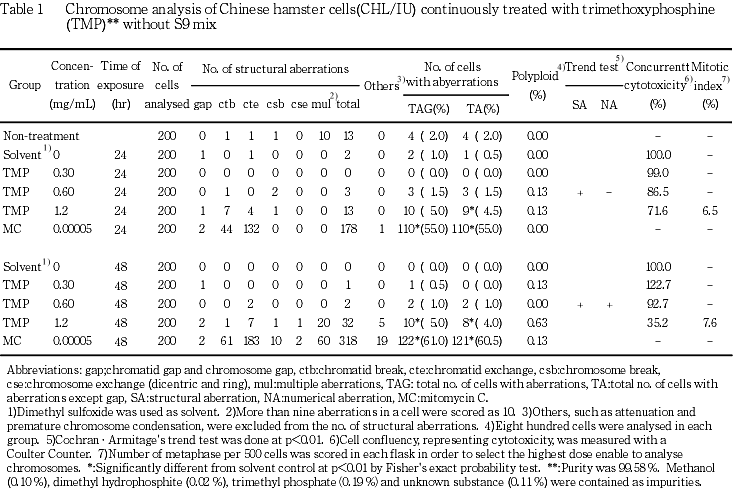
CHL/IU細胞を24時間連続処理した群では,傾向性検定(p<0.01)において有意差が認められたが,フィッシャーの直接確率法においてはいずれの濃度群でも有意差が認められず,高濃度群(1.2 mg/mL)においても誘発頻度は5.0 %と低かったことから,陰性と判定した.48時間処理した高濃度群(1.2 mg/mL)では,染色体異常が誘発され,その誘発頻度は5.0 %で,濃度依存性も認められたが,24時間処理では同じ誘発頻度でも有意差がつかず,誘発頻度自体も低いことなどから,陰性と判定した.また,倍数性細胞については,24時間連続処理したいずれの群でも,誘発作用は認められなかった.48時間連続処理した高濃度群では,傾向性検定(p<0.01)において有意差が認められたが,フィッシャーの直接確率法においてはいずれの濃度群でも有意差が認められず,高濃度群(1.2 mg/mL)においても,0.63 %と低頻度であったことから,陰性と判定した.短時間処理では,S9 mix非存在下では,いずれの処理群においても染色体異常および倍数性細胞の誘発作用は認められなかった.S9 mix存在下では,高濃度群(1.2 mg/mL)で,染色体異常の誘発作用が認められ,その誘発頻度は7.5 %(gapを含む)であった.また,倍数性細胞については,すべての処理群で倍数性細胞の誘発作用が認められ,その頻度は0.88-2.88 %であった.
以上の結果より,本試験条件下でトリメチル亜リン酸は,染色体異常を誘発する(陽性)と結論した.
その結果,連続処理およびS9 mix非存在下における短時間処理では,最高処理濃度の1.2 mg/mL(10 mM)においても50 %を越える細胞増殖抑制作用は認められなかった.S9 mix存在下における50 %細胞増殖抑制濃度は1.2 mg/mL であった(Fig. 1).

染色体異常試験において,溶媒対照群と処理群では1濃度あたり2フラスコを用い,染色体標本の作製およびコールターカウンターによる細胞増殖率測定を行った.無処理対照群および陽性対照群についてはコールターカウンターによる細胞増殖率測定は行わなかった.
作製したスライド標本のうち,1つのフラスコから得られた異なるスライドを,4名の観察者がそれぞれ処理条件が分からないようにコード化した状態で分析した.染色体の分析は,日本環境変異原学会・哺乳動物試験研究会(MMS)1)による分類法に基づいて行い,染色体型あるいは染色分体型のギャップ,切断,交換などの構造異常の有無と倍数性細胞(polyploid)の有無について観察した.また構造異常については1群200個,倍数性細胞については1群800個の分裂中期細胞を分析した.
染色体異常を有する細胞の出現頻度について,溶媒対照群と被験物質処理群および陽性対照群間でフィッシャーの直接確率法2)により,有意差検定を実施した(p<0.01).また,用量依存性に関してコクラン・アーミテッジの傾向性検定3)(p<0.01)を行った.これらの検定結果を参考とし,生物学的な観点からの判断を加味して染色体異常誘発性の評価を行った.
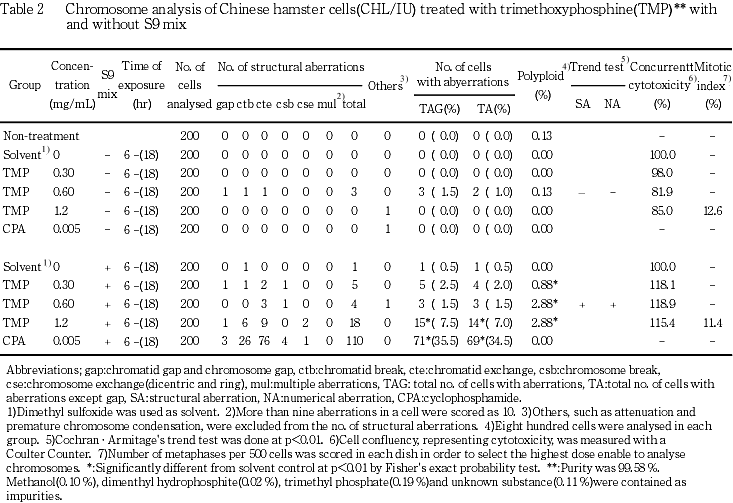
短時間処理による染色体分析の結果をTable 2に示した.トリメチル亜リン酸を加えた短時間処理では,S9 mix非存在下で処理した場合,いずれの群でも,染色体異常および倍数性細胞の誘発作用は認められなかった.S9 mix存在下で処理した高濃度群(1.2 mg/mL)で7.5 %(gapを含む)の染色体異常が誘発された.また,倍数性細胞については,すべての処理群で倍数性細胞の誘発作用が認められ,その頻度は低濃度群(0.30 mg/mL)では0.88 %,中濃度群(0.60 mg/mL)および高濃度群(1.2 mg/mL)ではともに2.88 %だった.
従って,トリメチル亜リン酸は,上記の試験条件下で,試験管内のCHL/IU細胞に染色体異常を誘発すると結論した.
なお,本物質は細菌を用いる復帰突然変異試験において,変異原性が認められなかった4).また,関連物質であるdibutyl phosphateおよびtrimethyl phosphateについては,染色体の構造異常を誘発しないことが報告されている5, 6).
| 1) | 日本環境変異原学会・哺乳動物試験分科会編,"化学物質による染色体異常アトラス,"朝倉書店,東京,1988, pp. 16-37. |
| 2) | 吉村功編,"毒性・薬効データの統計解析,事例研究によるアプローチ,"サイエンティスト社,東京,1987, pp. 76-78. |
| 3) | 吉村功,大橋靖夫編,"毒性試験講座14,毒性試験データの統計解析,"地人書館,東京,1992, pp. 218-223. |
| 4) | 厚生省生活衛生局企画課生活化学安全対策室監修,"化学物質毒性試験報告,"Vol. 7,化学物質点検推進連絡協議会,東京,1999, p. 462. |
| 5) | 厚生省生活衛生局企画課生活化学安全対策室監修,"化学物質毒性試験報告,"Vol. 2,化学物質点検推進連絡協議会,東京,1995, p. 75. |
| 6) | 厚生省生活衛生局企画課生活化学安全対策室監修,"化学物質毒性試験報告,"Vol. 3,化学物質点検推進連絡協議会,東京,1996, p. 301. |
| 連絡先 | |||
| 試験責任者: | 田中憲穂 | ||
| 試験担当者: | 田中憲穂,日下部博一,高橋俊孝,橋本恵子 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Noriho Tanaka(Study director) Hirokazu Kusakabe, Toshitaka Takahasi, Keiko Hashimoto | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai, Hadano, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||