 )で固定した後,0.1 %クリスタル・バイオレット(関東化学
)で固定した後,0.1 %クリスタル・バイオレット(関東化学 )水溶液で10分間染色した.色素溶出液(30 %エタノール,1 %酢酸水溶液)を適量加え,5分間程度放置して色素を溶出した後,580 nmでの吸光度を測定した.各用量群について溶媒対照群での吸光度に対する比,すなわち細胞生存率を算出した.
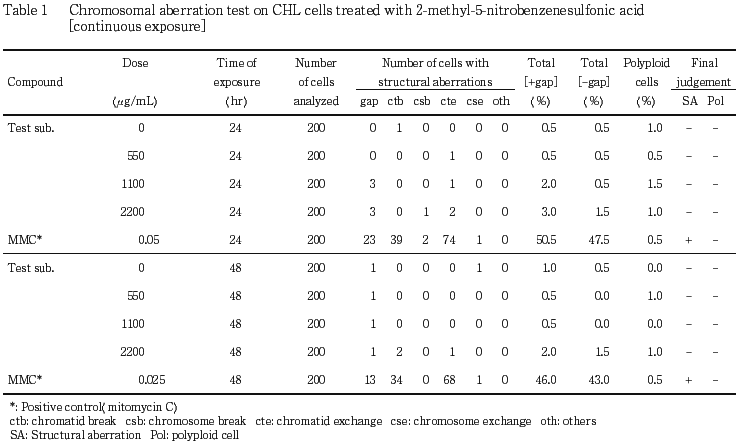
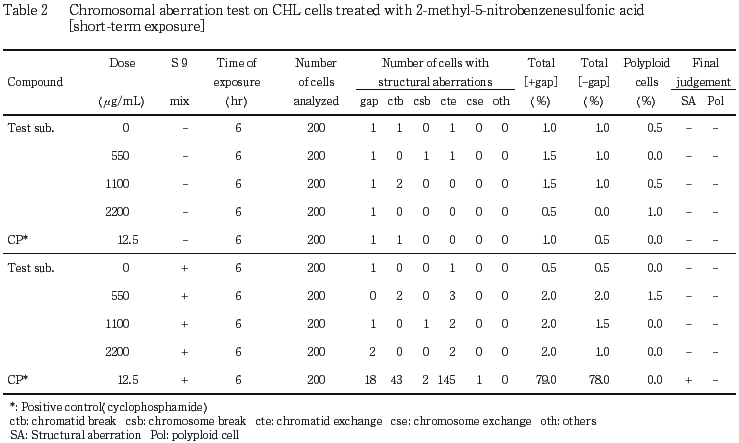
)水溶液で10分間染色した.色素溶出液(30 %エタノール,1 %酢酸水溶液)を適量加え,5分間程度放置して色素を溶出した後,580 nmでの吸光度を測定した.各用量群について溶媒対照群での吸光度に対する比,すなわち細胞生存率を算出した.細胞増殖抑制試験結果をもとに,連続処理法ならびに短時間処理法で2200 μg/mL(10 mM相当)を最高処理濃度とした.最高処理濃度の1/2および1/4をそれぞれ中濃度および低濃度として設定した.連続処理では,S9 mix非存在下における24時間および48時間連続処理後,短時間処理ではS9 mix存在下および非存在下で6時間処理(18時間の回復時間)後,標本を作製し,検鏡することにより染色体異常誘発性を検討した.
その結果,連続処理ならびに短時間処理のいずれの処理群においても,染色体の構造異常や倍数性細胞の誘発作用は認められなかった.
以上の結果より,本試験条件下では2-メチル-5-ニトロベンゼンスルホン酸は,染色体異常を誘発しない(陰性)と結論した.
 )を用い,CO2濃度5 %,37℃の条件で細胞を培養した.
)を用い,CO2濃度5 %,37℃の条件で細胞を培養した.
 製S9 mixを試験に使用した.S9 mix中のS9は誘導剤としてフェノバルビタールおよび5,6-ベンゾフラボンを投与したSprague-Dawley系雄ラットの肝臓から調製されたものである.S9 mixの組成は松岡らの方法に従った1).
製S9 mixを試験に使用した.S9 mix中のS9は誘導剤としてフェノバルビタールおよび5,6-ベンゾフラボンを投与したSprague-Dawley系雄ラットの肝臓から調製されたものである.S9 mixの組成は松岡らの方法に従った1).
 から提供された被験物質を使用した.被験物質は,使用時まで室温で保管した.試験終了後,被験物質提供元において残余被験物質を分析した結果,安定性に問題はなかった.
から提供された被験物質を使用した.被験物質は,使用時まで室温で保管した.試験終了後,被験物質提供元において残余被験物質を分析した結果,安定性に問題はなかった.
 大塚製薬工場)に被験物質を溶解して調製原液とした.調製原液を使用溶媒を用いて順次所定濃度に希釈した後,直ちに処理を行った(用時調製).ただし,本被験物質の純度は95 %未満であるため純度換算を行った.
大塚製薬工場)に被験物質を溶解して調製原液とした.調製原液を使用溶媒を用いて順次所定濃度に希釈した後,直ちに処理を行った(用時調製).ただし,本被験物質の純度は95 %未満であるため純度換算を行った.
細胞を10 %中性緩衝ホルマリン液(和光純薬工業 )で固定した後,0.1 %クリスタル・バイオレット(関東化学
)で固定した後,0.1 %クリスタル・バイオレット(関東化学 )水溶液で10分間染色した.色素溶出液(30 %エタノール,1 %酢酸水溶液)を適量加え,5分間程度放置して色素を溶出した後,580 nmでの吸光度を測定した.各用量群について溶媒対照群での吸光度に対する比,すなわち細胞生存率を算出した.
)水溶液で10分間染色した.色素溶出液(30 %エタノール,1 %酢酸水溶液)を適量加え,5分間程度放置して色素を溶出した後,580 nmでの吸光度を測定した.各用量群について溶媒対照群での吸光度に対する比,すなわち細胞生存率を算出した.
その結果,いずれの処理法においても明確な細胞増殖抑制は観察されなかった(Fig. 1).
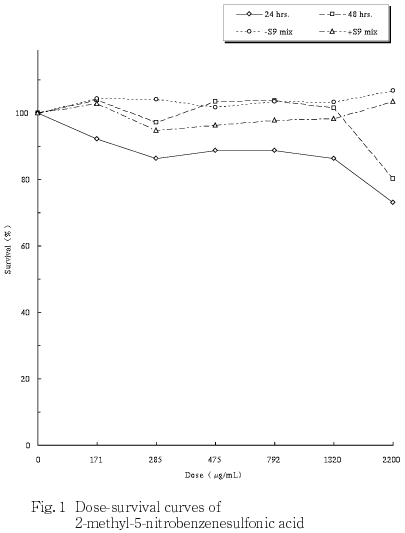
陽性対照として,連続処理の場合,マイトマイシンC(MMC:協和醗酵工業 )を,24時間処理で0.05 μg/mL,48時間処理で0.025 μg/mLの用量で,短時間処理の場合,シクロホスファミド(CP:塩野義製薬
)を,24時間処理で0.05 μg/mL,48時間処理で0.025 μg/mLの用量で,短時間処理の場合,シクロホスファミド(CP:塩野義製薬 )を,12.5 μg/mLの用量で試験した.
)を,12.5 μg/mLの用量で試験した.
すべての標本をコード化した後,観察した.
各試験群の構造異常を有する細胞あるいは倍数性細胞の出現頻度を,石館ら3)の基準に従って判定した.染色体異常を有する細胞の出現頻度が5 %未満を陰性(-),5 %以上10 %未満を疑陽性(±),10 %以上を陽性(+)とした.最終的には再現性あるいは用量に依存性が認められた場合に陽性と判定した.
なお,統計学的手法を用いた検定は実施しなかった.
| 1) | A. Matsuoka, M. Hayashi and M. Ishidate Jr., Mutat. Res., 66. 277(1979). |
| 2) | 日本環境変異原学会・哺乳動物試験分科会編,"化学物質による染色体異常アトラス,"朝倉書店,東京,1988,pp. 31-35. |
| 3) | 石館基 監修,"<改訂>染色体異常試験データ集,"エル・アイ・シー社,東京,1987,pp. 19-24. |
| 連絡先 | |||
| 試験責任者: | 中嶋 圓 | ||
| 試験担当者: | 益森勝志,板倉真由実 | ||
| 財団法人 食品農医薬品安全性評価センター | |||
| 〒437-1213 静岡県磐田郡福田町塩新田字荒浜582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | ||||
| Authors: | Madoka Nakajima(Study director) Shoji Masumori, Mayumi Itakura | |||
| Biosafety Research Center/Foods, Drugs and Pesticides(An-pyo Center) | ||||
| 582-2 Shioshinden Aza Arahama, Fukude-cho, Iwata-gun, Shizuoka, 437-1213, Japan | ||||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | |||