
今回, OECDによる既存化学物質の安全性点検に係わる毒性試験の一環として,2,2'-メチレンビス(6-tert-ブチル-p-クレゾール)の0(対照),50,200および800 mg/kg/dayを1群雌雄各6匹のCrj:CD(SD系)ラットに28日間反復経口投与する毒性試験を実施し,以下の結果を得た.なお,対照群および800 mg/kg群にはそれぞれ雌雄各6匹の14日間回復群も設けた.
投与期間および回復期間を通して,雌雄いずれの群にも死亡はなく,一般状態の観察,体重,摂餌量,尿検査および血液生化学検査においても変化はみられなかった.
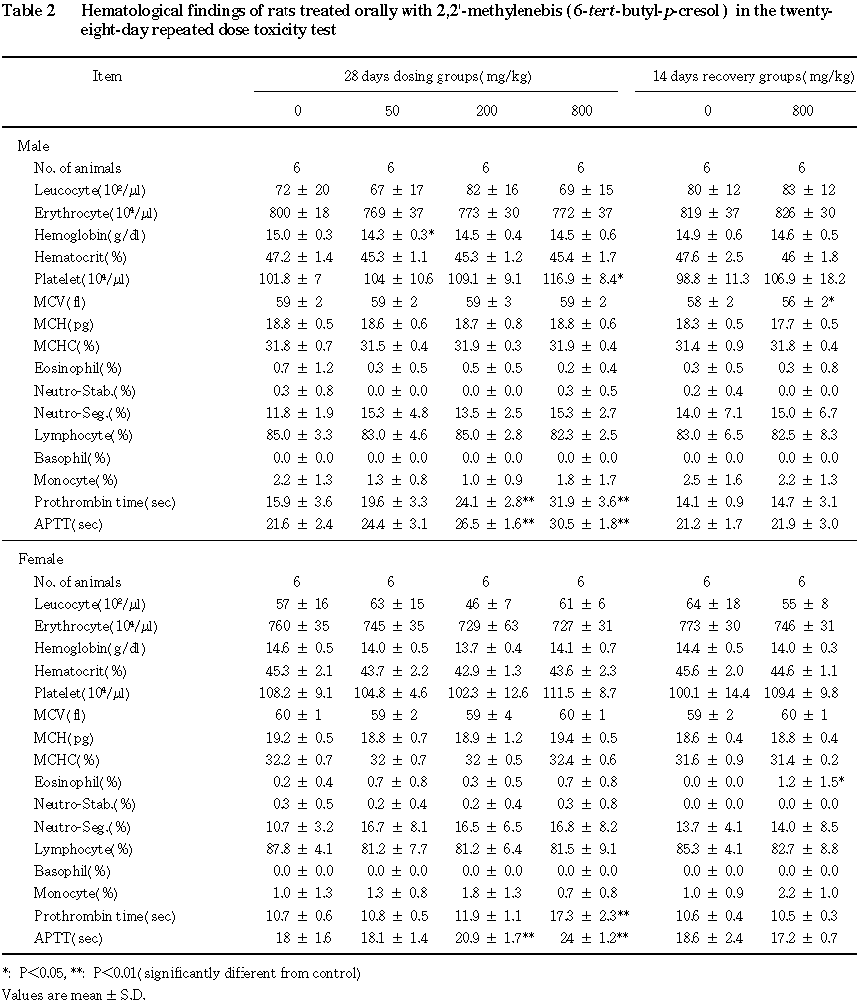
血液学検査では,プロトロンビン時間および活性化部分トロンボプラスチン時間の延長または延長傾向が 50 mg/kg以上の群にみられた.
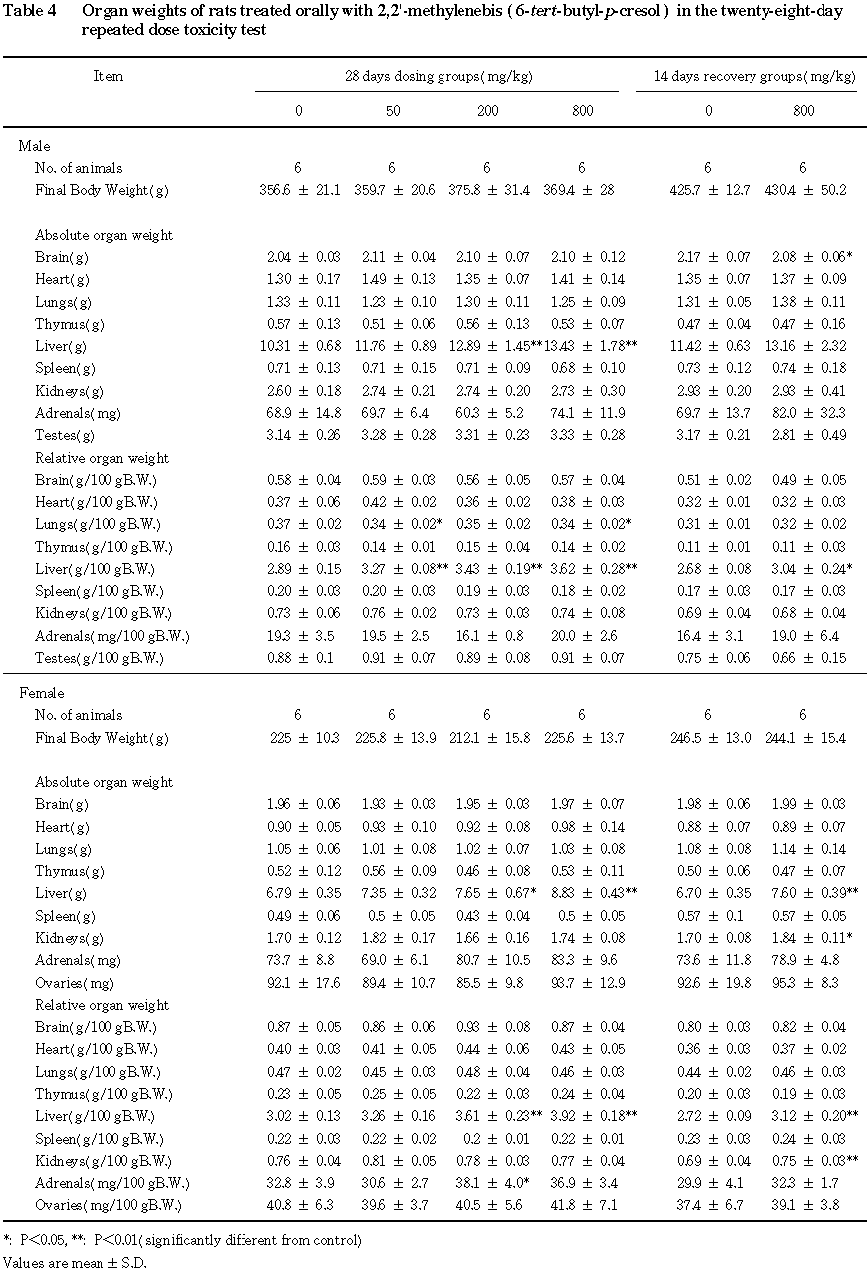
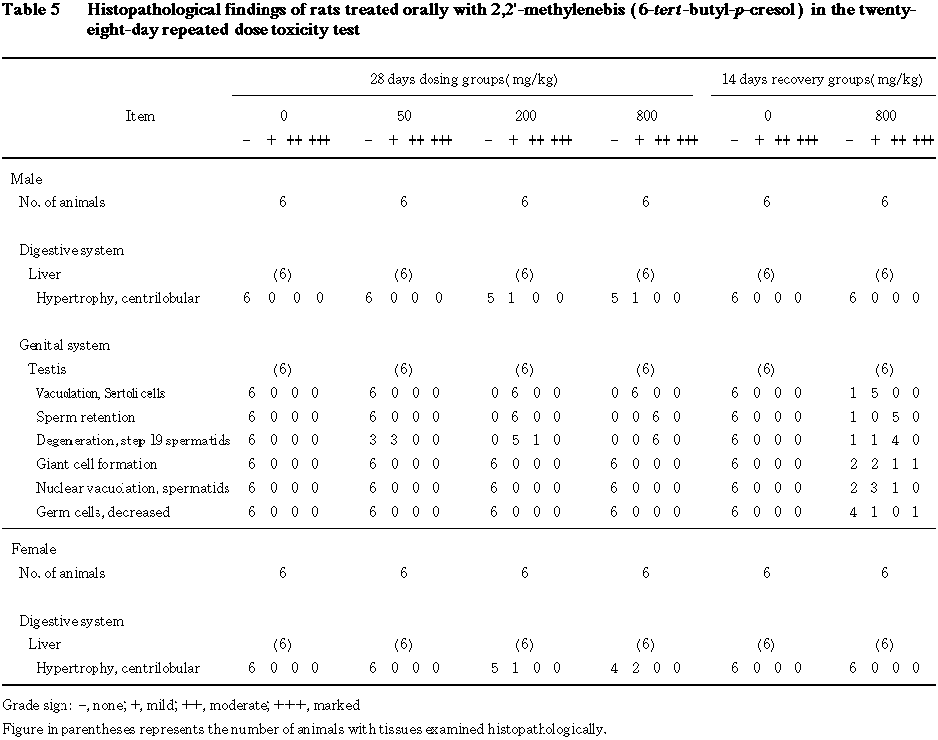
病理学検査では,肝臓重量の増加または増加傾向が 50 mg/kg以上の群でみられ,組織学的に肝小葉中心性の肝細胞の軽度の肥大が200 mg/kg以上の群でみられた.精巣では精子停滞およびstep 19の精子細胞の変性が50 mg/kg以上の群に,セルトリ細胞の空胞化が200 mg/kg以上の群でみられた.また,200 mg/kg以上の群で副腎重量の増加がみられた.上記の変化は,精巣の変化を除いていずれも回復するかその傾向を示した.しかし,精巣については,回復期間終了時に巨細胞の形成や精上皮細胞の減少などが 800 mg/kg群に新たに出現し,より重篤な変化を呈した.
以上の結果より,本試験条件下における無影響量は 50 mg/kg/day未満と考えられた.
投与経路は経口とし,胃管を用いた強制投与を 1日1回,28日間反復して行った.投与容量は10 ml/kgとし,個体ごとに最新の体重を基に算出した.
試験群は,上記 3用量に,5%アラビアゴム水溶液を投与する対照を加えて計4群とした.1群当たりの動物数は,投与期間終了時の剖検例として各群とも雌雄各6匹,さらに,対照群および800 mg/kg群には14日間の回復期間終了時の剖検例として雌雄各6匹を設けた.群分けは,投与開始前日の体重を基に層別連続無作為化法で行った.
 nwald-Giemsa染色を施して白血球百分比を視算した.さらに,3.8%クエン酸ナトリウム加血液を3000回転/分で15分間遠心分離し,得られた血漿を用いて全自動血液凝固測定装置(Sysmex CA-5000,東亜医用電子(株))により,プロトロンビン時間(散乱光検出方式)および活性化部分トロンボプラスチン時間(散乱光検出方式)を測定した.
nwald-Giemsa染色を施して白血球百分比を視算した.さらに,3.8%クエン酸ナトリウム加血液を3000回転/分で15分間遠心分離し,得られた血漿を用いて全自動血液凝固測定装置(Sysmex CA-5000,東亜医用電子(株))により,プロトロンビン時間(散乱光検出方式)および活性化部分トロンボプラスチン時間(散乱光検出方式)を測定した.
 blewski-La Due法),γ-グルタミルトランスペプチダーゼ(L-γ-グルタミル-DBHA基質法),アルカリ性フォスファターゼ(p-ニトロフェニルリン酸基質法),総コレステロール(COD-DAOS法),トリグリセライド(GPO-DAOS法・グリセリン消去法),リン脂質(酵素法・DAOS発色法),グルコース(グルコキナーゼ・G-6-PDH法),尿素窒素(ウレアーゼ-GlDH法),クレアチニン(Jaff
blewski-La Due法),γ-グルタミルトランスペプチダーゼ(L-γ-グルタミル-DBHA基質法),アルカリ性フォスファターゼ(p-ニトロフェニルリン酸基質法),総コレステロール(COD-DAOS法),トリグリセライド(GPO-DAOS法・グリセリン消去法),リン脂質(酵素法・DAOS発色法),グルコース(グルコキナーゼ・G-6-PDH法),尿素窒素(ウレアーゼ-GlDH法),クレアチニン(Jaff 法),無機リン(モリブデン酸直接法)およびカルシウム(OCPC法)を測定した.また,電解質分析装置(PVA-αIII,(株)アナリティカル・インスツルメンツ)によりナトリウム(電極法),カリウム(電極法)およびクロール(電量滴定法)を測定した.
法),無機リン(モリブデン酸直接法)およびカルシウム(OCPC法)を測定した.また,電解質分析装置(PVA-αIII,(株)アナリティカル・インスツルメンツ)によりナトリウム(電極法),カリウム(電極法)およびクロール(電量滴定法)を測定した.
投与期間終了時の対照群および高用量群の脾臓,心臓,腎臓,副腎については,常法に従ってパラフィン切片を作製し,ヘマトキシリン・エオジン (HE)染色を施して光学顕微鏡下で観察した.肝臓および精巣については投与期間および回復期間終了時の全例の検査を同様に行った.

血液学検査では,投与期間終了時に 50 mg/kg群の雄でヘモグロビンの軽微な減少が,800 mg/kg群の雄で血小板数の軽微な増加がみられた.また,プロトロンビン時間および活性化部分トロンボプラスチン時間の延長または延長傾向が,雄では50 mg/kg以上の群に,雌では200 mg/kg以上の群にみられ,いずれも用量が高くなるにつれて延長する傾向にあった.回復期間終了時の検査では,800 mg/kg群の雄でMCVの軽微な減少が,雌で好酸球百分比の軽微な増加がみられたのみであった.
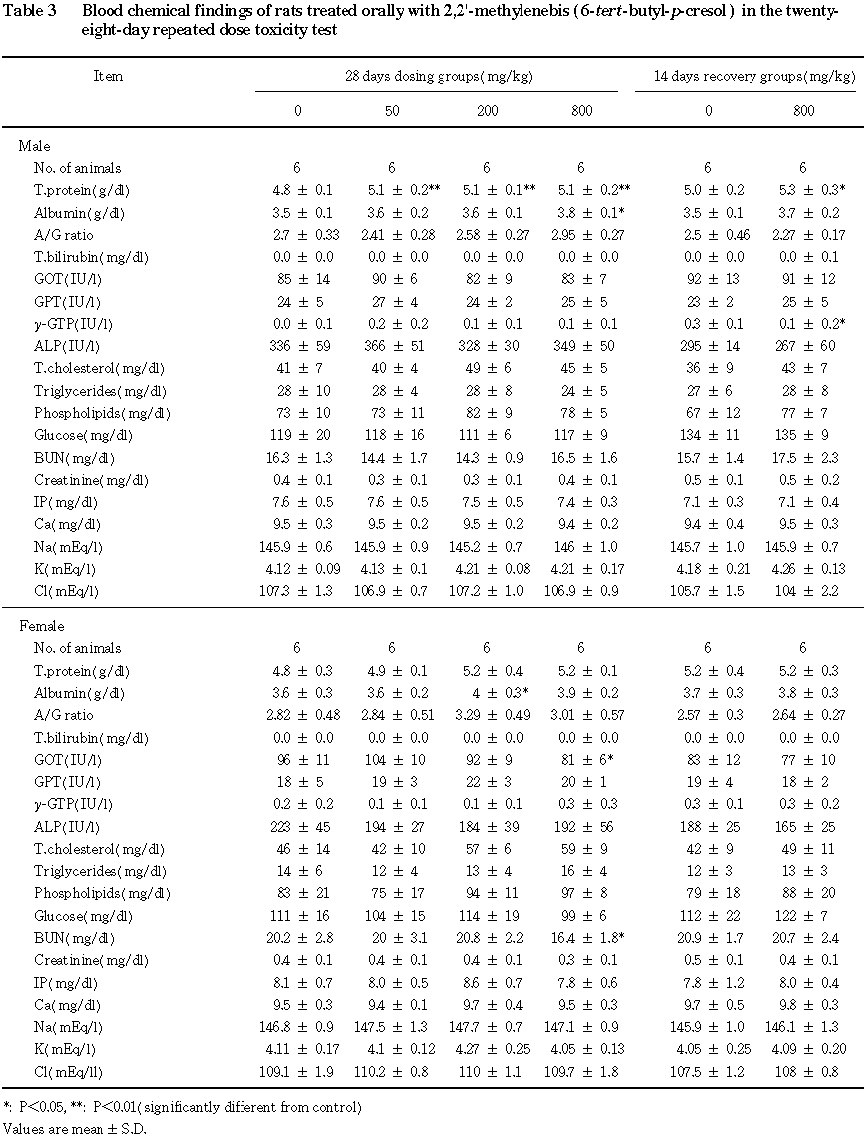
血液生化学検査では,投与期間終了時に雄の 50 mg/kg以上および雌の200 mg/kg以上の群で総蛋白質の増加または増加傾向がみられ,雄の800 mg/kgおよび雌の200 mg/kg以上の群でアルブミンの増加または増加傾向がみられたが,いずれも極めて軽微な変動であることから,生物学的意義はないと判断した.また,800 mg/kg群の雌で軽微なGOTの減少および尿素窒素の減少がみられた.回復期間終了時には,800 mg/kg群の雄で軽微な総蛋白質の増加およびγ−グルタミルトランスペプチダーゼの減少がみられた.

回復期間終了時には,雌雄の 800 mg/kg群で肝臓の絶対および相対重量の増加がみられたが,その程度は投与期間終了時に比べて小さかった.また,雄の800 mg/kg群で脳の絶対重量の軽微な減少がみられ,雌の800 mg/kg群で腎臓の絶対および相対重量の軽微な増加がみられた.
病理組織学検査では,投与期間終了時に 800 mg/kg群の雄1例および雌2例ならびに200 mg/kg群の雌雄各1例の肝臓に小葉中心性の肝細胞の軽度の肥大がみられた.また,雄では50 mg/kg以上の群の全例に精巣の精子停滞が,50 mg/kg群の3例および200 mg/kg以上の群の全例にstep 19の精子細胞の変性およびセルトリ細胞の空胞化がみられ,用量が高くなるほど病変の程度が強かった.回復期間終了時には,雄では800 mg/kg群の5例にセルトリ細胞の空胞化,精子停滞およびstep 19の精子細胞の変性が引き続きみられ,新たに軽度ないし中等度の巨細胞形成,精子細胞の核の空胞化あるいは軽度の精上皮細胞の減少を示す例もあった.さらに,他の1例には重度の巨細胞の形成および精上皮細胞の減少および軽度の精子細胞の核の空胞化がみられた.なお,投与期間終了時にみられた肝臓の変化は,回復期間終了時にはみられなかった.
尿検査では,投与 4週目の検査で雌雄のいずれにも変化はみられなかった.
血液学検査では,投与期間終了時の検査でプロトロンビン時間および活性化部分トロンボプラスチン時間の延長または延長傾向が,雄では 50 mg/kg以上の群に,雌では200 mg/kg以上の群にみられ,いずれも用量が高くなるにつれて程度が強くなる傾向にあった.本被験物質の混餌投与による試験2)でも,プロトロンビン時間および活性化部分トロンボプラスチン時間の延長がみられており,本被験物質の凝固系への影響が窺われた.
血液生化学検査では,投与 4週目の検査で雌雄のいずれにも変化はみられなかった.
病理学検査では,投与期間終了時に全被験物質投与群の雌雄で肝臓の絶対および相対重量の増加あるいは増加傾向がみられ,組織学的には雌雄の 800 mg/kg群および200 mg/kg群の少数例に肝小葉中心性の軽度の肝細胞肥大がみられた.また,精巣では,投与期間終了時に精子停滞およびStep 19の精子細胞の変性が50 mg/kg以上の群に,セルトリ細胞の空胞化が200 mg/kg以上の群にみられ,これらの変化の程度は800 mg/kg群で強かった.肝臓重量の増加は,本被験物質の混餌投与による試験1)でもみられており,また本被験物質の類似物質である2,2'-メチレンビス(4-エチル-6-tert-ブチルフェノール)をラットに4週間混餌投与すると,肝臓の相対重量が増加し,薬物代謝酵素の一つであるNADPH cytochrome c reductaseが増加することが知られている3)ことから,本試験の場合もこれと同様の現象である可能性が示唆された.精巣に対する影響は,本被験物質の混餌投与による試験1)でもみられているが,本試験における変化の程度はやや弱いものであった.また,投与期間終了時には,雌の200 mg/kg以上の群で副腎の絶対および相対重量の増加または増加傾向がみられたが,組織学的変化はみられず,回復期間終了時には重量の変動もなかったことから,毒性学的には重篤な変化とは思われなかった.
回復期間終了時には,これらの変化は,精巣の変化を除いていずれも回復するかその傾向を示しており,いずれも可逆性の変化と考えられた.精巣は,回復期間終了時には 800 mg/kg群で精細管の荒廃が進行し,巨細胞の形成,精子細胞の核の空胞化あるいは精上皮細胞の減少を示す例もあり,より重篤な形態学的変化を呈した.
上記のほか,投与期間終了時の変化として,血液学的検査で 50 mg/kg群の雄にヘモグロビンの軽微な減少が,800 mg/kg群の雄に血小板数の軽微な増加がみられ,血液生化学的検査で800 mg/kg群の雌にGOTの減少および尿素窒素の減少がみられたが,極めて軽微な変化であること,片性のみの変化であることあるいは関連する他のパラメータに変化がみられないことから,被験物質投与による変化とは考えられなかった.また,回復2週目あるいは回復期間終了時では,尿検査,血液学検査,血液生化学検査,剖検および器官重量測定において軽微な変動がみられたが,投与4週目あるいは投与期間終了時の検査では変化はみられないことや関連する他のパラメーターに変化がないことから,毒性学的意義のない変化と思われた.
以上のように,本試験における毒性は,既に実施された混餌投与による毒性試験の結果とほぼ同様であった.また,本試験条件下における無影響量は, 50mg/kg群において凝固時間の延長または延長傾向,肝臓重量の増加または増加傾向ならびに精巣に器質的変化がみられたことから,50mg/kg/day未満と考えられた.
| 1) | A. Takagi, et al. J. Toxicol. Sci., 19, 77(1994). |
| 2) | O. Takahashi, et al. Toxicol. Lett., 7, 405(1981). |
| 3) | A. Takagi, et al. J. Toxicol. Sci., 18, 49(1993). |
| 連絡先 | |||
| 試験責任者: | 一鬼 勉 | ||
| 試験担当者: | 大塚辰雄,古川浩美,幸 邦憲, 永井憲児,浜村政夫,鍬先惠美子, 津崎慎二 | ||
| (株)パナファーム・ラボラトリーズ 安全性研究所 | |||
| 〒869-04 熊本県宇土市栗崎町1285 | |||
| Tel 0964-23-5111 | Fax 0964-23-2282 | ||
| Correspondence | |||
| Authors: | Tsutomu Ichiki(Study director) Tatsuo Otsuka, Hiromi Furukawa, Kuninori Yuki, Kenji Nagai, Masao Hamamura, Emiko Kuwasaki, Shinji Tsusaki | ||
| Safety Assessment Laboratory, Panapharm Laboratories Co., Ltd. | |||
| 1285 Kurisaki-machi, Uto-shi, Kumamoto, 869-04, Japan | |||
| Tel +81-964-23-5111 | Fax +81-964-23-2282 | ||