 ,Lot No.:V6N3521〕にて溶解し,いずれの用量においても1 回の投与液量が5 mL/kg体重になるように濃度を調整した.調製検体は,冷蔵,遮光,気密の条件下で保管し,調製後7日以内に投与した.なお,0.2および20 %(w/v)の濃度の調製液については,冷蔵,遮光条件下で少なくとも11日間安定であることが確認されており,試験期間中に調製した投与液には,所定のジトリデシルフタラートが均一に含有されていたことを確認した.
,Lot No.:V6N3521〕にて溶解し,いずれの用量においても1 回の投与液量が5 mL/kg体重になるように濃度を調整した.調製検体は,冷蔵,遮光,気密の条件下で保管し,調製後7日以内に投与した.なお,0.2および20 %(w/v)の濃度の調製液については,冷蔵,遮光条件下で少なくとも11日間安定であることが確認されており,試験期間中に調製した投与液には,所定のジトリデシルフタラートが均一に含有されていたことを確認した.その結果,死亡動物は,対照群を含むいずれの投与群においても認められなかった.雄では,投与後一過性の流涎が,50 mg/kg以上のジトリデシルフタラート投与により投与16日以降,断続的ではあるが投与期間を通して観察された.摂餌量には,雌雄ともにジトリデシルフタラート投与による影響は認められなかったが,雌では体重の増加抑制が,50 mg/kg以上のジトリデシルフタラート投与により認められた.雌の一般状態および雄の体重推移には,ジトリデシルフタラート投与の影響は認められなかった.
肝臓重量の増加が,雄では250 mg/kgのジトリデシルフタラート投与により,雌では50 mg/kg以上のジトリデシルフタラート投与により認められた.病理組織学検査の結果,雌雄ともに,50 mg/kg以上のジトリデシルフタラート投与により小葉中心部の肝細胞が肥大し,雄では,250 mg/kgのジトリデシルフタラート投与により,カタラーゼ染色陽性顆粒が増加した.また,雄の腎臓重量の増加が,250 mg/kgのジトリデシルフタラート投与により認められた.病理組織学検査の結果,雄では,250 mg/kgのジトリデシルフタラート投与により,eosinophilicbodyの発現頻度が増加し,尿細管上皮が壊死した後の再生像と思われる好塩基性尿細管が観察された.雌の腎臓重量にはジトリデシルフタラート投与の影響は認められなかったが,250 mg/kgのジトリデシルフタラート投与により,腎盂上皮および膀胱移行上皮の過形成が認められた.しかし,尿検査の結果には,雌雄ともにジトリデシルフタラート投与の影響は認められなかった.雄について実施した血液生化学検査では,250 mg/kgのジトリデシルフタラート投与により,アルカリフォスファターゼの上昇が認められたが,血液学的検査にはジトリデシルフタラート投与の影響はなかった.
また,ジトリデシルフタラート投与による精巣毒性も認められなかった.
一方,生殖発生毒性に関しては,雌雄動物の交尾率,受胎率,雌の妊娠維持および分娩に関して,ジトリデシルフタラート投与の影響は認められなかった.250 mg/kg のジトリデシルフタラート投与により,哺育不良が示唆された.250 mg/kg のジトリデシルフタラート投与により認められた母動物の哺育不良に起因して,産児の生存性が低下した.しかし,産児の性比,体重および形態に,ジトリデシルフタラート投与の影響は認められなかった.
これらのことから,本試験条件下では,ジトリデシルフタラートの反復投与毒性に関する無影響量は,雌雄ともに,10 mg/kg/day,生殖発生毒性に関する無影響量は,雄に対しては,250 mg/kg/day,雌に対しては,50 mg/kg/day,産児に対しては,250 mg/kg/dayであると判断される.
 ),純度:93.7-100.0 %(エステル価198-212より換算),分子式:C34H58O4,分子量:530.83,比重:0.950(20℃/20℃),融点(凝固点):-21℃,沸点:250℃(2 mmHg)〕は,無色透明の液体でフタル酸エステルの一種であり,使用時まで室温保管した.
),純度:93.7-100.0 %(エステル価198-212より換算),分子式:C34H58O4,分子量:530.83,比重:0.950(20℃/20℃),融点(凝固点):-21℃,沸点:250℃(2 mmHg)〕は,無色透明の液体でフタル酸エステルの一種であり,使用時まで室温保管した.
被験物質は,コーン油〔ナカライテスク ,Lot No.:V6N3521〕にて溶解し,いずれの用量においても1 回の投与液量が5 mL/kg体重になるように濃度を調整した.調製検体は,冷蔵,遮光,気密の条件下で保管し,調製後7日以内に投与した.なお,0.2および20 %(w/v)の濃度の調製液については,冷蔵,遮光条件下で少なくとも11日間安定であることが確認されており,試験期間中に調製した投与液には,所定のジトリデシルフタラートが均一に含有されていたことを確認した.
,Lot No.:V6N3521〕にて溶解し,いずれの用量においても1 回の投与液量が5 mL/kg体重になるように濃度を調整した.調製検体は,冷蔵,遮光,気密の条件下で保管し,調製後7日以内に投与した.なお,0.2および20 %(w/v)の濃度の調製液については,冷蔵,遮光条件下で少なくとも11日間安定であることが確認されており,試験期間中に調製した投与液には,所定のジトリデシルフタラートが均一に含有されていたことを確認した.
 日野飼育センター生産のSprague-Dawley系ラット(Crj:CD,SPF)を使用した.動物は,入荷後1 週間,馴化と検疫を兼ねて予備飼育し,一般状態に異常が認められなかったものを試験に供した(群分け時体重範囲:雄312.0〜348.2 g,雌198.3〜221.7 g).
日野飼育センター生産のSprague-Dawley系ラット(Crj:CD,SPF)を使用した.動物は,入荷後1 週間,馴化と検疫を兼ねて予備飼育し,一般状態に異常が認められなかったものを試験に供した(群分け時体重範囲:雄312.0〜348.2 g,雌198.3〜221.7 g).
各動物は,温度23.8〜24.2℃および湿度53〜68 %,換気回数約15回/時,照明12時間(午前7時〜午後7時)の飼育室で,金属製ケージ(日本ケージ )に個別に収容して飼育し,固型飼料(CE-2,日本クレア
)に個別に収容して飼育し,固型飼料(CE-2,日本クレア )および飲料水を自由に摂取させた.妊娠14日(交尾確認日=妊娠0日)以後の雌動物については,ラット用繁殖ケージ(日本クレア
)および飲料水を自由に摂取させた.妊娠14日(交尾確認日=妊娠0日)以後の雌動物については,ラット用繁殖ケージ(日本クレア )に収容し,床敷として紙パルプ製チップ(ALPHA-dri,加商
)に収容し,床敷として紙パルプ製チップ(ALPHA-dri,加商 )を適宜供給した.
)を適宜供給した.
各用量の投与検体は,雄に対しては交配前2週間と交配期間(2週間)および交配期間終了後2週間(剖検日前日までの連続42日間),また,雌に対しては交配前2週間と最長2週間の交配期間中(交尾成立まで),ならびに交尾成立雌では妊娠期間を通して分娩後の哺育3日(分娩日=哺育0日)まで毎日1回,ラット用胃管を用いて経口投与した.毎日の投与は,午前9時から12時の間に行い,各動物の投与液量(5 mL/kg体重)は,雄ならびに交配前および交配期間中の雌については週1回測定した体重をもとに,また,交尾成立後の雌については妊娠0日の体重をもとにそれぞれ算出した.
最終投与日の投与終了後から絶食を開始し,翌日にペントバルビタールナトリウム麻酔下で放血・致死させて剖検した.その際,全例について胸腺,肝臓,腎臓,副腎,精巣および精巣上体の重量を測定した.精巣および精巣上体はブアン液に固定して保存し,残りの重量測定済み器官および脳,心臓,脾臓,膀胱ならびに剖検時に異常が認められた器官(肺)は,10 %ホルマリン液に固定して保存した.これらの器官は,高用量群および対照群について常法に従ってパラフィン切片とし,ヘマトキシリン−エオジン染色を行って病理組織学検査を実施した.病理組織学検査の結果,高用量群で異常が認められた肝臓および腎臓については,他の投与群についても病理組織学検査を行った.
また,各群2例について,肝臓のペルオキシゾーム酵素活性を調べるために,肝臓の一部を0.1 Mカコジル酸緩衝2.5 %グルタールアルデヒド液に固定し,カタラーゼ染色を行って酵素組織化学検査を実施した.
ロ.血液学検査
全例について,剖検に先立ち,ペントバルビタールナトリウム麻酔下で後大静脈腹部より,抗凝固剤としてEDTA-2K処理した注射筒を用いて採血し,赤血球数(RBC),白血球数(WBC),血色素量(Hb),平均赤血球容積(MCV),血小板数,ヘマトクリット値(Ht),平均赤血球血色素量(MCH),平均赤血球血色素濃度(MCHC)を多項目自動血液測定器(Coulter Counter Model S-PLUS IV)により測定し,白血球分類は,Wright-Giemsa 染色を行い,光学顕微鏡下で観察し算出した.
ハ.血液生化学検査
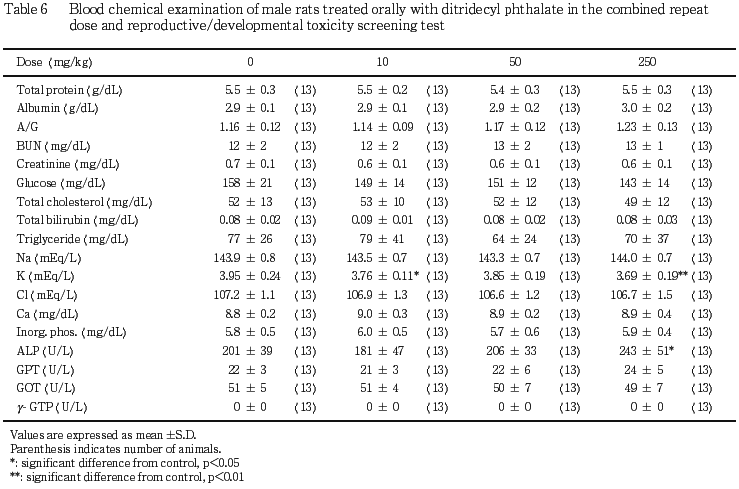
全例について,血液学検査のための採血に引き続き,抗凝固剤としてヘパリン処理した注射筒を用いて採血し,血漿を分離して遠心方式生化学自動分析装置COBAS-FARA(ロシュ)および全自動電解質分析装置EA05(A&T)を用い,総蛋白(ビウレット法),アルブミン(BCG法),総コレステロール(COD・DAOS法),ブドウ糖(グルコキナーゼG6PDH法),尿素窒素(ウレアーゼGι.DH法),クレアチニン(Jaff 法),アルカリフォスファターゼ(パラニトロフェニルリン酸基質法),GOT(SSCC法),GPT(SSCC法),γ-GTP(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),トリグリセライド(GPO・DAOS法),無機リン(モリブデン酸直接法),総ビリルビン(ビリルビン「ロシュ」キットSシリーズ),カルシウム(OCPC 法),A/G比(計算),ナトリウム(イオン電極法),カリウム(イオン電極法),塩素(イオン電極法)について分析した.
法),アルカリフォスファターゼ(パラニトロフェニルリン酸基質法),GOT(SSCC法),GPT(SSCC法),γ-GTP(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),トリグリセライド(GPO・DAOS法),無機リン(モリブデン酸直接法),総ビリルビン(ビリルビン「ロシュ」キットSシリーズ),カルシウム(OCPC 法),A/G比(計算),ナトリウム(イオン電極法),カリウム(イオン電極法),塩素(イオン電極法)について分析した.
 法を用いて対照群とジトリデシルフタラート各投与群との平均値の差の検定を行った.分散が一様でなかった場合,または分散が0となる群が存在した場合は,Kruskal-Wallis順位検定を行い,群間に有意性が認められた場合に,対照群とジトリデシルフタラート各投与群との差についてDunnett 法あるいはScheff
法を用いて対照群とジトリデシルフタラート各投与群との平均値の差の検定を行った.分散が一様でなかった場合,または分散が0となる群が存在した場合は,Kruskal-Wallis順位検定を行い,群間に有意性が認められた場合に,対照群とジトリデシルフタラート各投与群との差についてDunnett 法あるいはScheff 法の検定を行った.なお,有意水準は,5 %および1 %とした.
法の検定を行った.なお,有意水準は,5 %および1 %とした.
 .反復投与毒性(親動物所見)
.反復投与毒性(親動物所見)
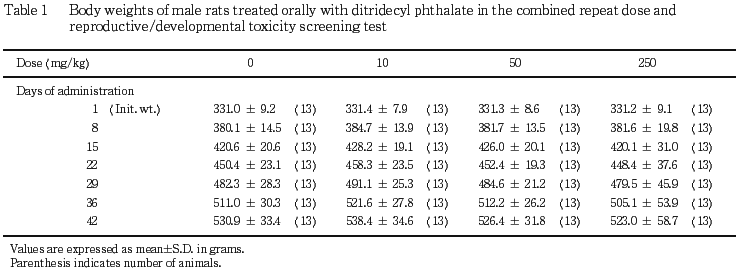
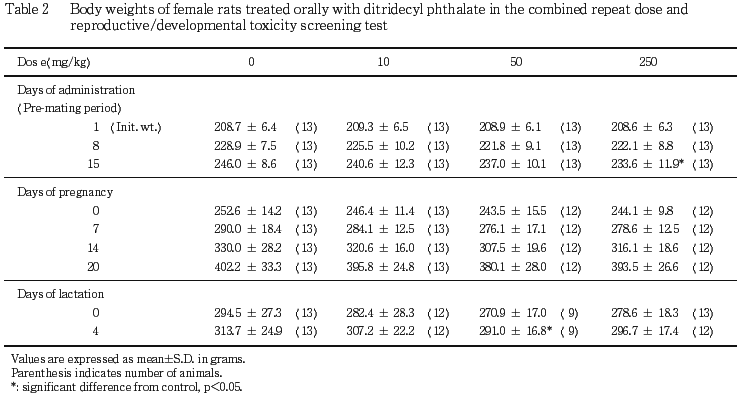
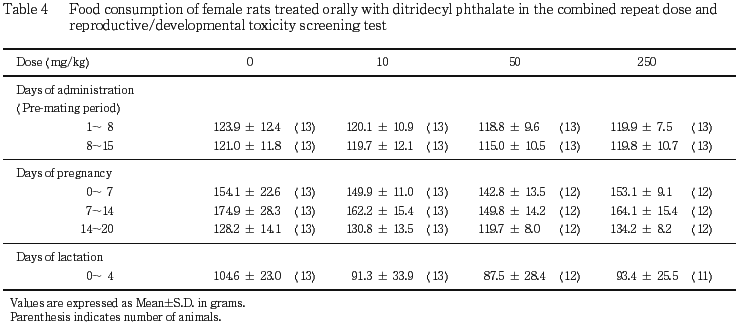
雌では,交配前の50 mg/kg以上の投与群において,体重の増加抑制が認められ,50 mg/kg投与群では,投与1〜8日および1 〜15日の増加量が,250 mg/kg投与群では,投与15日の体重および投与1〜15日の増加量が有意(p<0.05, 0.01)に減少した.
妊娠期間中の体重推移には,対照群と各投与群との間に有意差は認められなかった.哺育期では,50 mg/kg投与群の哺育4日の体重が対照群と比較して有意(p<0.05)に減少したが,哺育0〜4日の増加量には,対照群と各投与群との間に有意差は認められなかった.
肺では,暗色点が,対照群の2例および50 mg/kg投与群の1例に,暗色領域が,10 mg/kg投与群の1例にみられた.また,淡白色斑が,50 mg/kg投与群の1例にみられた.
腎臓では,腫大が,250 mg/kg投与群の3例に,腎盂の拡張が,対照群の1例に,腎臓表面に陥凹部が,50 mg/kg投与群の2例にみられた.
精巣上体では,結節が,250 mg/kg投与群の2例にみられた.
肝臓では,黄色化が,対照群の2例,10 mg/kg投与群の4例,50 mg/kg投与群の4例,250 mg/kg投与群の2例にみられた.また,退色が,対照群を含む各投与群に各1例みられた.
カタラーゼを組織化学的に染色した各群2例のうち,250 mg/kg投与群の2例では,小葉中心部の肝細胞で陽性顆粒がごく軽度に増加しており,これらの2例では,棒状に伸長した少数の陽性顆粒も含まれていた.なお,同群における陽性顆粒の発現頻度に有意差(p<0.01)が認められた.
門脈周囲性の脂肪化が,対照群を含む各投与群にみられたが,発現頻度には,対照群と各投与群との間に有意差はなく,程度は,250 mg/kg投与群で有意(p<0.01)に軽度であった.
皮質に好塩基性の尿細管が,対照群を含む各投与群にみられたが,250 mg/kg投与群のうちeosinophilic bodyの発現の著しい例では,好塩基性尿細管の程度が他の例より強く,これらの好塩基性尿細管の多くは尿細管上皮が壊死した後の再生像と思われた.さらにこの例では,皮髄境界部の尿細管腔内に顆粒状の円柱が認められ,これらは脱落した尿細管上皮の変性物であると推測された.その他,髄質の鉱質沈着が,対照群および250 mg/kg 投与群の各1例,腎盂の拡張が対照群の1例,嚢胞が10および50 mg/kg 投与群の各1例にみられた.
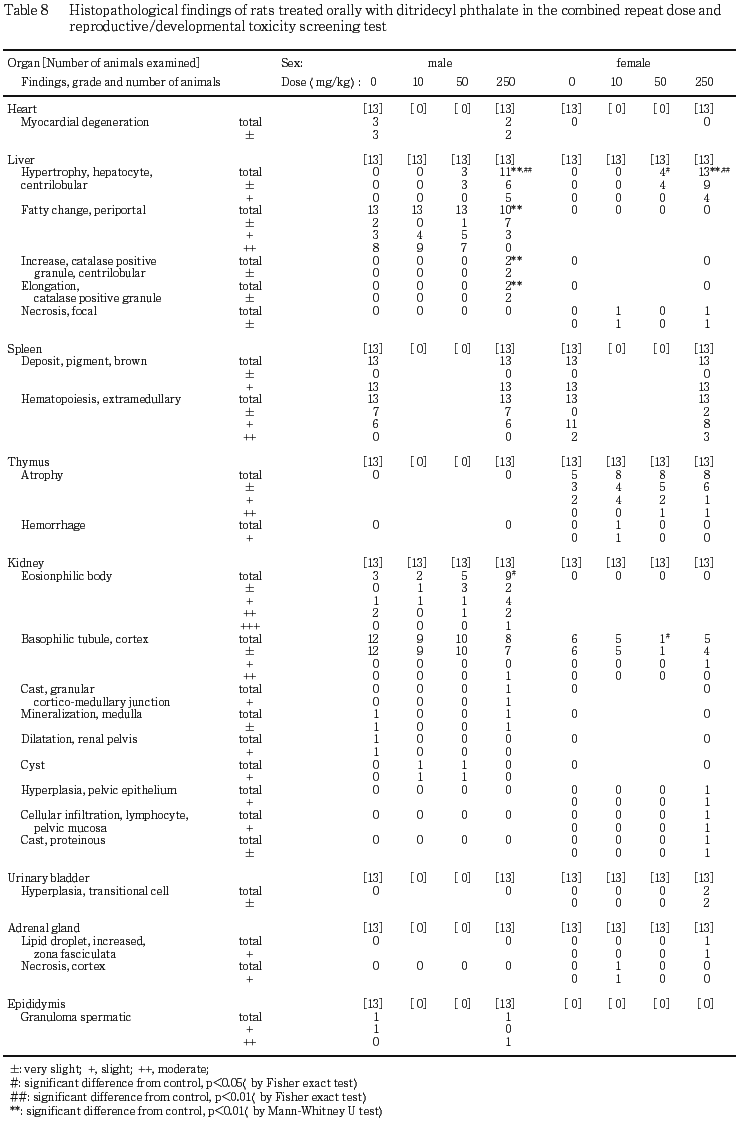
肝臓の腫大が,250 mg/kg投与群の2例にみられ,このうち1例は,暗色調を呈していた.また,横隔膜ヘルニアが,50 mg/kg 投与群の1例にみられた.
腎臓の退色が,50 mg/kg投与群の1例,肺の暗色点が,10 mg/kg投与群の2例,腺胃部粘膜に暗色点が,10 mg/kg投与群の1例にみられた.
その他,脱毛が,対照群の2 例,10 mg/kg投与群の2例,50 mg/kg投与群の1例にみられた.
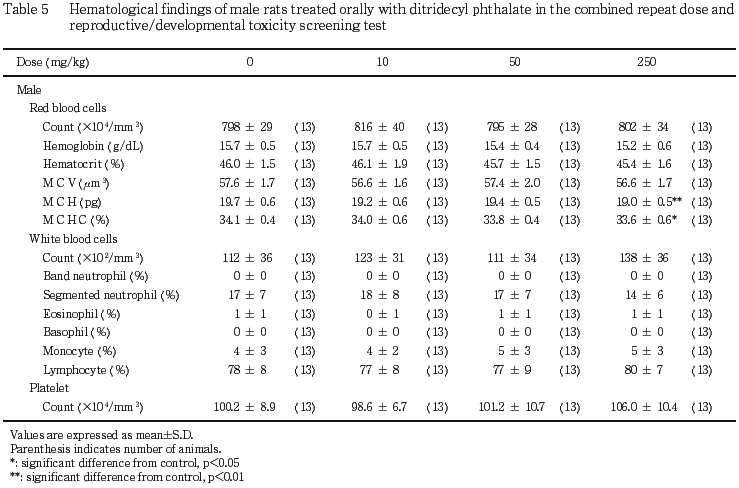
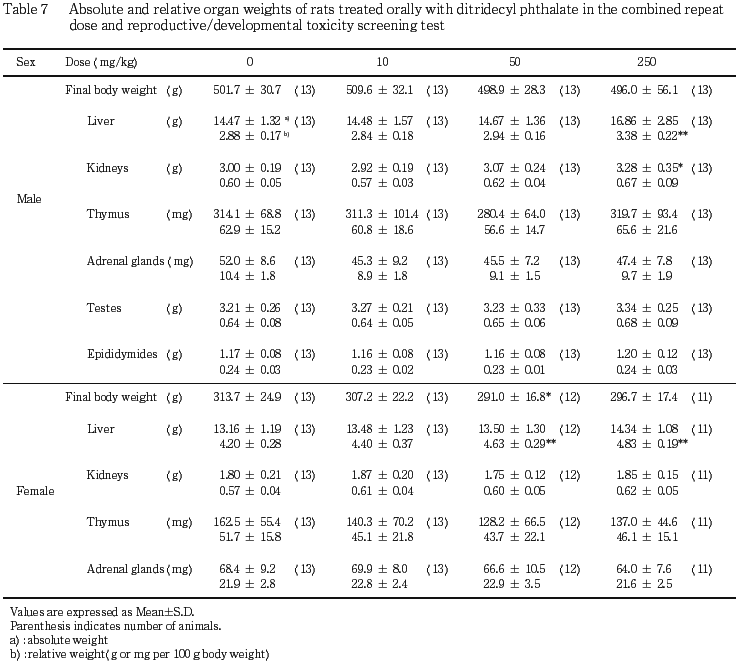
腎臓,胸腺および副腎重量には,対照群と各投与群との間に有意差は認められなかった.
その他,巣状壊死が,10および250 mg/kg投与群の各1例にみられた.
その他,出血が,10 mg/kg投与群の1例にみられた.
皮質に好塩基性の尿細管が,対照群を含む各投与群にみられたが,各群間の程度に明らかな差はなく,50 mg/kg投与群では発現頻度が低かった(p<0.05).
また,腎盂上皮の過形成が,250 mg/kg投与群の1例でみられ,蛋白円柱の形成および腎盂粘膜にリンパ球浸潤を伴っていた.
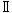 .生殖発生毒性
.生殖発生毒性
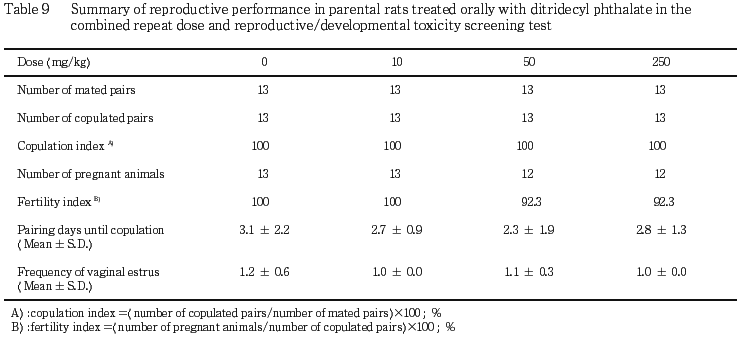
その他の動物には,分娩状態および哺育状態の異常は観察されなった.
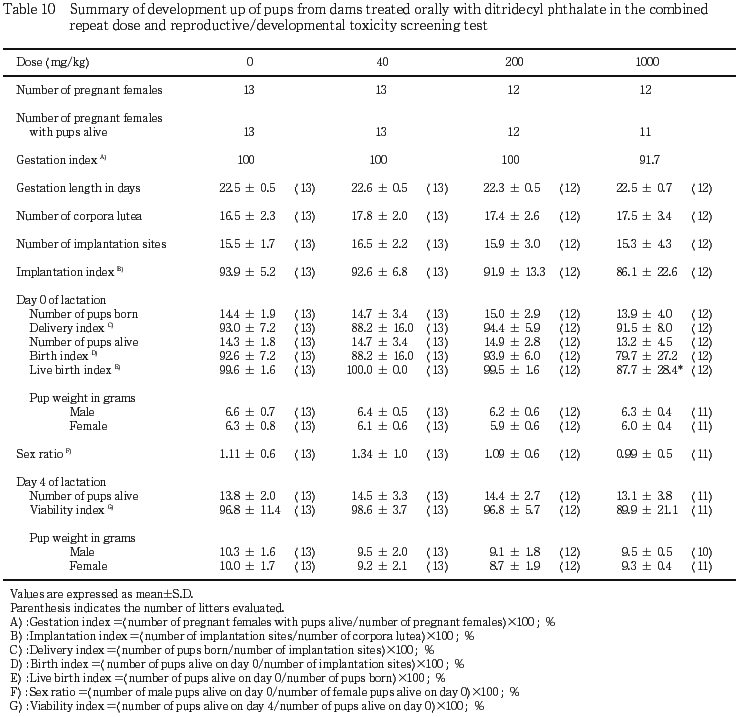
分娩率,生児出産率および性比には,対照群と各投与群との間に有意差は認められなかった.死亡児は,対照群を含む各投与群に認められたが,250 mg/kg投与群の総死亡児数は,対照群と比較してやや増加した.250 mg/kg投与群の出生率は,対照群と比較して有意(p<0.05)な低値を示し,同群の新生児の4日の生存率も減少傾向を示した.
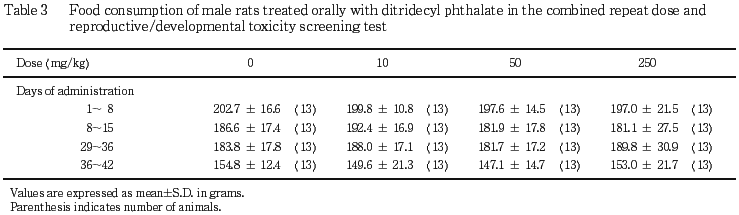
雌雄ともに,摂餌量にはジトリデシルフタラート投与の影響は認められなかったが,雌では 50 mg/kg以上のジトリデシルフタラート投与により,投与期間初期に体重の増加抑制が認められた.
肝臓重量が,雄では250 mg/kgのジトリデシルフタラート投与により,雌では 50 mg/kg以上のジトリデシルフタラート投与により増加し,病理組織学検査では,雌雄とも,50 mg/kg以上のジトリデシルフタラート投与により,小葉中心部の肝細胞に肥大が認められた.雄で実施したカタラーゼ染色では,250 mg/kgのジトリデシルフタラート投与により,小葉中心部の肝細胞にカタラーゼ陽性顆粒が増加していたことから,小葉中心性の肝細胞の腫大は,ペルオキシゾームの増殖に起因した変化と考えられた.
腎臓重量が,雄の250 mg/kgのジトリデシルフタラート投与により増加した.病理組織学検査では,eosinophilic bodyの増加が認められ,増加が著しかった動物では,尿細管上皮の壊死および脱落を伴っていた.雌の腎臓重量には,ジトリデシルフタラート投与の影響はなく,病理組織学検査では,いずれのジトリデシルフタラート投与群においても近位尿細管の空胞変性が観察されたが,頻度および程度にジトリデシルフタラートの用量に依存した明らかな変化は認められなかった.しかし,250 mg/kg投与群の雌では,膀胱移行上皮の過形成あるいはリンパ球浸潤および蛋白円柱の形成を伴った腎盂上皮の過形成が認められた.フタル酸エステルの一種であるdi-(2-ethylhexyl)phthalateのラットを用いた毒性試験において,腎臓重量の増加,尿細管上皮の変性および細胞質の崩壊・壊死が認められている1)ことから,250 mg/kg投与群の雌雄に観察された腎臓の形態学的な変化は,ジトリデシルフタラート投与による影響と考えられた.しかし,尿検査の結果には,雌雄ともにジトリデシルフタラート投与による変化は認められず,腎機能障害を示唆する所見は認められなかった.また,尿細管上皮の空胞変性の程度が著しかった雌の250 mg/kg投与群の1例では,分娩状態および分娩日の哺育状態が不良であった.病理組織学検査では,副腎束状帯に脂肪滴の増加が認められ,糖質コルチコイドの分泌増加が示唆された.さらに,胸腺細胞の著しい萎縮も認められた.ストレス負荷時には,胸腺が萎縮し,糖質コルチコイドの分泌が増加することから11),この1 例に認められた副腎の変化は,分娩時のストレスが過大であったことによるものと考えられた.
血液生化学検査の結果,250 mg/kgのジトリデシルフタラート投与により,僅かではあるがアルカリフォスファターゼ活性の上昇が認められた.アルカリフォスファターゼは,腎臓,肝臓の細胞膜に多く存在するが,本試験では,これらの組織にジトリデシルフタラート投与による変化と考えられる所見が認められていることから,ジトリデシルフタラート投与の影響である可能性が高い.
血液学検査の結果,250 mg/kgのジトリデシルフタラート投与により,平均赤血球血色素量および平均赤血球血色素濃度が低値を示したが,赤血球数,血色素量,ヘマトクリット値にジトリデシルフタラート投与の影響が認められていないことから,これらの変化は偶発的な変化であり,毒性学的に意義のないものと考えられた.
一方,フタル酸エステル投与により,精巣の萎縮,精子数減少などの精巣毒性が報告されているが5, 6),本試験では,精巣および精巣上体の重量および病理組織像には,ジトリデシルフタラート投与の影響は認められず,ジトリデシルフタラートの 250 mg/kgまでの投与では,精巣毒性はないと考えられた.
雌雄動物の交尾率,受胎率には,ジトリデシルフタラート投与による影響は認められなかった.250 mg/kg 投与群の2例で,哺育4日までに産児の約半数が死亡したが,50 mg/kg以下の投与群では,同様の変化を示した動物は認められていないことから,250 mg/kgのジトリデシルフタラート投与による哺育不良が示唆された.これに起因して,同群の死亡児総数が対照群と比較して増加し,産児の生存性が低下した.また,250 mg/kg投与群の1例が,妊娠24日に産児2例を娩出し,その産児は分娩日に死亡した.しかし,同群の他の動物は妊娠22〜23日に正常に分娩していることから,分娩遅延は,この動物の胎児2例(着床数:2)に起因したものと考えられ,ジトリデシルフタラート投与の影響ではないと考えられた.これらのことから,本試験条件下では,ジトリデシルフタラートの反復投与毒性に関する無影響量は,雌雄ともに10 mg/kg/day,生殖発生毒性に関する無影響量は,雄に対しては250 mg/kg/day,雌に対しては50 mg/kg/day,産児に対しては250 mg/kg/dayと結論される.
| 1) | 大場琢磨,鈴木康雄,大森義仁,桑村 司,山羽 力,田中 彰,小田嶋成和,石館 基,前川照彦,衛生試験所報告,93, 1(1975). |
| 2) | National toxicology program, Technical report series No.492(NTP TR 429)Diethylphthalate(Dermal studies), 5(1995). |
| 3) | 松島裕子,小野寺博志,三森国敏,前川昭彦,黒川雄二,高橋道人,衛生試験所報告,110, 26(1992). |
| 4) | E.D. Moody, K.J. Reddy, Toxicol. Appl. Pharmacol., 45, 497(1978). |
| 5) | M.D. Creasy, L.M. Beech, T.J. Gray, W.H. Butler, Exp. Mol. Pathol., 46, 357(1987). |
| 6) | S.P. Srivastava, S. Srivastava, D.K. Saxena, S.V. Chandra, P.K. Seth, Arch. Toxicol., 64, 148(1990). |
| 7) | M. R. Plasterer, W.S. Bradshaw, G.M. Booth, M.W. Carter, J. Toxicol. Environ. Health, 15, 25(1985). |
| 8) | C.J. Lamb IV, R.E. Chapin, A.D. Lawton, J.R. Reel, Toxicol. Appl. Pharmacol., 88, 255(1987). |
| 9) | J.A. Thomas, T.D. Darby, R.F. Wallin, P.J. Garvin, L. Martis, Toxicol. Appl. Pharmacol., 45, 1(1978). |
| 10) | H.F. Smyth JR., C.P. Carpenter, C.S. Weil, U.S. Pozzani, J.A. Striegel, "Range-finding toxicity data:list IV," Industrial Hygiene Journal, March-April, 1962, pp. 95-107. |
| 11) | P. Greaves, "Histopathology of preclinical toxicity studies," Elsevier, Amsterdam, New York, Oxford, 1990. |
| 連絡先 | |||
| 試験責任者: | 長尾哲二 | ||
| 試験担当者: | 和田和義,桑形麻樹子,関 剛幸,宮原 敬 | ||
| (財)食品薬品安全センター 秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Tetsuji Nagao(Study director) Kazuyoshi Wada, Makiko Kuwagata, Takayuki Seki, Takashi Miyahara | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai, Hadano, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||