2,6-ジクロロトルエンのラットを用いる反復経口投与毒性・生殖発生毒性併合試験
Combined Repeat Dose and Reproductive/Developmental Toxicity Screening Test
of 2,6-Dichlorotoluene by Oral Administration in Rats
要約
2,6-ジクロロトルエンの反復投与毒性・生殖発生毒性併合試験(以下,併合試験)を行い,同化合物の雌雄ラットに及ぼす反復投与毒性ならびに生殖発生毒性について検討した.すなわち,0(溶媒対照,コーン油),30,100,300および1000 mg/kgをSprague-Dawley系(Crj:CD)ラットの雌雄(各13匹/群)に,交配前2週間および交配期間2週間経口投与した.さらに,雄では交配期間終了後2週間,雌では妊娠期間を通して分娩後哺育3日まで投与を継続して,剖検した.
1. 反復投与毒性
雄動物では,自発運動減少が300 mg/kg投与群に1匹,活動性の低下(自発運動減少9匹,腹臥位2匹)が1000 mg/kg投与群で認められ,体重増加が300 mg/kg以上の投与群において抑制された.解剖時の検査では,腎臓の比体重値が300 mg/kg以上の投与群で,肝臓の比体重値が1000 mg/kg投与群でそれぞれ増加した.組織所見として,腎臓では,eosinophilic bodyの増加が100 mg/kg以上の投与群で認められ,肝臓では,小葉中心性の肝細胞の肥大および曇りガラス様変性が300 mg/kg以上の投与群で認められた.また,血液生化学検査では,グルコース濃度が300 mg/kg以上の投与群で減少した.摂餌量および血液学検査には,投与の影響は認められなかった.
雌動物では,活動性の低下(自発運動減少全例,腹臥位10匹),半眼(6匹),摂餌量の低下,体重増加の抑制が1000 mg/kg投与群で認められた.解剖時の検査では,腎臓および肝臓の比体重値が1000 mg/kg投与群で増加した.組織所見として,近位尿細管内に空胞および脂肪変性,小葉中心性の肝細胞の肥大が300 mg/kg以上の投与群で認められた.また,胸腺の比体重値が300 mg/kg以上の投与群で低下し,その組織所見では変化の程度が強く,その頻度も増加した.尿検査には,投与の影響は認められなかった.
2. 生殖発生毒性
交尾能力および受胎能力には,投与の影響は認められず,分娩状態にも異常は認められなかった.300 mg/kg以上の投与群において,哺育状態の不良が認められた.
産児では,300 mg/kg以上の投与群において死亡児数が増加し,新生児生存率が低下した.また,1000 mg/kg投与群では,哺育4日の産児の体重が低下傾向を示した.産児の形態異常はいずれの被験物質投与群にも認められなかった.
3. 無影響量
以上の試験成績から,本試験条件下では,2,6-ジクロロトルエンの反復投与毒性に関する無影響量は,雄では30 mg/kg/day,雌では100 mg/kg/day,生殖発生毒性に関する無影響量は,雄では1000 mg/kg/day,雌では100 mg/kg/day,産児では300 mg/kg/dayと判断される.
方法
1. 被験物質
2,6-ジクロロトルエンは,benzeneの単環メチル化合物であるtolueneの2-位および6-位に-Clを付加した化合物で,水に難溶でアセトンに易溶な無色透明の液体である.本試験に使用した2,6-ジクロロトルエン [ロット番号:960719,純度:99.2 %(wt%)] は,東レ(株)(東京)より提供を受けたもので,使用時まで室温,遮光条件下で密封保管した.なお,本被験物質を投与期間終了後に,残余被験物質を提供元で再分析した結果,純度は99.2 %であり,安定であったことが確認された.
投与検体は,コーン油(ロット番号:V6H2050,ナカライテスク(株))に溶解して,いずれの用量においても1回の投与液量が2 mL/kgになるように濃度を調整した.調製した投与液(1.5, 5.0, 15, 50 w/v%)には所定濃度の2,6-ジクロロトルエンが含有されていたことを確認した.なお,調製液中の被験物質の安定性について確認した結果,0.1〜50 w/v%の濃度では,室温,遮光条件下で少なくとも8日間安定(調製日に対する8日後の濃度の比率:98.0〜100 %)であることを確認した.
2. 使用動物および飼育条件
試験には,雌雄とも7週齢にて購入した日本チャールス・リバー(株)日野飼育センター生産のSprague-Dawley系ラット(Crj:CD,SPF)を使用した.購入した動物は,入荷後1週間,馴化と検疫を兼ねて予備飼育し,雌雄とも投与開始日(投与1日)に体重別層化無作為抽出法に準じて群分けし,各群とも雌雄各13匹を配した.
各動物は,基準温度24 ± 1 ℃,基準湿度50〜65 %,換気回数約15回/時間,照明12時間(午前7時〜午後7時)に制御された飼育室で,雄は金属製ケージ,雌は床敷として紙パルプ製チップ(ALPHA-dri®,加商(株))を供給したラット用繁殖ケージ(日本クレア(株))に個別に収容して飼育し,固形飼料(CE-2,日本クレア(株))および飲料水として水道水(秦野市水道局給水)を自由に摂取させた.
3. 投与量の設定および投与方法
被験物質の投与量は,投与量設定のための予備試験の結果を参考に決定した.すなわち,2,6-ジクロロトルエンの0,250,500および1000 mg/kgを各群5匹の雌雄ラット(Crj:CD,9週齢)に14日間連続投与したところ,死亡例は認められず,一般状態の変化として雄では各投与群に,雌では500 mg/kg以上の投与群に一過性の流涎が認められた.また,すべての被験物質投与群において軽度ではあるが雌雄ともに肝臓重量が増加し,さらに雄では腎臓重量も増加した.体重,摂餌量,血液学検査および血液生化学検査には,毒性変化を示唆する所見は認められなかった.これらのことから,より長期間の投与でも親動物は死亡しないと考えられ,OECDガイドラインに定められている最高限度の量である1000 mg/kgを最高用量に選び,以下,公比3で除して高用量を300 mg/kg,中用量を100 mg/kg,低用量を30 mg/kgに設定した.
対照群のラットには,被験物質の媒体としたコーン油を被験物質投与群と同一条件にて投与した.
各用量の投与検体は,雄に対しては交配前14日間と交配期間14日間および交配期間終了後14日間の連続42日間,また,雌に対しては交配前14日間と最長14日間の交配期間中(交尾まで)ならびに交尾雌では妊娠期間を通して分娩後の哺育3日(分娩日=哺育0日)まで毎日1回,ガラス製注射筒およびラット用金属製胃管を用いて経口投与した.毎日の投与は,9時〜12時の間に行い,各動物の投与液量(2 mL/kg体重)は,雄ならびに交配前および交配期間中の雌については投与日に最も近接した時期の測定体重をもとに,また,交尾後の雌については妊娠0日(交尾確認日)の体重をもとにそれぞれ算出した.
4. 検査項目
1) 親動物
(1) 一般状態
雌雄とも,全例について飼育期間中毎日観察した.
(2) 体重
雄は,全例について投与1,8,15,22,29,36,42日および解剖日に,雌は,全例について投与1,8,15日に測定し,投与22日までに交尾が確認されなかった雌は,投与22日にも体重を測定した.また,交尾雌では,妊娠0,7,14,20日に,分娩した雌では,哺育0および4日(解剖日)に体重を測定した.
(3) 摂餌量
雌雄とも全例について,体重測定日と同日に飼料重量を測定し,測定日から次の測定日までの間の摂餌量を算出した.2週間の交配期間中の摂餌量は測定しなかった.交尾雌では,妊娠0〜7,7〜14,14〜20日,さらに,分娩した雌では,哺育0〜4日の摂餌量を算出した.
(4) 交配
交配は,投与15日(投与開始日=投与1日)の夕方から最長2週間,同群内の雌雄を1対1で同居させて行った.交尾の確認は,毎朝,腟栓および腟垢中の精子の存在を調べることにより行い,交尾が確認された雌は,その日を妊娠0日と起算して雄から分離し,個別に飼育した.交配結果から,各群について交尾率 [(交尾動物数/交配動物数)× 100],受胎率[(受胎動物数/交尾動物数)× 100],同居開始日から交尾までに要した日数およびその間に回帰した発情期の回数を求めた.
(5) 分娩状態
各群とも交尾した雌は,全例を自然分娩させた.分娩状態の観察は,観察可能なものについて行い,それ以外の動物については,分娩後の徴候から分娩困難や遅延などの分娩障害の有無を判断した.分娩後は,哺育状態を観察した.
(6) 分娩日の規定
分娩の確認は,午前9時〜11時に限定し,この時間帯に分娩が完了していることを確認した動物について,その日を分娩日と規定した.午前11時を過ぎて分娩した動物については,翌日を分娩日とした.
分娩を確認した動物について妊娠期間(妊娠0日から分娩日までの日数)を算定し,出産率 [(生児出産雌数/受胎動物数)× 100] を各群について求めた.
(7) 尿検査
雌の全例について,妊娠20日および分娩した雌では哺育2日に,pH,潜血,蛋白,糖,ケトン体,ウロビリノーゲン,ビリルビンについて試験紙法(マルティスティックス/クリニテック200,マイルス三共)により尿検査を実施した.なお,排尿せず,尿採取ができなかった例は,尿検査を実施しなかった.
(8) 最終検査
A. 雄動物
イ. 剖検,器官重量および病理組織検査
最終投与日(投与42日)の投与終了後から絶食し,翌日にペントバルビタール投与後に放血・致死させて剖検した.その際,全例について肝臓,腎臓,胸腺,精巣および精巣上体の重量を測定した.また,これらの器官および脳,心臓,脾臓,副腎,膀胱および剖検において異常を認めた器官(肺,胃)は10 %ホルマリンに,精巣および精巣上体はブアン液に固定して保存した.対照群および最高用量群のこれらの器官(肺,胃を除く)は,常法に従ってパラフィン切片とし,ヘマトキシリン−エオジン染色を行って病理組織学検査を実施したが,最高用量群に異常が認められた器官(腎臓,肝臓,精巣)は,その他の投与群についても検査を実施した.なお,対照群2匹,30 mg/kg投与群3匹,100 mg/kg投与群3匹,300 mg/kg投与群3匹,1000 mg/kg投与群3匹の腎臓について,PAS染色を行った.
ロ. 血液検査
ペントバルビタール麻酔下で腹部後大静脈よりEDTAを抗凝固剤として採血し,Coulter Counter Model S-PLUS ・(コールターエレクトロニクス)を用いた電気抵抗法により,赤血球数(RBC),白血球数(WBC),平均赤血球容積(MCV),血小板数を自動測定し,また,吸光度法により血色素量(Hb)を自動測定してそれらの値から平均赤血球血色素量(MCH = Hb × 1000/RBC),ヘマトクリット値(Ht = RBC × MCV × 0.001),平均赤血球血色素濃度(MCHC = Hb × 100/Ht)を算出した.白血球分類は,Wright-Giemsa染色した静脈血塗抹標本を光学顕微鏡下で観察することにより視算した.
ハ. 血液生化学検査
全例について,血液学検査のための採血に引き続き,ヘパリンを抗凝固剤として採血し,血漿を分離して,遠心方式生化学自動分析装置COBAS-FARA(ロシュ)を用いて総蛋白濃度(ビウレット法),アルブミン濃度(BCG法),総コレステロール濃度(COD・DAOS法),ブドウ糖濃度(グルコキナーゼG6PDH法),尿素窒素濃度(BUN; ウレアーゼG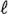 .DH法),クレアチニン濃度(Jaffe'法),アルカリフォスファターゼ活性(ALP; パラニトロフェニルリン酸基質法),GOTおよびGPT活性(SSCC法),総ビリルビン濃度(ビリルビン「ロシュ」キットSシリーズ),カルシウム濃度(OCPC法),無機リン濃度(Inorg. phos.; モリブデン酸直接法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法)を測定し,全自動電解質分析装置EA05(A&T)を用いてイオン電極法により,塩素,ナトリウムおよびカリウムの各濃度を測定した.また,A/G比は上記の測定結果に基づいて算出した.
.DH法),クレアチニン濃度(Jaffe'法),アルカリフォスファターゼ活性(ALP; パラニトロフェニルリン酸基質法),GOTおよびGPT活性(SSCC法),総ビリルビン濃度(ビリルビン「ロシュ」キットSシリーズ),カルシウム濃度(OCPC法),無機リン濃度(Inorg. phos.; モリブデン酸直接法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法)を測定し,全自動電解質分析装置EA05(A&T)を用いてイオン電極法により,塩素,ナトリウムおよびカリウムの各濃度を測定した.また,A/G比は上記の測定結果に基づいて算出した.
B. 雌動物
交尾したが分娩しない雌は妊娠25日相当日に,分娩した雌は哺育4日に,それぞれペントバルビタールを投与して放血・致死させ,剖検した.妊・不妊のいずれの例においても卵巣および子宮を摘出し,卵巣は実体顕微鏡下で妊娠黄体数を数えた後,ブアン液に固定して保存した.子宮についてはSalewski法1)を応用して着床痕を染色して着床数を確認し,着床率 [(着床数/妊娠黄体数)× 100] を算出した.また,胸腺,肝臓および腎臓の重量を全例について測定した.これらの器官および脳,心臓,脾臓,副腎,膀胱,子宮および剖検において異常を認めた器官(肺,胃)は10 %ホルマリンに固定して保存した.対照群および最高用量群のこれらの器官(肺,胃を除く)は,常法に従ってパラフィン切片とし,ヘマトキシリン−エオジン染色を行って病理組織学検査を実施したが,最高用量群に異常が認められた器官(腎臓,肝臓,脾臓および胸腺)は,その他の投与群についても検査を実施した.また,不妊例の卵巣については,病理組織学検査を行った.なお,対照群1匹,30 mg/kg投与群1匹,100 mg/kg投与群1匹,300 mg/kg投与群3匹,1000 mg/kg投与群4匹の腎臓について,Oil red O染色を行った.
2) 産児
(1) 産児数
哺育0日に産児数(生存児+死亡児)を調べ,分娩率 [(産児数/着床痕数)× 100] および生児出産率 [(出産生児数/着床痕数)× 100] を求めた.また,産児の外表異常の有無および性別を調べ,生存児の性比 [(雄の生児数/雌の生児数)× 100] を算出した.
(2) 死亡児数
死亡児数を毎日調べ,出生率 [(出産生児数/産児数)× 100] および新生児生存率 [(哺育4日の生児数/哺育0日の生児数)× 100] を求めた.死亡児は剖検し,胸腔および腹腔内の器官を除去した後,エタノールに固定して保存した.
(3) 体重
哺育0日および4日に1腹単位で雌雄別に体重(litter重量)を測定し,[litter重量/測定児数] を各腹について求めた.
(4) 剖検
哺育4日に全例をエーテル吸入により致死させ,剖検した.胸腔および腹腔内の器官は,一括して摘出し,各腹ごとに10 %ホルマリンに固定して保存した.カーカスは,1腹ごとにエタノールに固定して保存した.
5. データ解析法
交尾率,受胎率および産児の形態異常発現頻度についてはYatesの補正を含むχ2検定2)を行った.病理組織学所見については,Mann-WhitneyのU検定3)を用いて検定し,陽性グレードの合計値はFisherの直接確率の片側検定を用いた.その他のすべてのデータ(尿検査データを除く)は,個体ごとに得られた値あるいは1腹ごとの平均値を1標本として,先ず,Bartlett法4)により各群の分散の一様性について検定した.その結果に基づき,分散が一様とされた場合には,一元配置型の分散分析あるいはKruskal-Wallisの順位検定7)を行い,群間に有意性が認められた場合には対照群と被験物質各投与群との差について,Dunnett法5)あるいはScheff 法6)を用いて対照群と各投与群との平均値の差の検定を行った.有意水準は,Fisherの直接確率の片側検定は5 %とし,その他は,5 %および1 %とした.
法6)を用いて対照群と各投与群との平均値の差の検定を行った.有意水準は,Fisherの直接確率の片側検定は5 %とし,その他は,5 %および1 %とした.
結果
1. 反復投与毒性(親動物所見)
1) 一般状態
雌雄ともに,いずれの投与群にも死亡動物は認められなかった.
雄では,300 mg/kg投与群において投与期間初期に自発運動減少が1匹,1000 mg/kg投与群では,投与期間を通じて自発運動減少が9匹に,投与期間初期に腹臥位が2匹に,紅涙が1匹に観察された.雌では,1000 mg/kg投与群において自発運動減少が投与期間を通じて全例に,投与期間初期に腹臥位が10匹,半眼が6匹,立毛が1匹に観察された.これらの症状は,雌雄ともに翌日の投与までには消失した.また,雌雄ともに300 mg/kg以上の投与群では,投与期間を通じて投与直後に一過性の流涎が観察され,1000 mg/kg投与群では,投与直前から流涎を呈す動物も散見された.
分娩後の動物では,削痩および哺育行動を示さない母動物が300および1000 mg/kg投与群の各1匹に認められた.
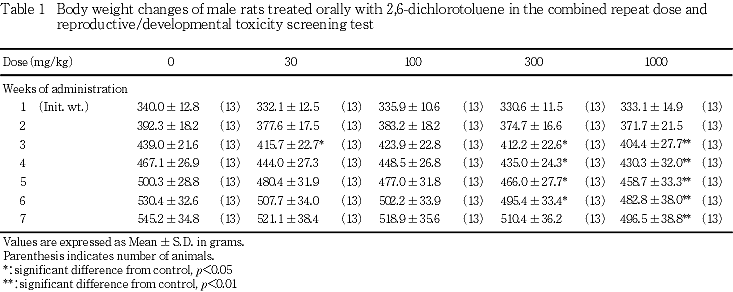
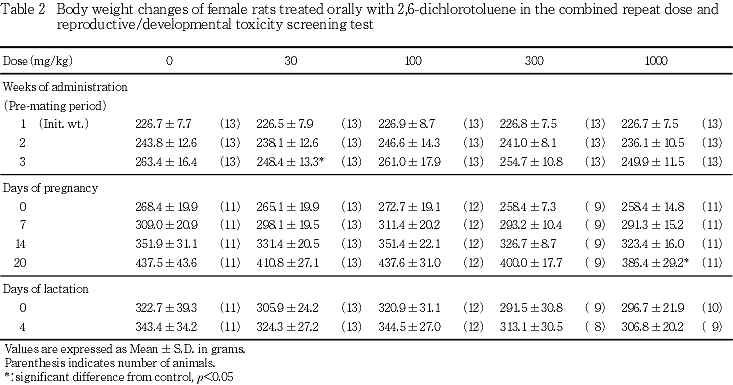
2) 体重(Tables 1, 2)
A. 雄動物
実測値については,30 mg/kg投与群では投与15日,300 mg/kg投与群では投与15,22,29および36日,1000 mg/kg投与群では投与15,22,29,36および42日(最終投与日)に対照群と比較して有意(p<0.05,p<0.01)な低値を示した.
増加量については,30 mg/kg投与群では投与開始日から15日,300 mg/kg投与群では投与開始日から15,22,29および36日まで,1000 mg/kg投与群では投与開始日から8,15,22,29,36および42日までの増加量が対照群と比較して有意(p<0.05,p<0.01)に抑制された.
100 mg/kg投与群では,実測値および増加量に統計学的有意差は認められなかった.
B. 雌動物
(1) 交配前
実測値については,30 mg/kg投与群では投与15日の体重が対照群と比較して有意(p<0.05)な低値を示した.
増加量については,30および1000 mg/kg投与群では投与開始日から15日までの増加量が有意(p<0.01)に抑制された.しかし,30〜300 mg/kg投与群では用量に依存した変化は認められなかった.
100および300 mg/kg投与群では,実測値および増加量に有意差は認められなかった.
(2) 妊娠期
実測値については,1000 mg/kg投与群において,妊娠20日の体重が対照群と比較して有意(p<0.05)な低値を示した.
増加量については,30 mg/kg投与群では妊娠0日から14日まで,1000 mg/kg投与群では妊娠0日から14および20日までの増加量が対照群と比較して有意(p<0.05,p<0.01)に抑制された.しかし,30〜300 mg/kg投与群では用量に依存した変化は認められなかった.
100および300 mg/kg投与群では,実測値および増加量に有意差は認められなかった.
(3) 哺育期
1000 mg/kg投与群において,哺育0〜4日の増加量に抑制傾向が認められたが,いずれの投与群においても,体重および体重増加量には対照群との間に有意差は認められなかった.
3) 摂餌量(Tables 3, 4)
A. 雄
いずれの投与群においても,摂餌量には対照群との間に有意差は認められなかった.
B. 雌
(1) 交配前
30 mg/kg投与群では投与8〜15日,1000 mg/kg投与群では投与1〜8日および8〜15日の摂餌量が対照群と比較して有意(p<0.05,p<0.01)な低値を示した.100および300 mg/kg投与群では,摂餌量には対照群との間に有意差は認められなかった.
(2) 妊娠期
1000 mg/kg投与群において,妊娠0〜7日および7〜14日の摂餌量が対照群と比較して有意(p<0.05)な低値を示した.300 mg/kg以下の投与群では,摂餌量には対照群との間に有意差は認められなかった.
(3) 哺育期
いずれの投与群においても,摂餌量には対照群との間に有意差は認められなかった.


4) 尿検査所見
採尿が可能であった動物では,いずれの投与群においても投与に起因したと考えられる変化は認められなかった.
5) 解剖時検査
A. 雄
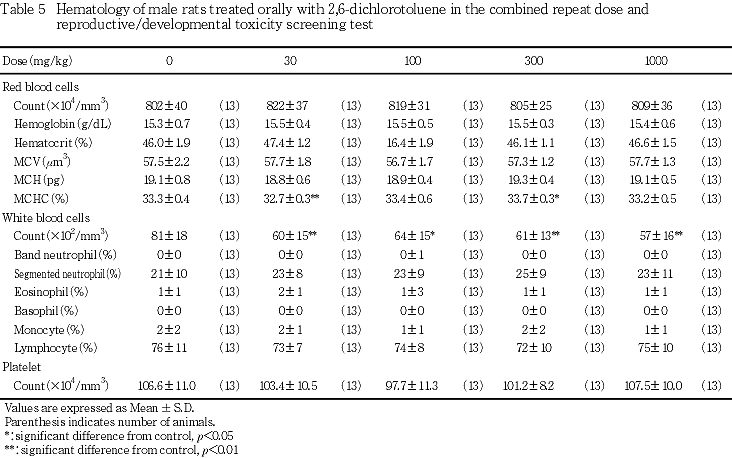
(1) 血液学検査(Table 5)
赤血球に関しては,平均赤血球血色素濃度が30 mg/kg投与群では対照群と比較して有意(p<0.01)に減少し,300 mg/kg投与群では有意(p<0.05)に上昇した.
白血球に関しては,白血球数が各投与群において有意(p<0.05,p<0.01)に減少したが,百分比には対照群との間に有意差は認められなかった.
血小板数にも対照群と各投与群との間に有意差は認められなかった.
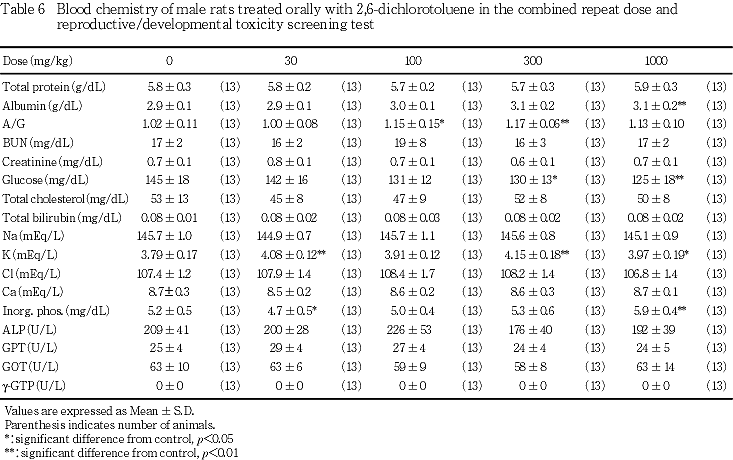
(2) 血液生化学検査(Table 6)
アルブミン濃度が300 mg/kg以上の投与群で上昇し,1000 mg/kg投与群において対照群との間に有意差(p<0.01)が認められ,A/G比は,100および300 mg/kg投与群において対照群と比較して有意(p<0.05,p<0.01)に上昇した.グルコース濃度は,300 mg/kg以上の投与群において有意(p<0.05,p<0.01)に減少した.
カリウム濃度は,30,300および1000 mg/kg投与群において有意(p<0.05,p<0.01)に上昇した.無機リン濃度は,30 mg/kg投与群で有意(p<0.05)に減少し,1000 mg/kg投与群では有意(p<0.01)に上昇した.
総蛋白濃度,尿素窒素濃度,クレアチニン濃度,総コレステロール濃度,総ビリルビン濃度,ナトリウム濃度,塩素濃度,カルシウム濃度,アルカリフォスファターゼ活性,GPT活性,GOT活性,γ-GTP活性には,対照群と各投与群との間に有意差は認められなかった.
(3) 剖検所見
肝臓では,腫大および小葉像の明瞭化が1000 mg/kg投与群の1匹に,黄白色または淡色の斑や領域が対照群および30 mg/kg投与群各3匹,100および300 mg/kg投与群各1匹に認められた.そのほかに,30 mg/kg投与群では胸腺の暗赤色化が1匹,肺の赤色点が2匹に,腺胃粘膜の赤褐色点が1匹に,1000 mg/kg投与群では肺に褐色域および精巣の小型化が1匹に認められた.
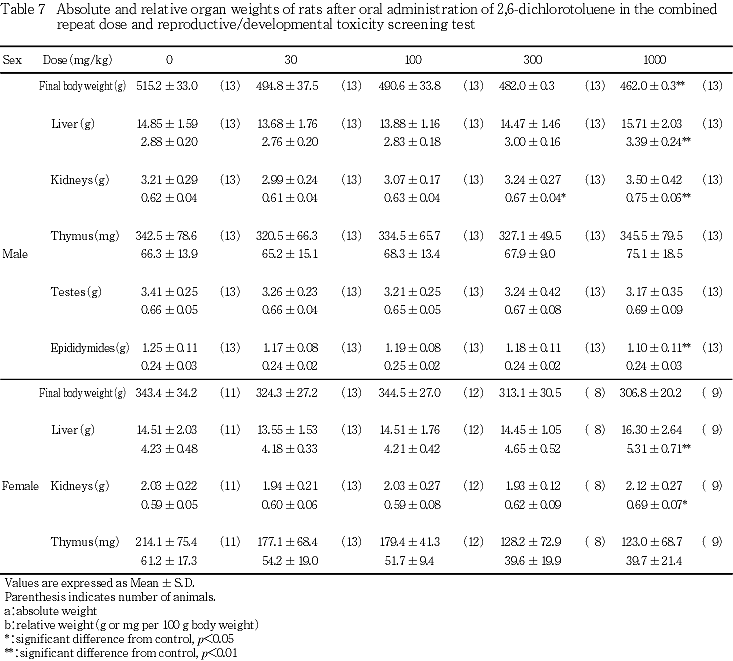
(4) 器官重量(Table 7)
肝臓の比体重値が1000 mg/kg投与群において,腎臓の比体重値が300 mg/kg以上の投与群において,それぞれ対照群と比較して有意(p<0.05,p<0.01)な高値を示した.また,精巣上体の実重量が1000 mg/kg投与群において有意(p<0.01)な低値を示したが,比体重値には,対照群との間に有意差は認められなかった.その他の器官には,対照群と各投与群との間に有意差は認められなかった.なお,剖検時体重が,1000 mg/kg投与群において対照群と比較して有意(p<0.01)な低値を示した.
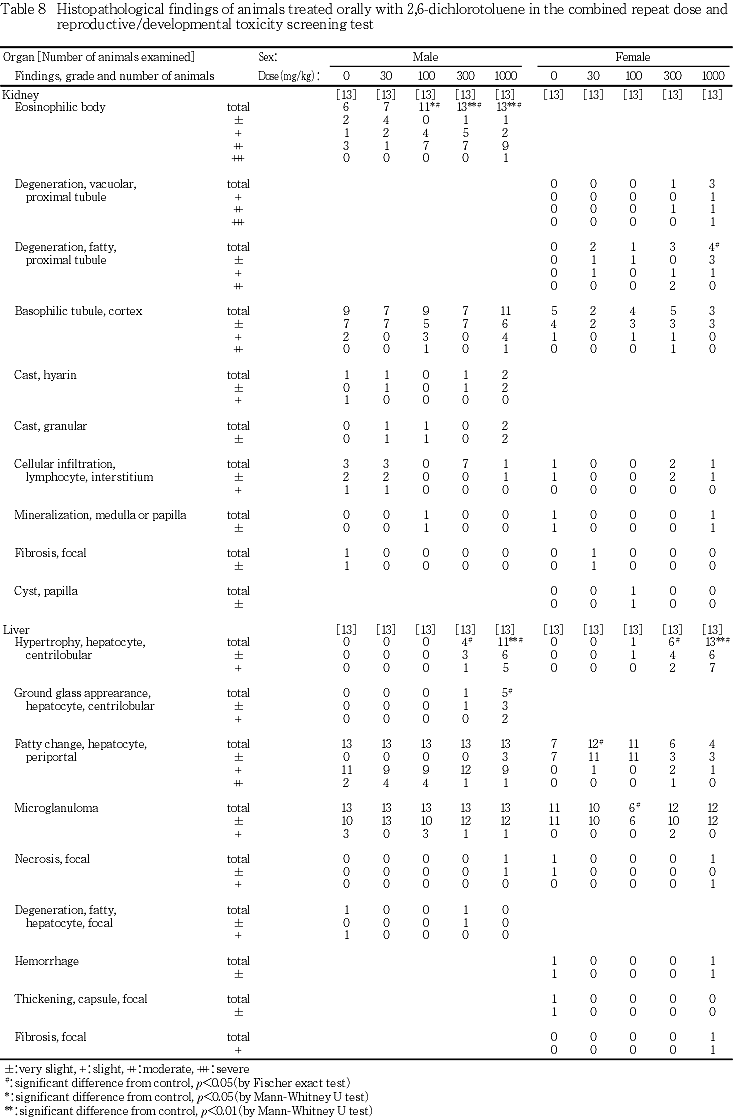
(5) 病理組織学検査(Table 8)
各器官における観察所見を以下に示す.
(腎臓)
Eosinophilic bodyが対照群6匹,30 mg/kg投与群7匹,100 mg/kg投与群11匹,300および1000 mg/kg投与群各全例に認められ,100 mg/kg以上の投与群では,その程度および頻度が対照群と比較して有意(p<0.05,p<0.01)に増強された.さらに,硝子円柱が対照群,30および300 mg/kg投与群各1匹,1000 mg/kg投与群2匹に,顆粒状の円柱が30および100 mg/kg投与群各1匹,1000 mg/kg投与群2匹に認められた.これらのうち,対照群2匹,被験物質投与群各3匹についてPAS染色を実施した結果,硝子円柱は陽性反応を示し,eosinophilic bodyおよび顆粒状の円柱は陽性反応を示さなかった.また,皮質に好塩基性尿細管が対照群9匹,30 mg/kg投与群7匹,100 mg/kg投与群9匹,300 mg/kg投与群7匹,1000 mg/kg投与群11匹に,間質へのリンパ球浸潤が対照群3匹,30 mg/kg投与群3匹,300 mg/kg投与群7匹,1000 mg/kg投与群1匹に認められたが,対照群と各投与群との間に程度および頻度の差は認められなかった.そのほかに,髄質に鉱質沈着が100 mg/kg投与群1匹に,限局性の線維化が対照群1匹に認められた.
(肝臓)
小葉中心性の肝細胞の肥大が300 mg/kg投与群4匹,1000 mg/kg投与群11匹に認められ,両投与群では対照群と比較してその発現頻度に有意差(p<0.05)が認められた.これらのうち,300 mg/kg投与群1匹,1000 mg/kg投与群5匹では肥大の程度が強く,1000 mg/kg投与群では,その程度が有意(p<0.01)に増強された.さらに,肝細胞が肥大した例のうち,300 mg/kg投与群1匹および1000 mg/kg投与群5匹に軽度あるいはごく軽度な曇りガラス様変性が認められ,1000 mg/kg投与群では,対照群と比較してその発現頻度に有意差(p<0.05)が認められた.また,門脈周囲性の肝細胞の脂肪化および小肉芽腫が全例に認められたが,対照群と2,6-DCT各投与群との間に程度および頻度の差は認められなかった.そのほかに,限局性壊死が1000 mg/kg投与群1匹,限局性の肝細胞の脂肪変性が対照群および300 mg/kg投与群の各1匹に認められた.
(精巣および精巣上体)
限局性の精細管の萎縮が100 mg/kg投与群1匹,300 mg/kg投与群2匹,1000 mg/kg投与群4匹に認められ,1000 mg/kg投与群では,対照群と比較してその発現頻度に有意差(p<0.05)が認められた.これらのうち,1000 mg/kg投与群の3匹に精巣上体の管腔内に細胞残屑が認められた.また,対照群および1000 mg/kg投与群各1匹の精巣上体に精子肉芽腫および間質へのリンパ球浸潤が認められた.
(脾臓)
髄外造血および褐色色素の沈着が対照群および1000 mg/kg投与群の全例に認められたが,両群間に程度および頻度の差は認められなかった.
(心臓)
限局性の心筋変性が対照群および1000 mg/kg投与群各1匹に,出血が1000 mg/kg投与群1匹に認められた.
(胸腺)
出血が対照群の1匹,1000 mg/kg投与群の2匹に認められた.
(脳,副腎および膀胱)
対照群および1000 mg/kg投与群に異常は認められなかった.
B. 雌
(1) 剖検所見
肝臓では,暗色化あるいは白色点が1000 mg/kg投与群に各1匹,黄白色または淡色の斑が30 mg/kg投与群1匹および300 mg/kg投与群2匹に認められた.腎臓では,淡色化が30,300および1000 mg/kg投与群各1匹に,髄質の赤色化が1000 mg/kg投与群1匹に認められた.胸腺では,小型化が300 mg/kg投与群2匹,1000 mg/kg投与群4匹に,赤色点が対照群および30 mg/kg投与群各2匹,1000 mg/kg投与群1匹に認められた.これらのほかに,1000 mg/kg投与群では,脾臓の小型化が1匹,肺の暗赤色域および白色点ならびに縦隔リンパ節腫大が1匹,前胃あるいは腺胃の粘膜に暗色点が各1匹に認められた.
(2) 器官重量(Table 7)
肝臓および腎臓の比体重値が1000 mg/kg投与群において,それぞれ対照群と比較して有意(p<0.05,p<0.01)な高値を示した.また,胸腺の実重量および比体重値が300および1000 mg/kg投与群において低値を示したが,対照群との間に有意差は認められなかった.
不妊動物および全産児が死亡した母動物では,肝臓の比体重値が1000 mg/kg投与群において増加傾向を示した.
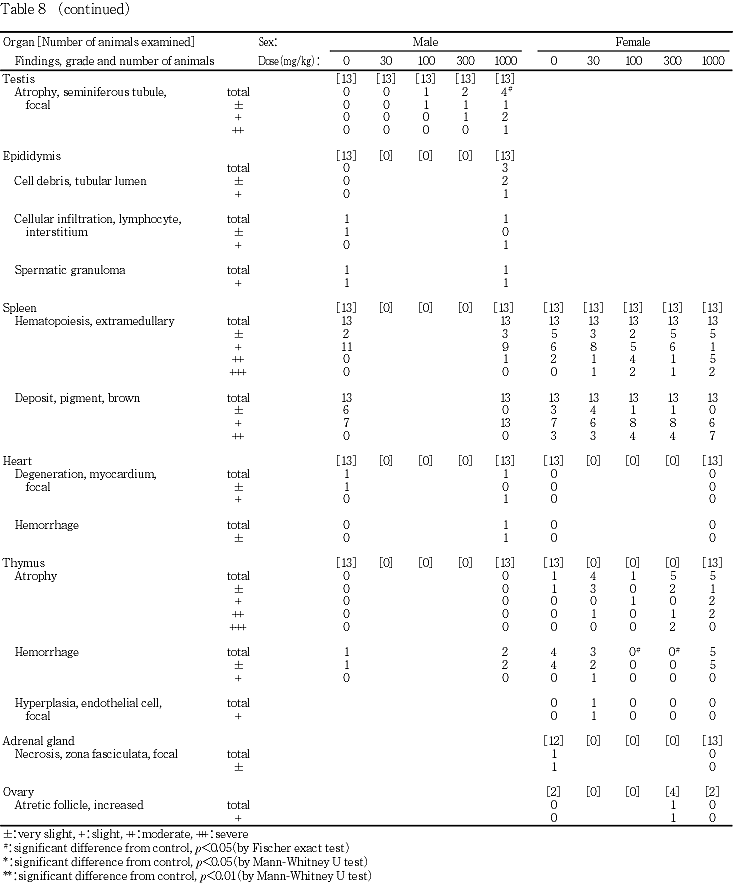
(3) 病理組織学検査(Table 8)
各器官における観察所見を以下に示す.
(腎臓)
近位尿細管の空胞変性が300 mg/kg投与群1匹,1000 mg/kg投与群3匹に認められ,300 mg/kg投与群1匹および1000 mg/kg投与群2匹では,広範囲な領域に空胞変性が認められた.一方,近位尿細管に脂肪変性が30 mg/kg投与群2匹,100 mg/kg投与群1匹,300 mg/kg投与群3匹,1000 mg/kg投与群4匹に認められ,1000 mg/kg投与群では,対照群と比較してその発現頻度に有意差(p<0.05)が認められた.これらのうち,300 mg/kg投与群の2匹では,他の群と比較して脂肪滴の数が多かった.空胞変性および脂肪様の変性が認められた例について,oil red O染色を実施した結果,空胞変性と考えられた尿細管の空胞は陽性反応を示さなかったが,脂肪変性と考えられた空胞は大部分が陽性反応を示した.また,好塩基性尿細管が対照群5匹,30 mg/kg投与群2匹,100 mg/kg投与群4匹,300 mg/kg投与群5匹,1000 mg/kg投与群3匹に認められたが,対照群と各投与群との間に程度および頻度の差は認められなかった.これらのほかに,間質へのリンパ球浸潤が対照群1匹,300 mg/kg投与群2匹,1000 mg/kg投与群1匹に,髄質又は乳頭部に鉱質沈着が対照群および1000 mg/kg投与群各1匹に,限局性の線維化が30 mg/kg投与群1匹に,乳頭部に嚢胞が100 mg/kg投与群1匹に認められた.
(肝臓)
小葉中心性の肝細胞の肥大が100 mg/kg投与群1匹,300 mg/kg投与群6匹,1000 mg/kg投与群全例に認められ,300 mg/kg以上の投与群では,対照群と比較してその発現頻度に有意差(p<0.05)が認められた.これらのうち,300 mg/kg投与群2匹,1000 mg/kg投与群7匹では肥大の程度が強く,1000 mg/kg投与群では,対照群と比較してその程度が有意(p<0.01)に増強された.また,門脈周囲性の肝細胞の脂肪化が対照群7匹,30 mg/kg投与群12匹,100 mg/kg投与群11匹,300 mg/kg投与群6匹,1000 mg/kg投与群4匹に,小肉芽腫が対照群11匹,30 mg/kg投与群10匹,100 mg/kg投与群6匹,300 mg/kg投与群12匹,1000 mg/kg投与群12匹に認められ,肝細胞の脂肪化の発現頻度が30 mg/kg 投与群において有意(p<0.05)に増加し,小肉芽腫の発現頻度が100 mg/kg投与群において有意(p<0.05)に減少したが,これらの変化は,用量依存的な変化ではなかった.そのほかに,出血を伴った限局性壊死が対照群および1000 mg/kg投与群各1匹,被膜の限局性の肥厚が対照群1匹,限局性の線維化が1000 mg/kg投与群1匹に認められた.
(脾臓)
髄外造血および褐色色素の沈着が全例に認められた.髄外造血は,対照群と比較して各投与群に程度の強い例が認められたが,その程度および頻度に明らかな差は認められず,褐色色素の沈着は,1000 mg/kg投与群で対照群と比較して程度の強い例が多く認められたが,対照群と300 mg/kg以下の投与群との間に程度の差は認められなかった.
(胸腺)
萎縮が対照群1匹,30 mg/kg投与群4匹,100 mg/kg投与群1匹,300および1000 mg/kg投与群各5匹に認められ,300および1000 mg/kg投与群では対照群と比較して程度および頻度が増加する傾向が認められた.そのほかに,出血が対照群4匹,30 mg/kg投与群3匹,1000 mg/kg投与群5匹に認められ,100および300 mg/kg投与群では出血が認められなかったことから,その発現頻度に対照群と比較して有意差(p<0.05)が認められた.出血の程度のやや強い30 mg/kg投与群の1例では内皮細胞の限局性の過形成が認められた.
(副腎)
束状帯の限局性の壊死が対照群の1匹に認められた.
(心臓,膀胱,脳)
対照群および1000 mg/kg投与群に異常は認められなかった.
(卵巣)
不妊例(対照群2匹,300 mg/kg投与群4匹,1000 mg/kg投与群2匹)の卵巣では,300 mg/kg投与群1匹に閉鎖卵胞の増加が認められた.
2. 生殖発生毒性
1) 生殖関連所見
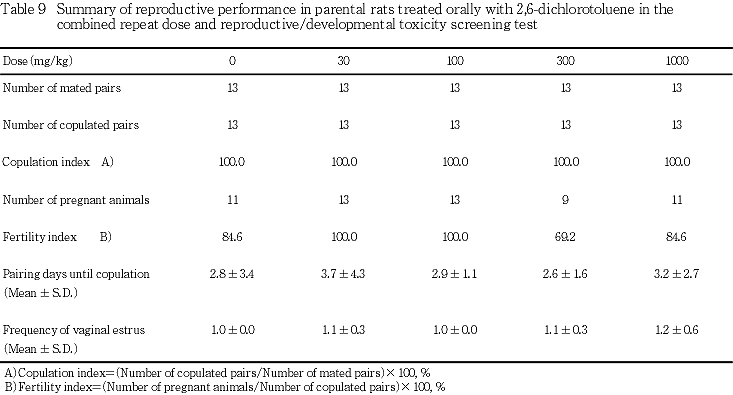
(1) 交配成績(Table 9)
交尾率は,すべての群で100 %を示した.受胎率は,300 mg/kg投与群で若干低下したが,用量依存的な変化ではなく,対照群との間に有意差も認められなかった.また,同居開始から交尾成立までに要した日数およびその間に回帰した発情期の回数にも,対照群と各投与群との間に有意差は認められなかった.
(2) 分娩および哺育状態
分娩状態の直接観察が可能であった動物に,異常分娩は観察されなかった.また,直接観察ができなかった動物に関しては,1000 mg/kg投与群の1匹に分娩終了後の観察時に全産児の死亡が確認された.
哺育状態に関しては,300 mg/kg投与群の1匹が哺育1日から哺育行動(児の回集,授乳)を示さず,その産児は胃内に乳汁の貯留がなく,また,ケージ内に散乱し,体表温低下が認められ,哺育3日までにすべてが死亡した.同群の他の1匹の産児も哺育3日に胃内の乳汁貯留がなく,体表温低下が認められたが,哺育4日まで生存した.
1000 mg/kg投与群では,1匹が哺育2および3日に哺育行動(児の回集)を示さず,その産児は胃内に乳汁の貯留がなく,また,ケージ内に散乱していたが,哺育4日まで生存した.同群の他の1匹は,哺育1日までにすべての産児が死亡した.
100 mg/kg以下の投与群では,哺育状態に異常は認められなかった.
(3) 出産率および妊娠期間(Table 10)
出産率は,1000 mg/kg投与群において若干低値を示したが,対照群との間に有意差は認められず,300 mg/kg以下の投与群では100 %を示した.
妊娠期間については,1000 mg/kg投与群の1匹に妊娠期間の延長(24日間)が認められたが,対照群と各投与群との間に有意差は認められなかった.
(4) 黄体数,着床数および着床率(Table 10)
黄体数には,対照群と各投与群との間で有意差は認められなかった.
1000 mg/kg投与群において,着床数が著しく低下した動物が2匹認められたことにより,群平均の着床数および着床率が低下傾向を示したが,対照群との間に有意差は認められなかった.
2) 産児所見
(1) 生存性(Table 10)
300 mg/kg投与群では,哺育4日の生児数および新生児生存率が,1000 mg/kg投与群では,産児数,分娩率,出産生児数,生児出産率,出生率,哺育4日の生児数および新生児生存率が低下傾向を示したが,対照群との間に有意差は認められなかった.性比についても対照群との間で有意差は認められなかった.
(2) 体重(Table 10)
1000 mg/kg投与群において,哺育4日の体重が雌雄ともに低下傾向を示したが,対照群との間に有意差は認められなかった.

(3) 形態
哺育0日の生存産児に外表奇形は認められず,哺育4日における産児の剖検でも,外表および内臓に異常は認められなかった.また,観察可能であった死亡児にも異常は認められなかった.
考察
2,6-ジクロロトルエンの0,30,100,300あるいは1000 mg/kgをSprague-Dawley系(Crj:CD)ラットの雌雄に交配前2週間および交配期間2週間を通して経口投与し,さらに雄では交配期間終了後2週間,雌では妊娠期間を通して分娩後哺育3日まで投与を継続して,親動物に対する反復投与毒性およびその生殖能力ならびに次世代児の発生・発育に及ぼす影響について検討した.
1. 反復投与毒性
雌雄ともに,1000 mg/kg投与群において,自発運動減少,腹臥位などの活動性の低下が,さらに雌では半眼も観察された.2,6-ジクロロトルエンの基本骨格であるトルエンは,中枢神経に対する抑制作用を有している8)ことから,上記の変化は,被験物質の投与に起因した変化と考えられる.さらに,雄の300 mg/kg投与群においても,1匹のみであったが自発運動減少が観察され,1000 mg/kg投与群に観察された自発運動減少と同様の変化であり,また,100 mg/kg以下の投与群では自発運動減少は認められていないことから,この変化も,軽度ではあるが投与に起因したものと考えられる.なお,雌雄ともに300 mg/kg以上の投与群で流涎が観察されたが,一過性の変化であり,また,投与直前に流涎を示す動物も認められていることから,毒性学的意義は少なく,被験物質の刺激性によるものと考えられる.
体重に関しては,雄では投与開始からの増加量が,300 mg/kg投与群では投与15日以降36日まで,1000 mg/kg投与群では投与8日以降42日まで,それぞれ継続して有意に抑制された.一方,30 mg/kg投与群では投与開始から15日の増加量が有意な低値を示したが,一時的な変化であり,100 mg/kg投与群ではいずれの時期にも有意差は認められていないことから,30 mg/kg投与群で認められた変化は,偶発的なものと考えられる.雌では,投与期間を通じて明瞭な用量依存の関係は認められなかったが,1000 mg/kg投与群において,交配前,妊娠期の増加量が有意に抑制された.摂餌量については,雄では明らかな変化は認められなかったが,雌では,体重増加量にほぼ対応して低下傾向を示した.
解剖時検査において,雄では,肝臓の比体重値が1000 mg/kg投与群において有意に増加した.肝臓の組織所見では,300 mg/kg以上の投与群で小葉中心性の肝細胞肥大の発現頻度が有意に増加し,さらに,同所見がみられた雄では,肝細胞の曇りガラス様変性も認められた.一般に,曇りガラス様変性は,薬物代謝酵素が誘導された時に観察される変化であり,被験物質の投与により誘導された薬物代謝酵素に起因した変化と考えられる.また,腎臓の比体重値が300 mg/kg以上の投与群で有意に増加し,組織所見では,eosinophilic bodyの程度および頻度が100 mg/kg以上の投与群において有意に増加した.雌では,肝臓の比体重値が1000 mg/kg投与群において有意に増加し,組織所見では,小葉中心性の肝細胞肥大の発現頻度が300 mg/kg以上の投与群で有意に増加した.腎臓の比体重値が1000 mg/kg投与群で有意に増加し,組織所見では,近位尿細管に空胞変性が300 mg/kg以上の投与群で認められた.これらのほかに,雌の300 mg/kg以上の投与群において胸腺重量が低下傾向を示し,組織所見でも萎縮した例の程度および頻度が増加傾向を示した.1000 mg/kg投与群では,脾臓に褐色色素の沈着の程度の強い例が増加する傾向を示した.なお,1000 mg/kg投与群の雄において,限局性の精細管の萎縮が認められた例が有意に増加したが,程度に有意差は認められていないこと,この変化は自然発生的にしばしば認められる変化であることから,投与に起因した変化ではないと考えられる.
雄の血液生化学検査では,グルコース濃度の減少が300 mg/kg以上の投与群で認められた.300 mg/kg以上の投与群では,体重の増加抑制,肝障害が認められていることから,投与の影響を示唆する変化と考えられる.また,300 mg/kg以上の投与群ではアルブミン濃度が上昇(3.1 g/dL)したが,総蛋白濃度には変化は認められず,また,正常値の変動範囲内(過去6併合試験の対照群の平均値:2.8〜3.1 g/dL)にあることから,この変化は偶発的なものと考えられ,毒性学的意義は少ないと考えられる.雄の血液学検査では,各投与群において白血球数が減少(5700〜6400 /mm3)したが,百分比には変化は認められず,用量に依存した変化でもなく,さらに,正常値の変動範囲内(過去6併合試験の対照群の平均値:5700〜11600 /mm3)にあることから,偶発的変化と考えられる.
以上のことから,雄では,2,6-ジクロロトルエンの300 mg/kg以上の投与は,活動性低下などの中枢抑制作用を惹起し,体重増加および肝臓に影響を及ぼすものと考えられ,100 mg/kg以上の投与で腎臓に影響を及ぼすものと考えられる.一方,雌では,1000 mg/kgの投与で活動性低下などの中枢抑制作用を惹起し,また,体重増加および摂餌量に影響を及ぼし,さらに,300 mg/kg以上の投与で肝臓,腎臓および胸腺に影響を及ぼすものと考えられる.
2. 生殖発生毒性
交尾能力および受胎能力に被験物質投与の影響は認められなかった.300 mg/kg投与群の1匹,1000 mg/kg投与群の2匹の母動物に全産児が死亡した例が認められ,これに起因して,300 mg/kg以上の投与群では死亡児数が増加し,産児の生存性が低下した.なお,全産児が死亡した例のうち,分娩状態の直接観察ができなかった 1000 mg/kg投与群の1例は妊娠24日に分娩した.しかし,同群の他の動物は妊娠22〜23日に正常に分娩していることから,分娩遅延は,この動物の胎児が1匹(着床数:3)であることに起因した分娩刺激の減弱によるものと考えられる.
また,1000 mg/kg投与群では,哺育4日の体重に低下傾向が認められたが,産児の形態異常は,いずれの投与群においても観察されなかった.したがって,300 mg/kg以上の投与は,母動物の哺育状態の不良に起因して産児の生存性に影響を及ぼし,1000 mg/kgの投与では,催奇形性は認められないものの,産児の発育に軽度な影響を及ぼすものと考えられる.
3. 無影響量
以上の成績から,本試験条件下では,2,6-ジクロロトルエンの反復投与毒性に関する無影響量は,雄に対しては,100 mg/kg以上の投与群において腎臓に影響が認められたことから,30 mg/kg/day,雌に対しては,300 mg/kg以上の投与群で肝臓,腎臓および胸腺に影響が認められたことから,100 mg/kg/dayと推定される.一方,生殖発生毒性に関する無影響量は,雄に対しては,1000 mg/kgまでの投与で異常は認められなかったことから,1000 mg/kg/day,雌に対しては,300 mg/kg以上の投与群で哺育状態の不良により産児の生存性が低下したことから,100 mg/kg/day,産児に対しては,1000 mg/kg投与群において発育に影響が認められたことから,300 mg/kg/dayと考えられる.
文献
| 1) | E. Salewski, Naunyn-Schmiedebergs Arch. Exp. Pathol. Pharmakol., 247, 367(1964). |
| 2) | 西村秀雄,"胎児科学,"雄鶏社,東京,1976, pp. 115-117. |
| 3) | 丹後俊郎,"医学への統計学,"古川俊之監修,朝倉書店,東京,1985. |
| 4) | 佐久間昭,"薬効評価−計画と解析,"東大出版会,東京,1977. |
| 5) | C. W. Dunnett, Biometrics, 20, 482(1964). |
| 6) | H. Scheff Biometrika., 40, 87(1953). Biometrika., 40, 87(1953). |
| 7) | W. H. Kruskal and W. A. Wallis, J. Amer. Statist. Assoc., 47, 583(1952). |
| 8) | 田所作太郎,"トキシコロジー,"浦口健二編,地人書館,東京,1978, pp. 296-306. |
| 連絡先 |
| 試験責任者: | 長尾哲二 |
| 試験担当者: | 和田和義,佐藤昌子,関 剛幸,笠間菊子,加藤博康,丸茂秀樹,畔上二郎,三枝克彦,稲田浩子,中尾美津男,安生孝子 |
| (財)食品薬品安全センター |
| 〒257-8523 神奈川県秦野市落合729-5 |
| TEL 0463-82-4751 | FAX 0463-82-9627 | |
| Correspondence |
| Authors: | Tetsuji Nagao(Study director)
Kazuyoshi Wada, Masako Sato, Takayuki Seki, Kikuko Kasama, Hiroyasu Kato, Hideki Marumo, Jiro Azegami, Katsuhiko Saegusa, Hiroko Inada, Mitsuo Nakao, Takako Anjo |
| Hatano Research Institute, Food and Drug Safety Center in Reproductive Toxicology |
| 729-5, Ochiai, Hadano city, Kanagawa, 257-8523, Japan |
| TEL +81-463-82-4751 | FAX +81-463-82-9627 | |
 .DH法),クレアチニン濃度(Jaffe'法),アルカリフォスファターゼ活性(ALP; パラニトロフェニルリン酸基質法),GOTおよびGPT活性(SSCC法),総ビリルビン濃度(ビリルビン「ロシュ」キットSシリーズ),カルシウム濃度(OCPC法),無機リン濃度(Inorg. phos.; モリブデン酸直接法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法)を測定し,全自動電解質分析装置EA05(A&T)を用いてイオン電極法により,塩素,ナトリウムおよびカリウムの各濃度を測定した.また,A/G比は上記の測定結果に基づいて算出した.
.DH法),クレアチニン濃度(Jaffe'法),アルカリフォスファターゼ活性(ALP; パラニトロフェニルリン酸基質法),GOTおよびGPT活性(SSCC法),総ビリルビン濃度(ビリルビン「ロシュ」キットSシリーズ),カルシウム濃度(OCPC法),無機リン濃度(Inorg. phos.; モリブデン酸直接法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法)を測定し,全自動電解質分析装置EA05(A&T)を用いてイオン電極法により,塩素,ナトリウムおよびカリウムの各濃度を測定した.また,A/G比は上記の測定結果に基づいて算出した.
 法6)を用いて対照群と各投与群との平均値の差の検定を行った.有意水準は,Fisherの直接確率の片側検定は5 %とし,その他は,5 %および1 %とした.
法6)を用いて対照群と各投与群との平均値の差の検定を行った.有意水準は,Fisherの直接確率の片側検定は5 %とし,その他は,5 %および1 %とした.










