ペンタエリスリトールのラットを用いる
反復経口投与毒性・生殖発生毒性併合試験
Combined Repeat Dose and Reproductive/Developmental Toxicity Screening Test of Pentaerythritol by Oral Administration
要約
ペンタエリスリトール の100, 300および1000 mg/kg/dayを雄ラットの交配前および交配期間を含む46日間,雌ラットの交配前,交配及び妊娠期間,ならびに哺育3日までの期間に経口反復投与し,雌雄動物への反復投与による影響,雌雄動物の生殖および次世代の発生に及ぼす影響について試験した.
雌雄動物への反復投与により,軟便が300 mg/kg以上の群の雌雄で,下痢便が300 mg/kg以上の群の雄および1000 mg/kg群の雌で認められた.飲水量の増加傾向が1000 mg/kg群の雄で 認められた.その他に,ペンタエリスリトール投与による影響は認められなかった.従って,ペンタエリスリトール反復投与による無影響量 (NOEL) は雌雄ともに100 mg/kg/dayであることが示された.
雌雄動物の生殖および次世代の発生に対して,ペンタエリスリトール投与による影響は認められなかった.従って,ペンタエリスリトールの雌雄動物の生殖および次世代の発生に対する無影響量は1000 mg/kg/dayであることが示された.
材料および方法
1. 被験物質
ペンタエリスリトールは,一般に合成樹脂,塗料あるいは釉薬に用いられる物質であり,水溶性(水溶解度7.23 g/100 g)の白色顆粒である.本試験では三菱ガス化学(株)より提供されたロット番号50825(純度92.7%)のものを使用した. 被験物質は7カ月間安定であり,本ロットは試験期間中安定であることを確認した.投与には,被験物質を0.5%カルボキシメチルセルロースナトリウム溶液(日本薬局方CMC-Na, 丸石製薬(株);日本薬局方精製水,ヤクハン製薬(株))で用時あるいは5日に1回の頻度で懸濁調製したものを使用した.なお,ペンタエリスリトールの低・高濃度の調製液が5日間安定であることを確認した.
2. 試験動物および飼育条件
生後8週齢のCrj:CD (SD) 系のSPFラット雌雄を日本チャールス・リバー(株)より受け入れ,15日間馴化飼育した後,順調な発育を示し,かつ雌では性周期に異常の認められない動物を試験に用いた.
動物は,温度23±3℃,湿度55±10%,換気回数10〜15回/時,照明12時間/日に設定したバリアシステムの飼育室において,ブラケット式金属製金網床ケージに群分け前は3匹以内,群分け後は1匹,交配中は雌雄各1匹,妊娠期間中は1母動物,哺育期間中は1腹を収容した.ただし,妊娠17日以降は金属網床のかわりに実験動物用床敷(ホワイトフレーク,日本チャールス・リバー(株))を敷いたステンレス製受皿を使用した.飼料は固型飼料(CRF-1,オリエンタル酵母工業(株)),飲料水は水道水(札幌市水道水)をそれぞれ自由に摂取させた.飼料の混入物質および飲料水の水質を検査し,異常がないことを確認した.
3. 試験群の設定
試験群は,本試験の用量設定試験(14日間反復投与試験)の結果を参考に設定した.すなわち,ペンタエリスリトールの100, 300および1000 mg/kg/dayを設定した試験では,1000 mg/kg群で雌雄ともに軟便,下痢便が認められたが,100および300 mg/kg群で異常は認められなかった.これらのことから,本試験の高用量を1000 mg/kg/day,以下,公比約3で300および100 mg/kg/dayとし,さらに0.5%CMC Na溶液を投与する対照群を設け,計4群とした.動物数は1群当たり雌雄各12匹とした.群分けは投与開始前日に体重別層化無作為抽出法により行った.
4. 投与方法
投与は胃ゾンデを用いた強制経口投与とし,投与容量は体重1 kg当たり10 mlとして,投与日に最も近い日に測定した体重に基づいて算出した.雄には交配前14日間および交配期間を含む46日間,雌には交配前14日間および交尾成立までの交配期間,さらに交尾成立例は妊娠期間および哺育3日までの期間投与した.投与は10週齢から開始し,投与開始時の平均体重(体重範囲)は雄で398.6 g (369〜432 g),雌で232.1 g (207〜254 g) であった.
5. 観察,測定および検査項目
1) 一般状態観察,体重, 摂餌量および飲水量測定
一般状態を試験期間中1日1回以上の頻度で観察した. 体重は,投与1日(投与前),投与2, 5, 7, 10および14日,その後は雄については7日毎(投与終了日を含む)および剖検日に,雌については妊娠0, 1, 3, 5, 7, 10, 14, 17および20日,哺育0, 1および4日に測定した.また,雄は投与1から46日の,雌は投与1から14日,妊娠0から20日および哺育0から4日の体重増加量および体重増加率を算出した.摂餌量は,雄については交配期間および剖検日を,雌については妊娠0日および哺育0日を除き体重測定日と同じ日(投与終了日を含む)に測定した.飲水量は,雄についてのみ,摂餌量測定日と同じ日に測定した.なお,妊娠日数は交尾成立日を妊娠0日,哺育日数は分娩終了日を哺育0日として起算した.
2) 尿検査
投与期間の最終週(投与43〜44日)に雄の各群6例を代謝ケージに収容して非絶食下で 採尿を行った.約3時間の蓄尿についてpH,蛋白,糖,ケトン体,潜血反応(以上,試験紙マルティスティックス;マイルス・三共)および沈渣(鏡検)を検査し,21時間蓄尿 について尿量,比重(アタゴ製屈折計ユリコン),ナトリウム,カリウム(以上,炎光法:コーニング480型炎光光度計)およびクロール(電量滴定法:平沼CL-6M型クロライドカウンター)を測定した.
3) 剖検および器官重量測定
雄は投与46日の翌日にエーテル麻酔下で採血後放血致死させ,剖検した.雌は全哺育児死亡例は発見後直ちに,交尾成立例については哺育4日に,交尾不成立例については交配期間終了の翌日に,妊娠25日まで分娩の認められない例(不妊例)は妊娠26日にエーテル麻酔下で放血致死させ,剖検した.また,子宮の着床痕および卵巣の妊娠黄体を計数した.さらに,肝臓,腎臓,胸腺,副腎,精巣,精巣上体および卵巣の重量を測定し,器官体重重量比を算出した.
4) 血液学的検査
剖検時に雄の全例について約16時間絶食させた後,エーテル麻酔下で大腿静脈より採血し, EDTA・2Kで処理した血液を用いて赤血球数,平均赤血球容積,血小板数,白血球数,(以上,電気抵抗法),血色素量(シアンメトヘモグロビン法)(以上,コールターカウンターT660型),ヘマトクリット値(RBC,MCV値より算出),平均赤血球ヘモグロビン量(RBC,Hb値より算出),平均赤血球ヘモグロビン濃度(Ht,Hb値より算出),網状赤血球数(Brecher法)および白血球型別百分率(鏡検)を測定した.また,無処理血液を用いて,凝固時間(流体粘度変化による空気圧測定法:グライナー社製マイクロコアグロメーター)を測定した.さらに,腹部大動脈より採血しクエン酸ナトリウムで処理した後,3000 rpmで10分間遠心分離して得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,AMELUNG KC-10A バクスターKK)を測定した.
5) 血液生化学検査
剖検時に雄の全例について腹部大動脈より採血し,3000 rpmで10分間遠心分離して得られた血清を用いてGOT,GPT(以上,IFCC法),γ-GPT(包接L-γ-グルタミル-p-ニトロアニリド基質法),コリンエステラーゼ(ヨウ化ブチリルチオコリン基質法),血糖(ヘキソキナーゼ法),総コレステロール,リン脂質(以上,酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(ヤッフェ法),カルシウム(OCPC法),無機リン(フィスケ・サバロー法),総蛋白(ビウレット法),アルブミン(BCG法),クレアチンフォスフォキナーゼ(GSCC法)(以上,日立7150形自動分析装置),ナトリウム,カリウム(以上,炎光法:コーニング480型炎光光度計),クロール(電量滴定法:平沼 CL-6M型クロライドカウンター),A/G比(TP,Alb値より算出)および蛋白分画(セルロースアセテート膜電気泳動法)を測定した.
6) 病理組織学的検査
全例の肝臓,腎臓,脾臓,心臓,肺,脳(大脳・小脳),下垂体,胸腺,副腎,甲状腺,胃(前胃・腺胃),十二指腸,空腸,回腸,盲腸,結腸,直腸,精巣,精巣上体,前立腺, 卵巣について,全哺育児死亡例はさらに乳腺および子宮(頸部含む)について,常法に従いパラフィン切片を作製し,ヘマトキシリン・エオジン染色および特殊染色[oil red O染色,および鍍銀(渡辺変法)染色,エラスチカ・ワンギーソン染色]標本を作製し,病理組織学的検査を行った.
7) 生殖能検査
雌全例について,投与前10日から交尾成立までの連日に腟垢塗抹標本を作製し,性周期の異常の有無を検査した.投与14日の雌雄について,同試験群内で夕方より1対1で最長14日間同居させた.交尾成立は雌の腟垢中に精子が確認された場合とし,妊娠成立は雌の子宮に着床痕が確認された場合とした.また,交尾率[(交尾動物数/同居動物数)×100]および受胎率[(受胎動物数/交尾動物数)×100]を算出した.
8) 分娩および母性行動観察
交尾した雌全例について,分娩状態,母性行動,総出産児数,生児数および死亡児数,出産児の性別および外表を観察した.また,着床率[(着床痕数/妊娠黄体数)×100],出産率[(生児出産雌数/妊娠雌数)×100],分娩率[(総出産児数/着床痕数)×100],出生率[(出産生児数/総出産児数)×100],哺育4日時哺育率[(哺育児確認雌数/正常分娩雌数)×100],性比[雄生児数/雌生児数]および妊娠期間[分娩終了日までの妊娠日数]を算出した.
9) 新生児の生存性,一般状態観察,体重測定および剖検
分娩終了日から哺育4日まで1日1回,生死を確認し,新生児生存率[(哺育4日生児数/出産生児数)×100]を算出した.また,一般状態および外表について観察し,体重を哺育0, 1および4日に測定し,哺育0から4日の体重増加量および体重増加率を算出した.死亡例は発見後直ちに,その他の例については哺育4日に二酸化炭素吸入法により安楽致死させ,剖検した.
6. 統計処理
性周期,交尾率,受胎率,出産率および哺育率については,Fisherの正確確率検定法により対照群とペンタエリスリトール投与各群との比較を行った.その他の検査項目については,Bartlettの等分散検定の後,一元配置分散分析法あるいはKruskal-Wallis法により解析し,有意な場合,Dunnettの検定法あるいはMann-WhitneyのU-検定法により対照群とペンタエリスリトール投与各群との比較を行った.なお,分娩および母性行動観察結果,新生児の生存率および体重については1腹を単位として検定を行い,対照群との検定については危険率5%以下を統計学的に有意とした.
成績
1. 反復投与毒性
1) 一般状態
雄では,投与期間中に300 mg/kg群で軟便が4例に,下痢便が1例に,1000 mg/kg群で軟便および下痢便が全例に認められた.雌では,妊娠前投与期間に300 mg/kg群で軟便が2例に,1000 mg/kg群で軟便および下痢便が全例に認められた.妊娠期間では,1000 mg/kg群で軟便が全例に,下痢便が11例に認められた.哺育期間では,1000 mg/kg群で軟便が全例に,下痢便が9例に認められた.なお,軟便および下痢便は,雌雄ともに300 mg/kg群で散発的に,1000 mg/kg群で断続的に認められた.
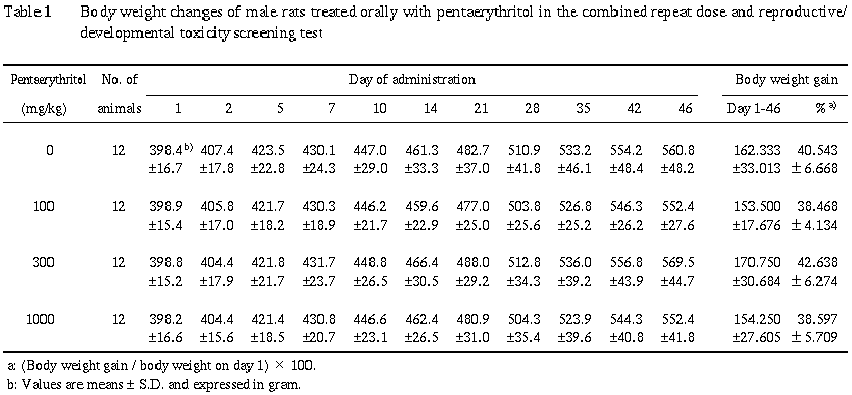
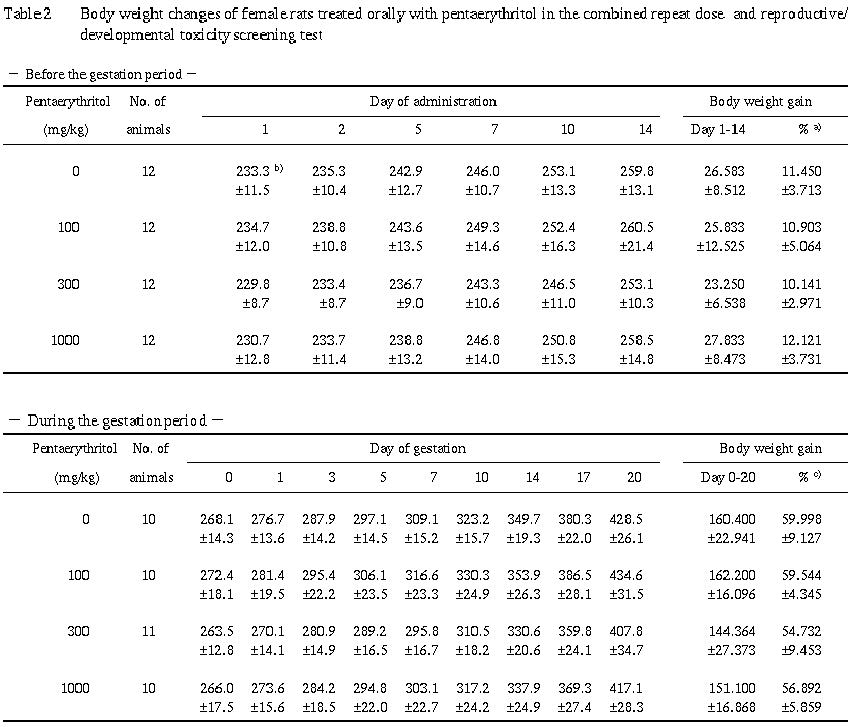
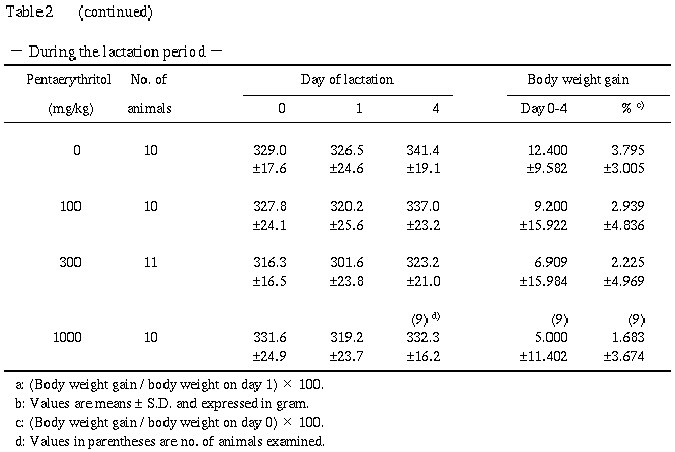
2) 体重 (Table 1, 2)
対照群と比較して有意な差は認められなかった.
3) 摂餌量
ペンタエリスリトール投与による異常は認められなかった.
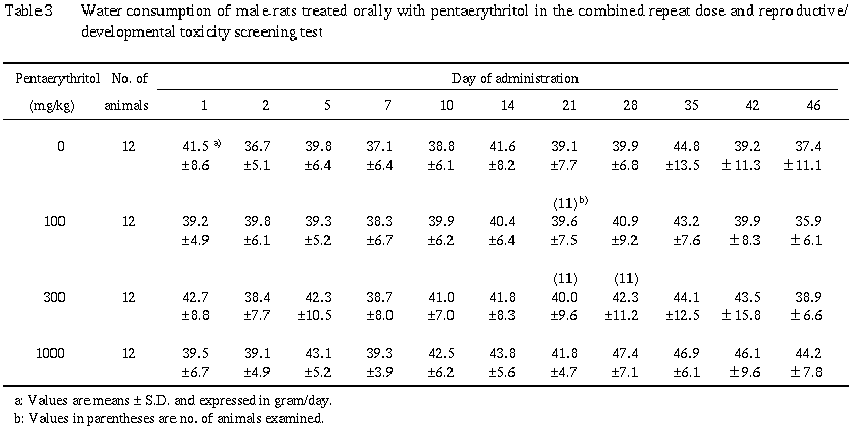
4) 飲水量 (Table 3)
雄の飲水量では,統計学的に有意な差はみられなかったものの,1000 mg/kg群で投与10日以降に増加傾向が認められた.
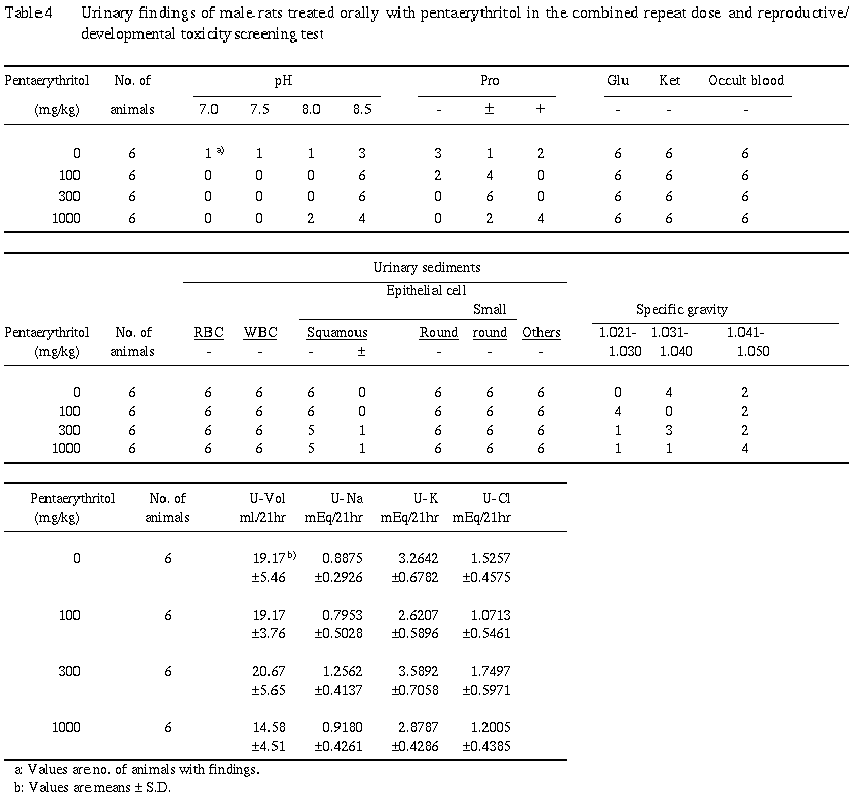
5) 尿検査 (Table 4)
対照群と比較して有意な差は認められなかった.
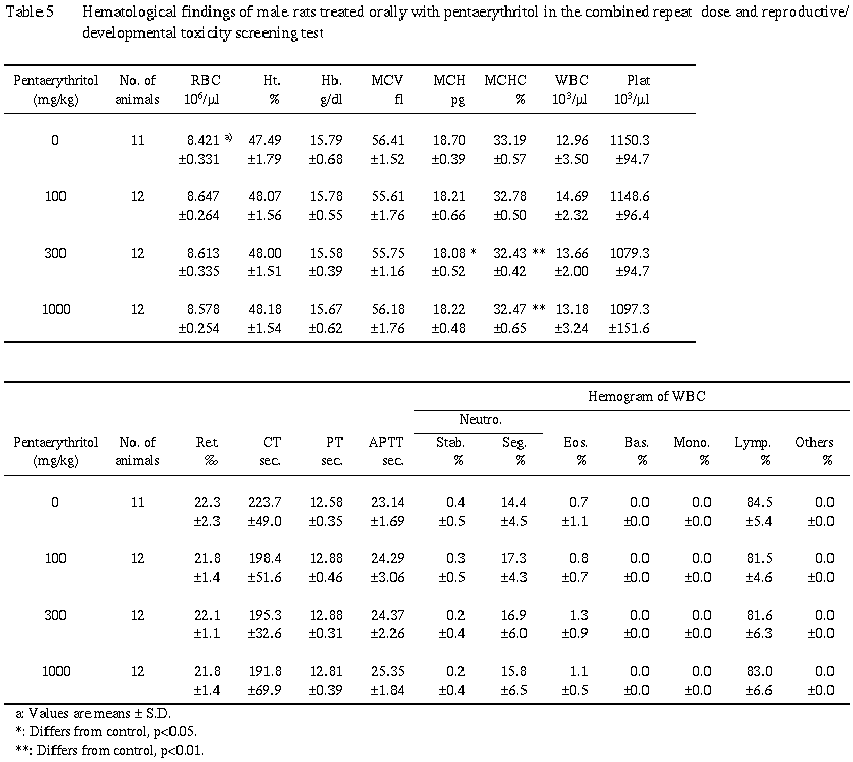
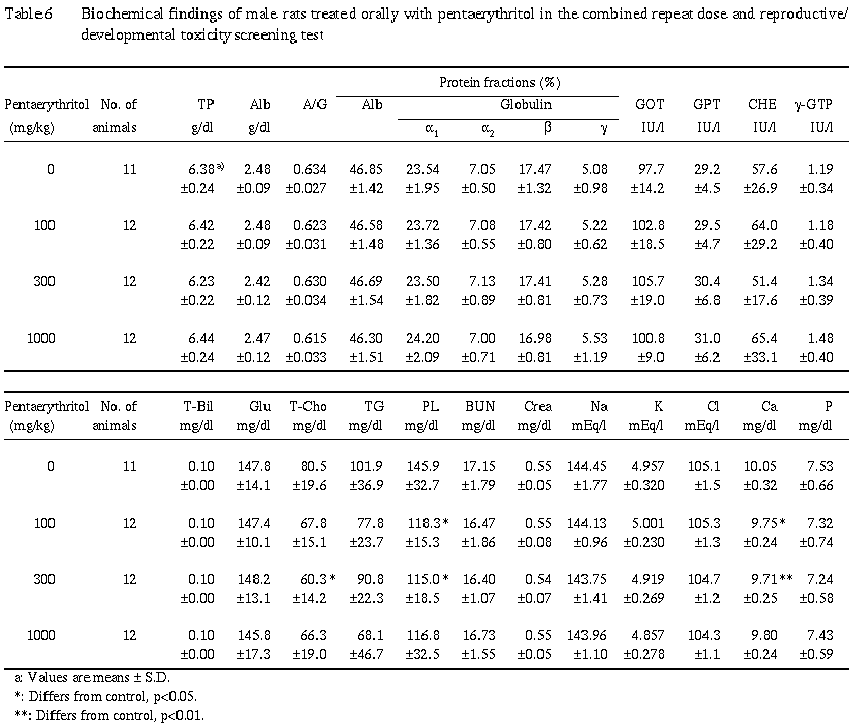
6) 血液学的検査 (Table 5) および血液生化学検査 (Table 6)
ペンタエリスリトール投与による異常は認められなかった.
7) 器官重量
対照群と比較して有意な差は認められなかった.
8) 剖検
ペンタエリスリトール投与による異常は認められなかった.
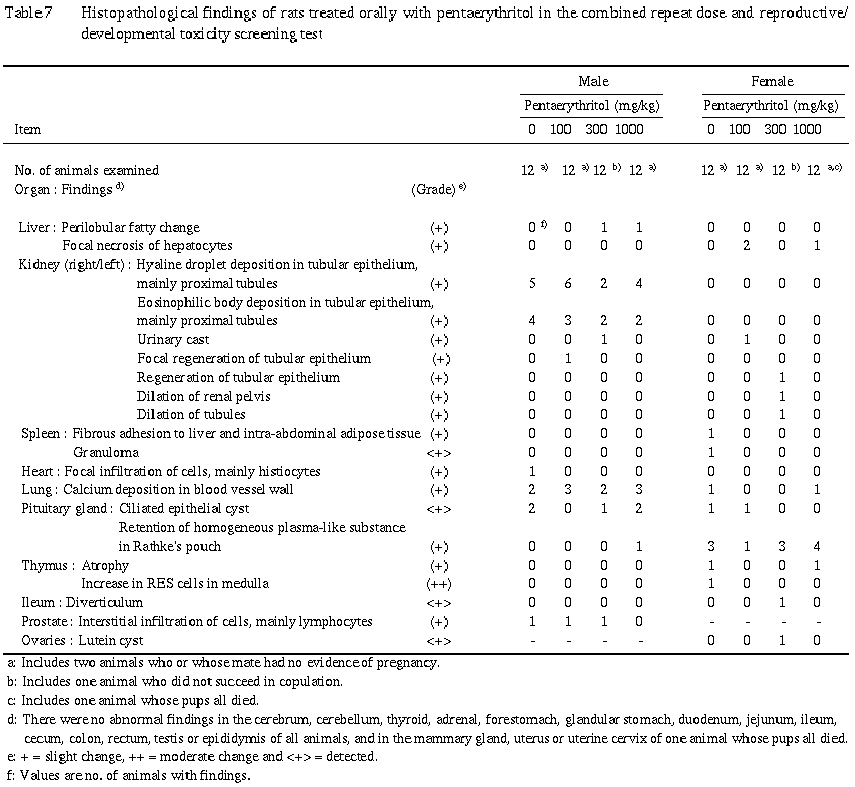
9) 病理組織学的検査 (Table 7)
ペンタエリスリトール投与による異常は認められなかった.また,交尾不成立例および不妊例においてもその原因を示唆する所見は認められなかった.
2. 生殖発生毒性 (Table 8)
1) 生殖能検査
ペンタエリスリトール投与による異常は認められなかった.なお,交尾不成立例は300 mg/kg群で1組,不妊例は対照群,100および1000 mg/kg群で各2組に認められた.
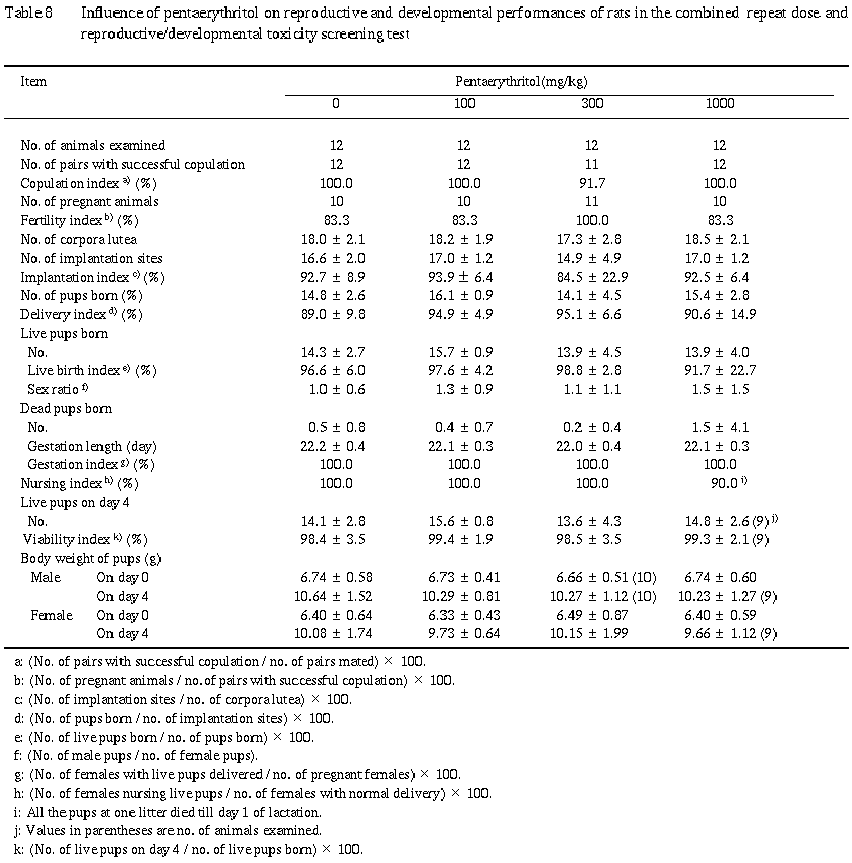
2) 分娩および母性行動観察
哺育異常として,哺育1日までに全哺育児を死亡させた例が1000 mg/kg群の1例に認められた.本例の出産児は18匹(生存5匹,死亡13匹)であり,いずれも喰殺を受け体の一部が欠損しているか,外傷が認められ,新生児は哺育1日に全例不明となった.母動物には, 分娩中,児舐めや巣作り行動が認められたが,分娩終了後は哺育行動は認められなかった. また,分娩中より児の捕喰が認められた.剖検では,子宮に胎盤が着床痕から遊離して認められた以外に異常はなく,病理組織学的検査でも乳腺を含め検査した器官・組織に異常は認められなかった.
分娩終了時の死亡児の剖検では,前述の哺育異常例の死亡児を含め,外傷以外に異常は認められなかった.
3) 新生児の生存性,一般状態,体重および剖検
ペンタエリスリトール投与による異常は認められなかった.
考察
軟便が300 mg/kg以上の群の雌雄で,下痢便が300 mg/kg以上の群の雄および1000 mg/kg群の雌で認められ,ペンタエリスリトール投与による影響と考えられた.これらの症状と関連するものとして飲水量の増加傾向が1000 mg/kg群の雄で認められたが,全身や生体の恒常性への影響を示唆する変化は認められなかった.その他に,体重推移,摂餌量,尿検査,血液学的検査,血液生化学検査,器官重量,剖検および病理組織学的検査ではペンタエリスリトール投与による影響は認められなかった.
以上より,300 mg/kg以上の群の雌雄で軟便あるいは下痢便が認められたことから,本スクリーニング試験におけるペンタエリスリトール反復投与による無影響量 (NOEL) は雌雄ともに100 mg/kg/dayであることが示された.
生殖能検査ではペンタエリスリトール投与による影響は認められず,生殖器の病理学的検査においてもペンタエリスリトール投与による影響は認められなかった.なお,交尾不成立例および不妊例の生殖器にその原因を示唆する病理組織学的所見は認められなかった. 全哺育児を死亡させた母動物が1000 mg/kg群の1例に認められた.本例では,哺育行動が認められず,出産児の喰殺などが認められることから,母動物側に起因した全哺育児の死亡と判断された.しかしながら,本例のような例は背景データで認められることや,本試験において他に哺育異常例は認められないことおよび新生児の生存性に影響は認められないことから,本例はペンタエリスリトール投与との関連はないと考えられた.新生児の観察では,ペンタエリスリトール投与による影響は認められなかった.
以上より,ペンタエリスリトールの生殖発生に対する影響は認められないことから,本スクリーニング試験におけるペンタエリスリトールの雌雄動物の生殖および次世代の発生に対する無影響量は1000 mg/kg/dayであることが示された.
| 連絡先 |
| 試験責任者: | 八幡昭子 |
| 試験担当者: | 山田高士,長谷淳一,小林裕幸 |
| 運営管理者: | 井本精一 |
| (株)化合物安全性研究所 |
| 〒004 北海道札幌市豊平区真栄363番24号 |
| Tel 011-885-5031 | Fax 011-885-5313 |
| |
| Correspondence |
| Authors : | Akiko Yahata (Study director)
Takashi Yamada, Jun-ichi Nagaya,Hiroyuki, Kobayashi,Seiichi Imoto (Management) |
| Safety Research Institute for Chemical Compounds Co., Ltd. |
| 363-24 Shin-ei, Toyohira-ku, Sapporo, Hokkaido, 004, Japan |
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | | |









