ウンデカンのラットを用いる
反復経口投与毒性・生殖発生毒性併合試験
Combined Repeat Dose and Reproductive / Developmental Toxicity
Screening Test of Undecane by Oral Administration
要約
ウンデカンの
100,300および1000 mg/kg/dayをCrj:CD(SD系)の雄ラットの交配前および交配期間を含む46日間,雌ラットの交配前,交配および妊娠期間,哺育3日までの期間に経口反復投与し,雌雄動物への反復投与による影響,雌雄動物の生殖および次世代の発生に及ぼす影響について試験を実施した.
雌雄動物への反復投与により,流涎が雌雄の
300 mg/kg以上の群で認められた.体重の増加抑制が雄の1000 mg/kg群で,体重の増加が雌の1000 mg/kg群の哺育期間に認められた.摂餌量の減少が雄の300および1000 mg/kg群で投与前期に,摂餌量の増加が雄の1000 mg/kg群で投与後期に,雌の1000 mg/kg群で妊娠後期および哺育期間に認められた.血液学および血液生化学検査では,ヘモグロビン量の減少,白血球数の増加,アルブミンの減少,α2-グロブリン,GPT,コリンエステラーゼおよび総コレステロールの増加が雄の1000 mg/kg群で認められた.器官重量では,肝臓の体重重量比の上昇,胸腺の重量の増加および体重重量比の上昇が雄の1000 mg/kg群で,肝臓の重量の増加および体重重量比の上昇が雌の1000 mg/kg群で認められた.以上より,雌雄の300 mg/kg以上の群に流涎が,雄の1000 mg/kg群で血液および肝臓に対する影響などが認められたことから,ウンデカンの反復投与による無影響量は雌雄ともに100 mg/kg/dayであることが示された.
雌雄動物の生殖および次世代の発生に対しては,
1000 mg/kg群で新生児の雌雄の体重増加率の低下が認められたことから,本試験におけるウンデカンの生殖発生に対する無影響量は300 mg/kg/dayであることが示された.
方法
1. 被験物質
ウンデカンは,水に不溶の無色透明液体であり,遮光気密容器に入れ,冷蔵で保存した.本試験では東京化成工業
(株)製造のロット番号FBQ041(純度99%以上)を使用した.被験物質は投与期間中安定であることが確認されている.
投与には,被験物質を,
2, 6および20 w/v%の濃度となるようにオリーブ油(日本薬局方,ヤクハン製薬(株))に用時に溶解したものを用いた.各濃度の調製液は規定の濃度であり,かつ均一であることが確認されている.
2. 試験動物および飼育条件
生後
8週齢のCrj:CD(SD系)のSPFラット雌雄を日本チャールス・リバー(株)より受け入れ,14日間の検疫・馴化飼育した後,順調な発育を示し,かつ雌では性周期に異常の認められない動物を試験に用いた.
動物は,温度
23±3℃,湿度55±10%,換気回数10〜15回/時,照明12時間/日に設定したバリアシステムの飼育室で,ブラケット式金属製金網床ケージに群分け前は2匹以内,群分け後は1匹,交配中は雌雄各1匹,妊娠期間中は1母動物,哺育期間中は1腹を収容して飼育した.ただし,妊娠17日以降は金属網床のかわりに実験動物用床敷(ホワイトフレーク,日本チャールス・リバー(株))を敷いたステンレス製受皿を使用した.飼料は固型飼料(CRF-1,オリエンタル酵母工業(株)),飲料水は水道水(札幌市水道水)をそれぞれ自由に摂取させた.
3. 試験群の設定
試験群は,本試験の用量設定試験
(14日間反復経口投与試験)の結果を参考に設定した.すなわち,250,500および1000 mg/kg/dayを設定した試験では,雄の1000 mg/kg群で体重増加量の減少傾向,雄の500あるいは1000 mg/kg群で肝臓重量の増加傾向がみられたが,250 mg/kg群で異常は認められなかった.これらのことから,本試験の高用量を1000 mg/kg/day,以下,公比約3で300および100 mg/kg/dayとし,さらに媒体であるオリーブ油を投与する対照群を設け,計4群とした.
動物数は
1群当たり雌雄各12匹とした.群分けは,馴化14日に体重別層化無作為抽出法を用いて行った.
4. 投与方法
投与は胃ゾンデを用いた強制経口投与とし,投与容量は体重
1 kg当たり5 mlとして投与日に最も近い日に測定した体重に基づいて算出した.雄には交配前14日間および交配期間を含む46日間,雌には交配前14日間および交尾成立までの交配期間,さらに交尾成立例は妊娠期間および哺育3日までの期間投与した.投与は10週齢から開始し,投与開始時の平均体重(体重範囲)は雄で400.3 g(374〜431 g),雌で226.5 g(192〜255 g)であった.
5. 観察,測定および検査項目
1) 一般状態観察,体重,摂餌量測定
一般状態を試験期間中
1日1回以上の頻度で観察した.体重は,投与1日(投与前),投与2,5,7,10および14日,その後は雄については7日毎(投与終了日を含む)および剖検日に,雌については妊娠0,1,3,5,7,10,14,17および20日,哺育0,1および4日に測定した.また,雄は投与1から46日の,雌は投与1から14日,妊娠0から20日および哺育0から4日の体重増加量および体重増加率を算出した.摂餌量は,雄については交配期間および剖検日を除き,雌については妊娠0日および哺育0日を除き体重測定日と同じ日(投与終了日を含む)に測定した.なお,妊娠日数は交尾成立日を妊娠0日,哺育日数は分娩終了日を哺育0日として起算した.
2) 尿検査
投与期間の最終週
(投与43〜44日)に雄の各群6例を代謝ケージに収容して非絶食下で採尿を行った.約3時間の蓄尿についてpH,蛋白,糖,ケトン体,ウロビリノーゲン,ビリルビン,潜血反応(以上,試験紙マルティスティックス;バイエル・三共)および沈渣(鏡検)を検査し,21時間蓄尿について尿量(容量),比重(アタゴ製屈折計ユリコン)を測定した.また,採尿中の飲水量(重量)を測定した.
3) 剖検および器官重量測定
雄は投与
46日の翌日にエーテル麻酔下で採血後放血致死させ,剖検した.雌は全哺育児死亡例は発見後直ちに,交尾成立例については哺育4日に,妊娠25日まで分娩の認められない例(不妊例)は妊娠26日にエーテル麻酔下で放血致死させ,剖検した.また,子宮の着床痕および卵巣の妊娠黄体を計数した.さらに,肝臓,腎臓,胸腺,副腎,精巣,精巣上体および卵巣の重量を測定し,器官体重重量比を算出した.
4) 血液学検査
剖検時に雄の全例について約
16時間絶食させた後,エーテル麻酔下で大腿静脈より採血し,EDTA・2Kで処理した血液を用いて赤血球数,平均赤血球容積,血小板数,白血球数,(以上,電気抵抗法),血色素量(シアンメトヘモグロビン法)(以上,コールターカウンターT660型),ヘマトクリット値(赤血球数,平均赤血球容積より算出),平均赤血球ヘモグロビン量(赤血球数,血色素量より算出),平均赤血球ヘモグロビン濃度(ヘマトクリット値,血色素量より算出),網状赤血球率(Brecher法)および白血球型別百分率(鏡検)を測定した.また,無処理血液を用いて,凝固時間(流体粘度変化による空気圧測定法:グライナー社製マイクロコアグロメーター)を測定した.さらに,腹部大動脈より採血しクエン酸ナトリウムで処理した後,3000 rpmで10分間遠心分離して得られた血漿を用いて,プロトロンビン時間(トロンボプラスチン法)および活性化部分トロンボプラスチン時間(エラジン酸法)(以上,AMELUNG KC-10A バクスターKK)を測定した.
5) 血液生化学検査
血液学検査に引き続いて,雄の全例について腹部大動脈より採血し,
3000 rpmで10分間遠心分離して得られた血清を用いてGOT,GPT(以上,IFCC法),γ-GPT(包接L-γ-グルタミル-p-ニトロアニリド基質法),コリンエステラーゼ(ヨウ化ブチリルチオコリン基質法),血糖(ヘキソキナーゼ法),総コレステロール,リン脂質(以上,酵素法),トリグリセリド(遊離グリセロール消去法),総ビリルビン(アゾビリルビン法),尿素窒素(ウレアーゼ・インドフェノール法),クレアチニン(ヤッフェ法),カルシウム(OCPC法),無機リン(フィスケ・サバロー法),総蛋白(ビウレット法),アルブミン(BCG法)(以上,日立7150形自動分析装置),ナトリウム,カリウム(以上,炎光法:コーニング480型炎光光度計),クロール(電量滴定法:平沼CL-6M型クロライドカウンター),A/G比(総蛋白,アルブミンより算出)および蛋白分画(セルロースアセテート膜電気泳動法)を測定した.
6) 病理組織学検査
全例の肝臓,腎臓,脾臓,心臓,肺,脳
(大脳・小脳),下垂体,胸腺,副腎,甲状腺,胃(前胃・腺胃),十二指腸,空腸,回腸,盲腸,結腸,直腸,精巣,精巣上体,前立腺,卵巣および異常所見部位について,常法に従いパラフィン切片を作製し,ヘマトキシリン・エオジン染色および特殊染色(oil red O染色あるいはルクソール・ファスト青-ボディアン重染色)標本を作製し,病理組織学検査を行った.
7) 生殖能検査
雌全例について,投与前
10日から交尾成立までの連日に腟垢塗抹標本を作製し,性周期の異常の有無を検査した.投与14日の雌雄について,同試験群内で夕方より1対1で最長14日間同居させた.交尾成立は雌の腟垢中に精子が確認された場合とし,妊娠成立は雌の子宮に着床痕が確認された場合とした.また,交尾率 [(交尾動物数/同居動物数)×100] および受胎率 [(受胎動物数/交尾動物数)×100] を算出した.
8) 分娩および母性行動観察
交尾した雌全例について,分娩状態,母性行動,総出産児数,生児数および死亡児数,出産児の性別および外表を観察した.また,着床率
[(着床痕数/妊娠黄体数)×100],出産率 [(生児出産雌数/妊娠雌数)×100],分娩率 [(総出産児数/着床痕数)×100],出生率 [(出産生児数/総出産児数)×100],哺育4日時哺育率 [(哺育児確認雌数/正常分娩雌数)×100],性比 [雄生児数/雌生児数] および妊娠期間 [分娩終了日までの妊娠日数] を算出した.
9) 新生児の生存性,一般状態観察,体重測定および剖検
分娩終了日から哺育
4日まで1日1回,生死を確認し,新生児の4日の生存率 [(哺育4日生児数/出産生児数)×100] を算出した.また,一般状態および外表について観察し,体重を哺育0,1および4日に測定し,哺育0から4日の体重増加量および体重増加率を算出した.死亡例は発見後直ちに,その他の例については哺育4日に二酸化炭素吸入法により安楽致死させ,剖検した.
6. 統計処理
性周期,交尾率,受胎率,出産率および哺育率については,
Fisherの正確確率検定法により対照群とウンデカン投与各群との比較を行った.その他の検査項目は,Bartlettの等分散検定の後,一元配置分散分析法あるいはKruskal-Wallis法により解析し,有意な場合,Dunnettの検定法あるいはMann-WhitneyのU-検定法により対照群とウンデカン投与各群との比較を行った.ただし,尿検査の定性的項目についてはKruskal-Wallis法およびMann-WhitneyのU-検定法を用いて解析した.なお,分娩および母性行動観察結果,4日の新生児の生存率および体重については1腹を単位として検定を行い,対照群との検定については危険率5%以下を統計学的に有意とした.
結果
1. 反復投与毒性
1) 死亡あるいは切迫屠殺
投与過誤によると判断された死亡あるいは切迫屠殺が,対照群の雄
1例(投与11日の投与前に死亡発見)および1000 mg/kg群の雄1例(投与21日(交尾成立後)の投与後に屠殺)に認められた.
2) 一般状態
雄では,流涎が
300 mg/kg群の1例で投与16日以降に投与後最長約3時間半,1000 mg/kg群の8例で投与15日以降に投与後最長約5時間半,断続的に認められた.
雌では,妊娠前投与期間に,流涎が
1000 mg/kg群の3例で投与15日以降の投与後に最長約3時間,交尾成立までの間に認められた.軟便が1000 mg/kg群の1例で投与1日に認められたが,ウンデカンの単回経口投与毒性試験のオリーブ油投与群に下痢が認められていることから,本試験で観察された軟便はウンデカンの媒体として用いたオリーブ油投与により生じた症状と考えられた.妊娠期間では,流涎が300 mg/kg群の1例で妊娠8日の投与後10分から56分に,1000 mg/kg群の8例で投与後に最長約6時間半,妊娠期間のほぼ全期間にわたり認められた.哺育期間では,流涎が1000 mg/kg群の2例で哺育2日に投与直後から投与後14あるいは15分に認められた.また,分娩異常例が300 mg/kg群で2例に,全哺育児死亡例が300および1000 mg/kg群の各1例に認められた.
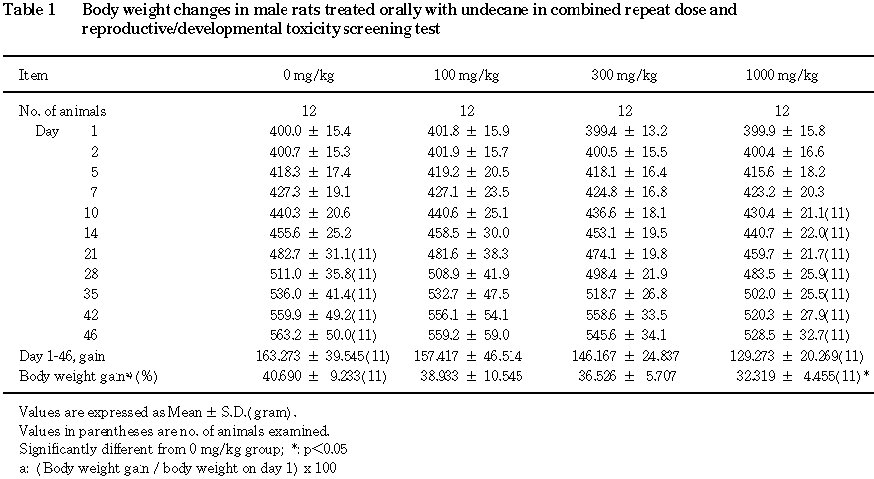
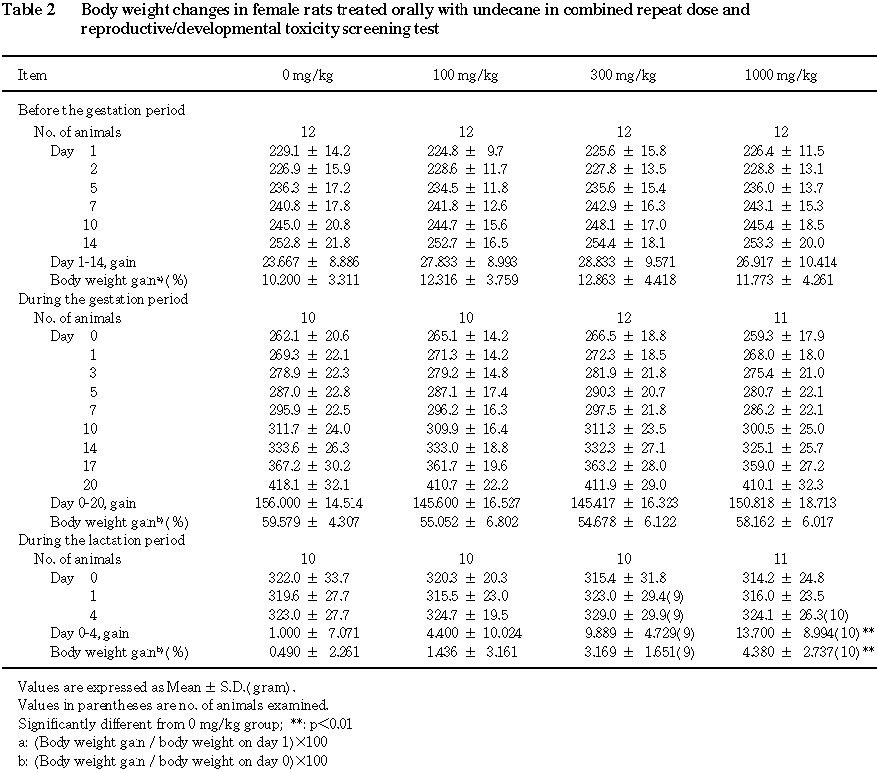
3) 体重(Table 1, 2)
雄では,投与期間中の体重増加抑制の傾向が
1000 mg/kg群で認められ,投与期間を通しての体重増加率は有意に減少した.
雌では,哺育期間の体重増加量の増加および増加率の上昇が
1000 mg/kg群で認められた.
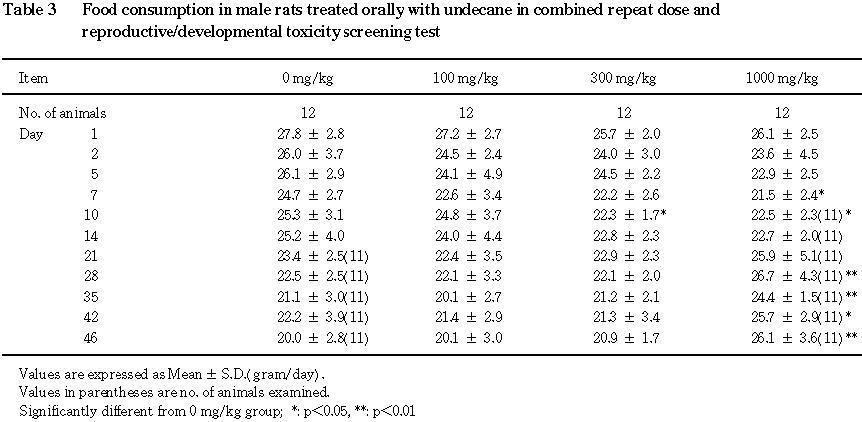
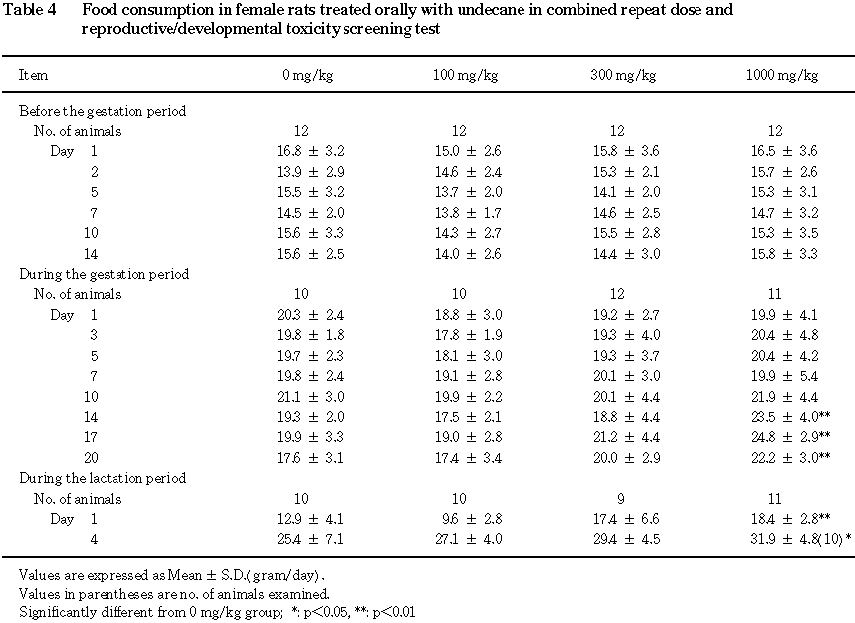
4) 摂餌量(Table 3, 4)
雄では,摂餌量の減少が
300 mg/kg群で投与10日に,1000 mg/kg群で投与7および10日に認められ,増加が1000 mg/kg群で投与28〜46日に認められた.
雌では,摂餌量の増加が
1000 mg/kg群で妊娠14〜20日,哺育1および4日に認められた.
5) 尿検査
対照群と比較して,雄のウンデカン投与各群で有意差は認められなかった.
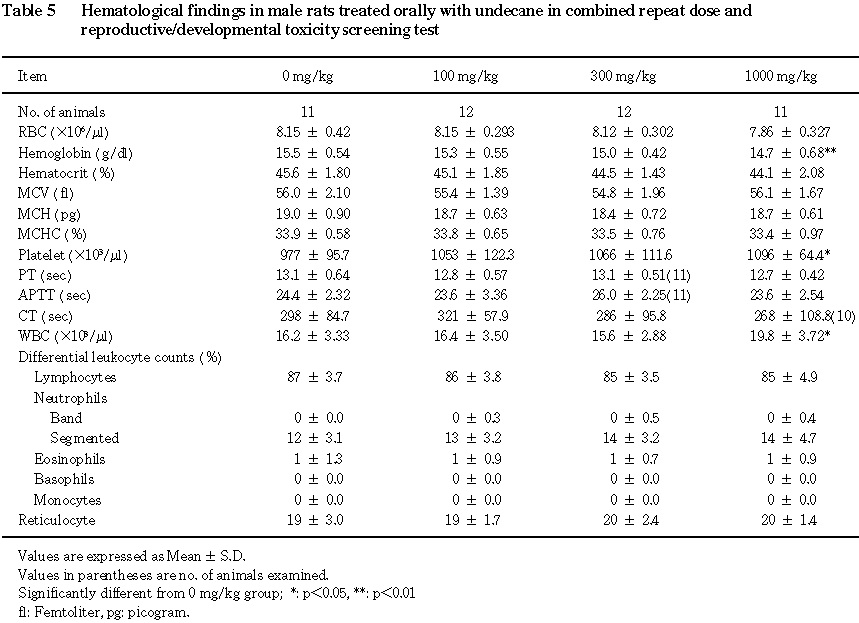
6) 血液学検査(Table 5)
ヘモグロビン量の減少および白血球数の増加が雄の
1000 mg/kg群で認められた.その他,雄の1000 mg/kg群では血小板数の増加がみられた.
7) 血液生化学検査(Table 6)
アルブミンの減少,α
2-グロブリン分画の上昇,GPT,コリンエステラーゼおよび総コレステロールの増加が雄の1000 mg/kg群で認められた.その他,雄の1000 mg/kg群では血糖の減少がみられた.

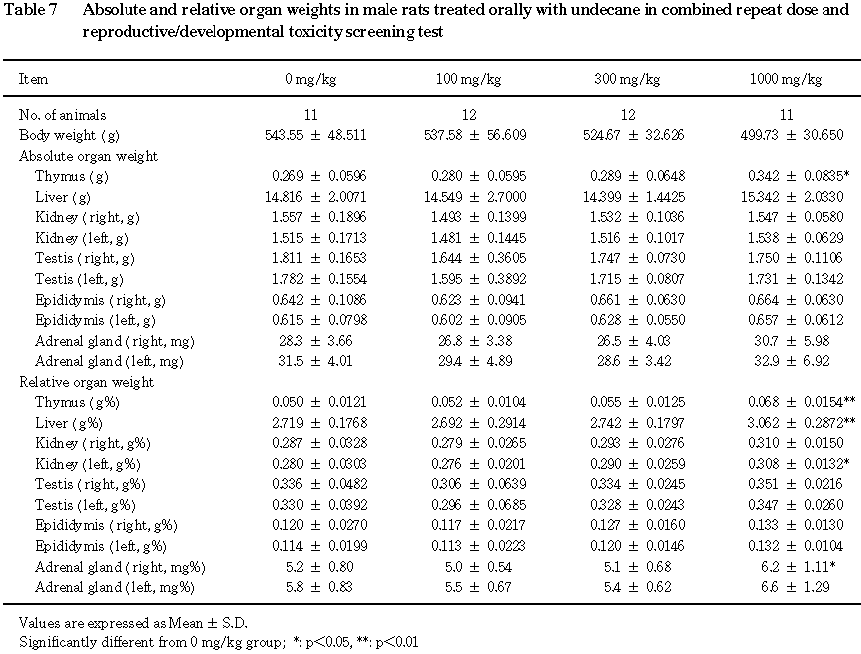
8) 器官重量(Table 7,8)
雄では,肝臓の体重重量比の上昇,胸腺の重量の増加および体重重量比の上昇が
1000 mg/kg群で認められた.その他に,1000 mg/kg群では腎臓および副腎の体重重量比の上昇が認められた.
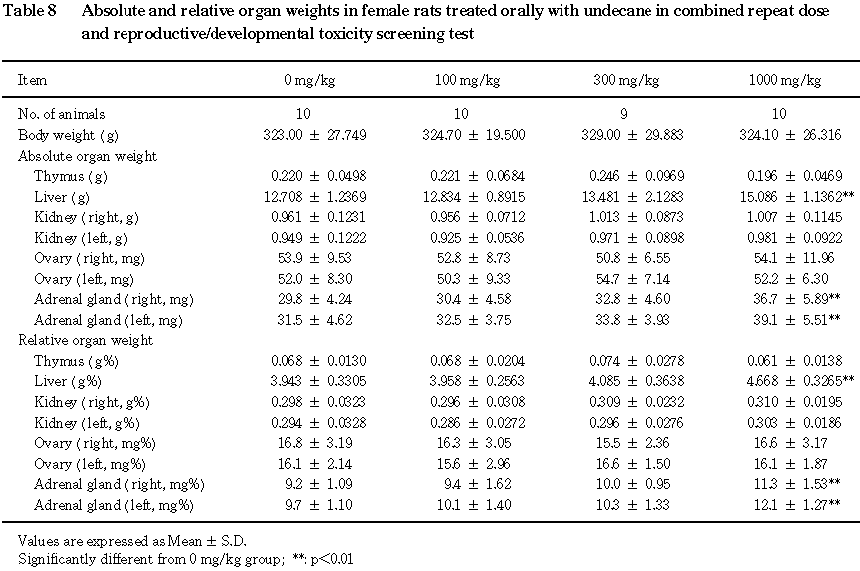
雌では,肝臓および副腎の重量の増加および体重重量比の上昇が
1000 mg/kg群で認められた.
9) 剖検
雄では,ウンデカン投与による異常は認められなかった.
雌では,
300 mg/kg群の分娩異常例2例には異常は認められなかった.全哺育児死亡例では,300 mg/kg群の1例に肝臓全葉の褪色,脾臓の褪色,胸腺の萎縮,子宮内腔の血液貯留および子宮内胎盤残存が,1000 mg/kg群の1例に大脳右半球の皮質一部欠損が認められた.その他,下垂体の嚢胞,腺胃粘膜の一部隆起が1000 mg/kg群で1例に認められた.
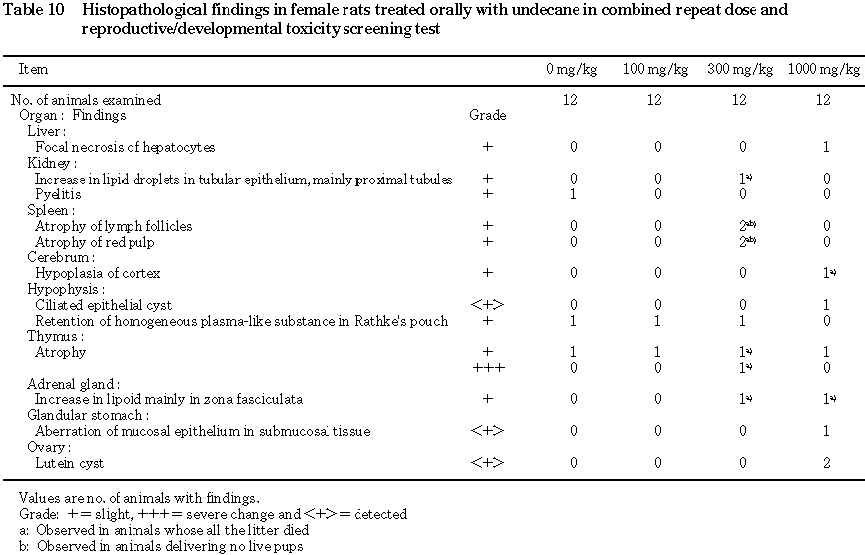
10) 病理組織学検査(Table 9,10)
雄では,肝臓の胆管増生,腎臓の近位尿細管を主とする尿細管上皮の硝子滴あるいは好酸体の沈着,下垂体の頭蓋咽頭管遺残が
1000 mg/kg群に認められた.相手雌が不妊であった100 mg/kg群の2例および1000 mg/kg群の1例において,その原因を示唆する所見は認められなかった.その他,ウンデカン投与による異常は認められなかった.
雌では,肝臓の限局性肝細胞壊死,下垂体の線毛上皮嚢胞,腺胃の粘膜下織における粘膜組織の迷入,卵巣の黄体嚢胞が全哺育児死亡例を除く
1000 mg/kg群の例に散見された.100 mg/kg群の2例および1000 mg/kg群の1例の不妊例において,その原因を示唆する所見は認められなかった.300 mg/kg群の分娩異常例のうち,1例では脾臓のリンパ濾胞の萎縮,赤脾髄の萎縮および胸腺の萎縮が認められたが,他の1例には異常は認められなかった.
300 mg/kg群の全哺育児死亡例では,脾臓のリンパ濾胞の萎縮,赤脾髄の萎縮,胸腺の萎縮,腎臓の近位を主とする尿細管上皮の脂肪滴増加および副腎の束状帯を主とするリポイドの増加が認められた.1000 mg/kg群の全哺育児死亡例では,大脳皮質の形成不全,副腎に束状帯を主とするリポイドの増加が認められた.その他,ウンデカン投与による異常は認められなかった.


2. 生殖発生毒性(Table 11)
1) 生殖能検査
雌の性周期検査では,全例に異常は認められず,対照群と比較して交尾までの日数,交尾率および受胎率に有意差は認められなかった.なお,不妊例は対照群および
100 mg/kg群で各2組,1000 mg/kg群で1組に認められたのみであった.
2) 分娩および母性行動観察
分娩異常として,分娩終了時に生児のみられない例が
300 mg/kg群の2例に認められた.これらの例の着床率および分娩率は,1例で60.0%および25.0%,もう1例で85.0%および41.2%であり,いずれも出産児数は少なかった.哺育異常として,全哺育児死亡例が300 mg/kg群の1例および1000 mg/kg群の1例に認められた.300 mg/kg群の例では,分娩終了時に16匹の出産児が認められたが,そのうち14匹(うち喰殺9匹)が死亡しており,他の2匹も分娩終了後喰殺を受け死亡し,全哺育児の死亡が確認された.1000 mg/kg群の例では,分娩終了時に15匹(生児14匹,死亡児1匹)の出産児が認められたが,哺育1日に3匹が不明,1匹が喰殺を受け死亡し,哺育2日には5匹が不明となり,全哺育児の死亡が確認された.また、出産生児数の減少,出生率の低下傾向,出産死亡児数の増加傾向が300 mg/kg群で認められた.その他,対照群と比較して妊娠黄体数,着床痕数,着床率,総出産児数,分娩率,出生率,性比,妊娠期間,出産率および哺育4日時哺育率に有意差は認められなかった.
分娩終了時にみられた死亡児および全哺育児死亡例の死亡児には,外傷が散見された他に異常は認められなかった.
3) 新生児の生存性,一般状態,体重および剖検
対照群と比較して,死亡あるいは不明例が
300および1000 mg/kg群で多くみられ,新生児の4日の生存率の低下傾向が300および1000 mg/kg群で認められた.
新生児の体重増加率の低下が
1000 mg/kg群の雌雄で認められた.
死亡児の剖検では,腎盂拡張が
1000 mg/kg群の雌雄各1例で認められた.哺育4日に屠殺した例では,腎臓の低形成および腎盂の拡張が1000 mg/kg群の雌各1例に,脳室の拡張が1000 mg/kg群の雄1例に認められた.
考察
1. 反復投与毒性
一般状態観察では,流涎が
300および1000 mg/kg群の雌雄で認められ,その発現状況からウンデカン投与による影響と考えられた.ただし,300 mg/kg群では雌雄各1例の出現であった.
雄では,投与期間中の体重増加抑制傾向および体重増加率の低下が
1000 mg/kg群で認められ,ウンデカン投与による影響と考えられた.また,投与前期には,摂餌量の減少が300および1000 mg/kg群で認められ,1000 mg/kg群については体重増加抑制の原因と考えられた.1000 mg/kg群では投与後期に摂餌量の増加が認められたが,本試験のデータからはその機序を明らかにすることはできなかった.一方,雌では,哺育期間の体重増加量の増加および増加率の上昇,妊娠後期および哺育期間に摂餌量の増加が1000 mg/kg群で認められた.この機序についても,1000 mg/kg群の雄でみられた上述の摂餌量変化と同様,明らかにすることはできなかった.
血液に及ぼす影響として,ヘモグロビン量の減少が
1000 mg/kg群で認められた.同群では,統計学的な有意差はみられないものの,赤血球数およびヘマトクリット値の減少傾向もみられていることから貧血状態にあったものと考えられる.しかし,網状赤血球率および脾臓の病理組織学検査においても異常は認められないことから,その貧血状態は軽度なものであると考えられた.また,白血球数の増加が1000 mg/kg群に認められ,胸腺の重量の増加および体重重量比の上昇も併せて認められたが,他に関連した項目に異常はみられないことから,ウンデカン投与との関連性は不明であった.その他,1000 mg/kg群では血小板数の増加がみられたが,背景データの範囲内の変動であり,ウンデカン投与との関連はないものと考えられた.
肝臓に対する影響として,アルブミンの減少,α
2-グロブリン分画の上昇,GPT,コリンエステラーゼおよび総コレステロールの増加が1000 mg/kg群の雄で,肝臓の重量の増加あるいは体重重量比の上昇が1000 mg/kg群の雌雄で認められた.これらの所見は,肝臓の病理学検査では異常は認められなかったものの,ウンデカン投与による肝機能への影響を示唆するものと考えられた.その他,1000 mg/kg群の雄では血糖の減少がみられたが,背景データの範囲内の変動であり,ウンデカン投与との関連はないものと考えられた.
器官重量では,他に
1000 mg/kg群では腎臓および副腎の体重重量比の上昇がみられたが,いずれも片側性であり,体重増加抑制傾向に起因した変動と考えられることから,ウンデカン投与との直接的な関連はないものと考えられた.
病理組織学検査では,
1000 mg/kg群において肝臓,腎臓,下垂体,腺胃および卵巣に種々の所見が認められたが,そのほとんどが自然発生するものであり,出現頻度も考慮すると,いずれもウンデカン投与との関連はないと考えられた.
以上より,
300 mg/kg以上の群の雌雄で流涎が,1000 mg/kg群で血液および肝臓に対する影響などが認められたことから,ウンデカンの反復投与による無影響量は雌雄ともに100 mg/kg/dayであることが示された.
2. 生殖発生毒性
生殖能検査では雌の性周期,雌雄の交尾および受胎に対して
ウンデカン投与による影響は認められなかった.また,生殖器(精巣,精巣上体および卵巣)の重量,剖検および病理組織学検査においてもウンデカン投与による影響は認められなかった.なお,不妊例の生殖器についてもその原因を示唆する病理組織学所見は認められなかった.
分娩異常として分娩終了時に生児のみられない例が
300 mg/kg群で2例に,哺育異常として全哺育児死亡例が300 mg/kg群の1例および1000 mg/kg群の1例に認められた.しかし,本試験と同様な異常例は被験物質投与と関係なく,偶発的に出現することが背景データでも確認されており,本試験でみられた例はいずれもウンデカン投与との関連はないものと考えられた.
新生児の観察では,出産生児数の減少,出生率の低下傾向,出産死亡児数の増加傾向および新生児の
4日の生存率の低下傾向が300あるいは1000 mg/kg群で認められたが,これは同群でみられた分娩異常あるいは全哺育児死亡によるものであり,ウンデカン投与との関連はないと考えられた.なお,ウンデカン投与各群の各腹当りの死亡あるいは不明児の出現例数は,分娩異常例あるいは全哺育児死亡例の死亡および不明児を除くと対照群と比較して明らかな差はなかった.1000 mg/kg群の雌雄で体重増加率の低下が認められたが,一般状態観察および剖検においてはウンデカン投与による影響は認められなかった.なお,哺育4日剖検例では,腎臓および脳に所見が認められたが,死亡例も含め,いずれもその出現頻度から,ウンデカン投与との関連はないと考えられた.
以上より,
1000 mg/kg群の雌雄の新生児で体重増加率の低値が認められたことから,本試験におけるウンデカンの生殖発生に対する無影響量は300 mg/kg/dayであることが示された.
| 連絡先 |
| 試験責任者: | 吉村浩幸 |
| 試験担当者: | 茂野 均,長谷淳一,古川正敏 |
| 運営管理者 | 小林茂吉 |
| (株)化合物安全性研究所 |
| 〒004 北海道札幌市豊平区真栄363番24号 |
| Tel 011-885-5031 | Fax 011-885-5313 | |
| Correspondence |
| Authors: | Hiroyuki Yoshimura(Study director)
Hitoshi Shigeno, Jun-ichi Nagaya, Masatoshi Furukawa,
Shigeyoshi Kobayashi(Management) |
| Safety Research Institute for Chemical Compounds Co., Ltd. |
| 363-24 Shin-ei, Toyohira-ku, Sapporo, Hokkaido, 004, Japan |
| Tel +81-11-885-5031 | Fax +81-11-885-5313 | |











