1,2-ビス(2-クロロエトキシ)エタンのチャイニーズ・ハムスター培養細胞を用いる
染色体異常試験
In Vitro Chromosomal Aberration Test of 1,2-Bis(2-chloroethoxy)ethane
in Cultured Chinese Hamster Cells
要約
1,2-ビス(2-クロロエトキシ)エタンの培養細胞に及ぼす細胞遺伝学的影響について,チャイニーズ・ハムスター培養細胞(CHL/IU)を用いて染色体異常試験を実施した.
S9 mix非存在下での短時間処理(6時間処理後18時間の回復時間)では,1.9 mg/mL(10 mmol/L)においても細胞増殖抑制は認められなかった.S9 mix存在下での短時間処理では,50 %増殖抑制濃度は0.060 mg/mLとなった.また,連続処理(24時間処理)した場合,50 %増殖抑制濃度は1.8 mg/mLとなった.
したがって,染色体異常試験では,S9 mix非存在下で短時間処理では,1.9 mg/mL(10 mM)を最高処理濃度とし,公比2で4濃度を設定した.また,S9 mix存在下で短時間処理では,0.12 mg/mLを最高処理濃度とし,公比2で5濃度を設定した.
細胞増殖率および分裂指数より,S9 mix非存在下では,0.48,0.95,1.9 mg/mLについて,S9 mix存在下で短時間処理した場合は0.015,0.030,0.060 mg/mLについて染色体分析を行った.
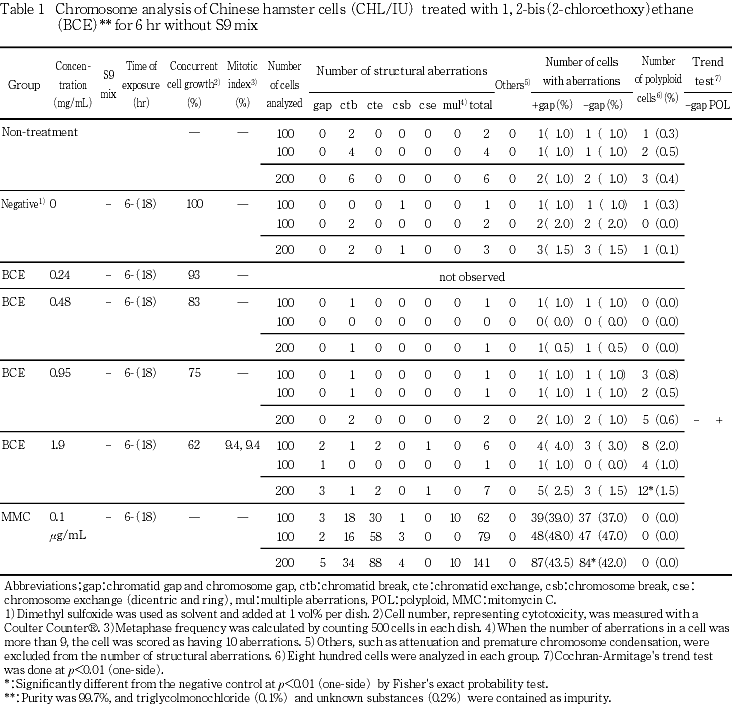
染色体分析の結果,S9 mix非存在下で短時間処理した場合,いずれの処理群においても,染色体の構造異常の誘発は認められなかった.倍数性細胞については,1.9 mg/mL(高濃度群)で,有意な増加が認められたが,その出現率(1.5 %)が低いことから,生物学的には陰性であると判断した.S9 mix存在下で短時間処理した場合には,0.060 mg/mL(高濃度群)で観察した細胞の81.5 %に染色体の構造異常が誘発され,陽性の結果が得られた.倍数性細胞について,誘発は認められなかった.
以上の結果より,本試験条件下で1,2-ビス(2-クロロエトキシ)エタンは,染色体異常を誘発する(陽性)と結論した.
方法
1.細胞
CHL/IU 細胞はチャイニーズ・ハムスター,肺由来で,リサーチ・リソースバンク(JCRB)から入手(1988年2月,入手時:継代4代,現在21および23代)した.試験には,解凍後継代10代以内で試験に用いた.仔牛血清(CS,Cansera International)を10 vol%添加したイーグルMEM(日水製薬)培養液を用い,CO2インキュベーター(37℃ ,5 % CO2)内で培養した.
2.S9 mix
S9(キッコーマン)は,フェノバルビタールと5,6-ベンゾフラボンを投与した雄Sprague-Dawley系ラットの肝臓から調製したものを購入した.S9 mixは処理培地に10 vol%添加し,各成分の最終濃度はS9 5 vol%,グルコース6リン酸(Sigma Chemical)0.83 mmol/L,β-ニコチンアミドアデニンジヌクレオチドリン酸(オリエンタル酵母工業)0.67 mmol/L,MgCl2 0.83 mmol/L,KCl 5.5 mmol/L,HEPES 緩衝液(pH 7.2)0.67 mmol/Lとした.
3.被験物質
1,2-ビス(2-クロロエトキシ)エタン(ロット番号:BB16,丸善ケミカル(東京))は,純度99.7 %(不純物としてトリグリコールモノクロライド0.1 %)の無色透明液体であり,冷暗所で保管した.本物質は水に対しては19 mg/mL未満の溶解性を示し,DMSOには502 mg/mL以上の溶解性を示した.
4.被験物質の調製
被験物質は用時調製して試験に用いた.溶媒はジメチルスルホキシド(DMSO,ロット番号:210G1441およびDWL9370,関東化学工業,和光純薬工業)を用いて原液を調製した.ついで原液を溶媒で順次希釈して所定の濃度の被験物質調製液を作製した.被験物質調製液は,すべての試験において培養液の1 vol%になるように加えた.なお,被験物質を溶媒に溶解させた際,発熱,発泡,変色などの変化はなかった.
5.培養条件
2×104個のCHL/IU細胞を,培養液5 mLを入れたガラスディッシュ(径6 cm)に播き,CO2インキュベーター内で3日間培養した.その後,連続処理では,新鮮培地と交換後,被験物質を加え,24時間処理した.また,短時間処理では,血清入りの培地によりS9 mix非存在下および存在下で6時間処理し,処理終了後新鮮な培養液でさらに18時間培養した.
6.細胞増殖抑制試験
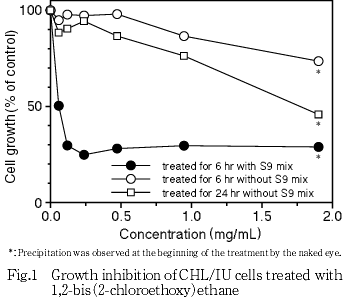
染色体異常試験に用いる被験物質の処理濃度を決定するため,被験物質の細胞増殖に及ぼす影響を調べた.最高濃度(1.9 mg/mL)では,処理時に沈殿が認められたが,処理終了時にはいずれの濃度においても沈殿は認められなかった.培養終了後,細胞を10 vol%ホルマリン水溶液で固定し,0.1 w/v%クリスタルバイオレット水溶液で染色した.被験物質のCHL/IU細胞に対する増殖抑制作用は,コールターカウンター(Model D,Coulter Electronics)を用いて各群の増殖度を計測し,被験物質処理群の溶媒対照群に対する細胞増殖の比をもって指標とした.
その結果, S9 mix非存在下で短時間処理した場合,1.9 mg/mL(10 mmol/L)においても細胞増殖抑制は認められなかった.S9 mix存在下での短時間処理では,50 %増殖抑制濃度は0.060 mg/mLとなった.また,連続処理における50 %増殖抑制濃度は1.8 mg/mLとなった(Fig. 1).
7.実験群の設定
細胞増殖抑制試験の結果より,染色体異常試験で用いる被験物質の高濃度群は,S9 mix 非存在下における短時間処理では,1.9 mg/mL(10 mmol/L)を最高濃度とし,公比2で4濃度設定した(0.24〜1.9 mg/mL).S9 mix 存在下における短時間処理では,0.12 mg/mL を最高濃度とし,公比2で計5濃度を設定し(0.0075〜0.12 mg/mL),試験を行った.なお,最初に実施した染色体異常試験の標本は,陰性対照群を含む全群で分裂指数が低く,染色体分析には不適当であったため,同じ濃度設定で再試験を実施した.
また,陽性対照物質として用いたマイトマイシンC(MMC,協和醗酵工業)およびシクロホスファミド(CP,Sigma Chemical)は,日局注射用水(大塚製薬工場)に溶解して調製した.それぞれ染色体異常を誘発することが知られている濃度を適用した.
染色体異常試験において,溶媒対照群と処理群では1濃度あたり2枚のディッシュを用いた.このうちの2枚は染色体標本を作製し,それぞれの一部を用いてコールターカウンターにより細胞増殖率を測定した.無処理対照群および陽性対照群については細胞増殖率測定は行わなかった.
8.染色体標本作製法
培養終了の2時間前に,コルセミドを最終濃度が約0.1 μg/mLになるように培養液に加えた.染色体標本の作製は常法に従って行った.スライド標本は各ディッシュにつき6枚作製した.作製した標本は3 vol%ギムザ溶液で染色した.
9.染色体分析
細胞増殖率と分裂指数を細胞毒性の指標として,20 %以上の相対増殖率で,かつ2ディッシュともに0.5 %以上の分裂指数を示した最も高い濃度を観察対象の最高濃度群とし,観察対象の3濃度群を決定した.その結果(Table 1,2),観察可能な最高濃度は,S9 mix 非存在下における短時間処理では1.9 mg/mL,S9 mix 存在下における短時間処理では0.060 mg/mLであったことから,この濃度を高濃度群として3濃度群を観察対象とした.
作製したスライド標本のうち,1つのディッシュから得られた異なるスライドを,4名の観察者がそれぞれ処理条件が分からないようにコード化した状態で分析した.染色体の分析は,日本環境変異原学会・哺乳動物試験研究会(MMS)1)による分類法に基づいて行い,染色体型あるいは染色分体型のギャップ,切断,交換などの構造異常の有無と倍数性細胞(polyploid)の有無について観察した.また構造異常については1群200個,倍数性細胞については1群800個の分裂中期細胞を分析した.

10.判定
染色体異常を有する細胞の出現頻度について,溶媒対照群と被験物質処理群および陽性対照群間でフィッシャーの直接確率法2)により,有意差検定を実施した(p<0.01).また,用量依存性に関してコクラン・アーミテッジの傾向性検定3)(p<0.01)を行った.これらの検定結果を参考とし,生物学的な観点からの判断を加味して染色体異常誘発性の評価を行った.
結果および考察
1, 2-ビス(2-クロロエトキシ)エタンを加えてS9 mix非存在下で短時間処理した場合,いずれの処理群においても染色体の構造異常の誘発は認められなかった(Table 1).倍数性細胞については,1.9 mg/mL(高濃度群)で 有意な増加が認められたが,その出現率は1.5 %と低いことから生物学的には陰性であると判断した(Table 1).一方,S9 mix存在下で短時間処理した場合には,0.060 mg/mL(高濃度群)において,観察した細胞の81.5 %に染色体の構造異常が誘発され,陽性の結果が得られた(Table 2).倍数性細胞については,いずれの処理群においても有意な増加は認められなかった(Table 2).
以上のように,陽性の結果が得られたことから,D20値4)を求めたところ0.020 mg/mLとなった.
陽性対照物質として用いたMMCは,S9 mix非存在下で短時間処理および24時間連続処理した場合において染色体の構造異常を誘発し(Table 1),CPはS9 mix存在下で短時間処理した場合において染色体の構造異常を誘発した(Table 2).これらの陽性対照物質の結果より,本実験系の成立が確認された.
なお,被験物質は,細菌を用いる復帰突然変異試験で陽性の結果が得られている5).
以上の結果より,1,2-ビス(2-クロロエトキシ)エタンは,本試験条件下でCHL/IU細胞に染色体異常を誘発すると結論した.
文献
| 1) | 日本環境変異原学会・哺乳動物試験分科会(編):「化学物質による染色体異常アトラス」朝倉書店,東京(1988)pp. 16-37. |
| 2) | 吉村 功(編):「毒性・薬効データの統計解析,事例研究によるアプローチ」サイエンティスト,東京,(1987)pp. 76-78. |
| 3) | 吉村 功,大橋靖夫(編):「毒性試験講座14,毒性試験データの統計解析」地人書館,東京(1992)pp. 218-223. |
| 4) | 石館 基(監修)「<改定> 染色体異常試験データ集」エル・アイ・シー,東京(1987)p. 23. |
| 5) | 原 巧ら:1,2-ビス(2-クロロエトキシ)エタンの細菌を用いる復帰変異試験.化学物質毒性試験報告,11:407-411(2004). |
| 連絡先 |
| 試験責任者: | 田中憲穂 |
| 試験担当者: | 山影康次,高橋俊孝,若栗 忍,
中川ゆづき,橋本恵子,三枝克彦,
加藤初美 |
| (財)食品薬品安全センター秦野研究所 |
| 〒257-8523 神奈川県秦野市落合729-5 |
| Tel 0463-82-4751 | Fax 0463-82-9627 | |
| Correspondence |
| Authors: | Noriho Tanaka(Study director)
Kohji Yamakage,
Toshitaka Takahashi,
Shinobu Wakuri, Yuzuki Nakagawa,
Keiko Hashimoto, Katsuhiko Saegusa,
Hatsumi Kato |
| Hatano Research Institute, Food and Drug Safety Center |
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan |
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |



