3,3'-チオビス(プロパン酸)のチャイニーズ・ハムスター培養細胞を用いる
染色体異常試験
In Vitro Chromosomal Aberration Test of 3,3'-Thiobispropanoic acid
in Cultured Chinese Hamster Cells
要約
3,3'-チオビス(プロパン酸)の染色体異常誘発能の有無を検討するために,チャイニーズハムスター培養細胞(CHL/IU細胞)を用いて染色体異常試験を実施した.
細胞増殖抑制試験を行った結果,短時間処理法及び連続処理法とも50 %細胞増殖抑制濃度は1780 μg/mL(10 mM相当)以上であった.このことから染色体異常試験における3,3'-チオビス(プロパン酸)の濃度は短時間処理法及び連続処理法ともに公比2で111〜1780 μg/mLの濃度範囲に設定した.短時間処理法では代謝活性化及び非代謝活性化について3,3'-チオビス(プロパン酸)を6時間処理した18時間後,連続処理法では3,3'-チオビス(プロパン酸)を24時間及び48時間連続処理後,それぞれ染色体標本を作製して検鏡し,染色体異常誘発性を検討した.
試験の結果,短時間処理法及び連続処理法のいずれの処理方法によっても,染色体の構造異常及び倍数性細胞の誘発は認められなかった.
以上の結果から,3,3'-チオビス(プロパン酸)は本試験条件下において染色体異常誘発能を有さない(陰性)と結論した.
材料及び方法
1.使用細胞株
ヒューマンサイエンス研究資源バンクから入手(2001年12月26日)したチャイニーズハムスターの肺由来線維芽細胞株(CHL/IU細胞)を用いた.なお,試験には細胞増殖抑制試験で4継代目,染色体異常試験で11及び21継代目の細胞を使用した.
2.培養液の調製
培養には,非働化(56℃,30分)した仔牛血清(Invitrogen Corporation)を10 vol%添加したEagle's MEM(Life Technologies)を用いた.調製後の培養液の保存は冷蔵とした.
3.培養条件
細胞は,炭酸ガス培養装置を用い,CO2濃度5 %,温度37℃の高湿度条件下で培養した.継代培養は3〜4日ごとに行った.試験に際しては2×104個の細胞を,培養液5 mLを入れた直径6 cmのプラスチックプレートに播種し,3日目に被験物質を処理した.
4.S9 mix
フェノバルビタール及び5,6-ベンゾフラボンを7週齢のSprague Dawley系雄ラットに腹腔内投与した肝臓から調製されたS9並びに補酵素をオリエンタル酵母工業から購入し,S9 mixを調製した.S9 mixの組成は松岡らの方法1)に従いS9の培地への添加量を5 vol%とした.
5.被験物質
3,3'-チオビス(プロパン酸)(ロット番号:EJ-068,MRCユニテック,青森)は,純度99.5 wt%(不純物:SO4根 0.02 wt%,水 0.04 wt%を含む),分子量 178.21,融点123〜134℃の白色結晶粉末で,密閉容器で冷暗所に保存した.
6.被験液の調製
溶媒は,dimethyl sulfoxide(試薬特級,和光純薬工業)を用いた.被験物質を溶媒で希釈して原液(178 mg/mL)を調製し,ついで順次溶媒で希釈して各濃度の被験液を調製した.被験液は,培養液の1 vol%になるように添加した.
7.細胞増殖抑制試験(予備試験)
染色体異常試験における被験物質の処理濃度を設定するため,被験物質の細胞増殖に及ぼす影響を調べた.被験物質の細胞増殖抑制作用は,単層培養細胞密度計(モノセレータ,オリンパス光学工業)を用いて細胞密度を測定し,被験物質処理群の陰性(媒体)対照群に対する細胞密度の比をもって指標とした.
その結果,S9 mixの有無にかかわらず短時間処理法及び連続処理法とも50 %細胞増殖抑制濃度は1780 μg/mL(10 mM相当)以上であった(Fig. 1, 2).
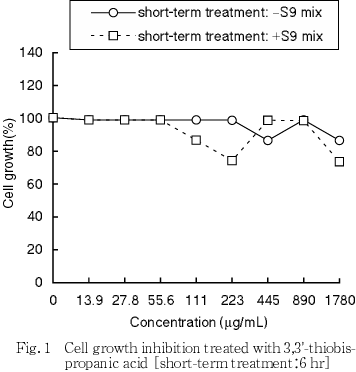
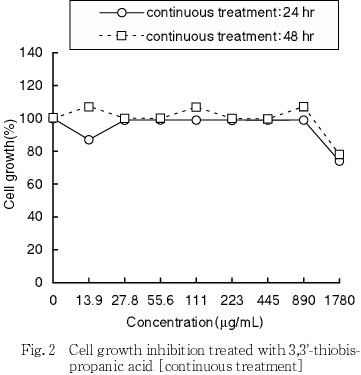
8.実験群の設定
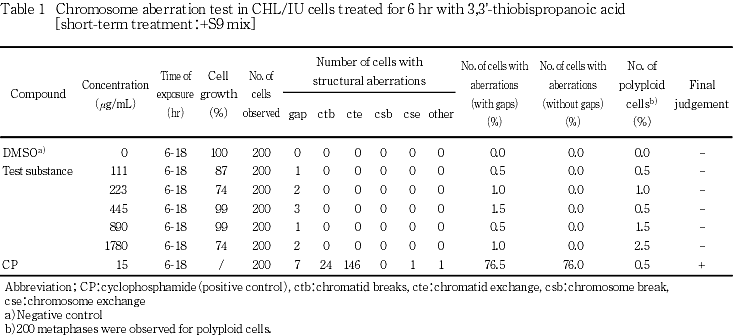
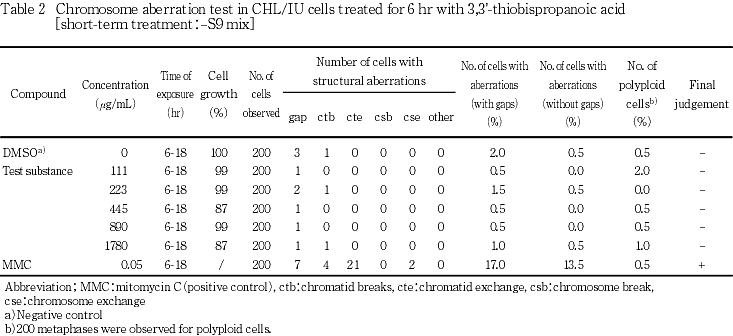
細胞増殖抑制試験で得られた50 %細胞増殖抑制濃度をもとに,染色体異常試験では短時間処理法及び連続処理法のいずれにおいても1780 μg/mL(10 mM相当)を最高濃度とし,以下公比2で希釈した計5濃度並びに陰性(媒体)対照群を設定した.なお,陽性対照として+S9 mix処理ではシクロフォスファミド(CP,和光純薬工業,15 μg/mL),-S9 mix処理ではマイトマイシンC(MMC,協和醗酵工業,0.05 μg/mL)を用いた.
濃度当たり4枚のプレートに処理し,2枚を染色体標本作製用,2枚を細胞増殖率測定用とした.
9.染色体標本の作製
培養終了の2時間前に,最終濃度が0.2 μg/mLとなるようコルセミドを加えた.以下,染色体標本は空気乾燥法によって作製した.スライド標本は各プレートにつき2枚作製し,2 vol%ギムザ液で15分間染色した.
10.染色体の観察
各用量当たり200個(プレート当たり100個)の分裂中期像についてギャップ(g),染色分体型切断(ctb),染色分体型交換(cte),染色体型切断(csb),染色体型交換(cse)及びその他の異常など構造異常の種類並びに異常を持つ細胞の数を記録した.同時に倍数性細胞の数も記録した.
客観的な観察を行うため,スライド標本をコード化した状態で分析した.
11.結果の判定
染色体構造異常を有する細胞の出現率は,ギャップを含む場合と含まない場合について集計し,ギャップを含まない場合で判定した.
判定は石館らの基準2)に従い,染色体異常を有する細胞の出現頻度が5 %未満を陰性(-),5 %以上10 %未満を疑陽性(±),10 %以上を陽性(+)とした.最終的には異常細胞の出現に用量依存性又は再現性が認められた場合を陽性と判定した.
結果及び考察
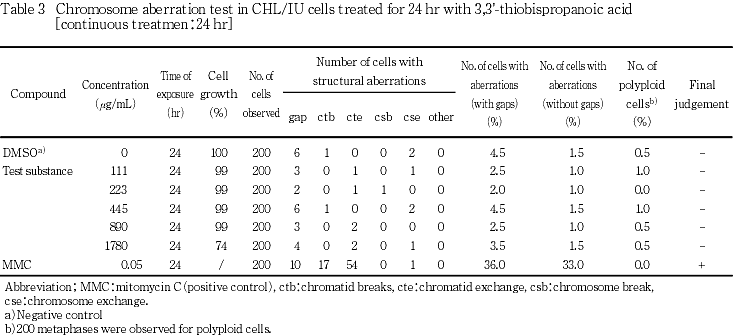
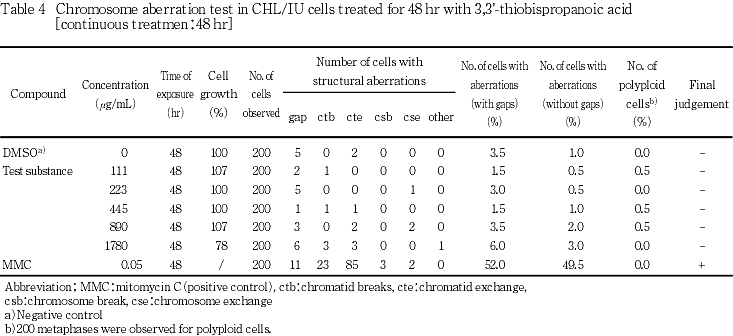
短時間処理法の結果をTable 1及び2に,連続処理法の結果をTable 3及び4に示した.いずれの処理方法においても,被験物質処理群に5 %を越える染色体の構造異常を有する細胞の出現頻度に用量依存的な増加は認められなかった.また,倍数性細胞の出現頻度にも増加は認められなかった.一方,陽性対照物質を処理した群においては顕著な染色体の構造異常を有する細胞の出現頻度の増加が認められた.
なお,本被験物質と類似の化学構造を持つ脂肪族ジカルボン酸では,citric acid, fumaric acid, L-glutamic acid, DL-malic acid, oxalic acid, succinic acid, D-tartaric acidは細菌を用いる復帰突然変異試験及びほ乳類培養細胞を用いる染色体異常試験で陰性との報告3, 4)が,またα-ketoglutaric acid, L-aspartic acid は,ほ乳類培養細胞を用いる染色体異常試験で陰性との報告3)がある.
以上の結果から,3,3'-チオビス(プロパン酸)は本試験条件下において染色体異常誘発能を有さない(陰性)と判定した.
文献
| 1) | Matsuoka A et al.:Chromosomal aberration tests on 29 chemicals combined with S9 mix in vitro. Mutat Res, 66:277-290(1979). |
| 2) | 石館 基(監修):「<改訂>染色体異常試験データ集」エル・アイ・シー,東京(1987) pp.19-24. |
| 3) | 祖父尼俊雄(監修):「染色体異常試験データ集」1998年版,林 真,松岡厚子(編),エル・アイ・シー,東京(1998). |
| 4) | 石館 基(監修):「微生物を用いる変異原性試験データ集」初版,能美健彦,松井道子(編),エル・アイ・シー,東京(1991). |
| 連絡先 |
| 試験責任者: | 園 明 |
| 試験担当者: | 西村 進,大久保寿美,
樋川奈穂美,勝亦倶慶,望月 肇 |
| (株)ボゾリサーチセンター |
| 〒412-0039 静岡県御殿場市かまど1284 |
| Tel & Fax 0550-82-9922 |
| Correspondence |
| Authors: | Akira Sono(Study Director)
Susumu Nishimura, Sumi Okubo,
Naomi Hikawa,
Tomoyoshi Katsumata,
Hajime Mochizuki |
| Bozo Research Center Inc. |
| 1284 Kamado, Gotemba-shi, Shizuoka, 412-0039, Japan |
| Tel & Fax +81-550-82-9922 |






