9-cis-オクタデセン酸(2,3-ジヒドロキシプロピル)エステルは,主に食品添加物「グリセリン脂肪酸エステル」として香料に用いられている.本物質の毒性に関して,WHO(世界保健機関)における食品添加物の安全性評価文章 1)では,グリセリン脂肪酸エステル類は腸でグリセリンと脂肪酸に完全に加水分解されること,その脂肪酸は食品中の脂質を構成する成分であり,グリセリンについては短期および長期の反復投与毒性試験,変異原性試験,生殖毒性試験などにより安全性が確認されていることから,香料としての微量摂取であれば問題はないと考えられているが,9-cis-オクタデセン酸(2,3-ジヒドロキシプロピル)エステルそのもの毒性に関する資料は認められない.
今回,9-cis-オクタデセン酸(2,3-ジヒドロキシプロピル)エステルの安全性を確認するため,SD系ラットに,0(溶媒),100,300および1000 mg/kg用量で,交配開始14日前から,雄は42日間,雌は分娩後哺育4日まで経口投与した.動物数は,1群雌雄各12匹の投与期間終了後屠殺の4群とした.さらに,雄については,12匹から5匹を選別して対照および250 mg/kg用量の14日間の回復群とし,雌については1群雌雄各5匹の対照および1000 mg/kg用量のサテライト群を設けて,回復群とした.
一般状態の観察,詳細な臨床観察,感覚反射機能検査,着地開脚幅,握力,自発運動量,体重,摂餌量,尿検査(雄のみ),血液学検査,血液生化学検査,剖検,器官重量および病理組織学検査で,被験物質の投与に起因する変化は認められなかった.従って,ラットへの反復経口投与における無毒性量(NOAEL)は,雌雄とも1000 mg/kg/day以上と結論された.
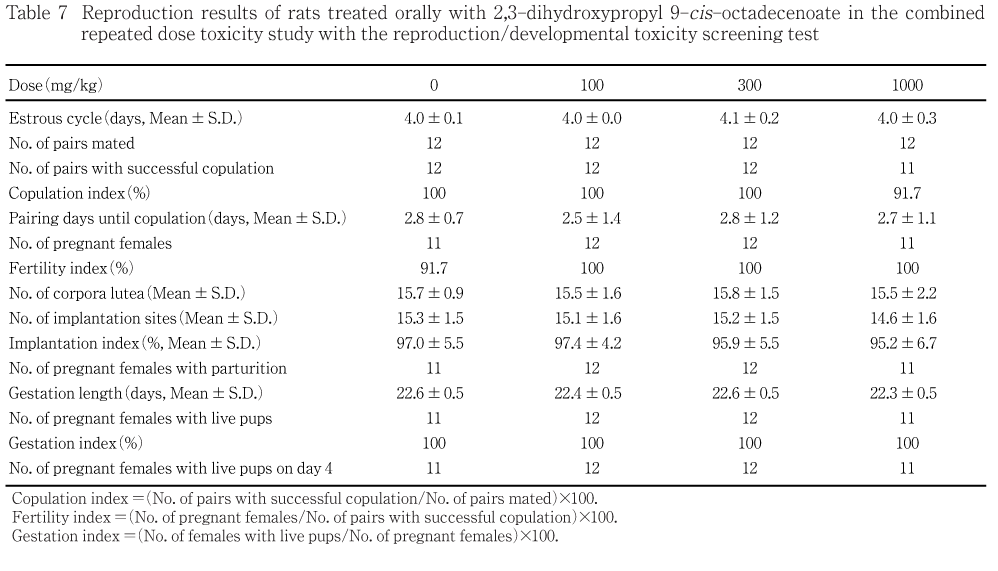
親動物の性周期(雌),交尾成立期間,交尾率,受胎率,妊娠期間,黄体数,着床率,出産率,分娩率,分娩および哺育状態に変化は認められなかった.児動物に対しても,総出産児数,新生児数,性比,出生率,体重,形態および哺育4日生存率に,被験物質の投与に起因する変化は認められなかった.従って,雌雄親動物の生殖能および児動物の発生に対する無毒性量は,いずれも1000 mg/kg/dayと結論された.
9-cis-オクタデセン酸(2,3-ジヒドロキシプロピル)エステルは水に不溶,食物油およびクロロホルムに可溶な淡黄色の,常温ではロウ状塊を呈する物質である.試験には,太陽化学(三重)からロット番号308251(純度 99.93 %)を入手し,冷暗(2〜6℃)条件下で保管し,使用した.被験物質の投与液は,コーン油(ナカライテスク)を溶媒として,所定の投与用量になるような濃度の溶液として調製し,使用時まで冷所(2〜6℃)遮光下で密栓保管し,調製後7日以内に使用した.保管条件下および投与形態での被験物質は安定であることを確認した.
動物は,SD系〔Crl:CD(SD)〕ラットを,日本チャールス・リバー(神奈川)より搬入し,雌雄とも11日間検疫を兼ねて試験環境に馴化させ,その間に雌については膣垢検査による性周期の確認も行い,10週齢で試験に供した.1群の動物数は雌雄各12匹とし,投与期間終了後屠殺の5群のほか,対照群および最高用量群については,雄は12匹から5匹を選別して回復群とし,雌は1群雌雄各5匹の対照および1000 mg/kg用量のサテライト群を設けて回復群とし,14日間の回復期間を設けた.なお,雌のサテライト群については交配を行わなかった.群分けは,投与開始前日の体重に基づく層化無作為抽出法により行った.群分け時の平均体重(体重範囲)は雄372(352〜426)g,雌224(192〜249)gであった.ラットは,温度22.1〜23.2℃,湿度は48〜61 %に制御した飼育室で,金網ケージに個体別に収容し,固型飼料〔ラボMRストック,日本農産工業〕および水を自由に摂取させて飼育した.ただし,交尾確認後の雌は,巣作り材料〔ホワイトフレーク,日本チャールス・リバー〕を入れたポリカーボネート製ケージに収容した.
投与量設定試験として,1群雌雄各4匹のラットに,被験物質を0,30,100,300および1000 mg/kg用量で14日間反復経口投与し,一般状態の観察,体重および摂餌量の測定,血液学および血液生化学検査,剖検並びに器官重量の測定を行った.その結果,投与に起因する毒性影響は認められなかった.従って,本試験における投与量は,1000 mg/kg/dayを最高用量とし,以下300および100 mg/kg/dayの3用量および対照を設定した.投与方法は,投与液量を体重1 kg当たり5 mLとし,テフロン製胃ゾンデを装着した注射筒を用いて,1日1回(午前中),交配開始14日前から,雌は分娩後哺育4日まで,雄と雌のサテライト群は42日間,経口投与した.対照群には,コーン油を同様に投与した.
1) 親動物に関する項目
投与期間およびそれに続く14日間の回復期間を通じて,動物の生死,外観,行動などを毎日観察した.
投与開始前日およびその後は週1回,動物をケ−ジから取り出す時およびケージ外のアルミ製オープンフィールド(370 W×560D×40H mm)で,ケージからの出し易さ,ケージから出す時の扱い易さ,体躯緊張(弛緩〜強直),皮膚(色),毛並み,立毛,眼分泌物,眼瞼閉鎖状態,眼球突出,流涙,口鼻分泌物(汚れ),流涎,下腹部被毛の尿による汚れ,肛門周囲の便による汚れ,発声,呼吸,姿勢,痙攣,振戦,探索行動(覚醒度),警戒性,自発運動(活動性),歩行(よろめき),異常行動(自咬,後ろ向き歩行など),常同(過度の毛繕い,反復旋回運動など),意識不全(混迷,カタレプシー,昏睡),四肢筋緊張度,排尿および排糞の29項目について観察した.
雄は最終投与日,雌は哺育期間中に1回,またサテライト群の雌雄は最終投与日および回復期間終了日に,聴覚反応,視覚反応,触覚反応,耳介反射,痛覚反応,瞳孔反射,同側屈筋反射,眼瞼反射および正向反射を調べた.
雄は投与41日,雌は哺育期間中に1回,またサテライト群の雌雄は最終投与日および回復13日に,着地開脚幅(30cmの高さから落とした時の足跡の幅を測定),前肢および後肢の握力(ラット・マウス用握力測定装置,MK-380R/FR,室町機械)並びに雄は30分間および60分間,雌は30分間の自発運動量(自発運動量測定装置,SUPERMEX,室町機械,測定装置内の区画間の60分間における移動回数を測定)を測定した.サテライト群の雌の自発運動量は,60分間も測定した.
体重は,週1回および屠殺日に測定した.摂餌量は,毎週1回,1日(24時間)の飼料消費量を測定した.
雌について,馴化・検疫期間に引き続き,交尾が確認されるまで,Giemsa染色による膣垢塗抹標本を作製し,鏡検により性周期段階の判定を行った.平均性周期は,角化細胞のみが散在または集塊状にみられる発情後期Iが回帰する日数の平均値とした.
投与15日の午後に,雄のケージに同一群内の雌を入れ(1対1),交尾が確認されるまで14日間を限度として連続同居させた.交尾の確認は毎朝一定時刻に行い,膣栓形成あるいは膣垢中に精子が確認された日を妊娠0日とした.分娩状態の観察も同じ時刻に行い,1腹ごとに分娩の終了が確認された日を哺育0日とした.交配および分娩の観察結果から,各群について交尾率(%)〔(交尾動物数/同居動物数)×100〕,受胎率(%)〔(受胎雌数/交尾成立雌数)×100〕および出産率(%)〔(生児出産雌数/妊娠雌数)×100〕並びに分娩が確認された例について妊娠期間(妊娠0日から分娩が確認された日までの日数)を算定した.雌のサテライト群は,交配を行わなかった.
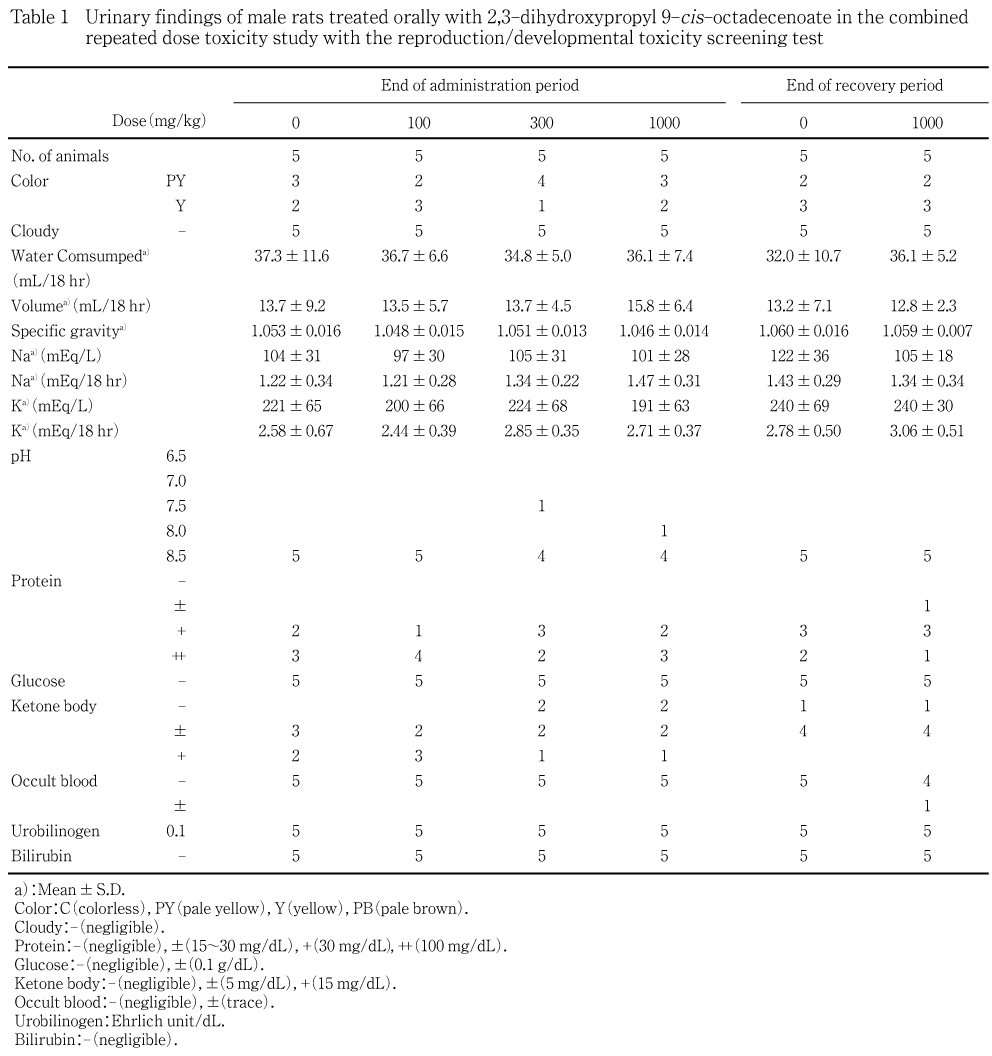
雄について,投与40日およびサテライト群については回復8日に,動物を約3時間代謝ケージに収容し,得られた尿を用いて,外観の観察,試験紙法〔マルティスティックス,バイエル・三共〕によるpH,潜血,タンパク,糖,ケトン体,ビリルビンおよびウロビリノーゲンの定性的検査並びに沈渣の検査(URI-CELL液,ケンブリッジケミカルプロダクト社,で染色して鏡検)を行った.さらに,18時間収容して得られた尿について,尿量,比重〔屈折計,エルマ光学〕並びにナトリウムおよびカリウム〔電解質自動分析装置,NAKL-132,東亜電波工業〕を測定した.
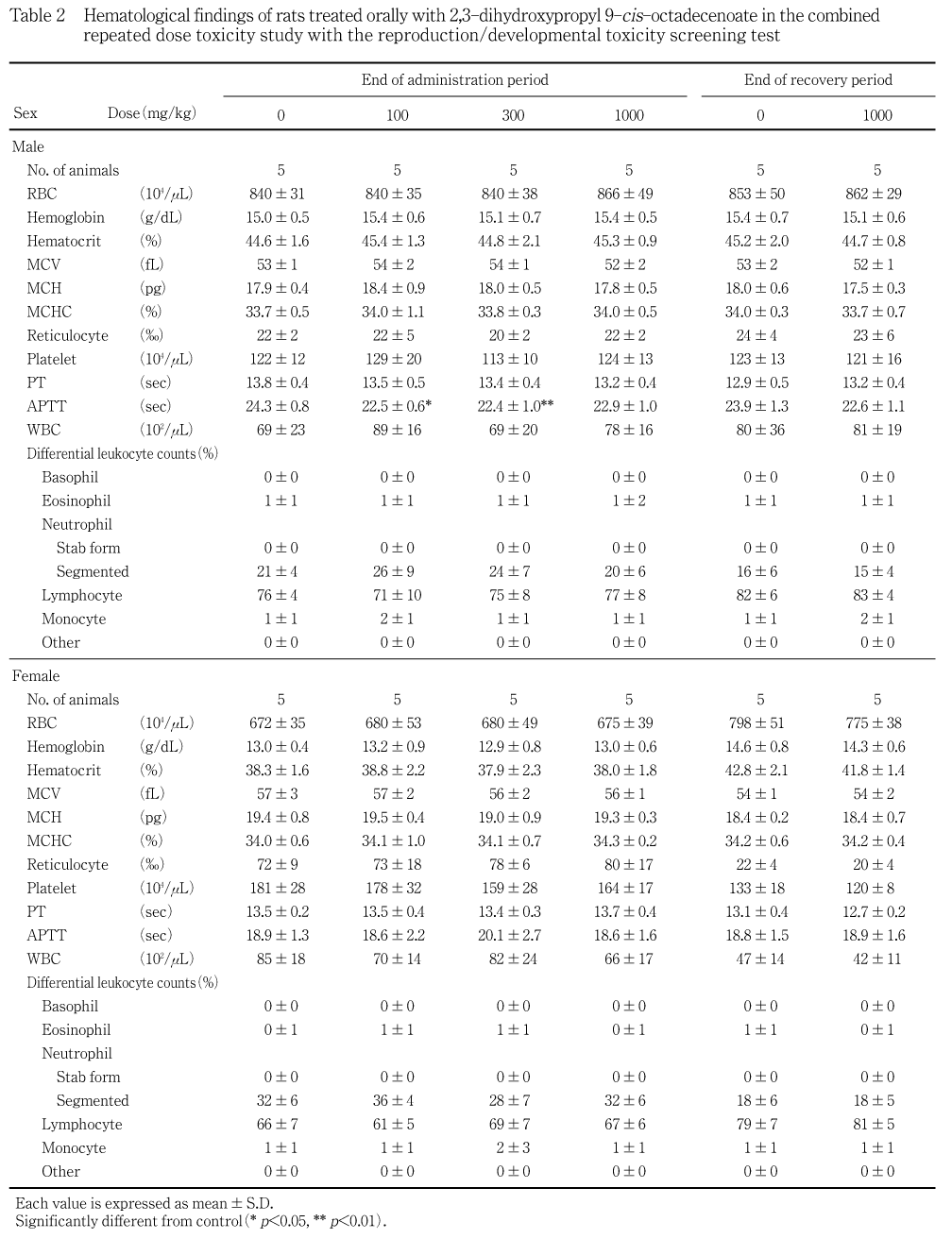
採血は,投与期間および回復期間終了翌日にエーテル麻酔下で開腹して腹大動脈より行った.動物は採血前日の午後5時から除餌し,水のみを給与した.採取した血液は3分割し,その一部は,EDTA-2Kで凝固防止処理し,多項目自動血球計数装置〔E-4000,シスメックス〕により,赤血球数(電気抵抗検出方式),血色素量(ラウリル硫酸ナトリウム-ヘモグロビン法),ヘマトクリット値(パルス検出方式),平均赤血球容積(MCV),平均赤血球血色素量(MCH),平均赤血球血色素濃度(MCHC,以上計算値),白血球数および血小板数(以上,電気抵抗検出方式)を,また塗抹標本を作製して網状赤血球数(Brilliant cresyl blueで染色して鏡検)および白血球百分率(May-Giemsaで染色して鏡検)を測定した.また一部は,3.8 %クエン酸ナトリウム液で凝固阻止処理して血漿を分離し,血液凝固自動測定装置〔KC-10A,アメルング社〕により,プロトロンビン時間(PT,Quick一段法)および活性化部分トロンボプラスチン時間(APTT,エラジン酸活性化法)を測定した.
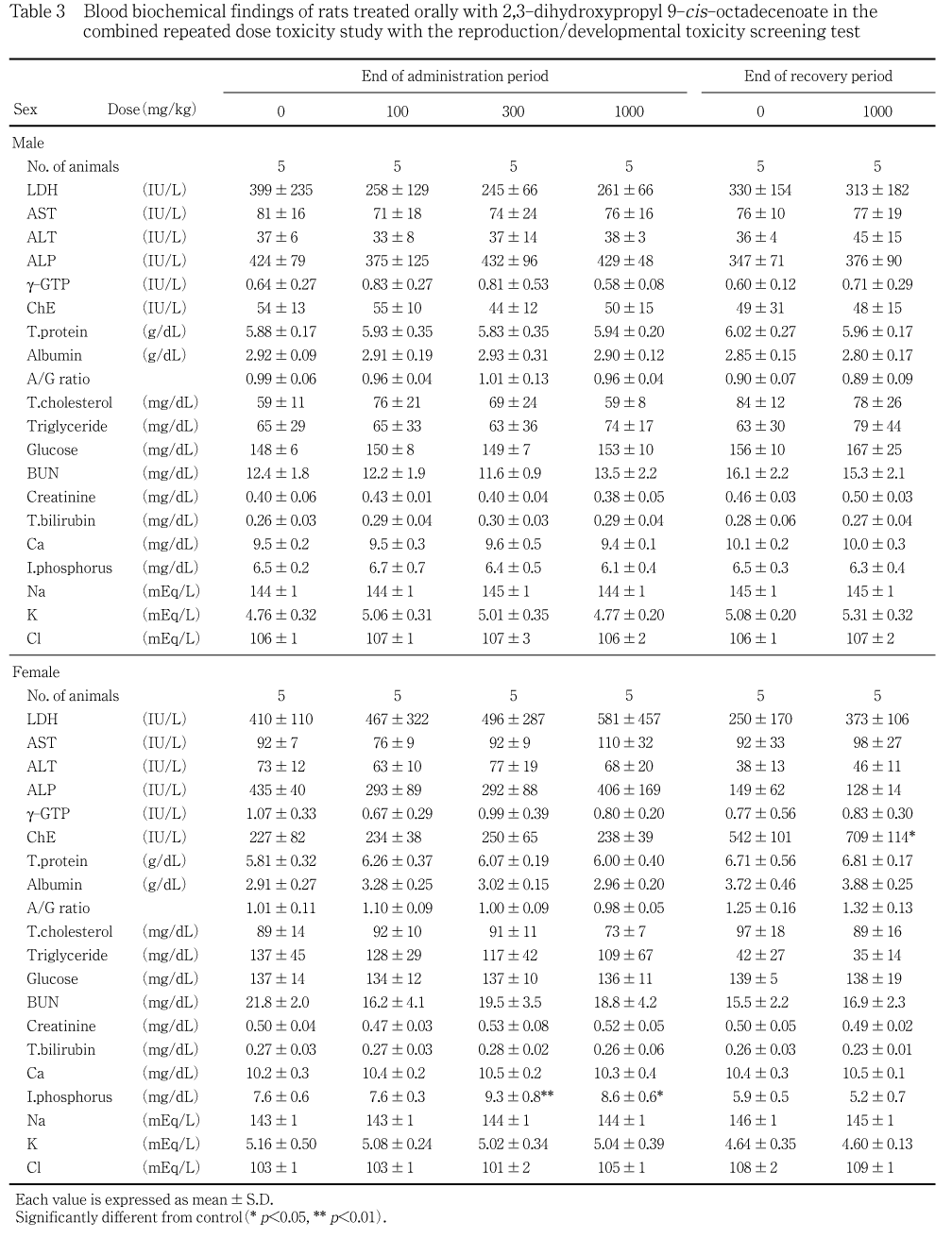
採取した血液の一部から血清を分離し,生化学自動分析装置〔JCA-BM8,日本電子〕により,総タンパク(Biuret法),アルブミン(BCG法),A/G比(計算値),グルコース,トリグリセライド,総コレステロール(以上,酵素法),総ビリルビン(ジアゾ法),尿素窒素(Urease-UV法),クレアチニン(Jaff事@),AST,ALT,g-GTP,ALP(以上,JSCC法),LDH(SFBC法),コリンエステラーゼ(BTC-DTNB法),カルシウム(OCPC法)および無機リン(酵素法)を,また電解質自動分析装置〔NAKL-132,東亜電波工業〕により,ナトリウム,カリウムおよび塩素(以上,イオン電極法)を測定した.
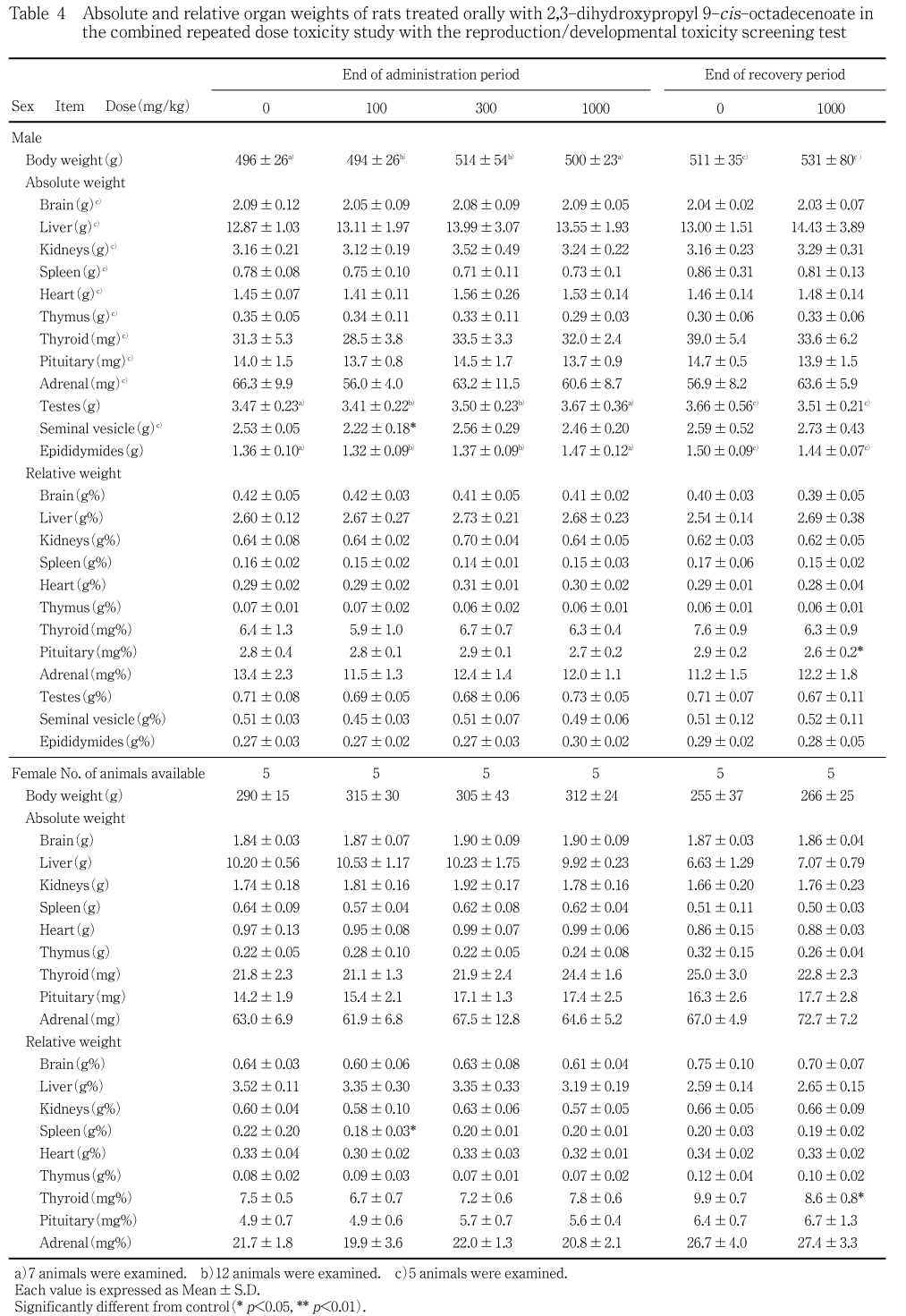
雄の計画屠殺動物は投与42日の翌日,雌では分娩し哺育も順調であった例は哺育5日,交尾の成立しなかった例は交配期間終了後24日(投与52日の翌日),交尾は成立したが分娩予定の4日後まで分娩が認められなかった例はその翌日,また,サテライト群については回復14日の翌日に,それぞれエ−テル麻酔下で放血屠殺し,体表,開口部粘膜および内部諸器官を肉眼的に観察した.また,各群雌雄各5匹の肝臓,腎臓,副腎,胸腺,脾臓,脳,心臓,下垂体,甲状腺および精嚢並びに全ての雄の精巣および精巣上体を秤量(絶対重量)し,屠殺日の体重に基づいて対体重比(相対重量)を算出した.雌については,卵巣の黄体数および子宮の着床数を調べ,着床率(%)〔(着床数/黄体数)×100〕を算出した.
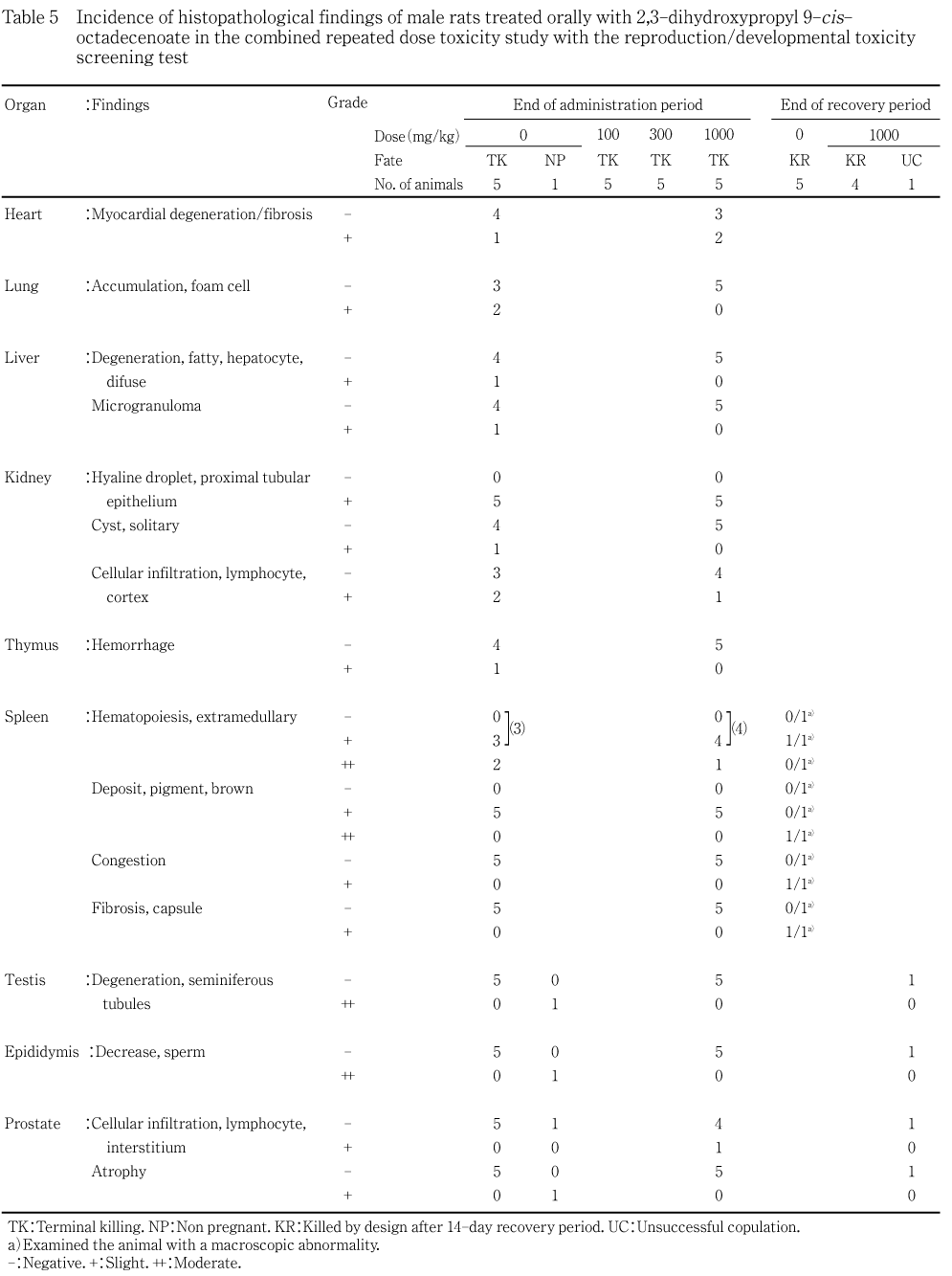
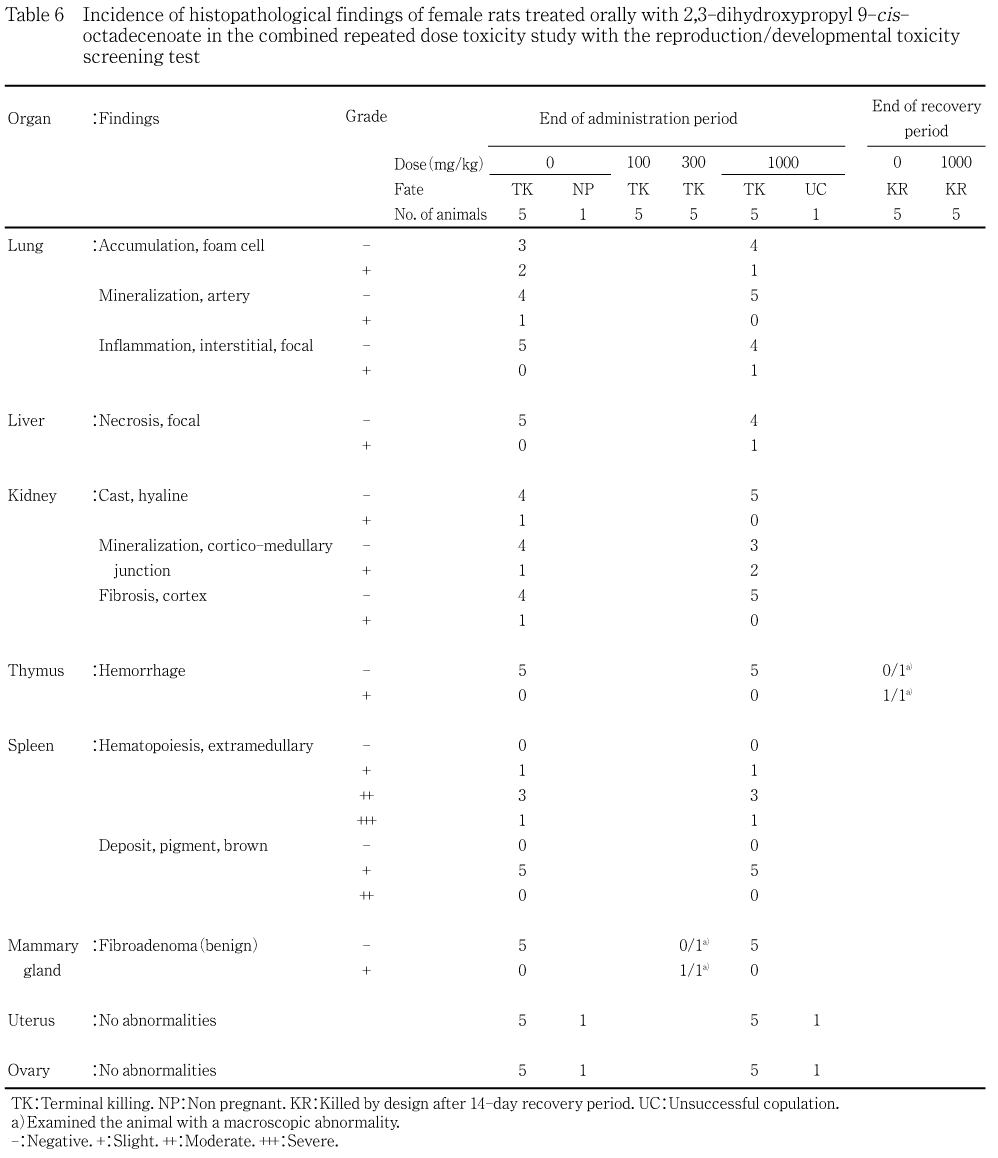
全例について脳,下垂体,甲状腺,胸腺,気管・肺(固定液を注入後浸漬),胃,腸,心臓,肝臓,脾臓,腎臓,副腎,膀胱,精巣,精巣上体,前立腺,精嚢,卵巣,子宮,脊髄(頸部,胸部,腰部),坐骨神経,骨髄(大腿骨),リンパ節(頸部リンパ節,腸間膜リンパ節),乳腺,その他肉眼的異常部位を採取し,10 %中性リン酸緩衝ホルマリン液(精巣,精巣上体はブアン液で前固定)で固定し,保存した.病理組織学検査は,対照群および250 mg/kg群の雌雄各5匹のこれら保存器官について実施した.各群の肉眼的異常部位については全例について検査した.また,交尾不成立の雌雄および交尾は成立したが分娩予定の4日後まで分娩が認められなかった雌については,雄では精巣,精巣上体,前立腺および精嚢を,雌では卵巣,子宮および下垂体を検査した.検査は,常法に従ってパラフィン切片を作製し,H-E 染色を施して鏡検した.対照群および1000 mg/kg群の精巣については,PAS染色を施して,精子形成サイクル検査(ステージII・III,V,VIIおよびXII)も行った.
(1) 産児数,性比および外表観察
分娩完了の確認後,各腹の産児数(生産児と死亡児の合計)を調べ,分娩率〔(総出産児数/着床数)×100〕を,また,肛門と生殖突起の長短により性別を判定し,群ごとの性比を算出した.新生児については,口腔内を含む外表の異常を観察した.
(2) 一般状態観察
毎日一般状態および生死を確認し,出生率〔(出産確認時生児数/総出産児数)×100〕および新生児生存率〔(哺育4日生児数/出産確認時生児数)×100〕を求めた.
(3) 体重測定
新生児について哺育0日および4日に雌雄別に各腹ごとの総体重を測定し,1匹当たりの平均体重を算出した.
(4) 病理学検査
死亡例はその都度,生存例は哺育4日にエーテル麻酔下で放血死させ,胸腹部における主要器官を肉眼的に観察した.
5. 統計解析
得られた平均値あるいは頻度について,対照群との有意差(危険率5 %以下)を,定量的データおよびパラメトリックデータについて,試験群が3群以上の場合,Bartlettの分散検定を行い,分散が一様な場合は一元配置の分散分析を行った.分散が一様でない場合およびノンパラメトリックデータは,Kruskal-Wallisの順位検定を行った.それらの結果有意差を認めた場合,DunnettないしDunnett型の検定法による多重比較を行った.試験群が2群間の場合は,パラメトリックデータについてF検定を行い,その結果分散が一様な場合は Studentのt検定を,分散が一様でない場合はAspin-Welchのt検定を行った.また,ノンパラメトリックデータは,Mann- WhitneyのU検定を行った.カテゴリカルデータについては,Fisherの直接確率法を用いて検定した.なお,出産児に関するデータは,1腹を1標本とした.
1. 反復投与毒性
300 mg/kg群の雌の1匹で,投与40日以降に小さな腫瘤が下腹部に確認された.その他の動物では,投与および回復期間を通じて,一般状態の変化および死亡は認められかなった.
投与期間中および回復期間中の観察とも,被験物質の投与に起因する変化は認められなかった.
投与6週および回復2週の検査において,各検査項目に有意な変化は認められなかった.
投与期間中の検査では,変化は認められなかった.
回復期間中の検査では,1000 mg/kg群の雌の測定開始60分間の自発運動量に有意な高値が認められた.しかし,測定開始30分間の自発運動量には有意差は認められなかった.
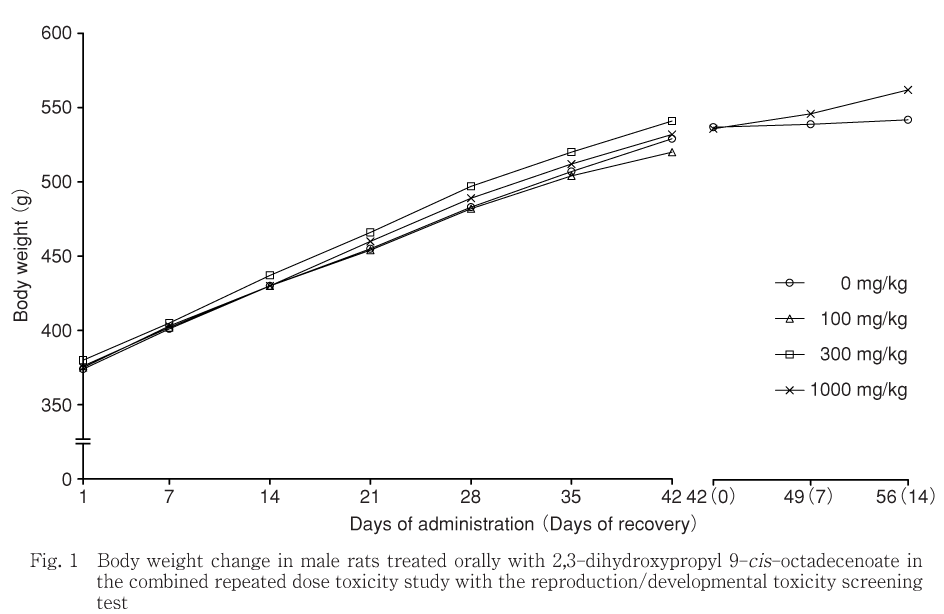
投与期間中の体重および体重増加量に,有意な変化は認められなかった.
回復期間中では,1000 mg/kg群の雄の体重増加量が有意な高値を示したが,これはむしろ対照群の体重増加量の低値傾向によるものであった.

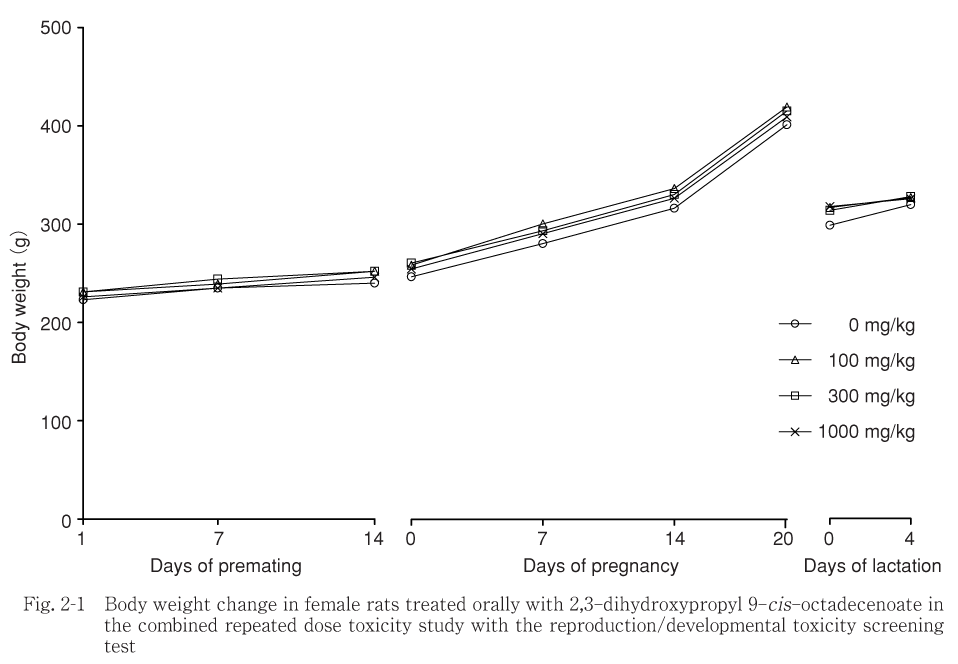
投与期間中および回復期間中とも被験物質の投与による変化は認められなかった.
投与期間中および回復期間中の検査において,有意な変化は認められなかった.
被験物質の投与による変化は認められなかった.投与期間終了時の検査で,被験物質投与各群の雄の活性化部分トロンボプラスチン時間(APTT)は対照群に比べて全般的にやや低値を示し,100 mg/kg群および300 mg/kg群には有意差が認められたが,変化に用量相関性は認められなかった.
回復期間終了時の検査では,各検査項目に有意な変化は認められなかった.
投与期間終了時の検査において,300 mg/kg群および1000 mg/kg群の雌で無機リンの有意な高値が認められた.これらの値は対照群および100
mg/kg群と比べるとやや高値であるものの用量相関性は明確でなかった.
回復期間終了時の検査において,1000 mg/kg群の雌のコリンエステラーゼが有意な高値を示した.
被験物質の投与に起因する変化は認められなかった.また,後述の交尾不成立あるいは交尾は成立したが妊娠しなかった対においても,雌雄に変化は認められなかった.被験物質の投与とは無関係に認められた所見としては,投与期間終了時の剖検で,胸腺の赤色域が対照群の雄の1匹に,また一般状態の観察において300 mg/kg群の雌の1匹で触知された腫瘤は,右鼠径部皮下の2.0×2.5 cm大の腫瘤として確認された.回復期間終了時の剖検では,脾臓の被膜肥厚部を伴う大型化が対照群の雄の1匹および胸腺の赤色域が1000 mg/kg群の雌の1匹に認められた.
投与期間終了時において,100 mg/kg群の雄に精嚢の絶対重量の有意な低値,100 mg/kgの雌に脾臓の相対重量の有意な低値が認められた.しかしながら,用量相関的な変化ではなかった.
回復期間終了時において,1000 mg/kg群で雄に下垂体,1000 mg/kg群の雌に甲状腺のいずれも相対重量の有意な低値が認められた.
被験物質の投与に起因する変化は認められなかった.精巣の精子形成サイクル検査でも有意な変化は認められなかった.
被験物質の投与とは無関係な自然発生病変と判断された所見として,心臓の心筋変性・線維化,肺の泡沫細胞集簇および動脈壁鉱質沈着,肝臓の肝細胞脂肪変性および微小肉芽腫,腎臓の孤立性嚢胞,皮質リンパ球浸潤,硝子円柱,皮髄境界部鉱質沈着および皮質線維化並びに胸腺の出血が対照群と1000 mg/kg群に共通して,あるいは対照群にのみいずれも低い発現率で認められた.また,雄の腎臓の近位尿細管上皮硝子滴並びに雌雄の脾臓の髄外造血および褐色色素沈着が高い発現率で認められたが,1000 mg/kg群と対照群の間に発現率や変化の程度に差は認められなかった.また,1000 mg/kg群にのみ,いずれも軽度な前立腺の間質リンパ球浸潤が雄の1匹に,肺の間質炎症巣および肝臓の巣状壊死が雌の各1匹に認められたが,これらの変化はラットに自然発生的に認められる所見で,被験物質の投与とは無関係な変化と判断された.
剖検で被験物質の投与とは無関係に認められた皮下の腫瘤は乳腺の線維腺腫(良性)であった.胸腺の赤色域には出血,被膜の肥厚部を伴う大型化した脾臓には被膜の線維化を伴ううっ血が認められた.
対照群に認められた妊娠不成立の1対においては,雄で精巣の性上皮変性,精巣上体の精巣上体管内精子低減および前立腺の萎縮が認められ,雌の下垂体,卵巣および子宮には変化は認められなかった.1000 mg/kg群に認められた交尾不成立の1対では,雌雄の生殖器系器官および雌の下垂体には変化は認められなかった.
2. 生殖発生毒性
(1) 性周期検査
群分けの翌日から交配前までの性周期検査において,各個体は3.7〜5.0日で発情を回帰し,対照群を含む各投与群の平均性周期は4.0〜4.1日を示し,有意な変化は認められなかった.
(2) 交尾率および受胎率
交尾不成立の1対が1000 mg/kg 群で,また交尾は成立したが妊娠しなかった1対が対照群で認められが,交尾はこの1対を除いて全例で成立し,交尾成立までに要する日数,交尾率および受胎率に有意な変化は認められなかった.1000
mg/kg群の交尾不成立の雌は,交配前2週間の性周期は順調であったが,交配開始後2日から交配期間終了時まで発情休止期が持続した.
(3) 黄体数,着床数および着床率
黄体数,着床数および着床率に有意な変化は認められなかった.
(4) 出産率および妊娠期間
受胎した動物の全例に出産が認められ,全ての群で出産率は100 %であった.妊娠期間にも有意な変化は認められなかった.
(5) 分娩および哺育状態
分娩状態および哺育状態の異常は認められなかった.
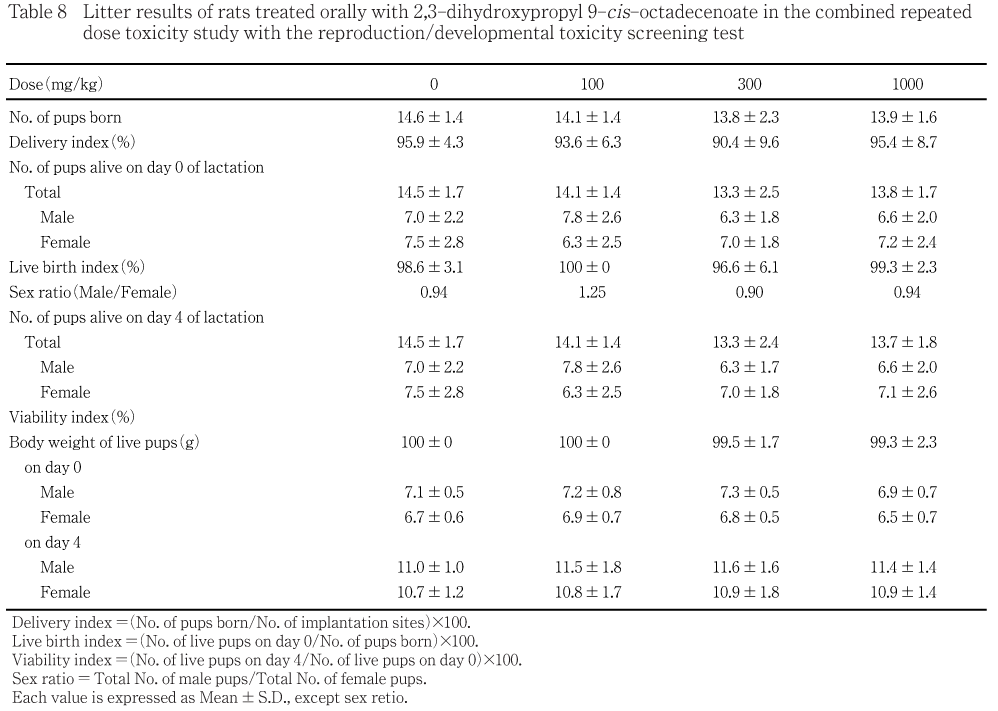
2) 新生児に及ぼす影響(Table 8)
(1) 生存性および体重
一腹当たりの総出産児数,分娩率,哺育0日および4日の新生児数および体重,出産率,性比並びに哺育4日の生存率に有意な変化は認められなかった.新生児の一般状態にも変化は認められなかった.
(2) 形態
いずれの群においても外表および内臓異常を有する児動物は認められなかった.内臓変異については,胸腺の頸部残留が対照群で1匹(発現率0.6
%),300 mg/kg群で1匹(0.5 %)および1000 mg/kg群で2匹(1.3 %)に,左臍動脈遺残が100
mg/kg群で1匹(0.5 %)および1000 mg/kg群で2匹(1.3 %)に,蛇行尿管が100 mg/kgで1匹(0.6
%),300 mg/kg群で3匹(2.0 %)および1000 mg/kg群で2匹(1.1 %)に,腎盂拡張が300
mg/kg群で1匹(0.7 %)に,尿管拡張が100 mg/kg群で1匹(0.6 %)および300 mg/kg群で2匹(1.4
%)に認められた.これらの内臓変異を有する児動物は,対照群で1匹(0.6 %),100
mg/kg群で3匹(1.8 %),300 mg/kg群で5匹(3.3 %)および1000 mg/kg群で6匹(3.8
%)であった.以上の内臓変異の種類別発現率およびいずれかの内臓変異を有する児動物の発現率において,対照群と被験物質投与各群との間に有意差は認められなかった.
1. 反復投与毒性について
一般状態の観察および詳細な臨床観察,感覚反射機能検査,着地開脚幅,握力,自発運動量などの神経行動学的観測,体重,摂餌量,尿検査において変化は認められなかった.
血液学検査では100 mg/kg群および300 mg/kg群の雄で,活性化部分トロンボプラスチン時間(APTT)の有意な低値が認められたが,背景データにおける正常範囲(17.1〜25.0 sec)の変化で,用量相関性も認められなかった.また,血液生化学検査では,300 mg/kg群および1000 mg/kg 群の雌で無機リンの有意な高値が認められたが,これも正常範囲の変化(6.6〜9.6 mg/dL)で他に関連する変化も認められず,また,用量相関性も明らかではなかった.従って,これら血液学検査および血液生化学検査における変化は,いずれも被験物質の投与とは無関係な所見と判断された.器官重量では,100 mg/kg群で,雄に精嚢の絶対重量のみの有意な低値,雌に脾臓の相対重量のみの有意な低値が認められたが,いずれも用量相関性のみられない変化であり,病理組織学検査でもこれらの器官に変化が認められなかったことから,被験物質の投与とは無関係な所見と考えられた.病理組織学検査では,いずれの器官も被験物質の投与に起因する変化は認められなかった.300 mg/kg群の雌の1匹に認められた乳腺の線維腺腫については,雌ラットでは比較的発現率の高い良性腫瘍 2, 3, 4) であり,自然発生的なものと判断される.一方,サテライト群においては,雄は下垂体相対重量の低値,雌は甲状腺相対重量の低値並びに自発運動量およびコリンエステラーゼの高値が認められた.しかしながら,投与期間中および投与期間終了時の検査ではこのような変化傾向は認められず,いずれも軽度な変化であることから,遅発的な毒性影響を示唆するものではなく,これらについても投与とは無関係な所見と判断された.
2. 生殖発生毒性について
親動物の生殖能に関連して,性周期(雌),交尾成立期間,交尾率,受胎率,妊娠期間,黄体数,着床率,出産率および分娩率に変化は認められず,分娩および哺育状態にも異常は認められなかった.
1000 mg/kg 群で認められた交尾不成立の1対については,雌雄の生殖器系器官や雌の下垂体に病理組織学的変化は認められなかった.雌の性周期検査の結果から,スメア採取などの刺激による偽妊娠が疑われ,これが交尾不成立の原因になったものと推察され,被験物質の投与とは無関係な変化と判断された.
また対照群で認められた妊娠不成立の1対については,病理組織学検査の結果で雄に精巣の性上皮変性,精巣上体の精巣上体管内精子低減および前立腺の萎縮が認められ,妊娠不成立の原因と考えられた.
児動物の発生に関連して,総出産児数,新生児数,性比,出生率,体重,形態および哺育4日生存率に変化は認められなかった.
対照群を含む各投与群で少数例の内臓変異がみられたが,いずれも自然発生的に認められるもので5),それらの発現率に有意差および用量相関性も認められなかった.また,何らかの内臓変異を有する児動物の発現率についても,いずれも背景データの正常範囲(0〜6.4 %)の値であり,催奇形性を示唆する変化ではないと判断された.
9-cis-オクタデセン酸(2,3-ジヒドロキシプロピル)エステルは経口摂取した場合,腸でそれぞれ安全性の高いオレイン酸とグリセリンに完全に加水分解されることから,安全性の問題は小さいと推定されていた1)が,本試験により,このことを確認することができた.
以上の結果から,9-cis-オクタデセン酸(2,3-ジヒドロキシプロピル)エステルのラットへの反復投与による無毒性量(NOAEL)は雌雄ともに1000 mg/kg/day以上,また,雌雄親動物の生殖能および児動物の発生に対する無毒性量も,1000 mg/kg/dayと結論された.
| 1) | Safety evaluation of certain food additived and contaminants, WHO food additive series: 48. |
| 2) | 日本毒性病理学会編:「毒性病理組織学」アイペック,東京(2000)p.542. |
| 3) | Chandra M et al.:Spontaneus neoplasma in aged Sprague-Dawley rats. Arch Toxicol, 66: 492-502 (1992). |
| 4) | Brix AE et al.:Incidences of selected lesions in control female Harlan Sprague-Dawley rats from Two-year studied performed the National Toxicology Program. Toxicol Pathol, 33: 477-483 (2005). |
| 5) | Morita H et al.:Spontaneous malformations in laboratory animals, Frequency of external, internal and skeletal malformations in rats, rabbits and mice. Cong Anom, 27: 147-206(1987). |
| 連絡先 | |||
| 試験責任者: | 山口真樹子 | ||
| 試験担当者: | 野田 篤,伊藤雅也,赤木 博, 杉本忠美,高見澤志保,昆 尚美, 伊藤義彦 | ||
| (財)畜産生物科学安全研究所 | |||
| 〒229-1132 神奈川県相模原市橋本台3-7-11 | |||
| Tel 042-762-2775 | Fax 042-762-7979 | ||
| Correspondence | |||
| Authors: | Makiko Yamaguchi(Study director) Atsushi Noda, Masaya Ito, Hiroshi Akagi, Tadami Sugimoto, Shiho Takamizawa, Naomi Kon, Yoshihiko Ito |
||
| Research Institute for Animal Science in Biochemistry and Toxicology | |||
| 3-7-11 Hashimotodai, Sagamihara-shi, Kanagawa, 229-1132, Japan | |||
| Tel +81-42-762-2775 | Fax +81-42-762-7979 | ||