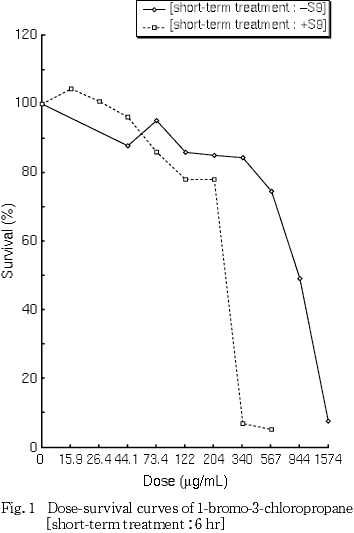
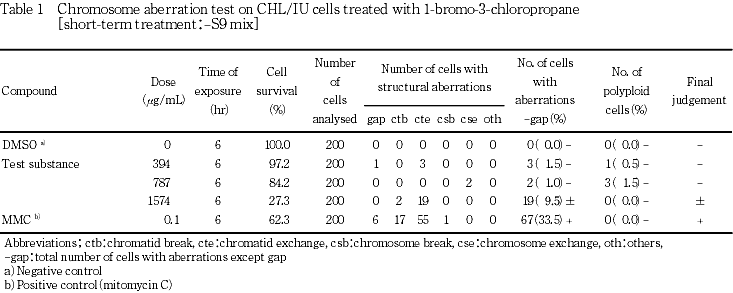
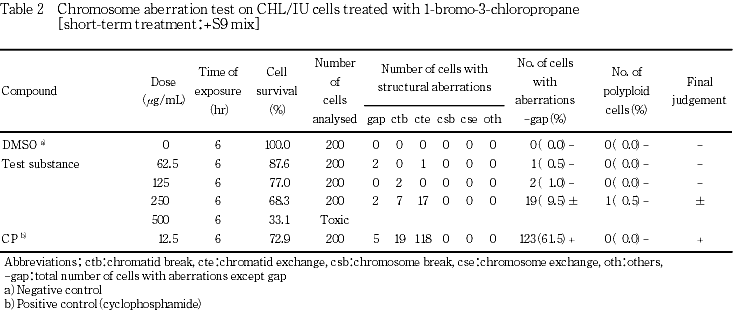
細胞増殖抑制試験結果をもとに,短時間処理法-S9処理では1574 μg/mL(10 mM相当)を最高処理濃度とし,98.4〜1574 μg/mLの5用量を,+S9処理では1000 μg/mL(10 mM相当)を最高処理濃度とし,31.3〜1000 μg/mLの6用量を設定した.S9 mix存在下および非存在下で6時間処理(18時間の回復時間)後,標本を作製し,検鏡することにより染色体異常誘発性を検討した.-S9処理では 394〜1574 μg/mLの3用量について,+S9処理では 62.5〜500 μg/mLの4用量について顕微鏡観察を実施した.
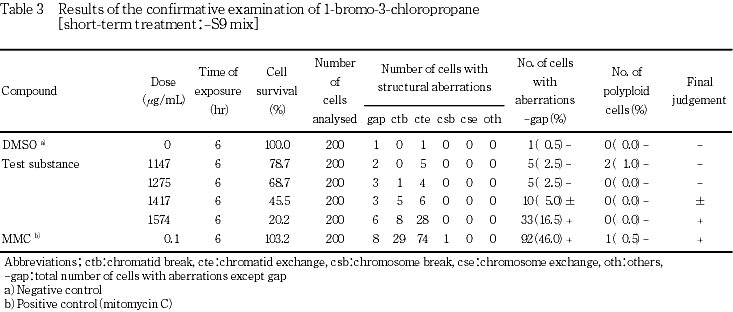
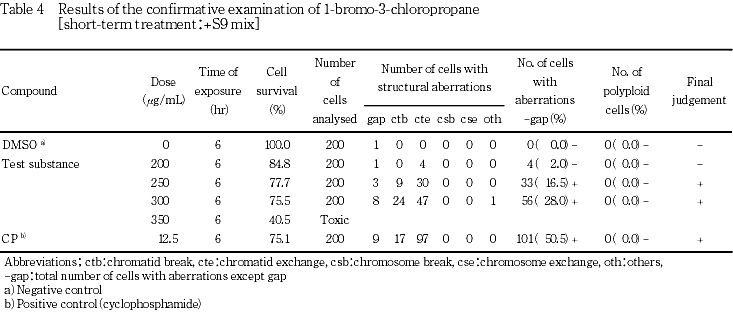
その結果,S9 mix非存在下および存在下で染色体構造異常の僅かな誘発がみられ疑陽性結果(±)が得られた.従って,-S9処理では753〜1574μg/mL,+S9処理では150〜500 μg/mLのそれぞれ8用量を用いた確認試験を実施した.顕微鏡観察については-S9処理で1147〜1574 μg/mL,+S9処理で200〜350 μg/mLのそれぞれ4用量について実施した.その結果,S9 mix非存在下ならびに存在下とも試験用量に依存した染色体構造異常の誘発が認められた.
以上の結果より,本試験条件下では1-ブロモ-3-クロロプロパンは,染色体異常を誘発する(陽性)と結論した.
| 成 分 | S9 mix 1 mL中の量 |
| S9 | 0.3 mL |
| MgCl2 | 5 μmol |
| KCl | 33 μmol |
| G-6-P | 5 μmol |
| NADP | 4 μmol |
| HEPES緩衝液(pH 7.2) | 4 μmol |
| 精製水 | 残 量 |
細胞を10 vol%中性緩衝ホルマリン液(和光純薬工業(株)で固定した後,0.1 w/v%クリスタル・バイオレット(関東化学(株)水溶液で10分間染色した.色素溶出液(30 vol%エタノール,1 vol%酢酸水溶液)を適量加え,5分間程度放置して色素を溶出した後,580 nmでの吸光度を測定した.各用量群について溶媒対照群での吸光度に対する比,すなわち細胞生存率を算出した.
その結果,細胞増殖を50 %抑制する濃度は,短時間処理法-S9処理で844 μg/mLおよび+S9処理で249 μg/mLと算出された(Fig. 1).
なお,被験物質暴露終了時,pHの変動,析出等の特筆すべき変化は認められなかった.

-S9処理において染色体構造異常の出現に関し疑陽性と判定されたことから,-S9処理では1574 μg/mLを,+S9処理では 500 μg/mLを最高処理濃度とし,それぞれ8用量を用いた確認試験を実施した.
なお,陽性対照として,-S9処理でマイトマイシンC(MMC:協和醗酵工業(株)を0.1 μg/mL,+S9処理でシクロホスファミド(CP:塩野義製薬(株)を12.5 μg/mLの用量で試験した.
すべての標本をコード化した後,マスキング法で観察した.
各試験群の構造異常を有する細胞あるいは倍数性細胞の出現頻度を,石館ら3)の基準に従って判定した.染色体異常を有する細胞の出現頻度が5 %未満を陰性(-),5 %以上10 %未満を疑陽性(±),10 %以上を陽性(+)とした.最終的には再現性あるいは用量に依存性が認められた場合に陽性と判定した.
なお,統計学的手法を用いた検定は実施しなかった.
また,分裂中期像の20 %にいずれかの異常を誘発するのに必要な被験物質濃度であるD20値を最小二乗法により算出し,一定濃度(mg/mL)あたりの交換型異常(cte)出現数を示す比較値であるTR値を,染色分体交換の出現頻度(%)を被験物質濃度(mg/mL換算)で割ることにより算出した.
本被験物質処理群において,染色体構造異常の出現頻度が疑陽性と判定されたことから,確認試験を実施した.その結果,染色体構造異常の誘発において用量依存的な増加傾向が認められた(Table 3〜4).一方,陽性対照では染色体構造異常の顕著な誘発が認められた.
変異原性の強さに関する相対的比較値であるD20値は0.291(mg/mL),TR値は78.3と算出され,既知変異原性物質に比較して1-ブロモ-3-クロロプロパンの変異原性は弱いことを示していた.なお,被験物質暴露終了時,pHの変動,析出等の特筆すべき変化は認められなかった.
以上の試験結果から,本試験条件下において1-ブロモ-3-クロロプロパンのチャイニーズハムスター培養細胞に対する染色体異常誘発性に関し,陽性と判定した.
なお,本被験物質についてはAmes試験で陽性4)との報告があった.類縁体である1,3-dibromopropaneはAmes試験および染色体異常試験で陽性4),1,3-dichloropropeneはAmes試験および染色体異常試験で陽性5, 3),ならびに1,3-dichloropropaneはin vitro小核およびSCG試験(コメットアッセイ)で陽性6)との報告があった.
| 1) | A. Matsuoka, M. Hayashi and M. Ishidate Jr., Mutat. Res., 66, 277(1979). |
| 2) | 日本環境変異原学会・哺乳動物試験分科会編,“化学物質による染色体異常アトラス,”朝倉書店,東京,1988, pp. 31-35. |
| 3) | 石館基監修,“<改訂>染色体異常試験データ集,”エル・アイ・シー,東京,1987. |
| 4) | 労働省労働基準局安全衛生部化学物質調査課監修,“労働安全衛生法有害性調査制度に基づく既存化学物質変異原性試験データ集,”日本化学物質安全・情報センター,東京,1996. |
| 5) | 石館基監修“微生物を用いる変異原性試験データ集,”エル・アイ・シー,東京,1991, pp. 176-177. |
| 6) | M. Tafazoli and M. Kirsch-Volders, Mutat. Res., 371(3-4), 185(1996). |
| 連絡先 | |||
| 試験責任者: | 益森勝志 | ||
| 試験担当者: | 菊池正憲,嶋田佐和子,梶原玲子,永井美穂 | ||
| (財)食品農医薬品安全性評価センター | |||
| 〒437-1213 静岡県磐田郡福田町塩新田582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | ||||
| Authors: | Shoji Masumori(Study Director) Masanori Kikuchi, Sawako Shimada, Reiko Kajihara, Miho Nagai | |||
| Biosafety Research Center, Foods, Drugs and Pesticides(An-pyo Center) | ||||
| 582-2 Shioshinden, Fukude-cho, Iwata-gun, Shizuoka, 437-1213, Japan | ||||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | |||