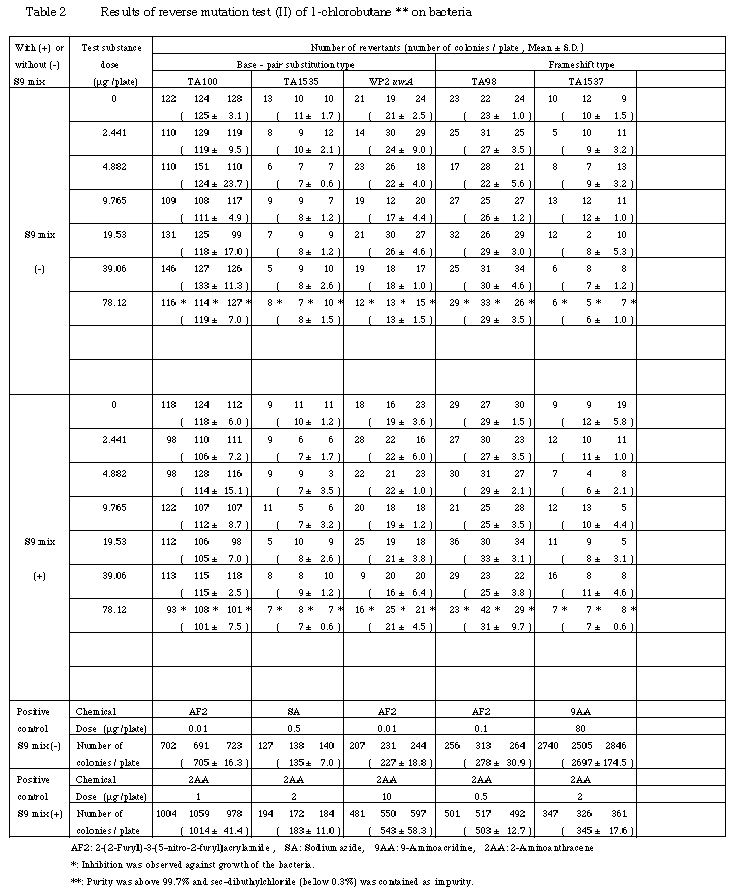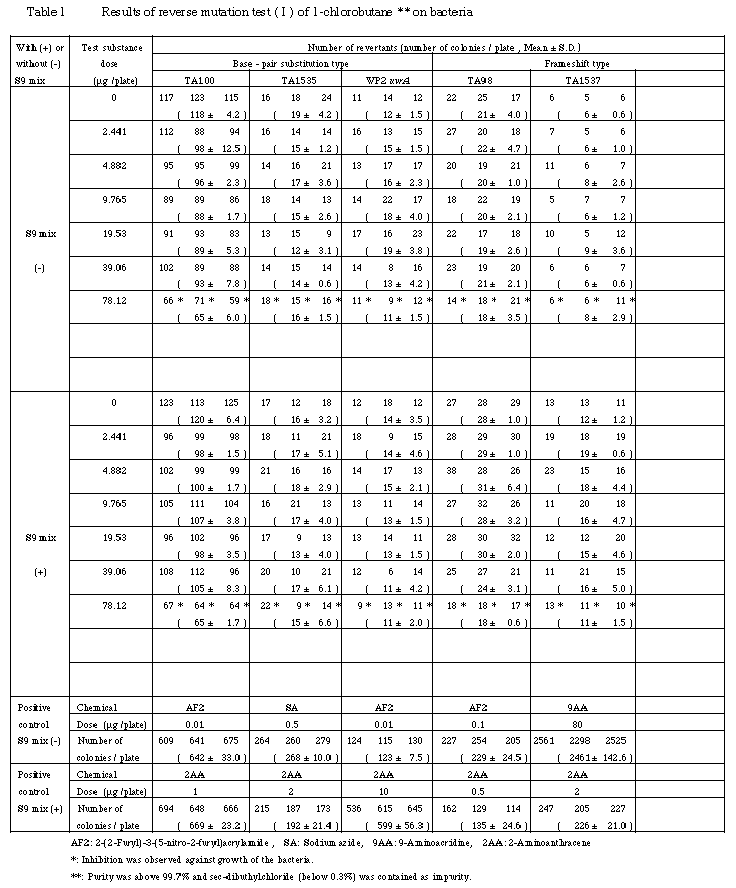
検定菌として,Salmonella typhimurium TA100, TA1535, TA98, TA1537およびEscherichia coli WP2 uvrAを用い,用量設定試験は直接法および代謝活性化法のいずれも,0.5〜5000μg/プレートの用量で,本試験は用量設定試験で抗菌性が認められたことから,直接法および代謝活性化法のいずれも2.441〜78.12μg/プレートの用量で試験を実施した.
その結果,それぞれ2回実施した本試験において,用いた5種類の検定菌とも,いずれの用量でも復帰変異コロニー数の増加が認められなかったことから,1-クロロブタンは,用いた試験系において変異原性を有しない(陰性)と判定された.
E. coli WP2 uvrA株は1979年5月9日に国立遺伝学研究所の賀田恒夫博士から分与を受けた. 検定菌は,-80℃以下で凍結保存した.
試験に際して,ニュートリエントブロスNo.2(Oxoid)を入れたL字型試験管に種菌を接種し,37℃,11〜12時間往復振とう培養したものを検定菌液とした.
1-クロロブタンは,アセトン(ロット番号:DSR3251,和光純薬工業(株))を用いて50mg/mlとなるように調製した後,同溶媒で更に公比2ないし3で希釈したものを,速やかに試験に用いた.なお,調製にあたって,純度および比重換算は行わなかった.
1-クロロブタンの本試験に用いた調製検体は秦野研究所に於いて含量測定試験を行った.含量測定試験は,原則として高濃度溶液および低濃度溶液各3サンプルについて実施するものであるが,化学分析条件の検討結果から,低濃度溶液についての測定が不可能となったため最高濃度(781.2μg/ml)および測定可能な中間濃度(195.3μg/ml)で行った.その結果,781.2μg/ml溶液の含量は,既定濃度に対し,85.4〜86.9%,195.3μg/ml溶液は,36.3〜58.5%であった.
以上の結果が得られた原因は,被験物質が極めて低沸点化合物であり易揮発性のため,検体調製操作,サンプル採取あるいは分析操作中における揮発と考えられる.
なお,本試験時での含量測定結果からわかるように,最高濃度以外での濃度では,易揮発性のため,既定濃度に必ずしも達しないまま試験を実施した.
その場合,多少でも1-クロロブタンと供試菌が接触するために以下の点に注意を払った.すなわち,用時調製後速やかに平板にまいたあと,各平板は,同一濃度毎に各密閉袋に入れ培養することとした.
なお,1-クロロブタンのアセトン溶液中での安定性試験については,サンプル間の測定値のばらつきが大きく,上記の操作法により安定性を確認することは困難と考え,実施しなかった.
| AF-2 | : | フリルフラマイド | (上野製薬(株)) |
| SA | : | アジ化ナトリウム | (和光純薬工業(株)) |
| 9-AA | : | 9-アミノアクリジン | (SigmaChem.Co.) |
| 2-AA | : | 2-アミノアントラセン | (和光純薬工業(株)) |
| (A) | バクトアガー(Difco) | 0.6% |
| 塩化ナトリウム | 0.5% | |
| (B)* | L-ヒスチジン | 0.5mM |
| ビオチン | 0.5mM |
| 硫酸マグネシウム・7水和物 | 0.2g |
| クエン酸・1水和物 | 2g |
| リン酸水素二カリウム | 10g |
| リン酸水素アンモニウムナトリウム・4水和物 | 3.5g |
| グルコース | 20g |
| バクトアガー(Difco) | 15g |
| S9** | 0.1ml |
| NADH | 4μmol |
| 塩化マグネシウム | 8μmol |
| NADPH | 4μmol |
| 塩化カリウム | 33μmol |
| 0.2Mリン酸緩衝液(pH7.4) | 0.5ml |
| グルコース・6リン酸 | 5μmol |
| **: | 7週齢のSprague-Dawley系雄ラットをフェノバルビタール(PB)および5,6-ベンゾフラボン(BF)の 併用投与で酵素誘導して作製したS9(キッコーマン(株))を用いた. |
小試験管中にトップアガー2ml,被験物質調製液0.1ml,リン酸緩衝液0.5ml(代謝活性化試験においてはS9混液0.5ml),検定菌液0.1mlを混合したのち合成培地平板上に流して固めた.また,対照群として被験物質調製液の代わりにアセトン,または数種の陽性対照物質溶液を用いた.各検定菌ごとの陽性対照物質の名称および用量はTableに示した.培養は37℃で48時間行い,生じた変異コロニー数を算定し,それぞれその平均値と標準偏差を求めた.抗菌性の有無については,肉眼的あるいは実体顕微鏡下で,寒天表面上の菌膜の状態から判断した.
なお,用量設定試験および本試験とも,被験物質の揮発性を考慮し,用時調製後速やかに平板上に処理したのち,各平板は,同一濃度ごとにそれぞれ密閉袋に入れ培養した.
以上の結果から,本試験における最高用量は,抗菌性の認められる78.12μg/プレートとした.なお,本試験では,直接法,代謝活性化法とも抗菌性を考慮して公比2で6用量を設定することとした.
以上の結果に基づき,1-クロロブタンは,用いた試験系において変異原性を有しないもの(陰性)と判定した.
| 1) | D. M. Maron, and B. N. Ames, Mutation Research. 113, 173-215(1983). |
| 2) | M. H. L. Green, "Handbook of Mutagenicity Test Procedures," (B. J. Kilbey, M. Legator, W. Nichols, and C. Ramel eds.) Elsevier, Amsterdam, New York, Oxford. 1984, pp.161-187. |
| 連絡先 | |||
| 試験責任者: | 高鳥浩介 | ||
| 試験担当者: | 鈴木文子,亀地礼子,川上久美子 松木容彦,中込まどか | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | |||
| Authors: | Kosuke Takatori (Study director), Fumiko Suzuki, Reiko Kameji,Kumiko Kawakami, Yasuhiko Matsuki, Madoka Nakagomi | ||
| Hatano Research Institute, Food and Drug Safety Center | |||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257, Japan | |||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | ||