1,3-ジブロモプロパンのチャイニーズ・ハムスター培養細胞を用いる染色体異常試験
In Vitro Chromosomal Aberration Test of 1,3-Dibromopropane
in Cultured Chinese Hamster Cells
要約
1,3-ジブロモプロパンの染色体異常誘発能の有無を検討するために,チャイニーズハムスター培養細胞(CHL/IU)を用いて染色体異常試験を実施した.
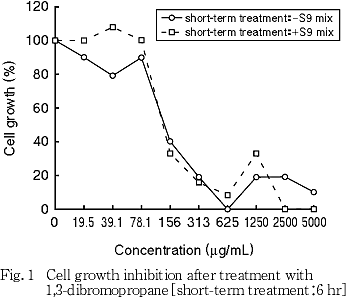
細胞増殖抑制試験の結果,短時間処理法における被験物質の50 %抑制率を示す濃度は140 μg/mL前後であった.このことから,染色体異常試験の短時間処理法における被験物質の用量をS9 mix存在の有無にかかわらず公差20で60〜180 μg/mLに設定した.本試験では被験物質を6時間処理した後18時間培養し,染色体標本を作製し,検鏡によって染色体異常誘発性を検索した.
試験の結果,S9 mix存在下では60 μg/mL以上,S9 mix非存在下では100 μg/mL以上で明らかな構造異常が出現し,その作用に用量依存性が認められた.また,その出現率は,ラットS9 mixによる代謝活性化によって高まる傾向にあった.D20値は0.066 mg/mL,TR値は290であった.
なお,1,3-ジブロモプロパンは短時間処理法で明らかに陽性を示したため,連続処理法は実施しなかった.
以上の結果から,1,3-ジブロモプロパンは本試験条件下において染色体異常を誘発する(陽性)と結論した.
材料及び方法
1. 使用細胞株
ヒューマンサイエンス研究資源バンクから入手(1997年10月22日)したチャイニーズハムスターの肺由来線維芽細胞株(CHL/IU)を,解凍後継代10代以内で試験に用いた.
2. 培養液の調製
培養には,非働化(56 ℃,30分)した仔牛血清(GIBCO Life Technologies Inc.)を10 vol%添加したEagle's MEM(GIBCO Life Technologies Inc.)を用いた.調製後の培養液の保存は冷蔵とした.
3. 培養条件
細胞の培養には,炭酸ガス培養装置を用い,CO2濃度5 %,温度37 ℃の高湿度条件下で培養した.継代培養は3〜4日ごとに行った.試験に際しては2 × 104個の細胞を,培養液5 mLを入れた直径6 cmのプレートに播種し,3日目に被験物質を処理した.なお,被験物質の揮発により処理群間に影響が及ぶ可能性を考慮し,被験物質処理時間中は,プレートを各被験液濃度ごと弗化ビニール樹脂製の袋(テドラーバッグ®)に入れた.また,溶媒対照群及び非処理群についても同様の条件で処理した.また,被験物質が腐食性を有することから,プレートはガラス製(Fine社製,型式60)を用いた.
4. S9 mix
フェノバルビタール及び5,6-ベンゾフラボンを腹腔内投与した7週齢のSprague Dawley系雄ラットの肝臓から調製したS9並びに補酵素をオリエンタル酵母工業(株)から購入し,S9 mixを調製した.S9 mixの組成は松岡らの方法1)に従い,S9の培地への添加量を5 vol%とした.
5. 被験物質
1,3-ジブロモプロパン(ロット番号:07253,東ソー(株),東京)は,純度99.8 %,比重1.9818,融点-36.2 ℃,沸点165 ℃の無色透明の液体である.使用時まで室温・遮光下,気密容器で保存した.なお,実験終了後,被験物質原体を東ソー(株)で分析した結果,実験期間中は安定であったことが示された.
6. 被験液の調製
被験液は用時に調製した.溶媒としては本被験物質が水に難溶であるため,ジメチルスルホキシド(DMSO:試薬特級,和光純薬工業(株))を用いた.被験物質を溶媒で希釈して原液を調製し,ついで順次溶媒で希釈して各濃度の被験液を調製した.被験液は,培養液の1 vol%になるように添加した.
7. 細胞増殖抑制試験(予備試験)
染色体異常試験における被験物質の処理濃度を設定するため,被験物質の細胞増殖に及ぼす影響を調べた.被験物質の細胞増殖抑制作用は,単層培養細胞密度計(モノセレータ,オリンパス光学工業(株))を用いて細胞密度を測定し,被験物質処理群の溶媒対照群に対する細胞密度の比をもって指標とした.
その結果,S9 mixの有無にかかわらず50 %細胞増殖抑制濃度は140 μg/mL前後であった(Fig. 1).
8. 実験群の設定
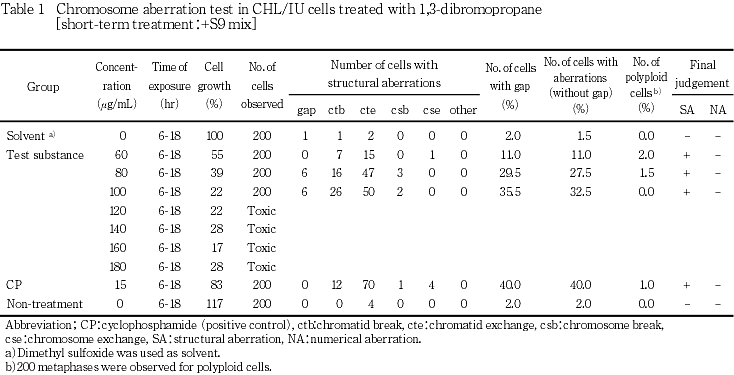
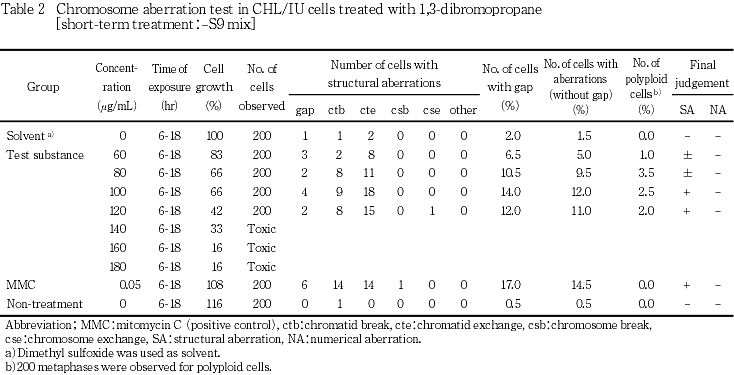
細胞増殖抑制試験で得られた50 %細胞増殖抑制濃度をもとに,染色体異常試験の短時間処理法では,S9 mix処理の有無にかかわらず180 μg/mLを最高濃度とし,以下公差20 μg/mLで減じた計7濃度並びに非処理群及び溶媒対照群を設定した.なお,陽性対照として代謝活性化(+S9 mix)処理ではシクロフォスファミド(CP,和光純薬工業(株),15 μg/mL),非代謝活性化(-S9 mix)処理ではマイトマイシンC(MMC,協和醗酵工業(株),0.05 μg/mL)を用いた.
濃度当たり4枚のプレートに処理し,2枚を染色体標本作製用,2枚を細胞増殖率測定用とした.
9. 染色体標本の作製
培養終了の2時間前に,最終濃度が0.2 μg/mLとなるようにコルセミドを加えた.以下,染色体標本は空気乾燥法によって作製した.スライド標本は各プレートにつき2枚作製し,2 vol%ギムザ液で15分間染色した.
10. 染色体の観察
用量当たり200個(プレート当たり100個)の分裂中期像についてギャップ(g),染色分体型切断(ctb),染色分体型交換(cte),染色体型切断(csb),染色体型交換(cse)及びその他の異常など構造異常の種類並びに異常を持つ細胞の数を記録した.同時に倍数性細胞の数も記録した.
客観的な観察を行うため,スライド標本をコード化した.
11. 結果の判定
染色体構造異常を有する細胞の出現率は,ギャップを含む場合と含まない場合について集計し,総合的判定にはギャップのみを持つ細胞を除いて判定した.
判定は石館らの基準2)に従い,染色体異常を有する細胞の出現頻度が5 %未満を陰性(-),5 %以上10 %未満を疑陽性(±),10 %以上を陽性(+)とした.最終的には異常細胞の出現に用量依存性又は再現性が認められた場合を陽性と判定した.
結果及び考察
短時間処理法における結果をTable 1及び2に示した.染色体構造異常の出現頻度は,+S9 mix処理群の60 μg/mLで11.0 %,80 μg/mLで27.5 %及び100 μg/mLで32.5 %と用量依存的に増加し,明らかに陽性を示した.また,-S9 mix処理群においても,60 μg/mLで5.0 %,80 μg/mLで9.5 %,100 μg/mLで12.0 %及び120 μg/mLで11.0 %となり,代謝活性化系と比較し弱い出現頻度ではあったが,用量依存的に疑陽性から陽性に移行した.したがって,構造異常はS9非存在下でも陽性となったが,S9の存在によって増加する傾向にあった.即ち,代謝活性化によって変異原性が高まることが示唆された.倍数性細胞に関しては,S9 mix存在の有無にかかわらず出現頻度に増加は認められなかった.なお,+S9 mix処理群では120 μg/mL以上,-S9 mix処理群では140 μg/mL以上の濃度では,毒性により染色体の観察が困難であった.一方,陽性対照物質を処理した群においては,顕著な染色体の構造異常を有する細胞の出現頻度の増加が認められた.
変異原性の強さに関する構造異常の相対的比較値であるD20値は0.066(mg/mL),TR値は290と推定されたこと,また,切断型よりも交換型がより多く出現したことから,染色体異常誘発性の強さは比較的強いものと考えられる.
以上の結果から,1,3-ジブロモプロパンは本試験条件下において染色体異常を誘発する(陽性)と結論した.
なお,本被験物質についてはAmes試験3)及び染色体異常試験4)で陽性との報告がある.更に,類縁体である1-bromo-3-chloropropane5),2,4,6-tribromophenol6)及びchloropentabromocyclo-hexane7)は染色体異常試験で陽性との報告があり,臭化化合物のDNA及び染色体に対する影響が示唆されている.
文献
| 1) | A. Matsuoka et al., Mutat. Res., 66, 277(1979). |
| 2) | 石館基監修,"<改訂>染色体異常試験データ集,"エル・アイ・シー,東京,1987, pp. 19-24. |
| 3) | 労働省労働基準局安全衛生部化学物質調査課監修,"労働安全衛生法有害調査制度に基づく既存化学物質変異原性試験データ集,"日本化学物質・情報センター,東京,1996, p. 315. |
| 4) | 労働省労働基準局安全衛生部化学物質調査課監修,"労働安全衛生法有害調査制度に基づく既存化学物質変異原性試験データ集,"日本化学物質・情報センター,東京,1996, pp. 553-554. |
| 5) | 益森勝志,化学物質毒性試験報告,8, 506(2001). |
| 6) | 佐々木澄志,化学物質毒性試験報告,7, 418(1999). |
| 7) | 西冨保,化学物質毒性試験報告,4, 91(1996). |
| 連絡先 |
| 試験責任者: | 林崎 篤 |
| 試験担当者: | 斎藤 準,三浦康義,西村 進 |
| (株)ボゾリサーチセンター |
| 〒412-0039 静岡県御殿場市かまど1284 |
| Tel 0550-82-2000 | Fax 0550-82-2379 | |
| Correspondence |
| Authors: | Atsusi Hayashizaki(Study Director)
Hitoshi Saito, Yasuyoshi Miura, Susumu Nishimura |
| Bozo Research Center Inc. |
| 1284 Kamado, Gotemba-shi, Shizuoka, 412-0039, Japan |
| Tel +81-550-82-2000 | Fax +81-550-82-2379 | |



